摩洛哥自然发酵驼乳中乳酸菌分离鉴定及特性研究
柳 青, 史 迪, 刘文俊, 张和平
(内蒙古农业大学 食品科学与工程学院/乳品生物技术与工程教育部重点实验室,内蒙古 呼和浩特 010018)
畜牧业是摩洛哥王国非常重要的支柱产业,骆驼、牛、羊等为主要饲养对象。当地原生态的生活方式和独特自然条件下造就出的自然发酵乳中含有丰富的微生物,且具有一定的地域特征,所以研究摩洛哥王国自然发酵乳中蕴含的菌种资源有较大的应用价值和理论意义[1-2]。
自然发酵乳制品包含丰富的营养成分,其低pH值造就的独特微生态环境,孕育了种类颇丰的乳酸菌资源[3]。驼乳是摩洛哥王国阿尤恩地区牧民在特殊的生存环境下经常饮用的饮品之一,其乳汁浓厚,富含蛋白质、矿物质、维生素等多种营养成分[4-5]。因此以驼乳为原料制成的酸驼乳、酸驼奶酪、驼奶酒等深受当地牧民喜爱,是阿尤恩地区的传统食品。酸驼乳有较好的保健作用,包括提高人体免疫力、降血脂等[6]。研究发现,驼乳有较低致敏性,一项为期3年的实验结果表明,婴幼儿饮用驼乳较山羊奶更安全。酸驼乳还有预防癌症的功效[7-8]。
驼乳产品的保健作用和优质营养令人瞩目,乳酸菌的作用不容忽视。因此,世界各国都在发掘自然发酵驼乳中具有优良益生特性的乳酸菌。樊哲新等[9]发现新疆传统发酵驼乳中Lactobacillusplantarum和Lactobacillushelveticus丰度较高。张哲等[10]研究表明,内蒙古阿拉善盟的发酵驼乳中,乳杆菌属为优势乳酸菌属。张苗苗等[11]发现哈密市原驼乳中,乳明串珠菌为优势乳酸菌。Khedid等[12]对摩洛哥南部30份骆驼乳样品中分离出的120株乳酸菌进行分析,结果发现乳杆菌属和乳球菌属分别占37.5%和25.8%,为优势菌属,主要菌种为Lactococcuslactissubsp.lactis。本研究针对摩洛哥阿尤恩地区自然发酵驼乳进行细菌多样性研究,以增加对不同地区驼乳细菌多样性的了解,丰富乳酸菌资源。
本研究通过纯培养方法,分离、鉴定样品中细菌菌种组成,并通过 PacBio SMRT 测序技术以不同样品为研究对象研究菌种多样性,并从优势菌种中筛选生物学特性较好菌株,进一步进行表型实验。研究旨在揭示阿尤恩地区自然发酵驼乳细菌多样性,帮助后续益生菌发掘,细化单菌株生化特性,希望为保护和丰富不同国家、地区自然发酵乳中乳酸菌资源及其开发利用奠定基础。
1 材料与方法
1.1 材料与试剂
4份自然发酵驼乳样品均采集自摩洛哥王国阿尤恩地区,使用无菌工具采集样品并即时低温寄回。采集过程中,将一组样品置于已灭菌的2 mL冻存管内,用于乳酸菌的纯培养实验。将另一组相同的样品每份20 mL置于50 mL无酶无菌管中,并在其中加入10~15 mL的DNA TaKaRa保护液,用于宏基因组多样性测序[13]。
MRS培养基(g/L):牛肉膏10,大豆蛋白胨10,酵母浸出汁粉5,葡萄糖20,醋酸钠5,柠檬酸二铵2,吐温80 1,硫酸镁0.58,硫酸锰0.28。
Lysozyme、egg white,法国Solarbio公司;TIANamp Bacteria DNA Kit试剂盒,北京天根生化科技有限公司;E.Z.N.A.®Soil DNA Kit试剂盒,美国Omega公司;SMRTbell Template Prep Kit 1.0试剂盒,美国Pacific Biosciences公司;KAPA HiFi Hot Start Ready Mix PCR Kit试剂盒,美国KAPA公司;API50CHL试剂盒,法国bioMerieux公司。
1.2 仪器与设备
SX- 700型高压蒸汽灭菌器,日本Kagoshima Seisakusyo公司;5810R型高速冷冻离心机,德国Eppendorf公司;PacBio RS II型测序系统,美国Pacific Biosciences公司。
1.3 实验方法
1.3.1样品乳酸菌计数
实验前准备试管装生理盐水(质量分数0.85%,4.5 mL/支)及1 mL枪头,灭菌后将枪头烘干放入超净工作台待用。将4份样品梯度稀释,取10-5、10-6、10-7梯度计数,稀释前需震荡30 s保证菌体混合均匀[14]。稀释完成,将试管中菌液混匀后,吸取1 mL加入培养皿,把培养基冷却至55 ℃后,在已有菌液的玻璃平皿中倾注25~30 mL培养基,37 ℃厌氧培养48 h,计算1 mL样品中乳酸菌菌落总数。
1.3.2乳酸菌的分离纯化及保藏
选取10-5、10-6、10-7这3个梯度,将每支试管梯度稀释液经振荡器混匀后,吸取200 μL移于提前准备好的平板培养基上,并使用涂布棒均匀涂布至液体全干,之后将涂布菌液的平皿倒置,防止污染,在厌氧工作站内37 ℃培养72 h;提前在经培养的涂布平板上用记号笔及放大镜辅助选择形态与其他菌不同的独立生长的单个菌落,经菌株纯化后,将革兰氏染色阳性、无半透明外层、内部着色均匀,过氧化氢酶阴性,发酵葡萄糖产乳酸的细菌暂定为乳酸菌。将这些细菌纯培养物用相同培养基在试管内继续传至3代增强活性;利用低速离心机将3代分离株菌泥与培养基分离,并使用磷酸缓冲液(NaCl 0.8 g、Na2HPO40.115 g、KH2PO40.02 g/100 mL)将培养基成分清洗2次,得到的菌体在试管内混合入800 μL冻菌保护剂(冻菌保护剂配方为每100 mL蒸馏水中包含8 g脱脂乳粉、2 g酵母粉,脱脂乳粉需灭菌后急速冷却),使用吸针分装在干热灭菌的安瓿管及湿热灭菌的冻存管中,安瓿管每支填满底部即可,经液氮速冻后,在-80 ℃的超低温冰箱冷冻保藏[13]。
1.3.3乳酸菌分子生物学鉴定
1.3.3.1 菌株DNA提取与扩增
将装有二代菌株的试管更换铝帽后经3 800 r/min低速离心5 min,去除分离出的培养基废液;加入3 mL磷酸缓冲液重复离心操作2遍;之后经振荡器混合均匀,吸取1 mL菌悬液到EP管内,12 000r/min条件下离心2 min,用1 mL枪头吸净上清废液,使用天根试剂盒提取DNA并检验其品质。PCR扩增体系及条件参考史迪等[15]的方法。
将品质良好的PCR产物与冰袋共同包装在保温箱内及时寄送至上海美吉生物科技有限公司进行测序。
1.3.3.2 16S rRNA基因同源性比对
使用SeqMan软件对测序得到的DNA两条序列进行拼接,此过程亦可判断菌株纯度,如得到双峰或DNA序列杂乱无法拼接,则可判断菌株有污染。完整的DNA序列在NCBI(www.ncbi.nlm.nih.gov)中进行分类学地位鉴定,选择相似度和覆盖率较高的结果,确定其菌种。在NCBI数据库Genome栏目内下载对应菌种模式株序列,选择标准为样品分离菌株与模式株之间同源性>98%,使用Mega7.0软件的邻接法构建样品分离株及模式株共同的系统发育树[16]。
1.4 自然发酵驼乳中细菌多样性分析
1.4.1细菌宏基因组DNA的提取
将样品混匀后使用E.Z.N.A.®Soil DNA Kit试剂盒提取样品DNA;与此同时,利用测定OD值与电泳的方法检验DNA的品质,检验标准为OD260/280需处于1.8~2.0,DNA质量浓度>20 ng/μL,如低于标准较多将无法成功测序;片段化程度小的DNA视为符合实验标准,提取好的DNA放置在-20 ℃冰箱备用[17]。
1.4.2细菌 16S rRNA 基因扩增
利用KAPA HiFi Hot Start Ready Mix PCR Kit试剂盒,通过PCR扩增得到宏基因组DNA模板。PCR产物需纯化流程提高品质,使用Qubit@ dsDNA HS Assay Kit试剂盒检测实时DNA质量浓度,DNA质量浓度在20~100 ng/μL可进行下一步实验[18]。
1.4.3PacBio SMRT三代测序及生物信息学分析
将品质达标的PCR产物,用试剂盒Pacific Biosciences SMRT bell TM Template Prep Kit构建文库,使用PacBio RS II仪器进行测序[14];使用QIIME平台根据菌株DNA序列分析菌株的系统发育关系。每条DNA序列使用PyNAST软件排齐后,对样品及样品中菌株划分分类操作单元(OTU),相似度达到≥97%便可聚为一簇,同一类群菌株亲缘关系较近,再使用Greengenes等数据库对比样品分离菌株测序结果的代表性序列,确定各菌株种类,并进一步分析样品的α多样性,判断各菌种在整体菌株中相对丰度,包含超1指数、发现物种数、香农指数和辛普森指数[18]。
1.5 菌株的生理生化特性分析
1.5.1菌株发酵特性研究
对自然发酵驼乳中的48株优势菌株Lactococcuslactis的发酵特性初选,将菌株在37 ℃下培养24 h,以发酵乳pH值和乳酸含量为指标,选出2株具有较低pH值、较高乳酸含量特性的优良乳酸菌。
1.5.2最适发酵条件测定
将2%已混匀的菌悬液接入MRS液体培养基,分别放置于不同温度(10、20、30、37、45、55、58 ℃)下发酵24 h,改变培养基pH值(2.5、3.5、4.5、5.5、6.5、7.5)和NaCl质量分数(0%、2.0%、4.0%、6.0%、8.0%、10.0%),测定OD600以确定菌株最适发酵条件。
1.5.3发酵产酸能力及生长曲线测定
将菌液按2%接种量接入改良牛乳培养基,最适温度下静置培养30 h,以OD600及活菌数为指标,每2 h测定1次,并绘制生长曲线。将菌液以2%的接种量接入牛乳,在最适温度下发酵30 h,每2 h取样1次,取样前需要充分摇匀,并绘制产酸曲线。
1.5.4碳水化合物发酵实验
碳水化合物发酵实验采用API50CHL系统,整体操作流程按照制造商的说明进行。
1.6 数据处理
实验结果使用Origin软件绘图便于后续分析。本研究相关菌株序列已提交到MG- RAST数据库,菌株序列号暂未释放。
2 结果与分析
2.1 摩洛哥阿尤恩地区样品乳酸菌计数结果分析
4份样品中乳酸菌活菌计数见表1,由表1可知不同样品间活菌数均有差异。结果表明,摩洛哥阿尤恩地区自然发酵驼乳中乳酸菌活菌数介于5.15×106~6.92×106CFU/mL。同一地区自然发酵乳的活菌数差异,可能与样品发酵和贮存条件等有关[14]。

表1 乳酸菌计数结果
2.2 摩洛哥阿尤恩地区乳酸菌分离纯化结果分析
根据菌落形态标准随机挑菌进行纯培养。4份自然发酵驼乳样品分离得到82株菌,在涂布板上观察样品分离出的菌落形态。菌落呈圆形,边缘呈锯齿状或光滑圆形,表面或有凸起,菌落颜色大多为纯白色或者淡黄色,部分呈透明形态。将培养的菌株纯培养物在显微镜下观察,菌株球菌居多,呈圆或椭圆形,成对、四联或成链状均匀排列;杆菌镜检着色深浅不同、粗细及长短不一,链状或分散排列[19]。
2.3 16S rRNA基因扩增结果分析
82株乳酸菌分离株使用TIANamp Bacteria DNA Kit试剂盒提取DNA,菌株基因组质量浓度均在100~300 ng/μL;OD260/280均处于1.8~2.0且0.8%的琼脂糖凝胶电泳结果合格,DNA质量满足后续实验要求。
2.4 系统发育树的构建和乳酸菌鉴定结果
4份样品分离出的乳酸菌菌株见表2。乳酸菌被鉴定为3个属、8个种,共82株乳酸菌。通过Seq-Man软件拼接得到所需序列,比对确定其菌种,并结合系统发育关系进行比较。结果可知,4份自然发酵驼乳中的82株分离株显示为乳酸菌。将分离株基因序列和参考菌株的基因序列使用MEGA 7.0软件绘制系统发育树(图1)。MLGⅡ- 27(IMAU98045)与模式菌株EnterococcusitalicusDSM 15952T(AJ582753.1)聚为一类群,菌株间同源性为99%,对比结果为Enterococcusitalicus;MLGⅢ- 17(IMAU98083)、MLGⅣ- 20(IMAU98105)与LactococcuslactisATCC19435T(AB100803.1)可聚为一簇,同源性符合标准,故可知菌株为Lactococcuslactis;MLGⅣ- 5(IMAU98094)与模式菌株LactobacillusplantarumATCC14917T(AF404710.1)聚成一簇,同源性为99%,故为Lactobacillusplantarum;MLGⅠ- 8(IMAU98008)与模式菌株LactobacillusparacaseiATCC25302T(D79212.1)同源性为99%,鉴定其为Lactobacillusparacasei;MLGⅠ- 2(IMAU98002)、MLGⅡ- 16(IMAU98038)与模式菌株LactobacillusfermentumATCC 14931T(X61142.1) 同源性符合标准,鉴定为Lactobacillusfermentum;MLGⅣ- 27(IMAU98133)与模式株LactobacillushelveticusATCC 15009T(FR683085.1)聚在一簇,同源性为99%,故鉴定为Lactobacillushelveticus[20-21]。

表2 乳酸菌分离鉴定结果

图1 乳酸菌分离株16S rRNA基因序列进化树
2.5 摩洛哥阿尤恩地区自然发酵驼乳菌株多样性分析
摩洛哥阿尤恩地区自然发酵驼乳菌株多样性分析结果见表3、图2。表3列出了4份样品中菌株序列信息和α多样性指数;图2展示了样品稀释曲线和香农曲线的趋势。4份驼乳样品的宏基因组测序获得了26 626条DNA序列。将获得的序列进行分组,可得1 905个代表性OTUs,MLGⅣ代表性OTUs最少,为395个;MLGⅠ的最多,为604个,OTUs数量与测序深度呈正相关。由图2(a)可以看出,4份样品曲线随测序深度增大不再升高,表明此次测序量充足。由图2(b)可知,4份样品在4 000测序量时已经趋于饱和,说明在此条件下可以充分了解样品的多样性信息。
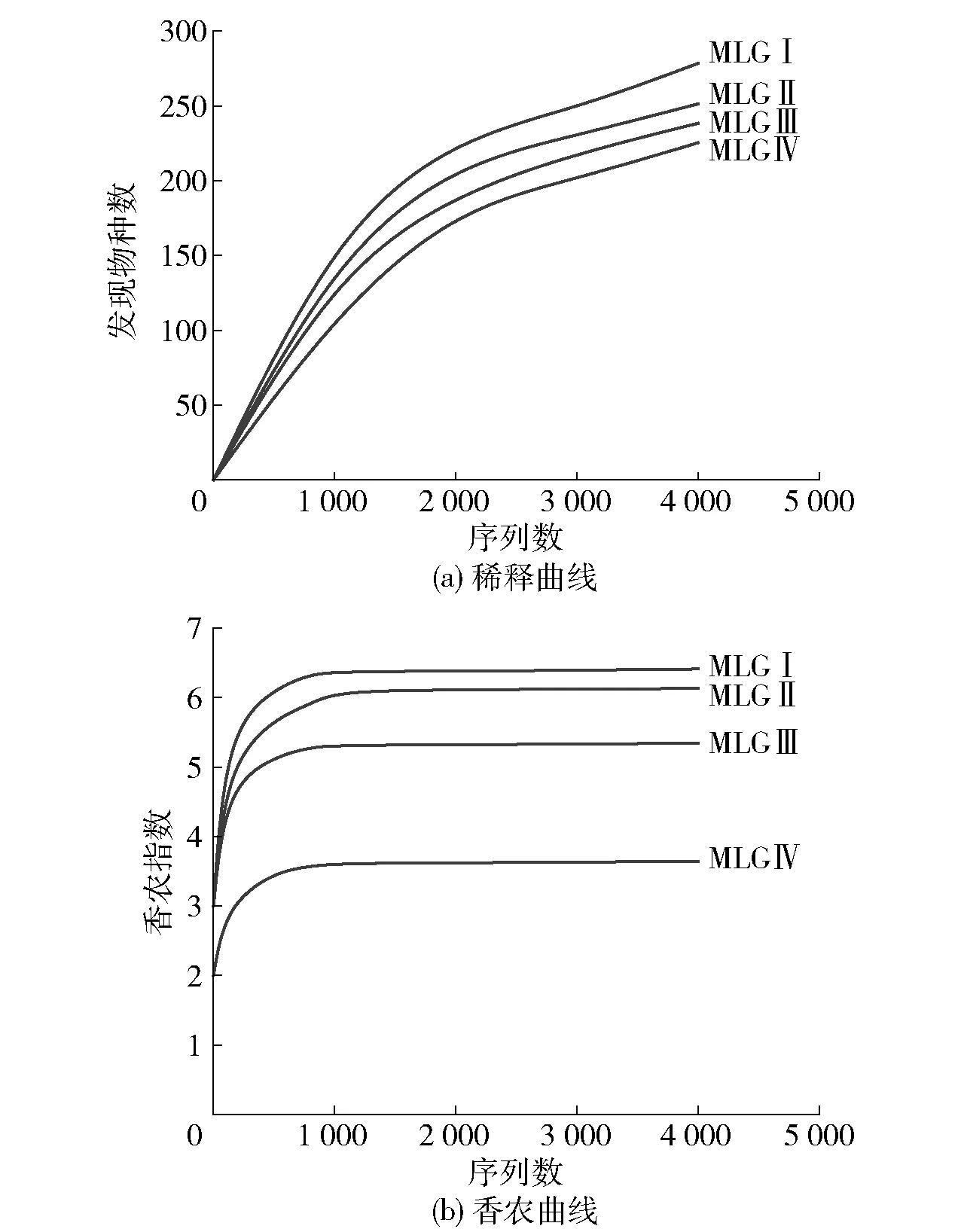
图2 摩洛哥阿尤恩地区自然发酵驼乳稀释曲线及香农曲线
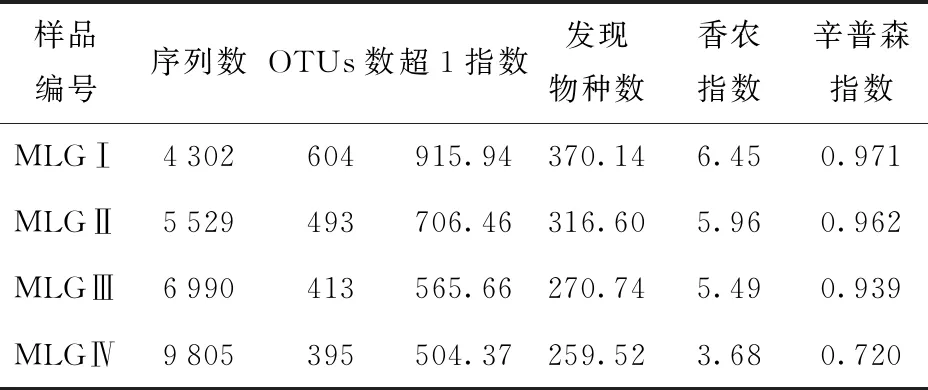
表3 摩洛哥阿尤恩地区自然发酵驼乳中序列信息和α多样性指数
2.5.1摩洛哥阿尤恩地区自然发酵驼乳的细菌群落结构分析
研究表明,4份自然发酵驼乳样品中细菌鉴定属于7个细菌门、78个菌属、143个菌种,7个菌门分别是Firmicutes、Proteobacteria、Actinobacteria、Deinococcus-Thermus、Acidobacteria、Bacillariophyta、Bacteroidetes。摩洛哥阿尤恩地区自然发酵乳细菌门水平分析结果见表4。由表4可知,样品中主要菌门是Proteobacteria(54.64%)和Firmicutes(41.77%)。
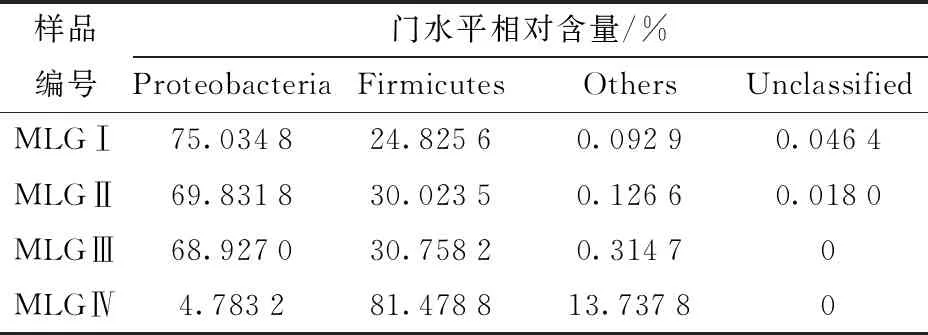
表4 摩洛哥阿尤恩地区自然发酵乳细菌门水平的相对含量
从样品的菌属水平来看,阿尤恩地区自然发酵驼乳中共包含78个细菌属,相对含量较高的属为Lactococcus(31.87%)、Acinetobacter(26.79%)、Enterobacter(7.44%)、Escherichia(7.39%)、Klebsiella(5.28%)、Lactobacillus(4.23%)、Thermus(3.09%)。MLGⅠ与MLGⅡ中Acinetobacter含量最多,达到43.49%;MLGⅢ与MLGⅣ中的Lactococcus的含量最高(17.63%)。
从种水平来看,样品中主要菌种为Lactococcuslactis(24.75%)、Acinetobacterjohnsonii(19.17%)、Escherichiafergusonii(6.40%)、Enterobactercloacae(5.77%)、Klebsiellaoxytoca(5.27%)、Lactococcuschungangensis(4.28%)、Acinetobacterjunii(4.23%)、Lactobacillushelveticus(3.35%)、Thermuscotoductus(3.09%)、Lactococcusraffinolactis(2.64%);相对含量高于1%的菌种还有Macrococcuscaseolyticus、Acinetobactervariabilis、Kurthiagibsonii、Exiguobacteriumindicum。
分析样品主要菌种,相对含量达到25.42%的Acinetobacterjohnsonii是MLGⅠ、MLGⅡ、MLGⅢ样品中的优势菌种,其中Lactococcuslactis、Lactococcuschungangensis在这3份样品中相对含量也较高;MLGⅣ中的优势乳酸菌菌种为Lactococcuslactis,相对含量高达63.45%,其次为乳酸菌中的Lactobacillushelveticus,相对含量为13.38%。
2.5.2OTU水平菌群结构分析
OTU水平菌群结构分析在α多样性里有重要作用[19],4份样品产生1 301个OTU,只在单独样品中存在的OTU有922个,这些OTU有2 921条DNA序列,占OTU总数和质控合格DNA序列数的比例为70.87%和10.98%。把4份样品中均出现的OTU定义为样品的核心OTU。58个OTU是所有样品共同存在的,其中有DNA序列17 108条,4份样品共有OTU分别占OTU总数和质控合格DNA序列数的4.46%和64.25%。这些OTU隶属于Acinetobacter(20个OTU)、Lactococcus(23个OTU)、Klebsiella(1个OTU)、Enterobacter(4个OTU)、Escherichia(5个OTU)、Pseudomonas(2个OTU)、Streptococcus(1个OTU)、Leuconostoc(1个OTU)、Leclercia(1个OTU)。
摩洛哥阿尤恩地区自然发酵驼乳中OTU出现次数和各样品中OTU分析结果表明,OTU在样品中也存在,MLGⅠ的OTU数量最少,仅为11个,MLGⅢ有25个OUT。Leuconostocfallax是MLGⅠ中特有的乳酸菌,Streptococcussalivarius、Streptococcusagalactiae这2种菌是MLGⅢ特有的乳酸菌,MLGⅣ独有菌种为Lactococcuslaudensis、Lactobacillugasseri。除乳酸菌外,MLGⅠ特有的为Shigellaflexneri,MLGⅡ包含Acinetobacterbaumannii、Enterobactertabaci这2种特有菌种,MLGⅢ样品特有菌种为Acinetobacterguillouiae,MLGⅣ样品特有菌种为Massiliatimonae。
2.5.3自然发酵驼乳中菌群相关性分析
本研究对每组自然发酵驼乳中平均相对含量大于1%的核心菌群的相互关系利用Spearman相关性检验进行分析,见图3。属水平结果显示:Enterobacter与Kurthia、Acinetobacter呈显著正相关(P<0.001),Exiguobacterium与Escherichia、Macrococcus呈显著正相关(P<0.001);Pseudomonas与Lactobacillus呈显著负相关(P<0.001),Lactococcus与Acinetobacter、Enterobacter呈显著负相关(P<0.001)。种水平结果显示:Lactococcusraffinolactis与Acinetobacterjohnsonii、Acinetobacterjunii、Acinetobactervariabilis、Kurthiagibsonii呈显著正相关(P<0.001),Lactococcuschungangensis与Klebsiellaoxytoca呈显著正相关(P<0.001),Lactobacillushelveticus与Lactococcuslactis呈显著正相关(P<0.01),Lactobacillushelveticus与Lactococcuschungangensis呈显著负相关(P<0.01)。

***表示显著相关(P<0.001)。
2.5.4自然发酵乳核心微生物分析
根据乳酸菌分离结果可知,自然发酵乳种水平的核心微生物为Lactococcuslactis(100.0%),其次为Acinetobacterjohnsonii(60.0%)、Lactobacillushelveticus(40.0%),这3种乳酸菌共同构成自然发酵驼乳样品的核心微生物。
本研究涉及的4份样品分离出Lactococcuslactissubsp. lactis 占分离菌株总数的66.67%,被认定为摩洛哥阿尤恩地区自然发酵驼乳制品的优势菌群。此外,MLGⅠ样品中分离出乳酸菌种类最为丰富,其中Lactobacillusplantarum、Leuconostocpseudomesenteroides、Lactobacilluscasei(paracasei)存在潜在益生功能,有待于进一步深入研究,其余3份样品分离出的菌株相似,优势菌群相同。MLGⅠ样品分离出乳酸菌种类最为丰富,因此应着重研究[21]。
2.6 摩洛哥阿尤恩地区菌株生化特性分析
根据样品优势菌群、菌株发酵速率、生长情况等因素,在样品分离出的乳酸菌中选取2株进一步分析。
2.6.1菌株最适温度的确定
菌株最适温度实验结果见图4。由图4可知,37 ℃时,2株菌的OD600最大,生长情况最佳,故37 ℃为最适生长温度。温度低于37 ℃时,2株菌的OD600随温度增高而逐渐增加,且菌株IMAU98084的生长情况优于IMAU98054。温度高于37 ℃时,2株菌的OD600均随温度的增高而逐渐降低,菌株活力降低,生长受到抑制,但菌株IMAU98054生长情况优于IMAU98084,IMAU98054虽在低于37 ℃的环境生长较慢,但整体生长趋势优于IMAU98084。
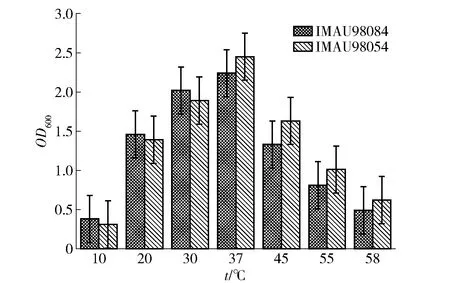
图4 菌株最适温度的确定
2.6.2菌株对pH值及盐耐受性分析
菌株最适pH值实验结果见图5。由图5可知,在pH值为7.5时,2株菌的OD600最大,生长情况最佳。在pH值低于7.5时,菌株的OD600逐步增高,2株菌的生长情况随pH值的增加呈现上升趋势;当pH值低于2.5时,OD600趋于0,菌株生长明显受到抑制。pH值在5.5~7.5,菌株OD600趋于平滑,故此为菌株最适生长pH值范围。

图5 菌株最适pH值的确定
菌株盐耐受性实验结果见图6。由图6可知,2株菌在一定程度上具有盐耐受性,当NaCl的质量分数小于2%时,菌株生长几乎不受影响;当NaCl的质量分数大于2%时,菌株的OD600随着NaCl质量分数增大而逐渐减小,且NaCl质量分数越大对菌株的生长抑制越强;当NaCl质量分数大于10%时,菌株的生长几乎停止。

图6 菌株对NaCl的耐受性
2.6.3菌株产酸能力测定及生长曲线绘制
菌株IMAU98054和IMAU98084的生长曲线及产酸能力如图7。0~2 h时为菌株生长的延滞期,2株菌的OD600变化很小,活菌数增长也很少;2 h延滞期过后,菌株进入对数生长期,2株菌的OD600及活菌数迅速增高,一直持续至14 h;之后菌株OD600增长变慢趋于平缓进入稳定期,在18 h时,2菌株活菌数均达到最高值,且菌株IMAU98054较IMAU98084高。在菌株生长至24 h之后,OD600开始有大幅下降趋势。根据图7中pH值曲线可知,0~2 h时,菌株pH值均变化不大;2~14 h时2株菌均进入对数生长期,由于活菌数大量增加,产乳酸能力增强,pH值大幅降低;20 h时菌株达到了pH最低值,IMAU98054为4.39,IMAU98084为4.41,并在此之后逐渐趋于稳定;24 h后菌株进入衰亡期,活菌数大幅减少,pH值有小幅增高情况。由此可知,菌株IMAU98054整体生长情况及产酸速率优于IMAU98084。

图7 菌株产酸能力分析及生长曲线
2.7 菌株IMAU98054和IMAU98084碳水化合物发酵结果
2株菌碳水化合物发酵结果见图8。由图8可知,在发酵48 h后,2株菌均可利用D-核糖、D-半乳糖、D-葡萄糖、D-果糖、D-甘露糖、甘露醇、N-乙酰葡萄糖胺、苦甘仁苷、ARBULIN、水杨苷、D-纤维二糖、D-麦芽糖、D-乳糖、D-海藻糖、D-龙胆二糖。菌株IMAU98054发酵了17种糖,与另一株菌不同的有D-木糖、葡萄糖酸钾(较弱);菌株IMAU98084发酵了19种糖,与另一株菌不同的有山梨醇、D-密二糖、D-蔗糖、D-土伦糖。菌种IMAU98084可发酵碳水化合物的种类多于IMAU98054。本研究中,4份样品均为自然发酵驼乳,发酵菌株均来自于自然条件,故无固定菌种来源。2株实验菌株来自不同样品,发酵条件及生存环境不同导致环境适应性存在差异[22];并且目前菌株只进行了16S rRNA鉴定,未准确区分出亚种,可进一步进行全基因组测序及功能基因预测,探究菌株发酵特性与基因组间的联系。

0.空白对照,1.甘露醇,2.赤藻糖醇,3. D-阿拉伯糖,4. L-阿拉伯糖,5.D-核糖,6.D-木糖,7.L-木糖,8.D-侧金盏花醇,9. 甲基-β-D吡喃木糖苷,10.D-半乳糖,11.D-葡萄糖,12.D-果糖,13.D-甘露糖,14.L-山梨糖,15. L-鼠李糖,16.卫矛醇,17.肌醇,18. 甘露醇,19.山梨醇,20.甲基-α-D-吡喃甘露糖苷,21.甲基-α-D-吡喃葡萄糖苷,22.N-乙酰葡萄糖胺,23.苦杏仁苷,24.熊果苷,25.七叶灵柠檬酸铁,26.水杨苷,27.D-纤维二糖,28.D-麦芽糖,29.D-乳糖,30.D-蜜二糖,31.D-蔗糖,32.D-海藻糖,33.菊粉,34.D-松三糖,35.D-棉子糖,36.淀粉,37.糖原,38.木糖醇,39.D-龙胆二糖,40.D-土伦糖,41.D-来苏糖,42.D-塔格糖,43.D-岩藻糖,44.L-岩藻糖,45.D-阿拉伯醇,46.L-阿拉伯醇,47.葡萄糖酸钾,48.2酮基葡萄糖酸钾,49.5酮基葡萄糖酸钾。
3 讨 论
自然发酵乳含有丰富的营养成分,是乳酸菌栖息的良好微生态环境,发掘不同分离地不同样品中的乳酸菌,研究乳酸菌的相互关系,发掘菌株的特性是乳品领域研究的重要课题,利用纯培养技术,分离乳酸菌,同时运用宏基因组测序技术,探寻样品的多样性,可为乳酸菌持续开发利用奠定基础。
摩洛哥阿尤恩地区4份自然发酵驼乳样品中分离获得了82株乳酸菌,其中Lactococcuslactis、Lactobacillusplantarum、Lactobacilluscasei、Lactobacillusfermentum分离株数量较多,Lactococcuslactis为其优势菌种。本研究通过最适温度实验、盐及pH值耐受性实验、碳水化合物发酵实验等探究了自然发酵驼乳2株分离株Lactococcuslactis的生物学特性,发现2株菌特性优良。并且菌株间存在相似部分,同时也存在差异。李远等[23]从新疆4个地区采集的发酵驼乳样品包含22株乳酸菌,其中优势菌种为Lactobacillushelveticus(18.18%) 、Lactococcuslactissubsp.1actis(13.63%)。本研究中Lactococcuslactis为优势菌种,可体现不同环境及运输条件中相同样品菌种的分布及丰度不同。张敏等[24]对新疆驼乳中细菌群落组成和多样性进行分析得出,发酵驼乳优势菌属主要以Lactococcus和Lactobacillus为主,与本研究结果一致。在菌属水平上,苏尼特双峰驼酸驼乳主要以乳杆菌属和乳球菌属为优势菌属,阿拉善双峰驼酸驼乳以乳杆菌属和醋酸杆菌属为优势菌属。与本研究结果对比可知,发酵驼乳样品中乳酸菌组成大体相似。Akhmetsadykova等[6]研究发现,哈萨克斯坦地区发酵驼乳中球菌丰度更高,与摩洛哥发酵驼乳中菌种分布相似;哈密市原驼乳中包含Lactococcus、Lactobacillus等5个属;除此之外,拉乌尔菌属(Raoultella)等有食源致病性和环境污染性的菌属被检出,可能对人体造成危害[25]。前人研究结果与本研究样品分离出的乳酸菌种类及丰度有所不同,因此,不同地区、不同采样阶段、不同运输条件产生的发酵驼乳中分离得到的乳酸菌种类及优势菌群存在差异性[7]。不同条件下产生的自然发酵乳蕴含丰富的菌种多样性,且2株特性优良菌株也展示了这一结果。
4 结 论
本研究运用纯培养的方法,从摩洛哥阿尤恩地区采集的4份酸驼乳样品中分离出82株乳酸菌,经鉴定分别归属于3个属、8个种,Lactococcuslactis占总分离株的58.54%,为优势菌。经宏基因组16S rRNA基因测序技术分析,4份样品中包含78个细菌属和147个菌种,其中优势菌门为Proteobacteria和Firmicutes,与其他自然发酵乳中优势菌门相似;优势菌属为Lactococcus;优势菌种为Lactococcuslactis(22.95%),同时也检测到Streptococcusthermophilus、Lactobacillushelveticus相对含量较高。从自然发酵驼乳优势菌种Lactococcuslactis中分离得到2株成长快、产酸能力强的菌株IMAU98054和IMAU98084。2株菌最适生长温度均为37 ℃,最适pH值为5.5~7.5;在NaCl质量分数6% 以下时具有一定的耐盐能力;且在18 h 时可达到最佳发酵状态,活菌数最高且pH值最低;整体分析菌株IMAU98054特性略优于IMAU98084。结果表明,Lactococcuslactis为摩洛哥阿尤恩地区自然发酵驼乳中的优势乳酸菌及优势细菌,并且样品细菌种类丰富。本研究分析了摩洛哥阿尤恩地区自然发酵驼乳的乳酸菌资源,明确了其细菌种群结构和多样性,并筛选得到了2株生化特性较好菌株IMAU98054和IMAU98084,研究旨在细化菌株优势,为乳酸菌的开发利用和传统发酵乳制品的品质提升提供指导。

