MMP-9、TIMP-1 水平变化参与FIRS 早产儿心肌损伤的机制研究
闫祎炜江 莲*李 梅张文浩张文婷王晓玲张原苏张会芬
(1.河北医科大学第四医院儿科,石家庄 050000;2.河北医科大学第四医院病理科,石家庄 050000)
心肌损害是胎儿炎症反应综合征(fetal inflammatory response syndrome,FIRS)的并发症之一,在成人研究中近40%脓毒症患者可出现不同程度心肌损伤[1]。 心肌损伤起病隐匿,临床表现多样,早期无特异性预测指标,容易漏诊,以致延迟治疗、预后不良。 心肌损伤在早产儿中发病率约30%左右,而在FIRS 早产儿中可上升至46.8%,严重者可并发心律失常(发生率约4.28%),死亡率0.6%~1%[2]。 因此,FIRS 患儿心肌损伤的早期诊断尤为重要,部分学者积极探寻高诊断效能的心肌损伤标志物[3]。 但是,FIRS 所致心肌损伤具体机制及特异性治疗药物尚无明确结论。 既往文献表明,脓毒症大鼠模型中,可检测到心脏组织基质金属蛋白酶(matrix metalloprotein 9,MMP-9)水平显著升高,并上调肌钙蛋白酶,过度降解肌钙蛋白,诱发心肌损伤[4]。 虽然FIRS 与全身炎症反应综合征(systemic inflammatory response syndrome,SIRS)的病程进展相近,但是MMP-9 及其抑制剂金属蛋白酶组织抑制因子-1(tissue inhibitor of metalloproteinase-1,TIMP-1)的水平变化是否参与FIRS 介导的心肌损伤尚不明确。 本研究临床验证MMP-9 及TIMP-1 表达水平,并构建FIRS 小鼠模型,探寻FIRS 诱发心肌损害的具体机制,为临床诊治提供新思路。
1 材料和方法
1.1 实验材料
1.1.1 实验动物
采用清洁级10 周龄KM 小鼠45 只购自河北省实验动物中心[SCXK(冀)2018-004],雄鼠15 只,体重分布35~40 g,雌鼠30 只,体重分布30~35 g。饲养和实验于河北医科大学第四医院动物实验中心[SYXK(冀)2018-001],本实验符合3R 原则,经河北医科大学第四医院实验动物伦理委员会审核通过(IACUC-4thHos Hebmu-2019006)。
1.1.2 研究人群
本临床部分研究人群和作者既往发表论文《FIRS 早产儿脐血MMP-9、TIMP-1 水平变化及其与肺损伤关系的研究》相同,但是研究方向不同[5]。 研究人群纳入连续生产的早产儿共118例,纳入时间区间为2018 年5 月到2019 年12 月。依据是否符合FIRS 诊断标准[6]分为FIRS 组(n=61)和非FIRS 组(n=57)。 其中FIRS 组男性32人,女性29 人,平均孕周为(29.35±1.44)周,出生体重为(1489±178)g,1 min Apgar 评分为(7.28±1.42)分,5 min Apgar 评分为(8.59±1.39)分,10 min Apgar 评分为(9.01±1.26)分;非FIRS 组男性30 人,女性27 人,平均孕周为(29.29±1.51)周,出生体重为(1482±169)g,1 min Apgar 评分为(7.32 ± 1.34) 分,5 min Apgar 评分为(8.72 ±1.26)分,10 min Apgar 评分为(9.12±1.32)分。两组新生儿基线资料无统计学差异(P>0.05)。研究方案经河北医科大学医学伦理委员会审核通过(2020004)。
1.2 主要试剂与仪器
人血清ELISA 试剂盒(IL-6、MMP-9、TIMP-1、CRP),来源中国艾莱萨生物科技有限公司;维甲酸(retinoic acid,RA),来源中国山东良福制药;脂多糖(lipopolysaccharide,LPS),来源美国Sigma 公司;瑞姬氏染色液,来源中国温州康泰生物科技公司。 离心机(YXI-2),来源日本三洋公司,超低温冰箱购(-80℃),来源日本SANYO 公司;显微镜(CX-21)来源日本OLYPUS 公司;荧光定PCR 仪(型号:Mx3000P),来源美国Agilent 公司;全自动酶标检测仪,来源美国VERS Amax 公司;电热恒温水浴箱(型号:JY-17-1),来源中国上海森信实验有限公司;蛋白分析(型号:Au2700),来源日本OLYPUS 公司。
1.3 实验方法
1.3.1 临床实验部分
通过ELLSA 法检测脐血中的白细胞介素-6(interleukin-6,IL-6)、金属蛋白酶组织抑制因子-1(tissue inhibitor of metalloproteinase-1,TIMP-1)、基质金属蛋白酶-9(matrix metalloprotein-9,MMP-9)水平。 所有入组新生儿通过病房治疗及门诊定期随访,每周随访1 次,随访至出生后28 d,明确是否发生心肌损伤结局。
新生儿心肌损伤诊断标准参照[7]执行,共纳入包括心肌酶、肌钙蛋白在内的两个必要诊断指标,以及心电图、超声心动图两个辅助诊断指标。 详见如下:①心肌酶升高(天冬氨酸转移酶>25 U/L 和/或乳酸脱氢酶>407 U/L 和/或肌酸激酶>725 U/L和/或肌酸激酶同工酶>39 U/L);②肌钙蛋白升高(心肌肌钙蛋白I>1.12 μg/L 和/或心肌肌钙蛋白T>0.14 μg/L);③心电图异常(心动过缓、心律不齐等改变);④超声心动图异常(心脏收缩功能和射血功能减退等)。
1.3.2 动物实验部分
(1)实验分组
实验分组根据是否为FIRS 小鼠及不同药物干预,随机分为3 组,详细如下:FIRS 组为LPS 构建FIRS 小鼠(模型构建详见下文)组、RA 组为FIRS小鼠+RA 组、NS 组为非FIRS 组(空白对照,生理盐水)。
(2)构建FIRS 小鼠动物模型
FIRS 小鼠动物模型构建FIRS 小鼠模型构建参考国外学者[8-9]进行。 饲养1 周将雌雄小鼠按2 ∶1合笼,次日观察到阴栓的雌鼠视为怀孕第1 天。 孕15 d 时对FIRS 组及RA 组小鼠进行羊膜囊内注射LPS(USA,sigma,0.25~2.5 μg/sac),总量不超过100 μg/kg,NS 组注射等量生理盐水。 注药后观察孕鼠感染、流产等征象,其中流产率10.00%。 建模成功标志:孕鼠分娩后进行胎盘组织镜下观察,可见炎细胞大量浸润、正常绒毛结构消失,伴随水肿及部分纤维化。 本实验小鼠建模成功建模成功率为83.73%。
(3)药物干预
药物干预对上述3 组小鼠进行不同干预,RA组建模成功后于孕17 d 开始,通过MMP-9 抑制剂维甲酸(retinoic acid,RA)(山东良福制药)灌胃,剂量50 μg/(kg·d),至分娩。 FIRS 组、NS 组在孕17 d 使用和RA 组等量生理盐水(normal saline,NS)灌胃,至分娩。
(4)留取标本
组织留取及指标观察从3 组中各随机取3 只孕19 d 孕鼠,行剖宫产手术,留取胎鼠的胎盘、心脏组织,余孕鼠待自然分娩,分别于产后1、7、14 d 处死仔鼠(每组每时间点n=10 只),均留取心脏组织,部分甲醛溶液中固定后石蜡包埋用于HE 染色,余于液氮中迅速冷冻后置-80℃保存用以RT-PCR 检测。
(5)HE 染色观察心肌病理损伤
胎盘及小鼠心脏组织HE 染色镜检:采集的胎盘及心脏组织中性甲醛中固定4 h 后进行制片、HE染色。
(6)RT-PCR 检测IL-6、MMP-9 及TIMP-1 表达量
小鼠心脏组织中IL-6、MMP-9 及TIMP-1 表达量的RT-PCR 测定:将留取的心脏组织中提取总RNA,并进行RNA 纯度及完整性测定。 样本进行反转录,其中引物设计如表1。 并进行实时荧光定量PCR 扩增,读取相对表达量。
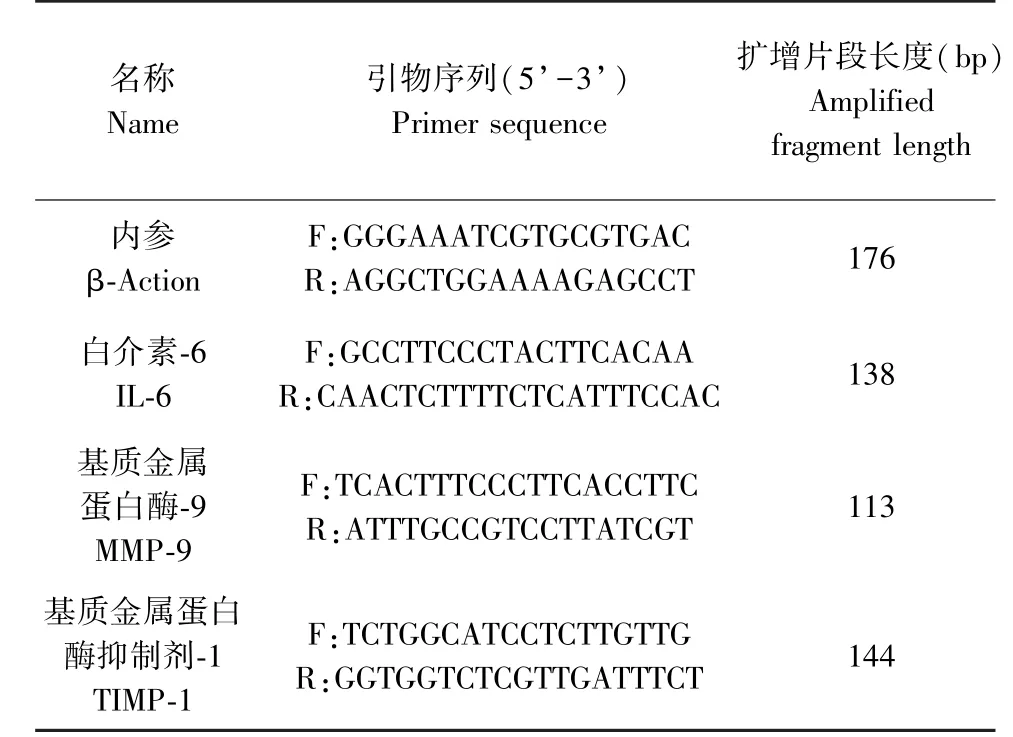
表1 相关指标扩增引物序列Table 1 Amplification primer sequence of related indicators
1.4 统计学方法
数据通过SPSS (21. 0, IBM) 及R 软件(RStudio 2021. 09. 0 Build 351)进行统计分析,相关矩阵图通过R 软件(RStudio 2021. 09. 0 Build 351)进行绘制。 计量资料采用t检验进行分析,多组均数的比较采用重复测量方差分析,相关性分析采用Spearman’s 线性相关。 计数资料比较采用卡方检验或Fisher 确切概率法进行。α=0. 05 为检验水准。
2 结果
2.1 早产儿脐血中IL-6、MMP-9、TIMP-1 及M/T比值表达水平
FIRS 组IL-6、MMP-9、TIMP-1 及M/T 比值分别为(38.53 ± 9.01) pg/L、 (42.27 ± 12.53) ng/L、(110.48±17.06)ng/L、(38.30±9.93)%和非FIRS组(对照组)比较,均高于对照组,差异具有统计学意义(P<0.05),详见表2。

表2 不同组别脐血IL-6、MMP-9、TIMP-1、M/T 比值水平比较(n=118)Table 2 Comparison of cord blood IL-6, MMP-9, TIMP-1, M/T ratio levels in different groups
2.2 不同组别早产儿心脏损伤结局比较
随访期间,FIRS 组患儿心肌损害发生17 例,非FIRS 组心肌损伤发生3 例,FIRS 组心肌损伤率(27.87%)显著高于非FIRS 组(5.26%),差异具有统计学意义(P=0.001),详见表3。

表3 不同组别新生儿心肌损伤发生率比较(n=118)Table 3 Comparison of incidence rates of neonatal myocardial injury in different groups
2.3 胎/仔鼠心脏病理组织改变
分别在小鼠孕19 d、产后1 d、产后7 d、产后14 d 4 个时间节点获取胎/仔鼠心脏标本,制备HE染色组织切片。 结果显示:结果可见FIRS 组心肌组织可见明显出血灶及水肿,心室壁变薄;RA 干预后与FIRS 组病变相似心脏结构变化,但是程度明显减轻,NS 组未见明显心脏组织结构改变,见图1。
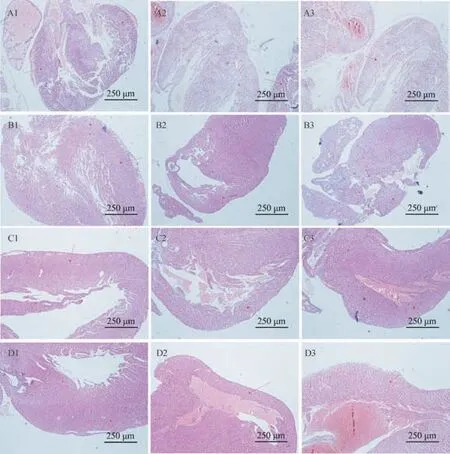
图1 不同时间点胎/仔鼠心脏组织切片图(HE 染色)Note. A1~D1, Control group (NS group)mouse heart tissue at 19 days of gestation, 1, 7, and 14 days after delivery. A2~D2, FIRS group at 19 days of gestation, 1 after delivery heart tissue of mice at day 7, 14 days after delivery. A3~D3, RA group mouse heart tissue at 19 days of gestation, 1, 7, and 14 days after delivery. The positions marked by the red arrows, Typical parts of pathological manifestations. Arrows of A2 and A3 point to two different hearts on the same slide, A2, FIRS group. A3, RA group.Figure 1 Tissue sections of fetal/offspring hearts at different time points (HE staining)
2.4 不同日龄组别胎/仔鼠心脏组织IL-6、MMP-9、TIMP-1 表达水平
FIRS 组小鼠在孕19 d、产后1 d、产后7 d、产后14 d 4 个时间节点IL-6、MMP-9、TIMP-1 mRNA 表达量及M/T 比值显著高于对照组,差异具有统计学意义,P<0.05。 RA 组通过RA 干预后,相同时间节点IL-6、MMP-9 mRNA 表达量及M/T 比值显著高于对照组(P<0.05),但是低于相同时间节点的FIRS 组(P<0.05),详见表4。

表4 不同组别不同胎龄下指标表达量比较(n=10)Table 4 Comparison of index expression in different groups and gestational ages
2.5 FIRS 小鼠心脏组织IL-6 与MMP-9、TIMP-1及M/T 的相关性分析
对FIRS 小鼠心脏组织中IL-6、MMP-9、TIMP-1及M/T 进行相关性分析,结果显示:IL-6 与MMP-9[rMMP-9=0.82,95%CI(0.69,0.90)]、TIMP-1[rTIMP-1=0.66,95%CI(0.44,0.81)]及M/T[rM/T=0.36,95%CI(0.06,0.61)]呈正相关,见图2。

图2 小鼠心脏组织中IL-6 与MMP-9、TIMP-1 及MMP-9 / TIMP-1 比值相关矩阵图Note. Blue dot, Positive correlation. Red dot, Negative correlation.Number of sitting angles, Correlation coefficient.Figure 2 Correlation matrix of IL-6 with MMP-9, TIMP-1 and MMP-9 / TIMP-1 ratio in mouse heart tissue
3 讨论
FIRS 是胎儿时期较为严重的炎症反应疾病,其主要机制为胎儿体内大量炎症因子释放,并激活体内不可控炎症级联反应,最终可能导致患儿的不同脏器损伤[10]。 Tang 等[11]人进行的一项纳入了10项研究共计1116 例患者的Meta 分析,评价了FIRS导致的新生儿不良结局,结果显示:FIRS 可导致新生儿早发败血症(neonatal early-onset sepsis,EOS)、支气管肺发育不良(bronchopulmonary dysplasia,BPD)等相关疾病。 此外,尚有报道证实FIRS 可诱导新生儿的心肌损伤[2,12]。 本研究结果也证实FIRS 新生儿心肌损伤发生率为27.87%,显著高于非FIRS 组(5.26%)。
但是截至目前,FIRS 介导的心肌损伤具体分子机制,尚不明确。 Mitchell 等[13]通过构建灵长类宫内感染模型,来探求FIRS 患者所致心肌损伤的具体机制,结果显示:通过PCR 技术共609 个分子探针来鉴别心脏组织中差异表达的分子,其中FIRS 组心脏组织中IL-6 和白细胞介素-8(interleukin-8, IL-8)显著高于对照组。 此外,炎症因子作为FIRS 重要的致病机制已经成为共识,IL-6 水平变化值已经成为重要的诊断依据[7,14-17]。 因此,炎症因子IL-6的升高,可能是FIRS 导致心肌损伤的潜在病因。
但是IL-6 是直接导致FIRS 介导的心肌损伤,还是通过其他分子途径进行调节,其机制尚不明确。 既往研究表明,炎性细胞因子IL-6 可在炎症感染后发生结构改变,成为活化的前体物质并上调MMP-9 表达。 而MMP-9 可促进炎性细胞的趋化、聚集,加速血管内皮IV 型胶原纤维的降解,破坏脏器结构并加重炎症损伤[18]。 本研究首先对FIRS 新生儿和对照组进行了IL-6、MMP-9 水平的检测,结果显示,FIRS 组中IL-6 和MMP-9 水平显著增加。笔者基于此,进一步设计动物实验,来探讨IL-6 通过调节MMP-9 表达水平介导FIRS 所致心肌损伤的可能机制。
本研究通过羊膜囊注射LPS 来构建小鼠FIRS模型。 结果通过胎盘组织学检测,来判定建模的成功率,本研究建模成功率为83.73%,和既往研究报道相仿[19-21]。 本研究中,FIRS 组心脏组织IL-6、MMP-9、TIMP-1 及M/T 比值显著高于对照组,P<0.05。 此外,人体内存在MMP-9 天然抑制剂TIMP-1,而结果显示FIRS 组M/T 比值显著高于对照组,这提示MMP-9 在心肌损伤的结局中起到了关键性作用。 而进一步的相关性分析结果显示,IL-6 水平的表达和MMP-9、TIMP-1 及M/T 比值呈正相关,进一步验证了IL-6 通过调节MMP-9 发挥FIRS 心肌损伤的机制。
维甲酸(RA)是维生素A 的代谢中间产物,是已经上市获批肿瘤治疗的药物,研究表明RA 具有抑制MMP-9 表达的作用[22]。 Axel 等[23]研究表明RA 可显著降低血管内皮细胞 MMP-9 的表达水平,可逆转心血管疾病的进展。 此外,阳双健等[24]研究发现维甲酸可下调MMP-9 的表达,并进一步增强滋养层细胞侵袭及促血管形成能力。 本研究通过应用RA 来干预FIRS 小鼠,结果显示IL-6、MMP-9、TIMP-1 及M/T 比值相较于FIRS 组均有不同程度下降,P均<0.05。 结果提示,RA 能减轻小鼠体内的炎症反应,对炎症所致的心肌损伤起保护作用,MMP-9 抑制剂相关的药物有可能成为治疗FIRS 早产儿心肌损伤的潜在药物。
综上所述:FIRS 可通过释放IL-6,调节MMP-9、TIMP-1 水平及M/T 比值,介导早产儿心肌损伤的发生,应用MMP-9 抑制剂相关药物可在心肌损伤过程中发挥保护作用,为临床提供潜在治疗药物。

