淫羊藿素通过Hedgehog信号通路抑制基底细胞癌细胞生存和迁移
胡文龙,吴平平,刘灵花,刘友饶
九江学院附属医院,九江 332000
基底细胞癌约占非黑色素瘤皮肤癌的80%,是全球最常见的癌症[1]。大多数基底细胞癌可以通过手术治愈,但对于晚期或进展性基底细胞癌,手术和/或放疗则显得力不从心,甚至可能造成明显的功能或外形的丧失。虽然铂类化疗药物具有显著的抗肿瘤活性,但对患者的生存率却无明显改变[2]。因此,寻求一种新的能改善基底细胞癌预后的治疗方法已十分必要。基底细胞癌来源于滤泡间表皮或毛囊的基底角质细胞[3,4],在95%的散发性基底细胞癌中,刺猬(Hedgehog,Hh)信号通路均出现异常激活[5]。大量研究数据证明,Hh信号通路抑制剂对难治性以及不适合手术或放疗的基底细胞癌患者是非常有效的治疗选择,但同时由于药物不良事件的出现而停止治疗也很常见[6]。因此,开发一种新型的安全有效的Hh信号通路抑制剂将显著改善目前和未来基底细胞癌的治疗前景。淫羊藿素(icaritin)是小檗科淫羊藿属植物淫羊藿的主要活性单体成分。近年来,淫羊藿素的抗肿瘤作用已得到广泛研究,能通过不同信号通路和细胞靶点抑制宫颈癌[7]、食管癌[8]、黑色素瘤[9,10]等多种恶性肿瘤活性,其中Hh信号通路在淫羊藿素抑制食管癌干细胞的增殖、迁移和侵袭的过程中发挥了重要作用[8]。本研究将着重探讨淫羊藿素的抗基底细胞癌活性及其与Hh信号通路的关系,以期为基底细胞癌的治疗提供新的潜在药物。
1 材料与方法
1.1 材料
人皮肤基底细胞癌A431细胞株为九江学院附属医院实验室馈赠;淫羊藿素38226-86-7(成都格利普生物科技有限公司,纯度98.5%)用DMSO溶解后配制成320 mmol/L母液;GANT 61500579-04-4(MedChemExpress公司);胰蛋白酶-EDTA消化液、DMEM高糖培养基、胎牛血清(Gibco公司,批号分别为:25300-054、C11995500BT、10091148);兔抗人Hedgehog、Smo、Gli1、Bcl-2、Bax、MMP-9抗体(Abcam公司,批号分别为:ab53281、ab5694、ab134906、ab32134、ab32503、ab76003);GREENspin细胞RNA快速提取试剂盒、CCK-8试剂盒(上海经科化学科技有限公司,批号分别为:hz-409-1、JK-021);Caspase-3活性测定试剂盒(Solarbio科技有限公司,批号:BC3830);Go Script逆转录试剂盒、Go Taq qPCR Master Mix(Promega公司,批号分别为:A5003、A6001);25 cm2塑料培养瓶、6孔、96孔、Transwell培养板(美国Corning公司);倒置相差显微镜(日本Nikon公司);酶标仪-Model680(美国BIO-RAD公司);化学发光成像分析系统、CO2恒温培养箱(Eppendorf公司)。
1.2 方法
1.2.1 CCK-8检测细胞活力
取对数生长期A431细胞1×104个/孔接种于96孔培养板,常规培养24 h后加药。实验设0、10、20、40、80、160 μmol/L 6个浓度梯度,空白对照组(control,Con)给予含0. 05% DMSO的完全培养基,各组均常规设置8个副孔和2个药物对照(含同组相同浓度药物培养基而不含细胞)孔。分别于作用24 h、48 h、72 h后每孔加入10 μL CCK-8试剂,酶标仪测定其450 nm处吸光度A值,以药物对照孔进行调零,计算细胞活力:细胞活力=(A实验/A对照)× 100%。
1.2.2 Transwell迁移实验
A431细胞按1×105/孔接种于6孔板,随机分组培养。A分组法分为对照组(0 μmol/L)、40 μmol/L组和80 μmol/L组,分别加入相应浓度淫羊藿素预处理24 h。B分组法分为对照组(0 μmol/L)、GANT 61组(10 μmol/L)和GANT 61(10 μmol/L)+Icaritin(80 μmol/L)组,分别加入相应浓度GANT 61和/或淫羊藿素预处理24 h。按以上方法分组培养后常规消化离心,无血清培养基调整细胞密度为1×106个/mL,上室每孔加入相应100 μL细胞悬液,下室均加入600 μL含5%胎牛血清的完全培养基。培养12 h后结晶紫染色,随机选取5个高倍镜视野进行计数。对上室底膜上下室侧附着的细胞进行直接计数。
1.2.3 Caspase-3活性检测
取生长良好的细胞按1×106/孔接种于6孔培养板,待细胞完全贴壁后同A方法分组培养,每组设4个复孔,培养24 h后按Caspase-3活性测定试剂盒说明操作,酶标仪检测各组样品405 nm波长处吸光度,计算Caspase-3活性。
1.2.4 流式细胞术检测细胞凋亡
将对数生长期的A431细胞常规接种于6孔板后同A方法分组培养24 h,收集各组细胞,调整细胞密度为1×106个/mL,取1 mL细胞悬液用预冷PBS洗涤离心2遍,先后加入200 μL Binding Buffer、10 μL Annexin V-FITC和10 μL PI,室温避光反应15 min后加入300 μL Binding Buffer,流式细胞仪定量检测细胞凋亡率。
1.2.5 qPCR检测mRNA表达水平
同“1.2.2”方法分组培养24 h后,按GREENspin细胞RNA快速提取试剂盒、Go Script逆转录试剂盒说明书提取细胞总RNA,逆转录为cDNA,按Go Taq qPCR Master Mix配制反应体系进行PCR扩增。引物序列及产物大小见表1。
1.2.6 Western blot检测蛋白表达水平
分组培养48 h后提取各组细胞总蛋白,BCA法测定蛋白浓度,进行SDS-PAGE凝胶电泳,依次进行转膜、封闭,孵育一抗、二抗,采用化学发光成像系统观察分析条带。内参为GAPDH,目的蛋白包括Hedgehog、Smo、Gli1、Bcl-2、Bax和MMP-9。

表1 引物序列和产物大小
1.2.7 统计学处理
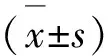
2 结果
2.1 淫羊藿素抑制A431细胞活力
CCK-8结果显示,不同浓度的淫羊藿素均能抑制基底细胞癌A431细胞增殖,造成细胞活力下降,药物浓度越高,抑制作用越强;同一浓度下,细胞活力随作用时间延长而下降。80 μmol/L的淫羊藿素作用48 h时抑制作用开始进入平台期,再增加作用浓度和时间,细胞活力下降不明显(见图1)。以上实验结果表明,80 μmol/L的淫羊藿素具有强大的抑制A431细胞活性的作用。计算得IC50=54.78 μmol/L,因此,后续实验均参考该实验结果设40 μmol/L和80 μmol/L两个浓度作为实验组,作用时间为24 h。
2.2 淫羊藿素抑制A431细胞迁移
Transwell迁移实验发现,淫羊藿素作用24 h后对基底细胞癌A431细胞的迁移能力具有明显的抑制作用(P<0.05),40 μmol/L组的抑制率可达约68.9%,而80 μmol/L组的抑制率高达91.1%,呈现出浓度依赖性(见图2)。
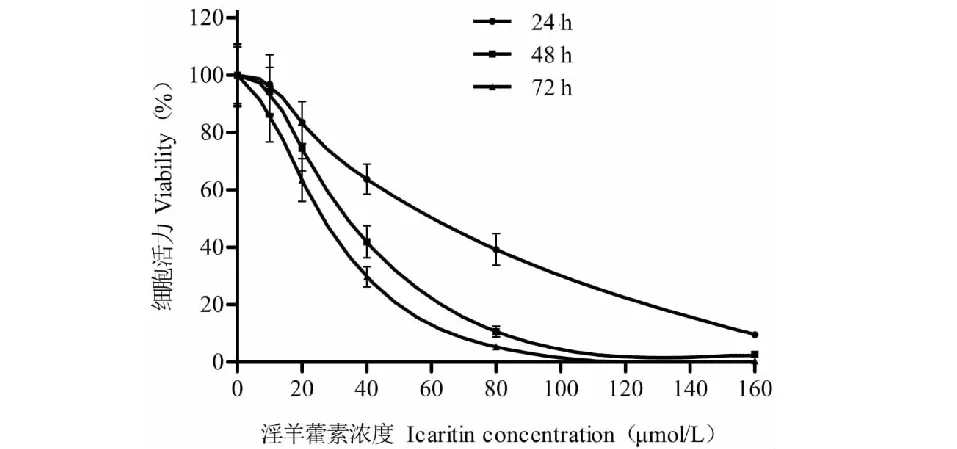
图1 CCK-8检测细胞活力Fig.1 Cell viability assay by CCK-8
2.3 淫羊藿素增强A431细胞Caspase-3活性诱导细胞凋亡
淫羊藿素(40、80 μmol/L)作用的A431细胞Caspase-3活性明显增强(P<0.05),且活性随浓度升高而增高(见图3)。进一步的流式细胞术结果显示,40 μmol/L和80 μmol/L组A431细胞的凋亡率分别为15.42%和42.87%,对照组凋亡率为2.21%,不同浓度的淫羊藿素均具有诱导基底细胞癌细胞凋亡的作用(P<0.05),且80 μmol/L较40 μmol/L的淫羊藿素促凋亡作用更强(见图4)。
2.4 淫羊藿素对Hh信号通路及凋亡、迁移相关基因转录及蛋白表达的影响
qPCR结果显示:与对照组相比,40 μmol/L和80 μmol/L的淫羊藿素均能下调Shh、Smo、Gli1、Bcl-2和MMP-9的转录水平(P<0.05),且高浓度的抑制作用更强,而促凋亡基因Bax的mRNA水平则明显增强(P<0.05)(见图5)。Western blot与qPCR结果一致,淫羊藿素能够抑制Hh信号通路相关因子及MMP-9蛋白的表达,促进凋亡因子Bax的表达同时抑制抗凋亡因子Bcl-2(见图6)。以上结果表明,淫羊藿素能够抑制Hh信号通路,启动细胞凋亡程序。

图2 淫羊藿素抑制A431细胞迁移Fig.2 Icaritin inhibited the migration of A431 cells注:与空白对照组比较,*P<0.05;与40 μmol/L组比较,#P<0.05。Note:Compared with control group,*P<0.05;Compared with 40 μmol/L,#P<0.05.
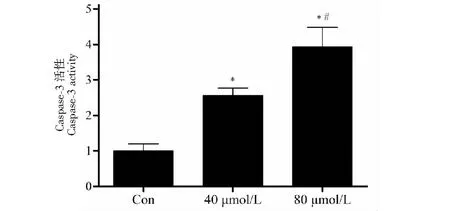
图3 不同浓度淫羊藿素对A431细胞caspase-3活性的影响Fig.3 Effects of icaritin at different concentrations on Caspase-3 activity in A431 cells注:与对照组比较,*P<0.05;与40 μmol/L组比较,#P<0.05。Note:Compared with control group,*P<0.05;Compared with 40 μmol/L,#P<0.05.
2.5 淫羊藿素主要通过抑制Hh信号通路上调凋亡相关因子并下调迁移相关因子的表达
GANT 61是Hh信号通路Gli1和Gli2的靶向抑制剂,Western blot结果也表明GANT 61具有强大的抑制Gli1表达的作用。GANT 61能明显上调Bax的表达,同时下调Bcl-2与MMP-9的表达(P<0.05),而使用GANT 61抑制Hh信号通路后,淫羊藿素对Bcl-2、BAX的表达均不能产生明显影响,对MMP-9则仍具有一定的抑制作用(P<0.05)(见图7)。
2.6 淫羊藿素通过抑制Hh信号通路介导基底细胞癌细胞凋亡
Caspase-3细胞活性检测表明使用GANT 61抑制Hh信号通路后,A431细胞Caspase-3活性明显增加(P<0.05),而淫羊藿素并不能进一步介导细胞凋亡(见图8)。
2.7 淫羊藿素通过抑制Hh信号通路抑制基底细胞癌细胞迁移
Transwell迁移实验结果显示,Hh信号通路被抑制后(GANT 61),A431细胞细胞迁移能力明显下降(P<0.05),而淫羊藿素未能加强抑制细胞迁移的作用(见图9)。
3 讨论与结论
Hh信号通路参与了肿瘤组织的启动、迁移和凋亡等多种生物学行为,与多达三分之一的恶性肿瘤的形成、发展有关[11]。Hedgehog蛋白在脊椎动物中至少有音速刺猬因子(sonic hedgehog,Shh)、印度刺猬因子(india hedgehog,Ihh)和沙漠刺猬因子(desert hedgehog,Dhh)三个基因编码,其中Shh在皮肤、神经系统和消化道中广泛表达,作用于Patched(Ptc)和Smothened(Smo)两种细胞膜受体。在正常生理状态下,Hh配体常常缺失,Ptc与Smo结合,抑制Smo蛋白活性,进而阻止下游胶质瘤相关癌基因(glioma-associated oncogene,Gli)转录因子(Gli1、GliI2和Gli3)向核内转移。当Hh蛋白和Ptc结合以后,解除了对Smo的抑制,可使全长Gli蛋白进入核内并激活下游靶基因转录[11,12]。研究表明,高达95%的基底细胞癌均出现Hh信号通路异常激活,其中约67%表现为Ptc缺失,10%表现为Smo突变[13-15],导致Gli进入细胞核并促进细胞分裂和肿瘤形成[13]。因此,靶向抑制Hh信号通路将可能有效抑制基底细胞癌的发展,而对正常组织细胞无明显影响。
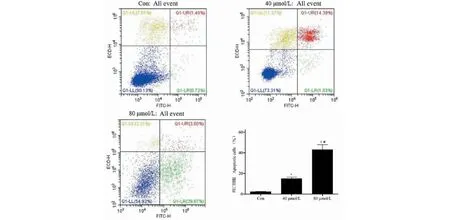
图4 流式细胞术比较不同浓度淫羊藿素对A431细胞凋亡率的影响Fig.4 Comparison of the effect of icaritin at different concentrations on apoptosis rate in A431 cells by flow cytometry注:与对照组比较,*P<0.05;与40 μmol/L组比较,#P<0.05。Note:Compared with control group,*P<0.05;Compared with 40 μmol/L,#P<0.05.
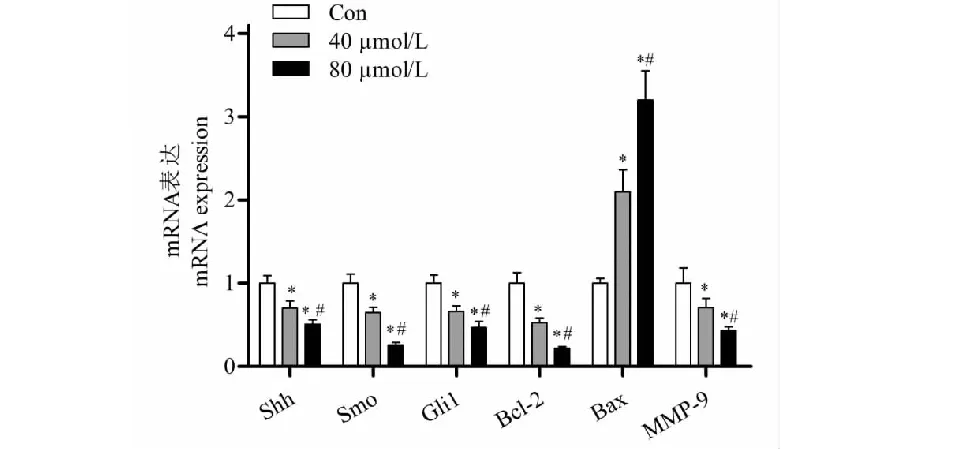
图5 Hedgehog、Smo、Gli1、Bcl-2、MMP-9和Bax的mRNA表达水平Fig.5 The mRNA expression levels of Hedgehog,Smo,Gli1,Bcl-2,MMP-9 and Bax注:与对照组比较,*P<0.05;与40 μmol/L组比较,#P<0.05。Note:Compared with control group,*P<0.05;Compared with 40 μmol/L,#P<0.05.
淫羊藿是在亚洲传统医学中常被用作滋补药、壮阳药,具有广泛的治疗能力。大量体内、外研究表明淫羊藿素具有广泛的抗肿瘤活性,通过凋亡、细胞周期调节、抗血管生成、抗转移和免疫调节等多种机制发挥作用[16]。其中,抑制Hh信号通路是淫羊藿素抑制食管癌细胞的主要作用机制[8]。本研究发现淫羊藿素具有广泛地抑制基底细胞癌A431细胞Hh信号通路相关因子(Hedgehog、Smo、Gli1)的作用,同时能够介导细胞凋亡并抑制其迁移。这表明,淫羊藿素可能通过抑制Hh信号通路发挥抗基底细胞癌的作用。
Gli是Hh信号通路的核心成员,其调控的下游靶基因包括通路本身成员Ptch1、Ptch2、Gli1和肿瘤细胞凋亡调控因子(Bcl-2)、细胞周期调控因子(CCND2)、细胞转移相关因子等[11]。MMP-9是目前研究最广泛的基质金属蛋白酶之一,可裂解多种细胞外基质蛋白,调节细胞外基质的重构,与肿瘤的侵袭、转移和血管生成等密切相关[17],在肝癌[18]、口腔鳞状细胞癌[19]、神经母细胞瘤[20]等肿瘤中高表达并与Hh信号通路密切相关。为了进一步阐明淫羊藿素抑制A431细胞的作用与Hh信号通路的关系,本研究使用GANT 61抑制Gli从而达到封闭Hh信号通路的作用,结果发现Gli1、Bcl-2、MMP-9表达明显下调而Bax明显上调,并出现细胞凋亡增加和迁移抑制,淫羊藿素具有调控以上细胞因子和行为的同样作用,但当Hh信号通路被抑制后,淫羊藿素则失去了对Bcl-2、Bax的调控作用,仅仅轻度增强了对MMP-9的抑制作用,细胞凋亡和迁移也未出现明显变化,说明淫羊藿素并未通过其他信号通路明显作用于A431细胞,但其对MMP-9的调控可能存在其他信号通路,仍有待进一步研究。因此,可以认为淫羊藿素可能主要通过抑制Hh信号通路,促进凋亡相关因子的表达,介导基底细胞癌细胞凋亡,同时下调MMP-9的表达,抑制基底细胞癌细胞的迁移。

图6 Hedgehog、Smo、Gli1、Bcl-2、Bax和MMP-9的蛋白表达水平Fig.6 The protein expression levels of Hedgehog,Smo,Gli1,Bcl-2,Bax and MMP-9注:与对照组比较,*P<0.05;与40 μmol/L组比较,#P<0.05。Note:Compared with control group,*P<0.05;Compared with 40 μmol/L,#P<0.05.

图7 GANT 61和/或淫羊藿素作用A431细胞后Gli1、Bcl-2、Bax和MMP-9的蛋白表达水平Fig.7 Changes in Gli1,Bcl-2,Bax and MMP-9 protein levels of A431 cells incubated with GANT 61 and/or icaritin注:与对照组比较,*P<0.05;与GANT 61组比较,#P<0.05。Note:Compared with control group,*P<0.05;Compared with 40 μmol/L,#P<0.05.

图8 GANT 61和/或淫羊藿素对A431细胞Caspase-3活性的影响Fig.8 Effects of GANT 61 and/or icaritin on Caspase-3 activity in A431 cells注:与对照组比较,*P<0.05;与GANT 61组比较,#P<0.05。Note:Compared with control group,*P<0.05;Compared with GANT 61,#P<0.05.
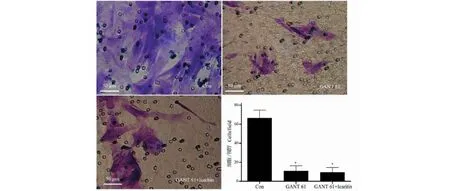
图9 GANT 61和/或淫羊藿素对A431细胞迁移的影响Fig.9 Effects of GANT 61 and/or icaritin on A431 cells migration注:与对照组比较,*P<0.05;与GANT 61组比较,#P<0.05。Note:Compared with control group,*P<0.05;Compared with GANT 61,#P<0.05.
综上,本研究表明淫羊藿素能通过抑制Hh信号通路抑制基底细胞癌细胞的生存和迁移能力,为其作为靶向药物或者辅助治疗药物治疗基底细胞癌提供了新的思路和方案。

