大鼠血液外泌体中外源性γ-羟基丁酸的检测
郜峥翔,罗奇志,张亮,裴茂清,王慧君,岳霞
1.南方医科大学法医学院,广东 广州 510080;2.广东省公安厅刑事技术中心,广东 广州510050
γ-羟基丁酸(gamma-hydroxybutyrate,GHB)是一种直链羧酸,分子式为C4H8O3,分子量为104.1[1-2]。GHB 是一种强效的、快速作用于中枢神经系统的抑制剂,同时也是一种微量的内源性生物物质,在哺乳动物体内主要来源于抑制性神经递质γ-氨基丁酸(gamma-aminobutyric acid,GABA)的代谢[3]。外源性GHB 摄入的药理学效应具有剂量依赖性,低剂量摄入会引起欣快感[4],在高剂量下会导致机体恶心、呕吐和意识丧失[5],单次急性过量摄入后可发生致命性呼吸抑制。此外,服用GHB 会引起顺行性遗忘。口服GHB 经肠道迅速吸收,约20~40 min 达到最大血药浓度,其血液半衰期较短(30~50 min),体内代谢后只有1%~5%的原型从尿液中排出[6]。由于GHB 血液半衰期短,并具有引起顺行性遗忘的特点,因此常被用作迷奸药,多见于药物辅助性犯罪案件(drug facilitated sexual assault,DFSA)中,在我国俗称“听话水”“G 水”“神仙水”等,有关GHB 的案件时有发生[7-8],由此带来一系列严重的社会问题。我国于2001 年将GHB 列为二类精神药物予以管制,后于2007年将其列为一类精神药物[9]。γ-丁内酯(gamma-butyrolactone,GBL)是GHB 的前体物质,这种物质在外源性给药后经体内的酶促反应迅速转化为GHB 并发挥药理学效应,其吸收速度快、转化率高[10]。然而与GHB 不同的是,GBL 由于具有工业等用途而没有被法律禁止,易于获得,经常被用作GHB 的合法替代品。在实际工作中,由于GHB 血液半衰期短并具有内源性分布的特性,导致GHB 相关法医学鉴定存在时限性问题以及难以鉴别内、外源性的困难。
外泌体(exosome)是一类能被机体大多数细胞分泌的微小囊泡,具有单层膜结构,直径30~150 nm,广泛分布于各种体液中,如尿液、唾液、血液、脑脊液等[11-12]。外泌体内包含微小RNA(microRNA,miRNA)、脂质、蛋白质等多种成分,不仅能清除体内的有害物质,同时还作为一种细胞间信息传递的媒介参与细胞的生命活动,在许多病理生理过程中起着重要的作用,研究[13-14]表明其可作为多种疾病进展及预后的生物标志物。鉴于外泌体在体内广泛存在以及内含物多样化的特点,本研究拟通过定量血液外泌体中的GHB,探索以外泌体为载体检测GHB 是否比血液更有优势以及外泌体是否可作为判断外源性药物摄入的依据。
1 材料与方法
1.1 主要仪器与试剂
Triple Quad 5500 质谱仪(美国AB Sciex 公司),Nexera X2 LC-30A 超高效液相色谱仪[岛津企业管理(中国)有限公司],Milli-Q IQ7000 超纯水系统(德国Merck 公司),Vortex-Genie 2 涡旋混合器(美国Scientific Industries 公司),Optima XPN-100 超速离心机(美国Beckman Coulter 公司),SorvallTMST 40R冷冻离心机(美国Thermo Scientific 公司),H-7650 型透射电子显微镜(日本日立公司)。
GHB(标准品)购自北京芬格尔安科技有限责任公司,GBL(分析纯96%)购自深圳市益百顺科技有限公司,甲醇(色谱纯)、乙腈(色谱纯)购自德国Merck公司,乙酸铵(色谱纯)购自上海阿拉丁生化科技股份有限公司,甲酸(色谱纯)购自上海麦克林生化科技有限公司,兔抗分化抗原63(cluster of differentiation 63,CD63;1∶1 000)抗体、兔抗肿瘤易感基因101(tumor susceptibility gene 101,TSG101;1∶1 000)蛋白抗体、辣根过氧化物酶(horseradish peroxidase,HRP;1∶3 000)标记山羊抗兔二抗购自英国Abcam 公司。
1.2 动物模型
成年雄性SD 大鼠12 只,体质量250~300 g,购自南方医科大学实验动物中心。将大鼠随机分为对照组和给药1 h、5 h、10 h 组,每组3 只。实验开始前1 周,将大鼠饲养在恒温恒湿(25 ℃,湿度55%)条件下,给予12 h 光照和12 h 黑暗循环,自由摄入水和食物。给药1 h、5 h、10 h 组大鼠单次腹腔注射GBL(600 mg/kg)后持续监测动物的生理情况(包括意识状态、体温和呼吸频率),分别于1 h、5 h、10 h 后麻醉并腹主动脉采血。对照组大鼠腹腔注射等量生理盐水1 h 后采取同样方式采血。每只大鼠采血5 mL,均保存至抗凝管,其中0.5 mL 全血备用,剩余4.5 mL 全血经差速超速离心分离外泌体。
所有动物实验均符合《实验动物管理和使用指南》的规定,并获得南方医科大学实验动物管理委员会的批准(审批号L2016074)。
1.3 外泌体分离及鉴定
将4.5 mL全血按照如下操作进行离心:(1)1 000×g离心15 min,收集上清液;(2)3 000×g离心15 min,收集上清液;(3)100 000×g离心70 min,弃去上清液,沉淀物重悬于1 mL 磷酸盐缓冲液(phosphate buffer saline,PBS);(4)100 000×g离心70 min,弃去上清液,沉淀物重悬于0.2 mL PBS 后保存备用[15]。采用透射电子显微镜对分离后外泌体的大小及形态进行鉴定,并通过Western 印迹法检测外泌体分子标志物CD63和TSG101[16-17]。
1.4 样本前处理
血液:取全血0.5 mL,加入1.0 mL 甲醇涡旋混合3 min,18 000×g离心10 min,取上清液,经Nexera X2 LC-30A 超高效液相色谱仪和Triple Quad 5500 质谱仪对GHB 进行检测。
外泌体:取1.3 节操作所得外泌体悬液0.2 mL,加入0.2 mL 甲醇涡旋混合3 min,18 000×g离心10 min,取上清液,经Nexera X2 LC-30A 超高效液相色谱仪和Triple Quad 5500 质谱仪对GHB 进行检测。
1.5 仪器条件
本研究采用超高效液相色谱-质谱法(ultra-high performance liquid chromatography-mass spectrometry,UPLC-MS)检测大鼠血液中GHB,其中超高效液相色谱作为质谱的进样系统,质谱作为检测器进行定性、定量分析技术。
色谱条件:Allure PFPP 色谱柱(2.1 mm×150 mm,5 μm)、Allure PFPP 预柱(2.1 mm×5 mm,5 μm)均购自美国Restek 公司;流动相A 为20 mmol 乙酸铵水溶液(含0.1%甲酸),流动相B 为乙腈(含0.1%甲酸);流速为0.2 mL/min,柱温为40 ℃,进样量为2 μL。
质谱条件:采用电喷雾离子源(electrospray ionization,ESI)负离子模式,多反应监测(multiple reaction monitoring,MRM)模式检测。GHB 特征离子对为103.0>57.1(定量)、103.0>85.1;锥孔电压-40 V,碰撞能量-18/-13 V;气帘气0.172 3 MPa,碰撞气设置为“Medium”;喷雾电压500 V,雾化温度550 ℃;雾化气0.334 5 MPa;辅助气0.413 4 MPa。
1.6 标准曲线配置
取GHB 标准品储备液(质量浓度为1.0 mg/mL),用甲醇逐级稀释成5.0、10.0、20.0、50.0、100.0、200.0、500.0、1 000.0 ng/mL 质量浓度梯度的标准溶液用于外泌体中GHB 的定量分析。
另取对照组空白血液6 份,每份0.5 mL,分别加入20.0、50.0、100.0、200.0、500.0、1 000.0 ng/mL 质量浓度梯度的GHB 标准溶液500 μL,按照1.4 节前处理方式进行处理,并通过Nexera X2 LC-30A 超高效液相色谱仪和Triple Quad 5500 质谱仪检测,绘制GHB工作曲线。
1.7 Western 印迹法检测
经差速超速离心分离得到的沉淀物中加入裂解液,并采用二喹啉甲酸(bicinchoninic acid,BCA)进行蛋白定量[18]。10%聚丙烯酰胺凝胶电泳并转移到聚偏二氟乙烯(polyvinylidene difluoride,PVDF)膜,5%脱脂奶粉常温封闭2 h,一抗4 ℃孵育过夜,二抗常温孵育1 h,增强化学发光(enhanced chemiluminescence,ECL)试剂盒法发光显影。
1.8 统计分析
使用GraphPad Prism 8.0 软件(美国GraphPad Software 公司)对数据进行统计分析。采用独立样本t检验比较两组间的差异,检验水准α=0.05。
2 结果
2.1 GHB 药理学效应
给药组大鼠在腹腔注射GBL 后,于5~10 min 内逐渐失去意识并陷入深度昏迷状态,伴随呼吸频率及体温的降低,药理学效应在给药2.5~3 h 后逐渐消失至完全苏醒,且恢复后无后遗效应。
2.2 外泌体鉴定
血液样本经差速超速离心后,沉淀物经透射电子显微镜观察到形状为类球形、直径为30~150 nm 的小囊泡结构(图1A),并且Western 印迹法检测到外泌体分子标志物CD63 和TSG101 的表达(图1B)。形态学及分子标志物鉴定证实离心沉淀物即为外泌体。

图1 血液外泌体的鉴定Fig.1 Identification of blood exosomes
2.3 GHB 检测结果
2.3.1 血液
对照组与给药组大鼠血液样本中均检测到与标准品一致的GHB 峰值信号(图2)。数据处理结果显示,对照组大鼠血液中GHB 质量浓度为(87.36±33.48)ng/mL,考虑到生物内源性GHB 的存在,因此,这一结果代表了大鼠血液GHB 的正常生理水平。给药1 h、5 h、10 h 组大鼠血液中GHB 质量浓度分别为(110 400.00±1 766.35)、(1 479.00±687.01)和(133.60±12.17)ng/mL(表1)。给药1 h 和5 h 组与对照组之间差异均有统计学意义(P<0.05),而给药10 h 组与对照组之间差异无统计学意义(P>0.05)。
2.3.2 外泌体
外泌体检测结果显示,对照组及给药10 h 组均未检测到GHB 峰值信号,仅在给药1 h 和5 h 组检测到峰值信号(图2),其GHB 质量浓度分别为(91.47±33.44)和(49.43±7.05)ng/mL(表1)。

表1 各组血液及外泌体中GHB 的质量浓度Tab.1 The concentration of GHB in blood and exosomes of each group(n=3,xˉ±s,ng/mL)
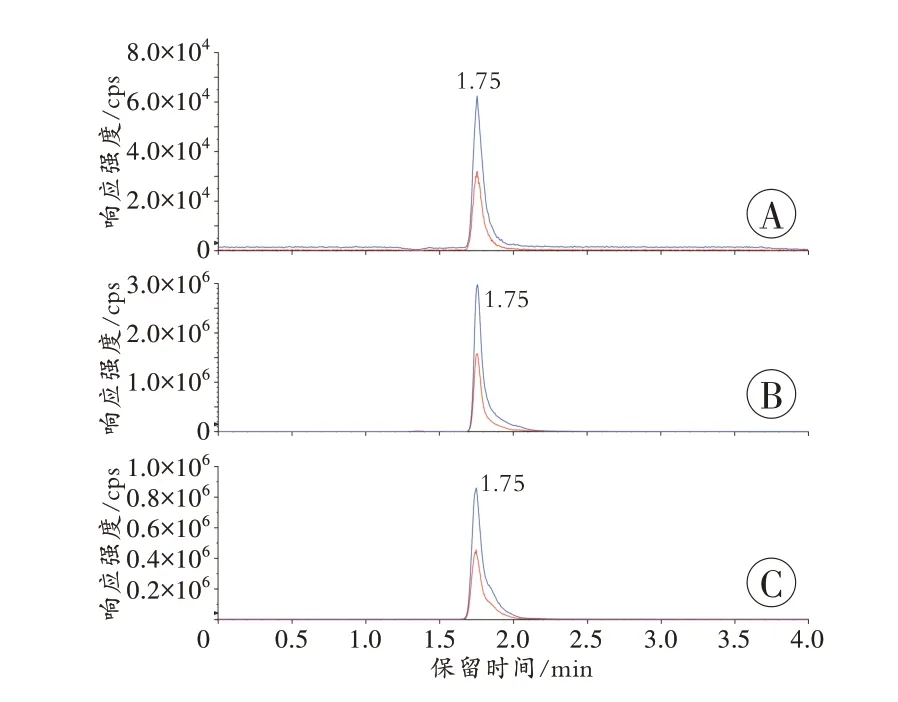
图2 给药1 h 组样本中GHB 的选择离子流图Fig.2 Selective ion flow diagrams of GHB in the samples at 1 h group
3 讨论
目前,涉及GHB 的违法犯罪案件中,判断是否有外源性摄入仍是一个棘手的问题。一方面是由于机体内源性分布,另一方面是因为该物质在体内代谢迅速,以致受害人接受检查时,所测出的GHB 不能区分是体外的还是体内的,或者其中哪些是体外的、哪些是体内的。此外,直接检测血液中GHB,其窗口期往往只有6~8 h,且需要设定一个区分内、外源性的截断值(cut-off 值),cut-off 值过低可能带来假阳性结果,而cut-off 值过高可能带来假阴性结果[19]。
GBL 作为GHB 的前体物质,在体内通过钙依赖性内酯酶的催化迅速转化为GHB,故一般很难在生物样本中检测到GBL,因此,鉴定实践中仍以GHB 作为分析对象[20]。此外,研究[10]表明,GBL 吸收速度快、生物利用度好,并且转化为GHB 的效率极高,因此,外源性GBL 给药后实际发挥药理学效应的是GHB。考虑到GBL 尚未被归类为管制药物,获取方式较易,并且进入机体后实际发挥药理学效应的是GHB,故本研究采用GBL 进行外源性给药,并采用UPLC-MS法对体内GHB 进行检测[21]。
本研究观察到,大鼠腹腔注射GBL 后短时间内进入无意识状态,并伴随着呼吸频率及体温的下降,说明GBL 在体内已转化为GHB 并发挥药理学效应,这表明动物建模成功。血液检测结果显示,大鼠给予外源性GBL 注射后,其血液GHB 质量浓度仅在给药1 h和5 h 组与对照组之间差异具有统计学意义,而在10 h组已基本降至生理水平,这是由于其血液半衰期短、体内代谢迅速造成的。此外,血液经差速超速离心得到的沉淀物中观察到形态与大小均与外泌体相符的小囊泡结构,并且检测到外泌体分子标志物的表达,这表明本研究成功提取到血液外泌体。与血液检测结果不同,对照组大鼠血液外泌体中未检测到GHB峰值信号,而仅在给药1 h 和5 h 组检测到GHB。基于此,初步推测生理水平的GHB 不会进入血液外泌体或进入量极少(低于检出限),而外源性GHB 进入血液以后,部分会进入外泌体并暂时储存。也就是说,血液外泌体中一旦检出GHB,就可以认为是外源性的。
GHB 作为中枢神经系统抑制剂,其药理学机制涉及多种神经递质系统,主要包括GHB 特异性受体、GABAB受体以及多巴胺递质系统[22]。外源性GHB 对中枢神经系统的抑制作用主要是由GHB 特异性受体介导,一方面通过GHB 受体减少多巴胺释放,另一方面作为间接的多巴胺受体拮抗剂发挥作用[23]。此外,外源性高浓度的GHB 也会与GABAB受体结合,引起膜超极化进而导致对中枢神经系统的抑制作用。在正常生理情况下,内源性低浓度的GHB 与上述受体结合较弱,因此几乎无中枢抑制效应。上述特性是否影响血液外泌体中GHB 的检出,有待进一步研究。
本研究发现,只有外源性GHB 能够在大鼠血液外泌体中检出,这可能是鉴别是否有外源性GHB 摄入的重大突破。由于本研究还处于实验阶段,目前的数据仅来源于大鼠,仍需在人体血液样本中进行验证以及采用其他检测手段再次证实,以获得更加可靠的结果。

