关于对消法测定电池电动势实验中标准电池的讨论
郭慧林,许文华
西北大学化学与材料科学学院,西安 710127
采用对消法测定电池电动势时,除电位差计之外,还需要一个电动势已知且稳定不变的标准电池——韦斯顿电池。然而,无论是理论课教材还是实验教材,关于标准电池的介绍都较为简单,且教材中对标准电池中电解质溶液饱和与否没有严格区别,使得电极反应和电池反应的表达不一致[1],也没有讨论溶液饱和与否对电池可逆性和稳定性的影响[2]。本文首先概述了标准电池的发展简史,其次讨论了不饱和与饱和标准电池的电动势的稳定性、可逆性,然后分析了饱和标准电池其负极标准电极电势的内涵,最后总结了标准电池在使用中应注意的事项。
1 标准电池概述
早在19世纪,随着人类社会进入电气时代,人们迅速意识到建立电压标准的重要性。理想的电压标准应该是精确的,可重复度高,对温度依赖小,而且方便实验室快速构建。早期使用的电压标准是丹尼尔电池(Daniel cell),但是该电池寿命短,电压稳定性不够好。随后采用的克拉克电池(Clark cell)具有较大的温度系数。1893年英裔美国电气工程师爱德华·韦斯顿(Edward Weston)发明了韦斯顿电池(Weston cell),由于其具有高度稳定的电动势,多用于实验室中电位计的校准。1911年该电池被采纳为电动势的国际标准,故而也称为标准电池[3]。直到1990年,电压标准才被基于约瑟夫森结(Josephson junction)的新标准代替并延续至今。电压标准从依赖于某个物理装置转变为依赖于体系内禀的性质,在精度等多个方面都实现了一次飞跃。韦斯顿标准电池在接近一个世纪的漫长时间里为各种电现象的研究提供了高精度的电压标准,是一个卓越的发明。
从研究的角度看,随着1990年电压标准的改变,自然而然,关于韦斯顿标准电池的研究工作变得非常少,在应用中也被逐渐取代。标准电池的应用领域相对来说非常单一,即提供校准等高精度电压的参考。作为可逆电池,它需要在几乎没有电流通过的环境下工作,这一点与作为电源提供电能的常见电池有着本质的不同。我国科学家胡衍瑞等曾对韦斯顿标准电池做出突出贡献,有兴趣的读者可参阅文献[4]。
具体讲,根据使用的电解质溶液是否饱和,韦斯顿标准电池可分为饱和标准电池和不饱和标准电池两种。前者精度更高,是作为标准电压使用时真正采用的,曾经被保存在很多国家的计量局中。后者精度虽然差些,但更便携,因此更方便使用。本文将结合大学物理化学课程及物理化学实验的背景,通过分析饱和、不饱和韦斯顿标准电池的性质,提升学生对原电池基础理论和热力学的综合理解。
2 韦斯顿标准电池
韦斯顿标准电池的负极为镉汞齐(含Cd的质量分数为0.05-0.14),正极是汞-硫酸亚汞电极,电解液则采用单一电解质——硫酸镉水溶液。其电池表达式为:
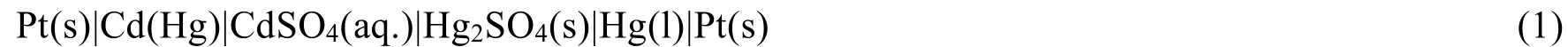
根据硫酸镉电解质溶液饱和与否,分为饱和标准电池和不饱和标准电池,如图1所示。
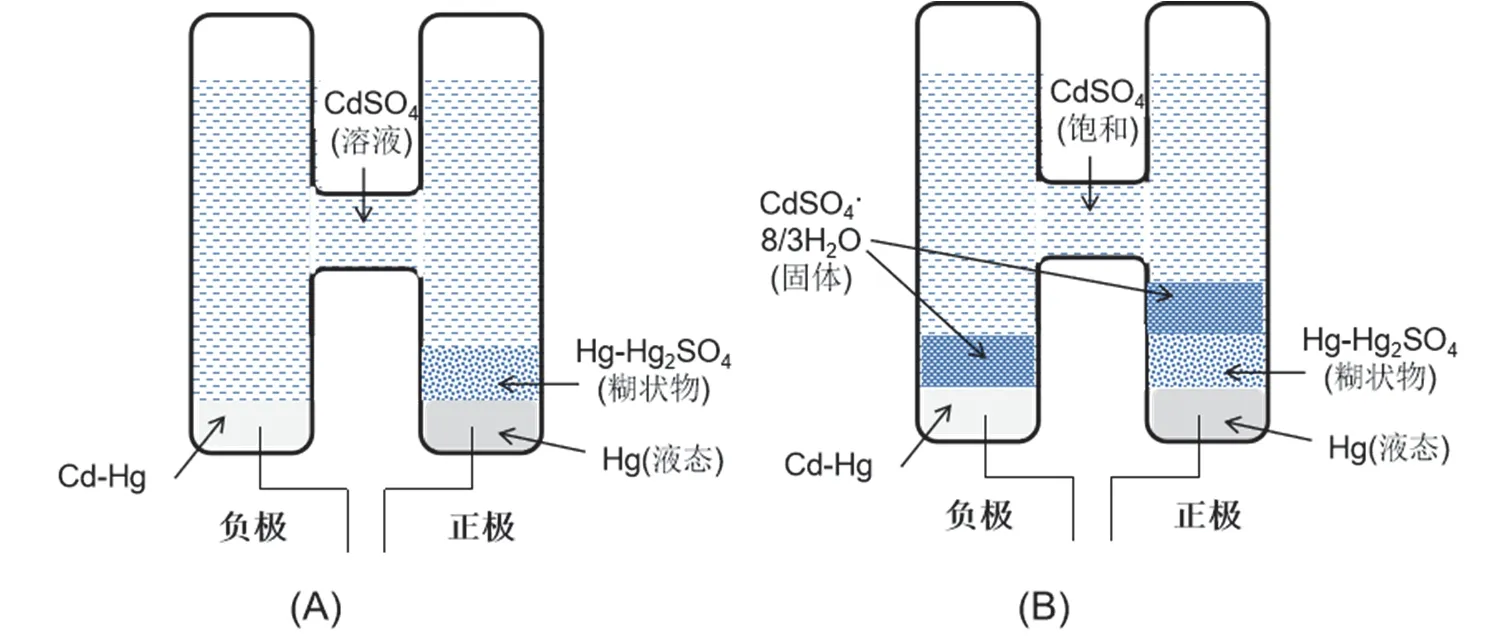
图1 标准电池示意图
2.1 不饱和标准电池及其电动势
对于不饱和标准电池,其电极反应为:
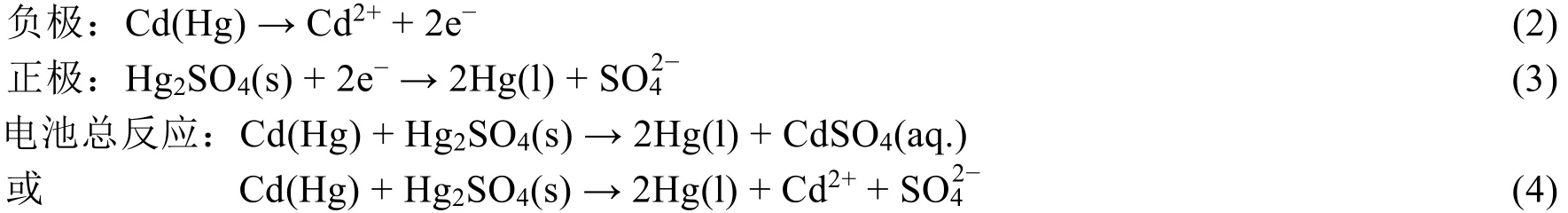
需要说明,在负极Cd(Hg)中的Cd失去电子被氧化后以Cd2+进入水溶液,液态Hg作为溶剂其数量与性质并未发生变化,故而不应出现在反应(2)中;在正极Hg2SO4(s)中Hg22+得到电子被还原生成2Hg(l),液态Hg参与了电极反应,2Hg(l)应该写出。
由能斯特(Nernst)方程:
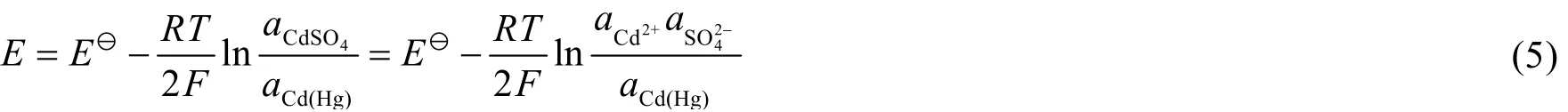
式中E和EӨ分别为电池的电动势和标准电动势,a为对应物质的活度。可以看出,在一定温度下,不饱和标准电池的电动势不但与Cd(Hg)中Cd的活度有关,还与CdSO4溶液的活度有关,且电池电动势随着CdSO4溶液浓度的增加而减小。
此外,与饱和标准电池相比,由于不饱和电池在充放电过程中负极反应涉及金属离子的不可逆扩散过程,从而造成其电池可逆性相对较差。在不饱和电池中,CdSO4溶液浓度越大,不可逆扩散越小,浓差极化也越小,电池的可逆性越好。
2.2 饱和标准电池及其电动势
饱和标准电池的电解质为饱和CdSO4溶液,溶液中还同时存在CdSO4饱和溶液与其水合物CdSO4·(8/3)H2O的平衡。
因此,饱和标准电池的负极反应可写作反应(7),即反应(2)与(6)之和[5]:
其电极表达式可写作Cd(Hg)|CdSO4·(8/3)H2O(s)|CdSO4(Sat.)。根据可逆电极的分类,该负极可看作为一个第二类电极(难溶盐电极或微溶盐电极)[6]。
正极反应(3)不变,因而饱和标准电池的总反应为:
饱和标准电池的表达式则为:
由能斯特(Nernst)方程:

可以看出,一定温度下,饱和标准电池的电动势仅仅与Cd(Hg)中Cd的活度有关。
3 负极的标准电极电势的讨论
需要指出,由于饱和与不饱和标准电池中,负极反应不同,其标准电极电势不同,对应的标准电池电动势也不同。
根据前面的讨论,当电解质为不饱和溶液时,负极反应为式(2),对应的电极电势为:

与一般金属电极不同,汞齐电极是溶解在液态汞中的金属与水溶液中的金属离子之间的平衡,Mz++ze-M(Hg),汞本身不参与电极反应[7]。汞齐电极的标准电极电势φӨ[Mz+|M(Hg)]与金属在其离子水溶液中的标准电极电势φӨ[Mz+|M]不同。一般定义汞齐电极的标准电极电势φӨ[Mz+|M(Hg)]为金属活度等于1的汞齐与金属离子活度等于1的水溶液之间的平衡电势[8]。表1列出298.15 K标准压力下,一些汞齐电极的标准电极电势及温度系数[9]。
表1 298.15 K标准压力下,一些汞齐电极的标准电极电势及温度系数* [9]
当电解质为饱和溶液时,此时溶液中存在CdSO4·(8/3)H2O的溶解-沉淀平衡,其负极反应为式(7),该负极可作为第二类电极处理,对应的电极电势为:
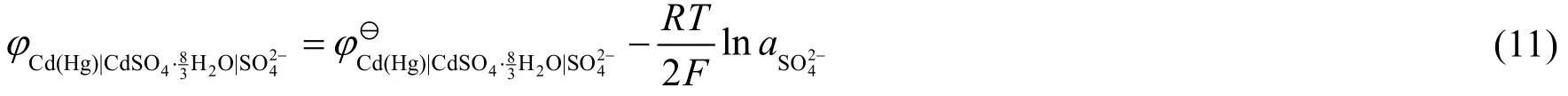
由于式(7) = 式(2) + 式(6),有ΔrGӨ(7) = ΔrGӨ(2) + ΔrGӨ(6),最后得到:

4 标准电池稳定性的讨论
饱和标准电池的电动势仅仅与Cd(Hg)中Cd的活度有关。而影响Cd(Hg)中Cd的活度的因素主要是温度及Cd(Hg)中Cd的浓度。图2所示为镉-汞二组分相图,可以看出,若温度在室温附近,当Cd的质量分数为0.05-0.14时,如298 K系统刚好处于固(Cd/Hg固熔体)-液(Cd/Hg熔液)两相平衡区[10],Cd(Hg)中Cd的活度有定值,与两相中Cd的具体含量无关。因此,在恒定的温度下,饱和标准电池有稳定的电动势。
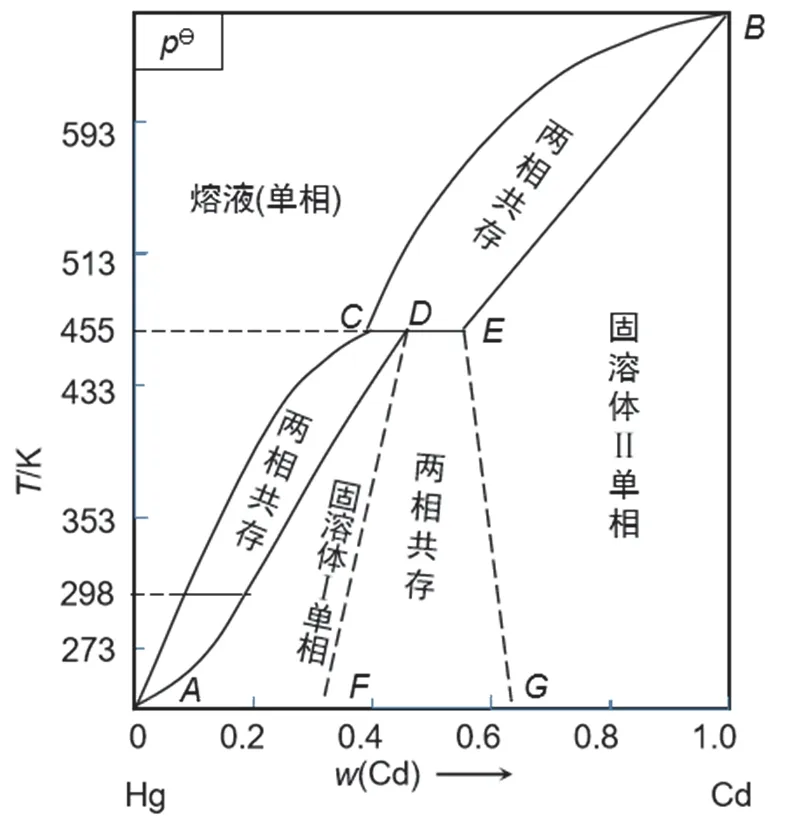
图2 Hg-Cd的相图
如果改变温度,Cd(Hg)中Cd的活度就会发生微小变化,电动势的值也会略有变动。在293.15 K和298.15 K时,饱和标准电池的电动势分别为1.01845 V和1.01832 V[2]。在其他温度时的电动势可由1908年美国Wolff提出的“国际温度公式”[11]式(13)求得:

我国老一辈科学家集体协作攻关制作一批性能优良的饱和标准电池并测试了电动势随温度的变化。1975年,提出了以293.15 K为标准温度的电动势-温度公式(14),该公式适用于273.15-313.15 K温度范围的饱和标准电池[2,11]:
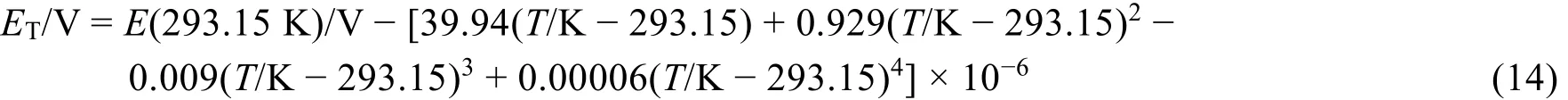
可见,饱和标准电池的电动势与温度的关系很小,不同温度下电动势的数值可按式(14)计算,电动势的稳定性较高。相关工作[11]于1980年发表在《中国科学》杂志上。
此后,我国科学家还制作了性能优良的可倒置不饱和标准电池。1983年,诸洵治等研究得到了适用于273.15-323.15 K温度范围内不饱和标准电池的电动势-温度公式,发现虽然不饱和电池电动势与温度、汞齐中Cd的活度、电解质的活度都有关,但是不饱和电池的温度系数与饱和电池相比更小,并归因于饱和电池其电解质的浓度是温度的函数[12]。然而,根据前面的讨论,可以认为其根本原因应该是饱和与不饱和电池的反应不同、熵变不同,进而造成两者的电动势温度系数的不同。根据电化学热力学,在一定压力下可逆电池反应的熵变与电动势温度系数有关系式(15):

5 标准电池的使用与维护
综合上述分析,饱和标准电池的可逆性好,因而电动势的稳定性和重现性均好;但是与不饱和标准电池相比,其温度系数较大,使用时必须进行温度校正,一般用于进行精密测量。而不饱和标准电池的温度系数很小,可以避免繁琐的温度校正,但是其可逆性略差,因此可用在精度要求不很高的测量中[13]。
在对消法实验中,一般选用的待测电池为锌铜电池,它是一个双液电池。在测定中需使用盐桥连接两种电解质溶液。由于盐桥不能完全消除液体接界电势,只能将液体接界电势降低到1-2 mV,也即待测电池电动势的测量准确度实际在毫伏级。从这个意义上讲,无论饱和还是不饱和标准电池(电动势都精确到微伏级),都远远满足实验测定的要求。当然,与不饱和标准电池相比,饱和标准电池可逆性较好、去极化作用强,是更好的选择。
为了保证标准电池的电动势的稳定性,在使用时要注意:① 虽然饱和标准电池的去极化能力较强,但是仍需严格限制通过标准电池的电流在允许的范围之内;② 尽可能将饱和标准电池置于温度波动不大的环境中,以避免电池中CdSO4·(8/3)H2O晶粒在温度波动的环境中的反复不断地溶解、再结晶,致使晶粒长大结块而增加电池内阻;③ 机械振动会破坏标准电池的平衡,在使用及搬移时应尽量避免振动,绝对不允许倒置;④ Hg2SO4在光照下会发生变质,从而使标准电池电动势对温度变化产生滞后特性,因此标准电池应避光保存。
6 结语
1) 根据硫酸镉电解液饱和与否,标准电池可分为饱和式和不饱和式。由于两者的负极反应不同,对应的电池反应不同,熵变也不同,因而两者的标准电池电动势、电动势及其温度系数、可逆性和稳定性等也不相同。
2) 在一定温度下,饱和标准电池的电动势仅与汞齐中镉的活度有关;而不饱和标准电池的电动势不但与汞齐中镉的活度有关,还与硫酸镉电解质的活度有关;因不饱和标准电池反应中涉及金属离子的不可逆扩散过程,从而造成其电池可逆性相对较差。
3) 当电解质为饱和溶液时,由于CdSO4·(8/3)H2O(s)与CdSO4饱和溶液之间溶解-沉淀平衡的存在,此时负极可作为第二类电极处理,对应的标准电极电势可由镉汞齐的标准电极电势与饱和硫酸镉溶液的活度(也即硫酸镉饱和溶液的活度积)求得。
4) 饱和标准电池的可逆性好,但温度系数较大,使用时必须进行温度校正,一般用于进行精密测量。不饱和标准电池的温度系数更小,可以免除繁琐的温度校正,但是其可逆性略差,因此用在精度要求不是很高的测量中。
5) 在对消法实验中由于盐桥的使用,无论饱和还是不饱和标准电池都可以满足实验测量精准度的要求。若考虑到可逆性较好、去极化作用强,则饱和标准电池是更好的选择。

