单环共轭多烯的结构与芳香性研究
侯秀芳,任雨欣,董文卓
延安大学化学与化工学院,陕西 延安 716000
结构化学课程因电子结构部分涉及量子力学深奥的知识,空间结构部分需要空间想象能力,因而是本科教学中最难学的课程之一[1,2],为了使学生能够深刻理解相关知识,将一些程序应用到教学中是一种较好的方法,例如将PGLite用于分子点群的教学[3]。
休克尔分子轨道法是结构化学课程多原子分子的结构和性质章节中的核心内容,是学生深入学习、认识和理解多原子的结构与性质之间关系的理论基础。在结构化学教学中,休克尔分子轨道法是结构化学教学的重点和难点。传统的教学通过求解休克尔行列式来得到分子轨道波函数及分子轨道能级[1]。然后分析电荷密度、键级和自由价来绘制分子图。通过分子图来解释实验所得出的结果,例如π电子离域可降低体系的能量、体系键长趋于均匀化以及反应性等特殊现象。当单环共轭多烯的π电子为4n+ 2时,体系为稳定的芳香性结构。当单环共轭多烯的π电子为4n时,不具有芳香性。宏观世界和微观世界的鸿合是本科生学习和理解物质结构与性质的最大障碍。课本内容讲解很清楚,但是如果结合现代高水平的量化计算软件Gaussian,可以帮助学生更直观地看到分子的稳定结构。波函数分析是量子化学中极其重要的组成部分,Multiwfn[4]是分析分子波函数的非常有力的程序。本文报道了用Gaussian程序计算结构化学基础课本中的七种单环共轭多烯和最新明星分子环碳18[5-7]稳定结构,用Multiwfn程序分析了其波函数,形象化展示了分子的结构和性质,尤其是芳香性。分析结果有利于学生更深入理解多原子分子的结构与性质之间的关系。
1 计算方法
本文采用Gaussian 09程序包用以所有的量化计算[8],ωB97XD交换关联泛函结合def2-TZVP[9,10]水平进行几何优化,这是因为已经证明该水平对环状化合物是准确和适用的,能够很好地重现高水平CCSD/def-TZVP的计算结果[11]。所有优化的几何结构都证明是无虚频率且局部极小值。分子波函数分析采用Multiwfn 3.8程序包[4]。基于可视化ICSS计算了其空间磁特性。基于Gaussian 09输出结果产生感应电流密度的各向异性(ACID)[12],图形由POV-Ray[13]生成。用VMD[14]软件绘制各种轨道和等值面图。
2 结果与讨论
新软件的引入为更形象理解休克尔分子轨道法提供了强有力支撑。我们通过制作分子几何结构图、体积图、静电势图和化学屏蔽表面图以及感应电流密度的各向异性AICD环电流图,形象表现了4n+ 2和4n体系π电子的不同,使学生将抽象的概念形象化地表现,有利于深刻理解休克尔分子轨道法。
2.1 几何结构
环丙烯基正离子C3H3+,它是由三个sp2杂化的碳和2个π电子组成的共轭体系,满足休克尔4n+ 2规则,2个π电子完全离域且平均分布在3个碳原子上,实验已证明具有芳香性。环丁二烯C4H4有4个π电子,虽然4个碳原子在同一平面,但无芳香性。环戊二烯负离子C5H5-是一个平面对称体系,具有6个π电子且完全离域在5个碳原子上,具有芳香性。苯有6个π电子,符合4n+ 2规则,6个碳原子在同一平面内,因此苯具有芳香性。环庚三烯正离子C7H7+具有环状共轭平面结构,且6个π电子完全离域在7个碳原子上,具有芳香性。环辛四烯π电子数为8,不符合休克尔原子规则,8个碳原子不在同一平面,具有船(澡盆)式和椅式两种结构,稳定的船式为非芳香性,这进一步验证了结构决定性质。环碳18有18个π电子,符合4n+ 2规则,18个碳原子在同一平面内,因此具有芳香性。
七种单环共轭分子和环碳18的最稳定结构显示在图1。乙烯C2H4的C―C键长为1.322 Å (1Å = 0.1 nm),C―H键长为1.084 Å。C3H3+三个碳原子形成正三角形,C―C键长为1.355 Å。单重态环丁二烯的四个碳形成了长方形,而三重态环C4H4为正方形。C5H5-、C6H6和C7H7+的碳原子分别形成正五边形、正六边形和正七边形。与其他环烯不同的是单环C8H8,它最稳定的结构是船式结构,八个碳原子不在同一平面。我们分析了七种单环共轭体系的分子结构,发现在C4H4和C8H8中存在C―C单键与C=C双键的交替结构,其余分子的C―C键长都是一样的。环碳18属于D9h点群,具有交替的1.344 Å和1.221 Å键长,CCC键角为160°。其余的单环烯烃的C―C键长都比C2H4的C―C键长,表明有不同程度的电子离域。
在图1中,对于每一个单环共轭分子,我们用黑色数字标记了C―C键和C―H键的键长,用原子着色方式展示了单环共轭体系和环碳18的原子电荷分布。从图1中,我们看到原子以不同的颜色展示。在C2H4中,C原子显示蓝色表示带负电荷,H原子带正电荷,这归因于C原子和H原子电负性的不同。其他中性分子C4H4,C6H6和C8H8的电荷分别情况类似与C2H4。在C3H3+中,碳原子显示白色表示带的电荷接近于零,H原子带正电荷,这符合整个分子带一个单位正电荷。与C3H3+电荷分别情况类似的是C7H7+,相反,在C5H5-中,H原子带极少量的正电荷,C原子带负电荷,整个分子带一个单位负电荷。显然,在C18中,碳原子的电荷几乎为零。

图1 单环共轭体系分子基态结构图
2.2 分子尺寸
我们计算了8种单环共轭分子的体积,在图2标记了三个边的长度。显而易见,随着C原子数的增加,环的体积逐渐增大。C2H4和环碳C18分子厚度为3.40 Å,非平面的C8H8分子高为4.25 Å,其余的分子厚度都为2.40 Å。随着C原子数的增加,分子逐渐的接近正方形构型。环碳18中间呈现较大的空腔。

图2 Multiwfn计算VDW体积
2.3 分子轨道
在休克尔分子轨道理论中,只考虑π电子在整个分子骨架的范围内运动,也就是只考虑π电子。课本中通过求解休克尔行列式得到分子轨道能级和波函数。我们这里采用Multiwfn软件,首先挑选出占据的和非占据的π轨道,然后绘制主要的π分子轨道图形。例如图3是苯分子离域π键分子轨道和能级图,三重态环丁二烯的能级图在补充材料SI中。这个操作简单方便,本科生特别是研究生容易学会,可以将课本中的知识更形象化的显示出来,有利于学生对这部分知识的深入理解。

图3 苯离域π键分子轨道及能级图(eV)
2.4 静电势分析
静电势图(图4)显示分子中电子密度分布情况,能用于预测分子间相互作用的可能位置。在图4中高电子密度的区域用蓝色显示,正的低电子密度区域用红色显示,白色表示中性。标注出静电势最大值和最小值。C3H3+和C7H7+因带一个单位正电荷,使得整个分子显示红色。同理C5H5-因带一个单位负电荷,使得整个分子显示蓝色。中性分子C2H4,C4H4和C6H6负的极小值位于环的上方,极大值位于氢原子的附近。船型的C8H8的最小值为-20.8 kcal·mol-1,极大值为12.2 kcal·mol-1。环碳18显示出较小的静电势分布范围。正的静电势分布在环内和环外,预示着环的内外是与其他分子相互作用的位点。
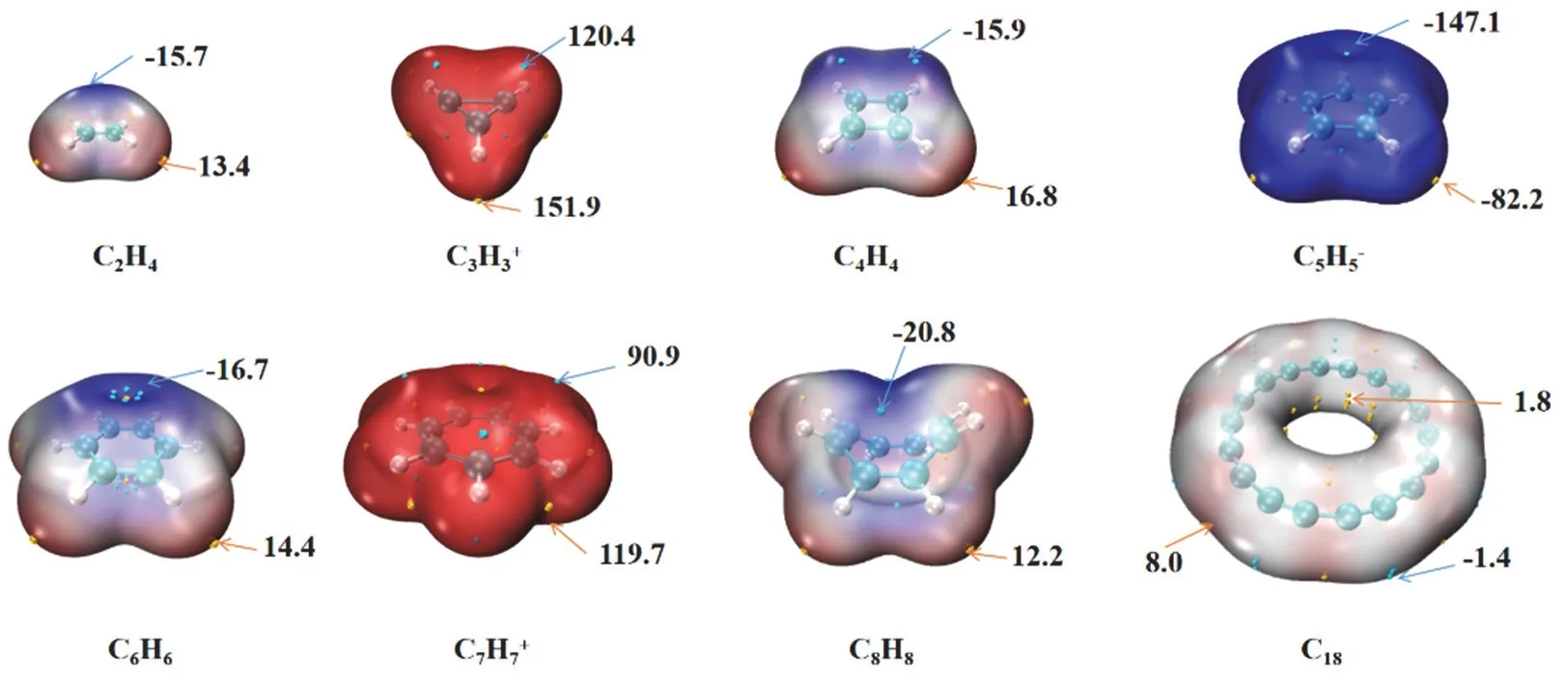
图4 七种单环和环碳18的Van der Waals表面(isovalue = 0.001 a.u.)
2.5 芳香性
芳香性[15]的特征是环状闭合共轭体系的π电子高度离域,具有离域能,体系能量低,较稳定。物质性质是否有芳香性可以根据休克尔规则来进行判定。休克尔规则:一个单环化合物只要具有平面离域体系,它的π电子数为4n+ 2 (n= 1,2,3,…整数),就有芳香性(当n> 7时,有例外)。非芳香性:环状多烯和相应的开链烃相比稳定性差不多。分子非平面,无共轭能。反芳香性:平面环状共轭多烯的稳定性小于相应的开链共轭多烯的性质。π电子为4n的环状共轭多烯为反芳香性。因此共平面且具有4n+ 2个π电子规则,是判断一个环状共轭体系是否具有芳香性的标准。需要注意的是分子共平面,并不是要求整个分子中的所有原子都处于同一平面上,而是指组成4n+ 2个π电子体系的那些碳原子处于同一平面。这样4n+ 2个π电子可以离域到这一平面。当组成4n+ 2个π电子体系的那些碳原子不可能或者难以共平面时,π电子离域程度减小或者完全消失,体系芳香性将减弱或者消失。如何形象化地反映单环共轭多烯的芳香性呢?
核独立化学位移(NICS)是目前用的最多且接受度最高的衡量芳香性的方法之一[16.17]。核独立化学位移的含义是在某个人为设定的不在原子核位置上的磁屏蔽值的负值,负值越大(即对磁场屏蔽越强),则芳香性越强。核独立化学位移(NICS)通常根据磁性研究芳香性,等化学屏蔽表面(ICSS)[18,19]相当于在三维层面上研究NICS,即计算磁屏蔽值在三维空间中的格点数据,并绘制成等值面图,比NICS方法更直观形象且展现出更丰富的信息。
从图5能看出,4n+ 2个π电子的C3H3+、C5H5-、C6H6、C7H7+和C18单环位于环内的绿色的等化学屏蔽表面ICSS轮廓在垂直于环平面的方向凸起,一个封闭的蓝色圆环等值面包围着它。这些图像说明在环内的磁屏蔽较强,具有极强的芳香性,π电子可以自由运动。绿色包围的区域说明外磁场被明显屏蔽。环丁二烯C4H4和环辛四烯C8H8的π电子数为4n,它们的ICSS图与苯环的截然不同,环的内侧和上下部分都是蓝色的等值面凸起,表示去屏蔽区域;而环的周围是绿色包围,代表屏蔽区域。这清楚的说明环丁二烯是典型的4n电子反芳香体系。等化学屏蔽表面形象的反映了两类单环的芳香性的不同。

图5 七种单环和环碳18的等化学屏蔽表面ICSS (isovalue = 0.25 ppm)
电子定域化函数(ELF)[20]是个三维实空间函数,数值在0到1之间。电子在EFL数值较高的等值面包围的区域具有较强的定域性,反之,电子较容易在EFL数值低的区域内随意运动。ELF是个极其重要的衡量电子定域性和离域性的三维实空间函数,为了考查单环芳烃的芳香性,我们只考虑π电子的离域情况即ELF-π(图6)。我们用ELF-π二分点数值来衡量C5H5-,C6H6和C7H7+的芳香性的不同,这个值就是单环芳烃ELF-π等值面首次发生断裂的等值面值。这个值有利于考察化学体系π共轭的强度,值越大π电子越容易离域。在C5H5-中多中心共轭的ELF-π等值面刚断开时的等值面数值为0.815,苯的为0.897,而C7H7+的断点等值面数值增加到0.935,这说明对于这三个等电子体,随着环中碳原子数的增加,电子的共轭程度增强。

图6 三种单环C5H5-,C6H6和C7H7+的ELF-π等值面图
计算这几种具有芳香性的单环的布居数,发现C5H5-的碳原子的布居数最大1.20,C7H7+的碳布居数较小为0.85。说明C5H5-更容易发生亲电反应。我们也绘制了这三种分子上方1埃处的电子密度填色图。从图7中很清楚地看到C5H5-的碳原子周围的白色范围更大,说明电子密度最大,显而易见C7H7+的碳原子的π电子密度最小。这种数字加图形显示,使得学生更容易理解π电子密度分布情况。这和我们通过解久期方程得到的结论是一致的。而对于含碳原子数较多的单环的体系,求解久期方程是一个复杂的过程,使得一部分学生难以掌握。这种作图法简单快速,且学生更容易理解π电子密度分布情况。所以在教学的过程中,既需要原始的最基本的应用休克尔法进行推导,也需要应用最新的量化软件进行快速而简便的处理,建立起学生从课本知识到最新科技的桥梁,激发学生学习的兴趣。
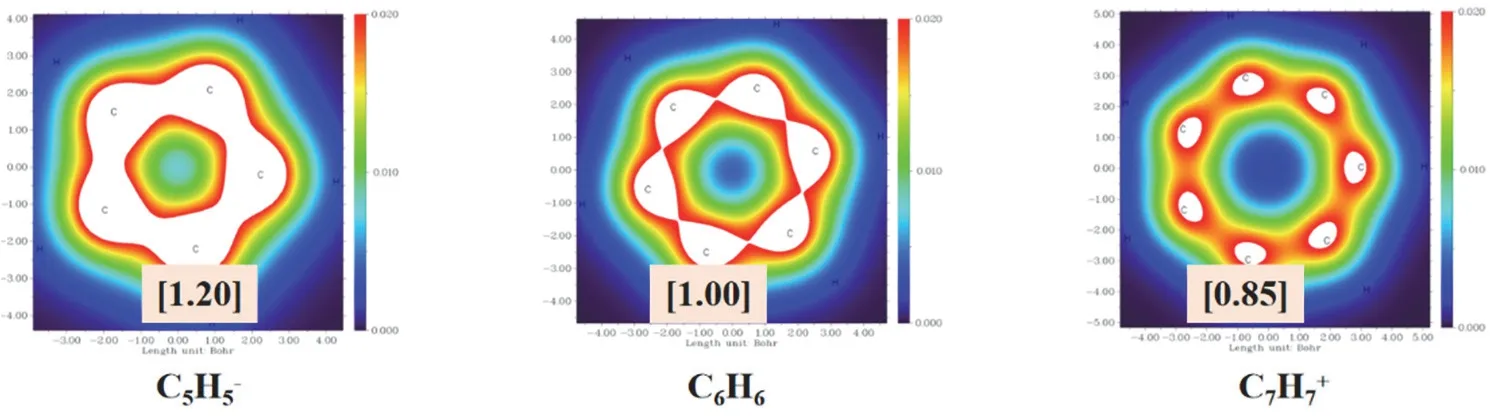
图7 三种单环的π电子布居分析及电子密度填色图
一般来说,分子中π电子的离域程度与外磁场下感应环电流相关,也可以反映分子的芳香性特征。当体系π电子满足休克尔4n+ 2规则,且施加外电场时,期望体系能形成单向环电流。感应电流密度的各向异性(ACID)[21]可用图形显示外部磁场感应的环电流。当施加外磁场垂直于环平面,我们采用ACID程序研究这几种单环的π电子离域性和磁感应电流密度。ACID本质上反映了相应位置电子对磁场感应的各向同性的强度。由于σ电子没有涉及离域,所以我们主要是研究π电子的分布来了解电子离域性。黄色是ACID等值面,等值面上红色的箭头是相应位置感应电流密度矢量,磁场的方向是从纸面里面指向纸面外面。只考虑π电子时氢原子上没有ACID等值面值,这是符合我们的常识。对于单环分子体系,π电子在整个环平面具有很强的离域性,也就是说π电子能够在整个环平面自由运动,在外加磁场的情况下,会在环平面产生一圈明显的感应环电流,在原子附近的电流密度较大。顺时针循环表示芳香性。从图8可以看出感应电流方向满足左手规则,C3H3+、C5H5-、C6H6、和C7H7+的π电子都呈现芳香性,C4H4的π电子都呈现反芳香性特征。对于C5H5-、C6H6和C7H7+分子,π电子都是6个,因为环的大小不同,显然C5H5-环最小,电流密度最大,而C7H7+环最大,电流密度最小。π电子在整个分子平面离域,在C―C成键区域产生环电流,没有离域到H原子附近。通过图形化显示芳香性和反芳香性环电流,可以引导学生突破分子结构的表象,从而有利于从电子本质认识芳香性问题。另外我们还应用程序GIMIC 2.0[22]考察了分子磁感生电流,绘制了C5H5-和C4H4的全空间动态流线场图(见补充材料),动画效果生动有趣,非常直观的将外磁场下的动态环电流的流动展现了出来。
2.6 电子光谱
电子光谱能用于理解分子的结构和运动状态,我们采用TD-DFT方法计算了七种环碳的前5个激发态的激发能和振子强度。在图9中C2H4最大吸收峰位于151.3 nm,振动强度为0.3766。C3H3+最大吸收峰位于128.1 nm,振动强度为0.1234。C4H4最大吸收峰位于181.3 nm,振动强度为0.0136。C5H5-最大吸收峰位于198.6 nm,振动强度为0.0278。C6H6最大吸收峰位于171.3 nm,振动强度为0.6099。C7H7是对称禁止,振动强度为0.0,因此图中没显示。C8H8最大吸收峰位于190.4 nm,振动强度为0.4187。因为这七个单环在380-760 nm的可见区都没有明显的吸收带,说明这几种单环都是无色的。

图9 七种单环的UV-Vis 吸收光谱
3 结语
随着计算机技术的高速发展,结构化学课程的教学思路和方法也需要不断更新和前进。此文介绍了将Gaussian和Multiwfn程序用于处理八种单环共轭多烯的情况。将学生课本学习的知识进一步用图形化进行描述,使学生能够直观而深刻地理解休克尔分子轨道法知识。我们理论调查了八种单环的分子结构和性质。结果显示4n+ 2π电子的C3H3+,C5H5-,C6H6,C7H7+单环具有均一化的键长,说明非常广泛的π电子离域,因此表现出很强的芳香性。用磁学性质判断分子的芳香性,结论与休克尔理论一致。我们的计算结果有利于学生深入的理解单环共轭多烯的结构与性质,特别是芳香性。对于一部分学生进行大学生创新项目时,可以利于Gaussian和Multiwfn程序进行自己感兴趣的分子,如多环芳烃的研究。
补充材料:可通过链接http://www.dxhx.pku.edu.cn免费下载。

