磁性纳米Fe3O4制备及在酵母RNA提取分析中的应用
王萍萍,李浩辰,彭玉,罗小梦,朱丽华,王宏,陈芳,王楠
华中科技大学化学与化工学院,武汉 430074
核酸提取是分子生物学检测的首要步骤,常用方法有酚-氯仿抽提法、阴离子交换法、硅介质吸附法等[1]。近年来,采用磁性Fe3O4为吸附介质的磁珠法,不仅避免了使用有毒有机溶剂,而且可采用磁分离装置实现自动化、批量化操作,逐渐成为核酸提取的主导方法,在医学检验、疾病诊断、基因工程等领域发挥了重要作用[2-6]。磁珠法又被称为磁固相萃取法,是21世纪分离富集领域的革命性技术。Fe3O4的粒径分布、表面理化性质和分散性是影响其吸附性能的主要因素。纳米Fe3O4(又名纳米磁珠)比表面积大,表面具有丰富的羟基及铁离子,既可作为吸附位点直接结合目标物,又可通过表面修饰改善吸附性能。因此,纳米Fe3O4的制备及表面改性是开发磁珠法应用的关键。
本文将磁珠法提取核酸引入实验教学,开发了一个综合实验(表1),不仅能激发学生的兴趣,而且能培养学生的社会责任感。基于实验条件及安全性考虑,本实验选取生物化学实验中常用的酵母RNA作为提取对象,首先采用超声辅助反相共沉淀法制备粒径小、分散性好的磁性纳米Fe3O4;通过调控Fe3O4与RNA之间的相互作用,建立提取分析酵母RNA的方法;最后,考察新方法的实际应用情况。本实验涉及无机化学、分析化学(含仪器分析)、生物化学等五大基础化学知识,能够锻炼学生综合运用化学知识和实验手段解决实际问题的能力。此外,本实验内容可拆分为不同模块,自由组合为4-16学时,满足不同专业、不同背景学生的教学需求。

表1 实验教学内容及学时安排
1 实验目的
通过文献检索,了解磁性纳米Fe3O4的制备方法及其在磁固相萃取中的应用;掌握超声辅助反相共沉淀法制备纳米Fe3O4的方法及表征手段;学习磁珠法提取RNA的原理;锻炼学生学以致用、解决实际问题的能力。
2 实验原理
2.1 纳米Fe3O4的制备及表征
纳米Fe3O4的制备方法主要有共沉淀法、溶胶-凝胶法、微乳液法和水热法等[7]。其中,共沉淀法操作简便,但传统机械搅拌正相共沉淀法耗时较长(> 4 h)、需要N2保护且产物粒径分布宽。超声辅助反相共沉淀法在空气氛围下即可制得粒径约20 nm的Fe3O4,耗时短(< 1 h),且条件温和(60 °C)[8],适合实验教学。在反相沉淀法中,铁盐过饱和,生成的晶核多,产物粒径小;超声波“空化泡”效应和剪切作用进一步抑制粒径生长,加速传质和反应进行。采用多种仪器分析方法,表征产物的组成、产率、表面性质及磁响应性等。
2.2 磁珠法提取酵母RNA
以酵母RNA为代表,建立纳米Fe3O4提取分析RNA的方法。纳米Fe3O4表面存在丰富的羟基和铁离子,可通过氢键、静电和/或配位作用结合RNA的磷酸基或碱基(图1)实现吸附。采用合适的解吸剂(例如磷酸盐)破坏上述作用,即可实现解吸。RNA碱基中存在共轭结构,在紫外波段有强吸收,故可用紫外光度法测定其含量,评价吸附及解吸情况。利用FT-IR技术研究了Fe3O4与RNA及解吸剂之间的相互作用,探究提取机制。

图1 Fe3O4吸附及磷酸盐解吸酵母RNA示意图
2.3 磁珠法的实际应用情况
选择酵母粉为实际样品,考察磁珠法的实际应用情况。超声辅助-低盐法是利用超声机械作用和电解质渗透效应破坏酵母粉的细胞结构,释放出RNA[9],随后采用磁珠法提取分析。控制超声时间在45 min以内,可将酵母粉破壁但不破坏RNA结构[10]。破壁处理液中存在细胞壁、细胞膜、蛋白质及少量氨基酸、多肽、糖类、DNA和RNA等,其中细胞膜、细胞壁及蛋白质沉淀可采用低速离心分离去除。预实验发现氨基酸、多肽及糖类不影响RNA的吸附。DNA和RNA具有类似结构,但酵母粉中DNA含量仅为RNA的0.3%-5.0%,其干扰与紫外光度法误差相比亦可忽略。
3 实验部分
3.1 试剂和仪器
硫酸亚铁(FeSO4·7H2O)、氯化铁(FeCl3·6H2O)、氨水(NH3·H2O)、硫酸铁铵(NH4Fe(SO4)2·12H2O)、邻二氮菲(C12H8N2·7H2O)、磷酸二氢钾(KH2PO4)、磷酸一氢钠(Na2HPO4·12H2O)和乙酸钠(CH3COONa)均为分析纯试剂,购自国药集团化学试剂有限公司;酵母RNA购自上海如吉生物科技发展有限公司;酵母粉购自安琪酵母股份有限公司。
10%盐酸羟胺溶液,0.15%邻二氮菲溶液(1 : 1乙醇水溶液),50 μg·mL-1铁标准溶液(用硫酸铁铵配制),1000 μg·mL-1酵母RNA标准溶液,pH = 5.5醋酸-醋酸钠缓冲溶液(1 mol·L-1),pH = 7.0磷酸盐缓冲溶液(0.2 mol·L-1)。
BS210S电子分析天平(北京赛多利斯有限公司),pHS-25型pH计(上海精密科学仪器有限公司),KQ-200KDE超声波清洗器(昆山市超声仪器有限公司),UV2600i紫外-可见分光光度计(UV-Vis,日本岛津公司),INVENIO R傅立叶变换红外光谱仪(FT-IR,德国Bruker公司),ZEN3690 Zeta电位分析仪(英国Malvern公司),Tecnai G2 T20透射电子显微镜(TEM,美国FEI公司);D8 Advance X射线衍射仪(XRD,德国Bruker公司),PPMS-9物理特性测试系统(美国Quantum Design公司)。
3.2 纳米Fe3O4的制备及表征
3.2.1 纳米Fe3O4的制备
采用超声辅助反向共沉淀法制备纳米Fe3O4[8],具体过程如下:称取1.39 g FeSO4·7H2O (5 mmol)和1.35 g FeCl3·6H2O (5 mmol)于15.00 mL水中,溶解得Fe2+和Fe3+混合溶液(现配现用)。将超声波清洗器的温度升至60 °C,取20.00 mL 3.5 mol·L-1氨水溶液于100 mL碘量瓶中并置于超声器中,将上述铁盐溶液逐滴加到氨水溶液中,加完后继续反应30 min。通过磁分离收集所得沉淀,并用水洗涤至溶液pH近中性。最后,将Fe3O4超声分散于50.00 mL水中,转移至试剂瓶备用。
由于常规加热干燥易导致纳米Fe3O4表面氧化及团聚,影响水中分散度及磁分离性能,故本实验将新制备的Fe3O4配制成分散液备用。
3.2.2 纳米Fe3O4的表征
(1) 邻二氮菲法测全铁和亚铁。
采用酸溶解-邻二氮菲显色光度法测定Fe2+和全铁(Fe2+和Fe3+)含量[8,11],具体步骤如下:准确移取0.50 mL Fe3O4分散液于10 mL比色管中,加入1 : 1盐酸6-8 mL,溶解后,用水定容。分别取2份上述试液0.25 mL于50 mL容量瓶,一份加盐酸羟胺,另一份不加,采用邻二氮菲显色法,在510 nm处测定吸光度,据此计算产量及Fe2+/Fe3+摩尔比。根据3.2.1节实验数据可知Fe3O4理论产量,进而可计算产率。
(2) 表面官能团及电荷测定。
通过磁分离收集Fe3O4,干燥,然后与适量KBr混合研磨、压片,进行FT-IR测试,获取其表面官能团信息;用稀盐酸或NaOH调节水溶液pH为4.0、5.0、6.0、7.0、8.0、9.0、10.0和10.5。取上述溶液10.00 mL,加入0.10 mL Fe3O4分散液,摇匀,利用Zeta电位分析仪测试,获取Fe3O4的表面电荷行为。若无Zeta电位分析仪,也可采用酸碱滴定法测定Fe3O4表面电荷[12]。
(3) 形貌及晶体结构等表征。
若有实验条件,还可进行如下表征:采用TEM观察Fe3O4的形貌;采用XRD测试其晶型;在±3 T、温度为300 K下,采用物理特性测试系统测定Fe3O4的磁滞回线。
3.3 纳米Fe3O4提取酵母RNA方法的建立
3.3.1 提取条件优化
以酵母RNA标液(20 μg·mL-1)为代表,参照表2所示实验条件考察溶液pH、Fe3O4用量、解吸剂种类及用量对RNA吸附及解吸的影响,具体步骤如下(图2):用稀盐酸或NaOH调节RNA标液pH,移取10.00 mL上述溶液,加入定量Fe3O4分散液,摇匀后超声5 min,静置吸附0.5 h。用磁铁分离固液,取上清液测试其在260 nm处的吸光度,通过公式(1)和(2)分别计算RNA的吸附率(Y)和吸附量(Q)。向回收的Fe3O4中加入定量解吸剂,摇匀后静置5 min。用磁铁分离,取上清液测试其在260 nm处的吸光度,分别通过公式(3)和公式(4)计算酵母RNA的回收率(R)和富集倍数(E)。

表2 Fe3O4提取酵母RNA实验条件优化

图2 Fe3O4提取酵母RNA实验过程示意图

其中,c0(μg·mL-1)和V0(mL)分别为待提取RNA的浓度和体积,ct(μg·mL-1)为上清液中RNA的浓度,cMBs(g·L-1)和VMBs(mL)分别为磁珠分散液的浓度和体积,cR(μg·mL-1)和VR(mL)分别为解吸后RNA浓度和解吸剂体积。ct和cR可通过UV光度法直接测定酵母RNA的标曲(A= 0.0198c+ 0.0086)计算得到。
3.3.2 提取机制研究
磁回收吸附及解吸前后的纳米Fe3O4,干燥后与适量KBr混合研磨、压片,进行FT-IR测试。
3.3.3 提取方法建立
用稀盐酸调节溶液pH = 2.0,配制一系列1-100 μg·mL-1酵母RNA标液;根据浓度范围,按照优化的提取条件进行实验及紫外光度测定,绘制标准工作曲线。
3.4 酵母粉中RNA的提取分析
参照表3所示的实验条件,考察破壁及提取条件的影响,实验过程如下:称取定量酵母粉,加入20.00 mL NaCl溶液,摇匀,在超声波清洗器里抽提45 min,转移至离心机(转速为3000 r·min-1)中离心5 min,收集上清液。移取0.20 mL上清液于10 mL比色管,定容,加入定量Fe3O4分散液,摇匀后超声5 min,静置吸附0.5 h。磁分离去除上清液,向残留的固体中加入定量磷酸盐溶液,摇匀后静置5 min。用磁铁分离固液,取上清液测试其在260 nm处的吸光度。在优化的条件下,提取酵母粉中RNA,并计算其含量。

表3 酵母粉破壁及RNA提取实验条件优化
4 结果与讨论
4.1 纳米Fe3O4的理化表征
4.1.1 产率、组成及磁响应性能
采用超声辅助反向共沉淀法制备Fe3O4,利用TEM观察其形貌。如图3a和3b所示,产物为球形,粒径约17 nm,与文献报道类似[8]。图3c为产物的XRD图谱,在衍射角2θ =30.2°、35.7°、43.3°、57.2°和62.8°处出现5个特征峰,与Fe3O4的XRD标准卡片(JCPDS card No. 19-0629)一致,分别对应于(220)、(311)、(400)、(511)和(440)晶面。图3d为产物的磁滞回线,饱和磁化强度为71.5 emu·g-1,且未出现磁滞现象。将Fe3O4分散液置于磁铁附近静置10 s,分散液中的颗粒快速聚集在磁铁处(图3e),表明可通过磁铁高效分离回收Fe3O4。以上结果表明,磁性纳米Fe3O4成功制备。考虑到实验教学条件限制,图3a、3d实验结果可由教师进行展示教学。
采用酸溶解-邻二氮菲显色光度法测定了产物中Fe2+及全铁含量。图3f为邻二氮菲法测定铁的标准工作曲线,显色产物吸光度与Fe2+浓度在1-5 μg·mL-1内线性相关(A= 0.203c- 0.0015)。按照3.2.2小节(1)实验方法,试样溶液直接显色的吸光度为0.151,而经盐酸羟胺还原再显色的吸光度为0.449,经计算知3.2.1小节制得的分散液中Fe2+、Fe3+和全铁分别为3.0、5.9和8.9 g·L-1,即产物中Fe3+/Fe2+摩尔比为1.97,与Fe3O4理论值2相符;Fe3O4含量为12.3 g·L-1。采用5 mmol Fe2+和5 mmol Fe3+按照3.2.1小节实验方法制得的50.00 mL分散液中理论上应含全铁为11.2 g·L-1,即Fe3O4浓度为15.4 g·L-1,因此,该方法的产率为80%。

图3 纳米Fe3O4的表征结果
4.1.2 表面官能团及电荷情况
图4a为纳米Fe3O4的FT-IR光谱曲线。3433、1627 cm-1处的吸收峰分别为Fe3O4表面O―H的伸缩和弯曲振动;578和449 cm-1处的吸收峰分别为Fe―O的伸缩和剪切振动[13]。图4b考察了Fe3O4分散液在不同pH条件下的Zeta电位。由图可知,纳米Fe3O4的零电点pH ≈ 7.5;当pH < 7.5时,Fe3O4表面带正电荷;反之,则带负电荷,这是由于Fe3O4表面OH得失H+所致(反应式5)[12,14]。


图4 (a) 纳米Fe3O4的FT-IR吸收光谱曲线;(b) Fe3O4分散液的Zeta电位曲线(n = 3)
4.2 纳米Fe3O4提取酵母RNA方法的建立
4.2.1 吸附条件优化
图5a对比了酵母RNA标液吸附前后的紫外吸收光谱曲线变化。pH = 2.0时,20 μg·mL-1酵母RNA标液的最大吸收波长(λmax)为260 nm,吸光度为0.41;加入0.20 mL纳米Fe3O4分散液,磁分离后的上清液吸光度仅0.05,表明Fe3O4对酵母RNA有较强的吸附能力。当溶液pH由2.0增至10.0,RNA的吸附率由90%降至30% (图5b)。酵母RNA的等电点约为2-2.5,pH = 2.0时,其磷酸基带负电荷,氨基带正电荷;此时,纳米Fe3O4表面带正电(图4b),可通过静电引力及氢键吸附RNA的磷酸基;溶液pH增加,Fe3O4表面正电荷减少,对RNA的静电引力减弱,吸附率下降。因此,选择溶液pH = 2.0进行吸附实验。
在pH = 2.0时,考察了纳米Fe3O4用量对10.00 mL酵母RNA标液(20 μg·mL-1)吸附的影响。结果显示:Fe3O4用量由0.20增至0.70 mL时,酵母RNA的吸附率在90%左右略微变化,而吸附量由72.0降至20.4 mg·g-1(图5c),表明RNA/Fe3O4初始质量比在23.2-81.3 mg·g-1时,Fe3O4表面的吸附位点并未被RNA完全占据,且RNA初始含量越大,单位质量Fe3O4对RNA的吸附量越大。从节约试剂的角度来看,宜选择加入0.20 mL Fe3O4分散液。
实际样品RNA含量范围广,例如面包、葡萄酒等中酵母RNA含量不足100 μg·g-1,而酵母粉中RNA高达1%-5%,故本实验还考察了Fe3O4对100 μg·mL-1RNA的吸附情况。以5.00 mL酵母RNA标液(pH = 2.0)为提取对象,参照上述实验结果将RNA/Fe3O4初始质量比设为81.3 mg·g-1,即加入0.50 mL Fe3O4,实验测得酵母RNA的吸附率和吸附量分别高达93%和76.3 mg·g-1(图5d),表明RNA浓度在20-100 μg·mL-1时,可选择加入0.50 mL Fe3O4分散液。

图5 (a) 酵母RNA (20 μg·mL-1)吸附前后的紫外吸收光谱曲线;(b) 溶液pH和(c) Fe3O4用量(VMBs)对酵母RNA 吸附率(Y)及吸附量(Q)的影响;(d) 酵母RNA在不同条件下的吸附情况
4.2.2 解吸条件优化
核酸提取中常用的解吸剂有强电解质盐溶液、酸碱缓冲溶液和阳离子表面活性剂等。基于绿色化学理念,本实验考察了三种价廉无毒的无机解吸剂:pH = 5.5醋酸-醋酸钠缓冲溶液(1.0 mol·L-1)、pH ≈ 6.0氯化钠溶液(1.0 mol·L-1)和pH = 7.0磷酸盐缓冲溶液(0.2 mol·L-1)。如图6a所示,采用磷酸盐时,解吸后的上清液显示了与酵母RNA相似的吸收光谱曲线,表明RNA的结构未被破坏;λmax= 260 nm处的吸光度为1.02,大于吸附前样品的吸光度(0.41,图6a)。作为对照,磷酸盐溶液自身在230-300 nm区间无吸收,表明磷酸盐已将RNA解吸下来,根据公式(3)计算得回收率约88%。相反,NaCl溶液几乎无解吸效果,而醋酸-醋酸钠体系的回收率不足20% (图6b)。此外,磷酸盐解吸后的溶液放置过夜,酵母RNA的吸收光谱曲线几乎不变,表明磁珠法提取的RNA较稳定。
选择磷酸盐为解吸剂,当其用量由2.00增至4.00 mL,酵母RNA回收率由76%增至88% (图6c),但富集倍数由3.2降至1.8 (图6d)。综合考虑,选择3.00 mL磷酸盐作为解吸剂。

图6 (a) 酵母RNA经吸附及磷酸盐解吸的紫外吸收光谱曲线;(b) 解吸剂种类及(c, d) 磷酸盐用量(VPO4)对 酵母RNA回收率(R)和富集倍数(E)的影响
4.2.3 提取机制研究
为了探究磁珠提取核酸的机制,本文考察了吸附及解吸前后,Fe3O4的FT-IR光谱曲线的变化。如图7a所示,吸附RNA后,Fe3O4在1680、1220和1067 cm-1处出现新的吸收峰。对比酵母RNA标样的FT-IR光谱曲线可知,1680 cm-1为RNA碱基上C=O的伸缩振动,1220和1067 cm-1为磷酸基的对称和非对称伸缩振动[15]。吸附后,上述RNA的三处吸收峰均向低波数移动,表明C=O以氢键形式吸附在Fe3O4表面,而磷酸基可通过氢键、静电引力或配位作用吸附(图1)。采用pH = 7磷酸盐溶液解吸后,Fe3O4表面吸附RNA在1680和1220 cm-1处的特征吸收峰消失,而1126和1053 cm-1处的吸收峰显著增强(图7b),表明磷酸盐吸附在Fe3O4表面,从而将RNA解吸下来。这与图6a解吸液的紫外吸收测试结果一致,可能是由于与RNA的磷酸基及羰基相比,磷酸盐与Fe3O4表面OH及Fe3+之间的作用更强,可有效破坏Fe3O4与RNA之间的作用。

图7 (a) Fe3O4吸附酵母RNA前后及(b)磷酸盐解吸前后的FT-IR光谱曲线
4.2.4 磁珠提取分析酵母RNA方法的建立
针对不同浓度范围的酵母RNA,本文在优化的提取条件下建立了2套提取分析方法(表4),以适应实际应用的需要。如图8所示,解吸液吸光度与酵母RNA初始浓度在1-20及10-100 μg·mL-1范围内线性相关,直线斜率分别为0.0449和0.0268,均高于实验测得的酵母RNA的吸光系数(0.0198 L·μg-1·cm-1),表明磁珠法还具有富集作用,富集倍数分别为2.3和1.4倍。由图6d及表4可知,增加取样量、降低磁珠及磷酸盐用量可提高富集倍数,满足更低浓度酵母RNA的测定需求。反之亦然。此外,针对生物样品中(超)痕量核酸,例如新冠病毒核酸检测,可利用实时荧光定量聚合酶链反应(PCR)技术对磁珠法提取的核酸进行扩增后再检测,检出限可低至5.2-3.8 copies/reaction[16]。

表4 不同浓度范围内的RNA提取分析方法建立

图8 Fe3O4提取分析不同浓度范围酵母RNA的标准工作曲线(n = 3)
4.3 实际样品酵母粉中RNA的提取分析
将酵母粉分散在20.00 mL NaCl溶液中进行超声辅助破壁,当NaCl浓度由2.5%增至10%,RNA的释放量逐渐增多;之后继续增加盐浓度至15%,RNA释放量逐渐下降(图9a),故选择NaCl浓度为10%;降低酵母粉与盐溶液的固液比,有利于RNA的释放(图9b),但固液比过低,酵母粉用量少,称量误差较大,因此,选择酵母粉用量为0.10 g;破壁后的上清液采用磁珠法提取,固定磷酸盐用量为3.00 mL,改变Fe3O4用量(0.20-1.00 mL),实验发现采用0.50 mL Fe3O4时提取效率较佳(图9c),经计算得酵母粉中RNA含量约为1.9%。
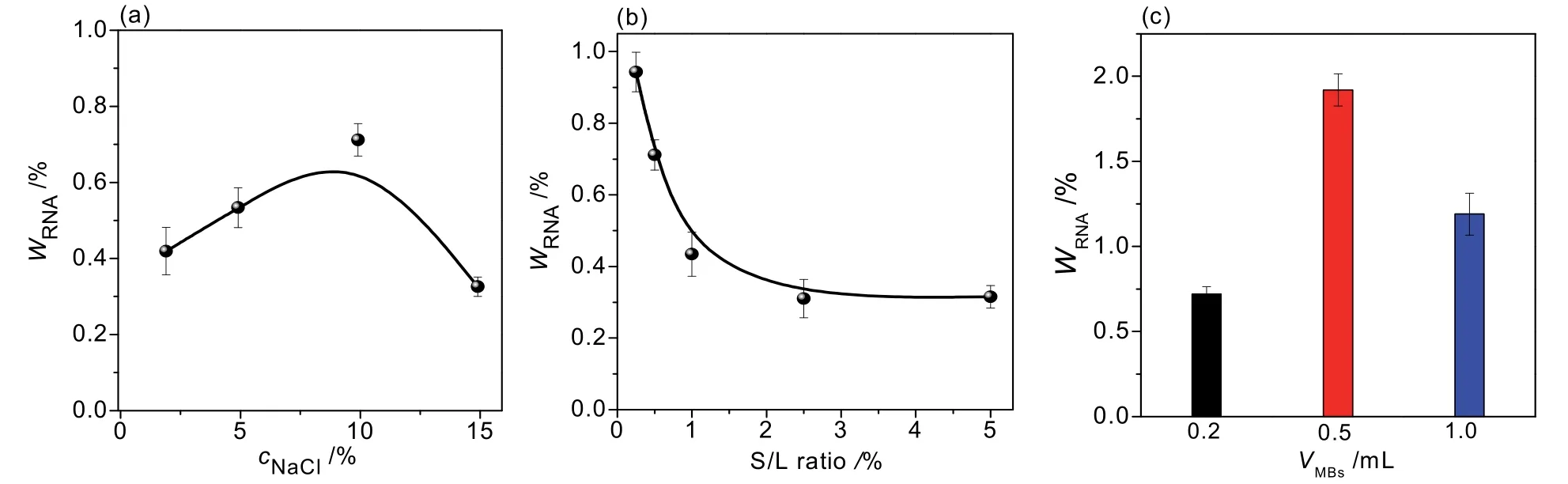
图9 (a) NaCl溶液浓度、(b) 固液比(S/L ratio)及(c) Fe3O4用量对酵母粉RNA提取的影响(n = 3)
5 实验教学组织形式和特点
本综合实验涉及无机纳米材料合成与表征、核酸提取方法建立与机制探究、实际样品应用等,适合在化学类专业高年级开设。建议将实验分为4个环节、学生分为6-8人项目组进行教学(表1):第1-4周,课外预习,引导学生分析问题,查阅文献,完成实验方案设计;第5周,项目组汇报实验设计方案,师生共同讨论,确定实验方案;第6-7周,实验操作环节,将项目组再分成2-3人实验小组,合作完成整个实验;第8-9周,完成实验报告及成果汇报PPT,分享实验结果和经验,教师点评总结,提升教学质量。
6 结语
本实验采用超声辅助反相共沉淀法制备了磁性纳米Fe3O4,粒径约17 nm;FT-IR表征显示表面有Fe-O及OH官能团,邻二氮菲显色法测得Fe3+/Fe2+摩尔比为1.97,产率为80%。磁珠法提取酵母RNA的回收率受Fe3O4用量、溶液pH、解吸剂组成与用量的影响,在优化的条件下,RNA回收率达85%以上,建立了提取分析方法,并成功用于实际样品中酵母RNA的提取分析。利用FT-IR技术研究了Fe3O4与RNA及解吸剂之间的相互作用,提出了磁珠法提取酵母RNA的机制。
在教学过程中,本实验利用项目式教学激发了学生自主探索的潜能和创新意识,借助问题导向调动学生学习的积极性和主动性,在解决问题的实践中锻炼学生学以致用的能力,在分组实验过程中培养学生的合作意识和团队精神。此外,结合全球公共卫生事件,引入科学研究前沿和热点,能够激发学生的兴趣、培养社会责任感;内容涉及多学科交叉,学时分配灵活,实验操作简单,试剂安全无毒,适合学生实验教学,培养学生的化学素养。

