硫化零价铁及其耦合高级氧化技术在水处理中的研究进展
廖 兵,叶秋月,胥 雯
1. 成都理工大学,地质灾害防治与地质环境保护国家重点实验室,四川 成都 610059
2. 成都理工大学,国家环境保护水土污染协同控制与联合修复重点实验室,四川 成都 610059
3. 成都理工大学生态环境学院,四川 成都 610059
4. 四川省城市污泥建材资源化利用工程研究中心,四川 德阳 618000
硫化零价铁(S-ZVI)导电性强、电子选择性高[1],能够有效去除类金属、重金属和有机污染物等.S-ZVI按粒径可分为微米级硫化零价铁(S-mZVI)和纳米级硫化零价铁(S-nZVI),S-mZVI主要通过单质硫、铁粉与球相互挤压、碰撞、研磨得到. S-nZVI制备方法有高能球磨法和液相化学还原法等,根据反应过程可以分为一步合成法(S-nZVIone-step)和两步合成法(S-nZVItwo-step)[2]. S-ZVI可将毒性较高的类金属或重金属离子吸附在颗粒表面后将其还原为毒性较低的离子,如高毒性的Cr(Ⅵ)被吸附,还原为毒性较低的Cr(Ⅲ)[3]. S-ZVI对有机污染物的去除以还原作用为主,如氯代有机物脱氯[4]、溴代有机物脱溴[5]以及硝基类有机物的硝基转变为氨基基团等[6],大多只能实现有机物部分断键,降解不彻底,甚至可能转变为毒性更强的中间产物. 因此,如何实现S-ZVI对有机污染物的深度降解和矿化尤为重要.
高级氧化技术(AOPs)在处理难降解有机污染物方面效果显著且环境友好,在环境污染治理方面有广阔的应用前景[7],主要包括臭氧催化氧化法、Fenton和类Fenton (氧化法及活化PS氧化法)[8-12]等. S-ZVI/AOPs不仅保留了S-ZVI较强的还原能力,同时S-ZVI可进一步活化氧化剂生成强氧化性自由基(如·OH、SO4·-和O2·-等),实现有机污染物的深度降解和矿化. 另外,S-ZVI中的Fe0与溶液中Fe3+反应不断生成Fe2+,持续活化氧化剂产生活性组分. 鉴于此,该文针对S-ZVI及其耦合不同AOPs体系进行综述,系统介绍了不同体系中污染物去除性能的影响因素,重点阐述了去除污染物的反应机理,并简述了相关工程应用,最后提出建议和研究展望,以期为相关研究和工程应用提供一定的参考.
1 S-ZVI去除污染物的影响因素及反应机理
1.1 S-ZVI去除污染物的影响因素
将ZVI硫化改性可增大比表面积、提高电子选择性和电子传递效率等,S-ZVI在水处理方面得到广泛应用,主要包含砷(As)、锑(Sb)等类金属[13-14],铬(Cr)、镉(Cd)等重金属[15-16],三氯乙烯(TCE)、偶氮染料(橙色Ⅰ)等有机污染物[17-18],以及抗生素抗性基因等[19],S-ZVI对不同污染物的反应条件和去除效果如表1所示. S-ZVI不仅可以去除单一污染物,也能够去除复合污染物. 纺织、印染等工业废水中可能同时含有Cr和Sb,将S-ZVI用于开放式和混合良好的间歇式反应器中,可同时有效螯合去除Cr(Ⅵ)和Sb(Ⅲ)[14]. Wei等[16]结果表明,S-nZVI可同时去除重金属离子和多溴二苯醚(PBDEs),重金属离子对PBDEs的去除率存在促进或抑制作用.

表1 S-ZVI用于类/重金属和有机污染物的去除效果和反应条件汇总Table 1 Brief summary of removal efficiency and reaction conditions of metalloid/heavy metal and organic pollutants by S-ZVI
S-ZVI在水处理中的影响因素主要包括合成方法、S/Fe、S-ZVI投加量、反应溶液pH、溶解氧、共存离子和腐殖酸等.
采用不同硫化方法制备的S-ZVI在形貌、结构和对目标污染物的去除效果等方面有所不同. 机械球磨法制备的S-mZVI大多呈不规则的球形颗粒且通常被认为是核壳结构,但Tian等[24]明确揭示S均匀分布在S-mZVI内部. S-nZVIone-step以球形为主,链状聚集,含有少量立方体或片状结构;S-nZVItwo-step具有明显的核壳结构,颗粒表面包覆了一层硫铁化物(FeSx)[25]. S-nZVIone-step在去除目标污染物方面表现出更好的反应性、选择性和使用寿命[26]. 不同硫化剂会对S-ZVI的物理化学特征产生一定影响[25],但Han等[17]利用不同硫化剂(硫化钠、连二亚硫酸盐或硫代硫酸盐)硫化ZVI时,发现S-ZVI的反应性受硫化剂的影响很小. 提高硫化时间有利于增大S-ZVI对目标污染物的去除,但硫的负载和扩散达到饱和后继续延长硫化时间不会对样品的组成和结构产生太大影响[24].
ZVI硫化过程中表面形成的一层FeSx会增加表面粗糙度,提供更多反应位点[27]. S-ZVI电负电位(5.02 eV)比ZVI电负电位(4.02 eV)更高,能够促进电子从颗粒内部转移到污染物溶液,提高电子传递效率. 提高S/Fe(摩尔比,下同)有利于提高污染物去除率,但过度硫化会导致ZVI(主要电子供体)含量降低[28]. 因此,随着S/Fe增加,污染物去除率往往呈现先升后降趋势,最佳S/Fe随目标污染物不同而变化;同时,随着S-ZVI投加量增加,吸附位点和活性位点增多,污染物去除率相应提高[5].
S-ZVI在酸性条件下较稳定,在碱性条件下反应活性更强,pH适用范围较广. 反应溶液pH较高时,游离的和表面结合的Fe2+更容易被氧化,在表面形成厚厚的氢氧化物层,抑制Fe0腐蚀[23]. 研究表明,随溶液初始pH增加,污染物去除率总体呈先增后降趋势[5,21]. 但在Su等[20]研究中,Cd去除率受pH影响较小,在pH=5~9范围内,Cd去除率均大于95%.
反应溶液中共存离子会影响污染物去除率,通常阳离子会与重金属离子竞争活性位点[29],但Kim等[30]发现,Mg2+或Ca2+的存在显著提高了TCE还原速率,这与Turcio-Ortega等[31]研究结果一致,其研究结果显示,含氯化物的介质对Fe/FeS具有强烈的活化作用. 反应溶液中阴离子可能与ZVI反应,如NO3-与Fe0反应生成氧化铁〔见式(1)〕[32];同时阴离子与铁离子生成铁-阴离子配合物占据表面反应位点,导致目标污染物去除受到抑制[33]. 腐植酸(HA)是水和土壤中典型天然有机物(NOM),与重金属相互作用会影响其在环境介质中的归宿和运输[29]. Kim等[30]通过FeS包覆的纳米零价铁还原TCE模拟修复地下水,结果表明,HA导致TCE去除率下降,且随着HA浓度增加,反应速率越来越低.

1.2 S-ZVI去除污染物的反应机理
硫化能够提高ZVI表面疏水性,促进ZVI释放的电子倾向于转移到目标污染物,提高电子选择性[34];同时,FeSx作为电子导层,能够促进电子从铁芯转移到表面,加速Fe2+释放[35]. 此外,硫还可以调节球磨ZVI的形态,使其分散并呈现出不规则的球形或片状结构[36].
S-ZVI去除类/重金属机制主要包括吸附、还原或共沉淀[37]. ZVI硫化后表面粗糙度和比表面积增加,有效增强对类/重金属的吸附能力,同时其表面羟基氧化铁为污染物提供了优异的吸附性能[38]. 金属离子(如Cd2+和Pb2+等)能够与硫反应生成溶解度更低的金属硫化物而发生共沉淀[39]. 以Cr(Ⅵ)为例,Cr(Ⅵ)首先吸附到S-nZVI颗粒上,再通过表面Fe2+、直接电子转移和反应性硫化物物种还原为Cr(Ⅲ),最后以铬铁(羟基)氧化物的形式固定在颗粒表面〔见式(2)(3)〕[3,40]. S-ZVI对有机污染物的去除机制通常为还原或氧化反应. 在水处理中,S-nZVI主要作为还原剂对卤化物进行脱卤处理,如TCE脱氯[17]、氟苯尼考(FF)脱氟[1]等. S-nZVI对TCE的还原主要通过FeS发生,主要还原机制为直接电子转移[41]. Tian等[42]探究了厌氧条件下S-nZVI对硝基苯酚(PNP)的氧化还原机制,结果表明,90% PNP被还原降解为对氨基苯酚,10% PNP被原位生成的·OH氧化成苯醌. 当水处理涉及氧化过程时,S-nZVI可以作为催化剂发挥作用,即在溶解氧的存在下,S-nZVI及其释放的Fe2+会引发芬顿和类芬顿反应产生·OH和O2·-〔见式(4)(5)〕,有效去除水中的有机污染物[23].

2 S-ZVI/AOPs体系
S-ZVI/AOPs体系可同时利用S-ZVI的吸附性、还原性和AOPs的强氧化能力,实现有机污染物的深度降解甚至矿化,不同耦合体系在水处理中的反应效果及反应条件如表2所示.

表2 S-ZVI/AOPs对水中污染物的去除效果和反应条件总结Table 2 Brief summary of the removal effect and reaction conditions of pollutants in water by S-ZVI/AOPs
2.1 S-ZVI/H2O2体系去除污染物的影响因素
Fenton氧化法反应速度快且易于操作,但也存在不足:Fenton反应受溶液pH影响较大,一般需将pH控制在3左右;同时反应过程中pH升高后会导致Fe3+转变成Fe(OH)3,产生大量铁泥. nZVI发生腐蚀产生大量Fe2+诱导·OH清除〔见式(6)〕[53],因此很多学者将S-ZVI作为非均相类Fenton体系的催化剂.

S-ZVI耦合H2O2体系去除污染物过程中,S/Fe对水处理效果影响较小. 当硫负载量较低时,表面主要成分是FeSx,有利于活化H2O2生成·OH;当硫负载量较高时,颗粒表面主要生成FeSO4或Fe2(SO4)3等物质,同样可以激活H2O2生成·OH[54]. 随着S-ZVI投加量增加,表面催化活性位点数量与表面吸附污染物数量均增加,污染物去除率也随之提高[43]. 但过量FeS会消耗·OH,并且还可能导致催化剂发生团聚现象,减少其表面催化活性位点数量[55]. 氧化剂投加量在S-ZVI/AOPs体系用于污染物去除中起着关键性作用. 当H2O2浓度较低时,由于溶液没有足够的·OH,可能导致污染物降解不彻底[43]. 随着H2O2投加量增加,体系中·OH浓度随之升高,但过量H2O2会引起自由基清除〔见式(7)〕[43]. Fenton体系受反应溶液pH变化影响很大,仅在酸性条件下去除效果显著[53]. 当pH升高,H2O2发生快速自分解生成H2O和分子氧,同时Fe2+和Fe3+在碱性条件下会发生水解,导致Fe2+含量减少并阻碍表面电子传递[43].

2.2 S-ZVI/O2体系去除污染物的影响因素
S-ZVI去除有机污染物的研究大多在无氧条件下进行,去除效果显著. Du等[40]研究表明,O2通过与目标污染物竞争电子而抑制S-nZVI对铬酸盐的去除. 近年来,基于nZVI活化空气中分子氧产生活性氧(ROS)〔包括H2O2、·OH和O2·-〕能够氧化、甚至矿化有机污染物[56],有学者开始探索S-ZVI/O2体系对污染物的去除效果. Zhang等[23]在O2存在下利用FeS包覆nZVI去除罗丹明B,结果表明,O2的存在提高了罗丹明B的去除率. 因此,O2既可能对污染物去除产生抑制作用,也可能产生促进作用. 基于此,Wu等[57]通过设计动态两步缺氧/好氧过程,提高了S-nZVI对四溴双酚A(TBBPA)的去除效果并成功实现矿化,即在缺氧阶段,TBBPA还原脱溴完全转化为双酚A (BPA);在好氧阶段,BPA被·OH氧化为二羟基苯和苯醌,最终通过开环反应实现矿化.
S-ZVI/O2对污染物的去除效果在一定范围内随S/Fe增加而提高[46]. Zhao等[13]指出,在有氧条件下As(Ⅲ)主要通过吸附去除,S/Fe增加会引起Fe0减少,导致铁(羟基)氧化物的形成减少,最终导致As(Ⅲ)的去除能力降低. 在有氧环境中,O2·-和·OH对溶液pH有强烈的依赖关系,酸性条件有利于·OH生成,但在碱性条件下O2·-占主导地位[58]. 因此,S-ZVI/O2体系在去除污染物时会受到溶液pH较大影响. 已有研究[46]表明,S-nZVI/O2在中性条件下对有机污染物去除效果更好,在去除DCF试验中,pH=3.5时,S-nZVI快速溶解,DCF去除率略微降低;pH=10时,虽然O2·-占主导地位,可以有效地作为还原脱氯自由基,但并没有观察到DCF去除.
天然环境中的无机阴离子(如SO42-和Cl-)会竞争性消耗·OH,对污染物去除效果产生不同程度的抑制作用. S-ZVI/O2系统中ROS产量不高,在体系中添加配体后,配体与Fe2+结合形成复合物有利于自由基生成,主要原因有:①配体可以降低Fe3+/ Fe2+氧化还原电位,促进O2·-生成〔见式(8)〕;②某些配体(如聚磷酸盐)能够促进表面复合Fe3+与颗粒内Fe0反应生成表面复合Fe2+;③配体与表面Fe2+络合会导致溶解Fe2+浓度增加,有利于ROS产生[59].

2.3 S-ZVI/PS体系去除污染物的影响因素
PS分为过氧一硫酸盐(PMS)和过氧二硫酸盐(PDS),均具有较高的氧化还原电位,常用于活化生成SO4·-以氧化去除污染物[44]. S-ZVI活化PS氧化法具有氧化还原电位高、反应快速、作用条件温和等优点[60](见表3),被广泛应用于环境修复领域.

表3 不同S-ZVI/AOPs体系的优缺点对比Table 3 Comparison of advantages and disadvantages of different S-ZVI/AOPs systems
已有研究[44,49]表明,提高S/Fe有利于提高污染物去除效果,但较高硫剂量会造成Fe0含量显著降低,导致电子供体减少,并且大量SO42-沉积在颗粒表面会阻碍电子转移. 因此,污染物去除效果通常随S/Fe先增加后降低. 提高S-ZVI投加量可以增加反应活性位点,同样较高浓度PS有更多与催化剂接触的机会,有利于SO4·-和·OH形成[35]. 但投加过量PS会对SO4·-和·OH产生负面影响,高浓度SO4·-可能与S2O82-

与Fenton体系相比,PS体系在较宽pH范围内对污染物均有良好去除效果,Guo等[35]研究发现,在pH=3.0~9.0范围内,S-ZVIbm都能有效地活化PDS.污染物去除率受溶液初始pH影响,污染物不同,去反应生成S2O8·-和SO42-〔见式(9)(10)〕[49].除效果最佳的酸碱度也不相同. Dong等[28]研究显示,在酸性条件下S-nZVI活化PS去除三氯乙烯的性能更好,这与Ahmad等[61]研究结果一致. 但RhB在初始酸碱度为中性时去除率最高,这是因为在中性和碱性条件下会产生更多的活性物质[62]. Liang等[63]研究显示,pH=7时,TCE去除率最高. 在碱性条件下,PDS可以催化水解生成SO4·-、·OH和超氧化物,去除污染物性能较好[64].工业水体和自然水体中的共存离子和天然有机质与活性物质反应将降低S-ZVI对PS的活化效率.Guo等[35]研究表明,虽然SO42-可以去除铁表面钝化层以产生更多Fe2+,但大量Fe2+很容易与过量的硫酸盐螯合,因此SO42-抑制作用更明显. 同样,理论上Cl-可以打破氧化层,增强Fe2+释放,但由于体系本身溶解出Fe2+能力较强,Cl-促进效果并不明显,并且过量Cl-可能与Fe2+产生FeCl+复合物,降低溶液中Fe2+含量. 过量NO3-与SO4·-反应产生氧化能力较弱的·NO3,但S-ZVIbm/PDS系统中产生的大量自由基能够弥补·NO3氧化能力弱的问题. Chen等[65]用FeS活化PS去除2,4-二氯甲氧乙酸(2,4-D),加入HCO3-会明显抑制2,4-D去除,这可能是因为HCO3-可作为自由基清除剂同时消耗SO4·-和·OH〔见式(11)(12)〕.
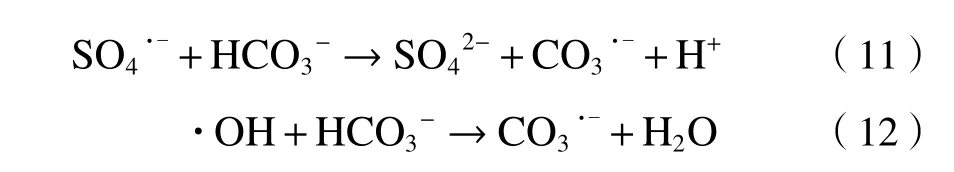
3 S-ZVI/AOPs体系去除污染物的反应机理
3.1 硫化作用
ZVI硫化改性后在电子传递效率和反应活性等方面表现出独特优势[66].
a) 硫化改变电子转移路径. 在nZVI/O2体系中,nZVI腐蚀主要通过四电子转移反应(见图1)进行,Fe0首先与O2反应生成中间产物H2O2(双电子转移),此时产生的H2O2大部分通过双电子转移被nZVI还原成H2O,一小部分H2O2在Fe2+激活下生成活性氧化 剂·OH或Fe(Ⅳ)〔见 式(13)~(15)〕[68],这 是 由 于H2O2与Fe0反应速率比Fe2+反应速率快[56]. Fe(Ⅳ)反应性比·OH低,但选择性更强,并具有不同的形式,如氧化物和羟基配合物以及与有机或无机配体的配合物[69]. ZVI硫化改性后,电子传递方式将发生改变. 在S-nZVI/O2体系中,Fe2+活化H2O2的单电子转移成为主要途径〔见式(4)〕,同时Fe2+氧化过程产生大量O2·-[46]. Su等[67]探讨了S-nZVI/O2体系中的电子转移数,发现S-nZVI/O2的氧还原(ORR)电子转移数远低于2.8,表明四电子转移途径受到抑制,单电子转移成为·OH产生的主要途径. 因此,减少Fe0与H2O2反应或增加Fe2+对H2O2的活化可提高活性物质产量.
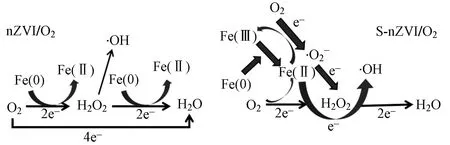
图1 nZVI/O2和S-nZVI/O2体系中的电子转移途径[67]Fig.1 Electron-transfer pathway in nZVI/O2 and S-nZVI/O2 system[67]

b) 硫化层促进Fe2+快速溶解. 硫化层作为电子导体可以加快Fe0与溶液的电子传递速度,提高Fe2+溶解速度. 通过调节溶液pH在酸性或中性条件可有效促进Fe0释放Fe2+,同时防止Fe2+生成铁氧化物沉淀,提高氧化剂活化效果,为反应体系提供更多的活性物质.
c) 硫物质激活氧化剂. ZVI在硫化过程中会产生多种硫物质,包括S2-、Sn2-、SO32-和SO42-等,某些硫物质可激活氧化剂生成自由基. 在利用S-mZVI活化PMS去除磺胺甲恶唑时,SO32-可有效激活PMS产生SO4·-,并转化为·OH〔见式(16)(17)〕,S2-和S2O32-不能激活PMS,但S2-具有还原性,通过加速Fe3+/Fe2+转化可促进激活PMS[51]. 此外,SO32-也可通过激活Fe3+引发自由基链反应生成SO4·-[70]〔见式(18)~(20)〕.

3.2 活性物质
已有研究表明,Fe2+是S-ZVI激活氧化剂过程中主要活化物质[62],包括溶解Fe2+和表面结合Fe2+.S-ZVI表面结合Fe2+主要来源于FeS,少量FeS2也可以与水反应生成Fe2+〔见式(21)(22)〕[35]. 溶解Fe2+大部分通过均相活化氧化剂产生活性物质,而颗粒表面结合Fe2+则以非均相活化方式活化氧化剂. Song等[46]在O2环境下利用S-nZVI去除DCF,Fe2+浓度非常低时,H2O2产量却在增加,进一步加入碘离子清除表面结合的·OH后发现DCF去除率大大降低,这表明表面结合Fe2+在活化氧化剂中起着重要作用. Jin等[50]在研究S-mZVI/PDS体系对AR大肠杆菌的灭活率时,发现在加入1,10-菲咯啉30 min后,灭活效果几乎不受影响,这表明溶解的或表面结合的Fe2+都不是PDS主要活化剂,最后通过原位衰减全反射傅里叶变换红外光谱(ATR-FTIR)表征确定从Fe0到PDS的直接电子转移是PDS活化主要方式. 因此,氧化剂活化途径不仅包括溶解的和表面结合的Fe2+活化,还包括Fe0对氧化剂的直接活化.

在S-ZVI/O2体系中,Fe0可以活化空气中分子氧原位产生H2O2,再经活化生成·OH和O2·-[56,71]. 通 过向反应溶液中添加H2O2,可有效增加反应体系中·OH含量,S-ZVI/H2O2体系中主要活性物质为·OH.已有研究表明,S-ZVI/PS体系中存在SO4·-与·OH两种 主 要 自 由 基[28,62],SO4·-与H2O/OH-反 应 可 以 生成·OH〔见式(23)(24)〕[49],但关于SO4·-与·OH在体系中的主导作用一直以来备受关注. Guo等[35]利用化学淬灭试验和电子顺磁共振(EPR)证明,SO4·-是S-mZVI/PS体系中主要氧化产物,而Rayaroth等[48]通过分析清除剂存在下铁溶解和PS分解,确定S-nZVI/PS体系中主要活性物质是·OH. 总结已有相关研究,S-ZVI/PS体系中主要活性物种根据pH不同而变化. 在酸性条件下,SO4·-是主要自由基[63],而在较高pH时,·OH是主要自由基,一方面是由于碱的活化;另一方面是随着溶液pH增加,SO4·-转化为·OH[72].此外,S-nZVI/PS体系活性物种还含有Fe(Ⅳ)[73],但Fe(Ⅳ)对活性物质的贡献率低于SO4·-和·OH;同时,由于在较高pH下可用的Fe2+含量减少,Fe(Ⅳ)相对贡献随着pH增加而减少[52].
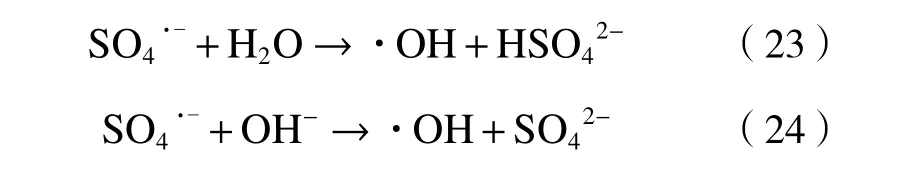
S-ZVI/AOPs对水中污染物的去除机理如图2所示,除S-ZVI本身的吸附、还原作用外,还包括:①硫化在O2存在时改变电子传递途径,促进活性自由基生成,硫化层加快Fe0释放活化剂Fe2+,并且硫物质可直接活化氧化剂;②氧化剂的活化包括Fe2+均相活化和非均相活化以及Fe0直接活化;③有机污染物的深度降解和矿化主要依赖于活性物质的强氧化作用,S-ZVI/O2和S-ZVI/H2O2的主要活性物质包括O2·-、·OH和Fe(Ⅳ),S-ZVI/PS的主要活性物质包括SO4·-、·OH和Fe(Ⅳ).

图2 S-ZVI和S-ZVI/AOPs对水中污染物的去除机理Fig.2 Removal mechanism of pollutants in water by S-ZVI and S-ZVI/AOPs
4 工程应用
目前,基于S-ZVI和S-ZVI/AOPs的水处理技术在实际中应用试验较少. Nunez-Gircia等[74-75]提出将羧甲基酸钠稳定的S-nZVI用于修复受氯化挥发性有机化合物(cVOCs)污染的地下水及周边土壤原位修复,处理后的周边土壤区域VOCs浓度显著下降,最终脱氯. Brumovský等[76]成功将S-nZVI颗粒注入了被Cr(Ⅵ)污染的含水层,Cr(Ⅵ)被快速吸附还原为Cr(Ⅲ),并固定在不溶相中,证明了S-nZVI在修复受Cr(Ⅵ)污染含水层中的适用性. 注射后,S-nZVI纳米颗粒形成聚集体,并根据现场条件缓慢氧化成铁(羟基)氧化物、碳酸盐绿锈和其他矿物质. Fe0含量升高甚至在注射几个月后检测到,这表明S-nZVI在含水层中稳定性高且寿命长,具有很好的应用前景.
5 结论与建议
a) 近年来,S-ZVI已广泛用于类金属、重金属和有机污染物的去除,S-ZVI/AOPs体系对难降解有机物降解效果显著,在水处理方面具有很好的应用前景. S-ZVI去除污染物的机理主要是吸附和还原作用,S-ZVI/AOPs体系去除污染物的机理主要是活性物种的氧化作用,铁硫化层可以通过改变电子转移路径提高活性物种产量,同时一些硫物种也可以活化氧化剂. 氧化剂的活化途径包括Fe2+均相活化和非均相活化及Fe0直接活化. S-ZVI/AOPs体系中的活性物种除常见活性自由基外,如·OH、O2·-和SO4·-等,还包含非自由基Fe(Ⅳ),但Fe(Ⅳ)贡献量相对较少.
b) 利用S-ZVI/AOPs体系去除污染物过程中,电子传递途径主要包括Fe0转化为Fe2+、Fe2+活化氧化剂生成活性物质、Fe3+与Fe0反应生成Fe2+以及Fe0/Fe2+还原目标污染物等几方面,电子传递途径的主次顺序会直接影响到耦合体系的氧化、还原作用,进而影响污染物去除效果. 因此,对各电子传递途径进行定量分析,并研究影响电子传递途径的因素和机理,可以有效提高该耦合体系的氧化去除效能.
c) 溶解氧会通过与目标污染物竞争电子而抑制S-ZVI对污染物的去除效果,但S-ZVI可通过活化O2产生活性物种增强对污染物的去除能力,因此通过深入厘清O2对S-ZVI去除污染物的促进或抑制作用的影响机制,将有利于提高S-ZVI在工业废水处理领域中的应用效果.
d) 目前,S-ZVI和S-ZVI/AOPs的研究基本在实验室中进行,主要针对一种或两种污染物,而实际水体中大多含有多种污染物,应考察多种污染物同时存在时的去除效果,并探究不同污染物之间的相互影响机制,以期将更多研究投入到实际污染水体修复应用中;同时,应注意该体系用于实际水体处理后是否会造成潜在危害有待进一步研究论证,特别是在地下水修复方面,更需要考虑反应剂的潜在危害性.

