鱼腥草素钠调节软骨基质平衡延缓骨关节炎进展
朱天峰,赵志坚,刘 洋,张一健,陆英杰,朱雪松
(苏州大学附属第一医院骨科,江苏 苏州 215006)
骨关节炎(osteoarthritis, OA)是一种常见的关节退行性疾病,多以关节软骨退变、滑膜炎、软骨下骨骨化、关节边缘骨赘形成等为特征[1-2]。骨关节炎的临床表现常为关节疼痛、肿胀、晨僵、关节积液及活动受限和功能障碍,不仅降低病人生活质量,也给家庭带来沉重的经济负担。在全球范围内,骨关节炎的发病率呈现逐年上升的趋势,总患病率约为15%,且随着年龄的增加,骨关节炎的发病率也呈现上升趋势,60 岁以上达50%,75 岁以上更是高达80%[3-4];而在我国,骨关节炎的发病率及患病人数也呈现逐年上升趋势[5]。而对于骨关节炎的治疗,目前临床上多采取三级阶梯式的诊疗方案[6],即早期多以预防为主,健康宣教,控制体重;中期建议加强肌肉力量的功能锻炼,并服用非甾体类抗炎药镇痛等方式缓解症状;而对于晚期严重骨关节炎的患者,则只能通过手术治疗。总而言之,骨关节炎目前尚无有效的治疗药物,因而亟需开发能够缓解或逆转骨关节炎发生、发展的新型治疗药物或方案。
骨关节炎的发病机制十分复杂,其中细胞外基质合成降解稳态的破坏被认为是其发生发展的重要机制[7]。在骨关节炎发生时,蛋白聚糖(ACAN)和Ⅱ型胶原(COL Ⅱ)的表达常常受到抑制,而基质金属蛋白酶13(MMP13)及聚蛋白多糖酶(ADAMTS5)等的表达往往会增加,细胞外基质的合成和分解代谢平衡因此受到破坏,进而导致软骨稳态破坏。鉴于此,抑制MMP13、ADAMTS5等表达,促进COL Ⅱ及ACAN的表达,调节细胞外基质稳态是缓解骨关节炎的重要方式之一[8]。
针对骨关节炎新型治疗药物的研发,经典中药是一个巨大的宝库,从中我们可以找到许多应用于缓解骨关节炎发生、发展的潜在药物[9]。鱼腥草作为一种源自于常见的中药组分,具有抗病毒[10],抗菌[11-12],抗炎[13],抗肿瘤[14],以及增强免疫力[15]等多种作用。鱼腥草素是来源于中药鱼腥草的一种主要活性成分,而鱼腥草素钠(Sodium Houttuyfonate, SH)则是由鱼腥草素与亚硫酸氢钠相结合而形成的相对稳定形式[16]。与鱼腥草类似,既往研究[17]提示SH同样具备抗菌、抗病毒、抗炎、抗氧化、抗肿瘤以及保护心肌细胞及神经细胞等多重功效。近期研究[18-19]显示,SH对炎症及氧化还原平衡具有良好的调控效应。因此,我们推测SH可作为潜在药物用于骨关节炎的治疗。
1 材料和方法
1.1 设计 体外细胞实验。
1.2 时间及地点 实验于2020年3月—2021年7月在苏州大学附属第一医院完成。
1.3 材料
1.3.1 实验动物:雄性bal/c小鼠,5天龄,SPF级,用于获取软骨组织,进而提取和培养软骨细胞,实验动物均由昭衍苏州新药研究中心提供,实验动物机构许可证号:SCXK(苏)2018-0006。
1.3.2 实验试剂:胎牛血清、青链霉素、0.25%EDTA-胰蛋白酶、DMEM/F12(1:1)(Gibco公司);CCK-8(东仁化学公司);Trizol(Invitrogen公司);反转录试剂盒(Takara公司);Ⅱ型胶原一抗(Abcam公司);RT-PCR引物(金唯智公司);Ⅱ型胶原酶(Serva公司);活死染色试剂盒(碧云天公司)。
1.3.3 实验仪器:PCR仪(Bio-Rad公司);全波长酶标仪(BioTek公司);凝胶电泳仪(Bio-Rad公司);凝胶自动成像仪(美国Bio-Rad公司);倒置显微镜、正置显微镜(蔡司公司)。
1.4 实验方法
1.4.1 软骨细胞的提取与培养:在超净台中无菌条件下取5天龄bal/c小鼠肩、膝关节处软骨组织,用PBS缓冲液冲洗3 遍后,0.25%胰酶消化约5 min,用DMEM/F12(1:1)完全培养基中和来终止消化,吸去液体,加入0.2% Ⅱ型胶原酶,置于37 ℃恒温摇床震荡消化约4 h,待消化完全后,使用细胞筛网滤去杂质,获得单细胞悬液,离心弃上清,用DMEM/F12(1:1)完全培养基重悬并接种于细胞培养皿中,待细胞融合至80%~90%时进行细胞消化传代,传代至P2代备用。
1.4.2 CCK-8增殖实验:取P2代的软骨细胞,以104个/孔的密度接种于96孔板中,分为5组,每组5 个复孔,分别为对照组、白介素组、低浓度SH组、中浓度SH组、高浓度SH组(其中白介素浓度为10 ng/mL,而SH组的低、中、高浓度分别为1、10、100 μg/mL,且SH组均以相同浓度的白介素预处理),分别用相应的药物干预后置于37 ℃、5% CO2的培养箱中培养。分别于培养第1、3、5、7天的同一时间点取出,每孔用PBS缓冲液轻轻冲洗2遍后加入100 μL 10%的CCK-8工作液,置于37 ℃培养箱中避光孵育2 h后取出,每孔吸取90 μL上清液于新的96孔板中,于全波长酶标仪上测定450 nm处的吸光度值。
1.4.3 活死细胞染色:取P2代软骨细胞,采用1.4.2中分组方式分组,在种板、预处理、干预后第7天分别取出爬片,按照活死染色试剂盒说明书上的操作步骤来进行活死染色,按说明书上的配比钙黄绿素AM(Calcein AM):碘化丙啶(PI):检测缓冲液=1:1:1 000配制活死染色检测工作液。用PBS缓冲液轻轻冲洗爬片后,加入适量的染色检测工作液,量以浸没整个爬片为准,于室温下避光孵育30 min。孵育结束后,用PBS缓冲液轻轻冲洗,置于正置显微镜下观察。Calcein AM染色活细胞显示绿色荧光,PI染色死细胞显示红色荧光。
1.4.4 荧光染色:取P2代软骨细胞,采用1.4.2中分组方式分组,在种板、预处理、干预完成后,分别取出爬片,用PBS缓冲液轻轻清洗,冰甲醇固定后,先用0.25% Triton X-100在室温下通透8 min,用封闭液于室温下封闭30 min后,再于室温下分别加入相应浓度的一抗孵育1 h后,回收一抗,用PBS缓冲液轻轻冲洗,加入相应浓度的二抗室温下避光孵育1 h后,除去二抗,用PBS缓冲液轻轻冲洗,加入适量DAPI染色液避光孵育1 min染核,用PBS缓冲液轻轻冲洗爬片,最后用抗荧光猝灭封片剂封片,置于正置显微镜下观察。调整荧光显微镜参数,荧光染色细胞骨架显示绿色荧光,胞质显示红色荧光,细胞核显示蓝色荧光。
1.4.5 实时荧光定量PCR:取P2代细胞,1.4.2中分组方式分组,再种板、预处理、干预7 d后,采用Trizol法提取总RNA并测量浓度,用反转录试剂盒获得cDNA。再将1 μL cDNA混合液、上下游引物各0.5 μL、5 μL SYBR Green、1.5 μL DEPC水混匀后,进行RT-PCR检测。引物序列见表1。
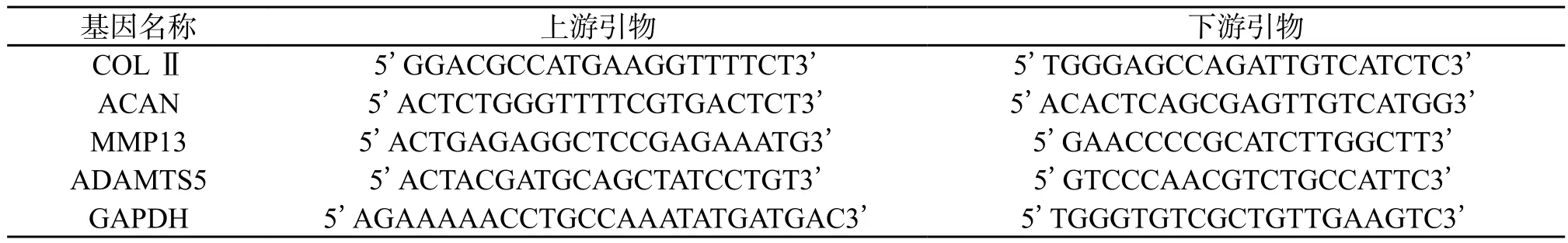
表1 引物序列Tab.1 Primer sequences
1.4.6 蛋白印迹实验:取P2代细胞,1.4.2中分组方式分组,在种板、预处理、干预7 d后,收集细胞并提取蛋白,测定所有样本蛋白浓度后,进行蛋白电泳,然后将蛋白转印至硝酸纤维素膜,进行封闭后裁剪相应条带,用COL Ⅱ、ACAN、MMP13、ADAMTS5、Tubulin的一抗孵育过夜,次日用洗涤液清洗3 遍后孵育对应种属二抗,孵育完成后再次洗涤,最后用化学发光成像系统进行曝光。
1.5 主要观察指标 ①经诱导刺激后软骨细胞的增殖能力和存活率;②经诱导刺激后,软骨细胞的COLⅡ及MMP13荧光染色结果;③经诱导刺激后,COL Ⅱ、ACAN、MMP13、ADAMTS5等基质合成及降解相关mRNA表达;④经诱导刺激后,COLⅡ、ACAN、MMP13、ADAMTS5等基质合成及降解相关蛋白的表达。
1.6 统计学分析 实验数据以均值±标准差表示,应用Graphpad Prism 9.0软件进行统计学分析,采用t检验或方差分析计算P值,P<0.05为差异具有统计学意义。
2 结果
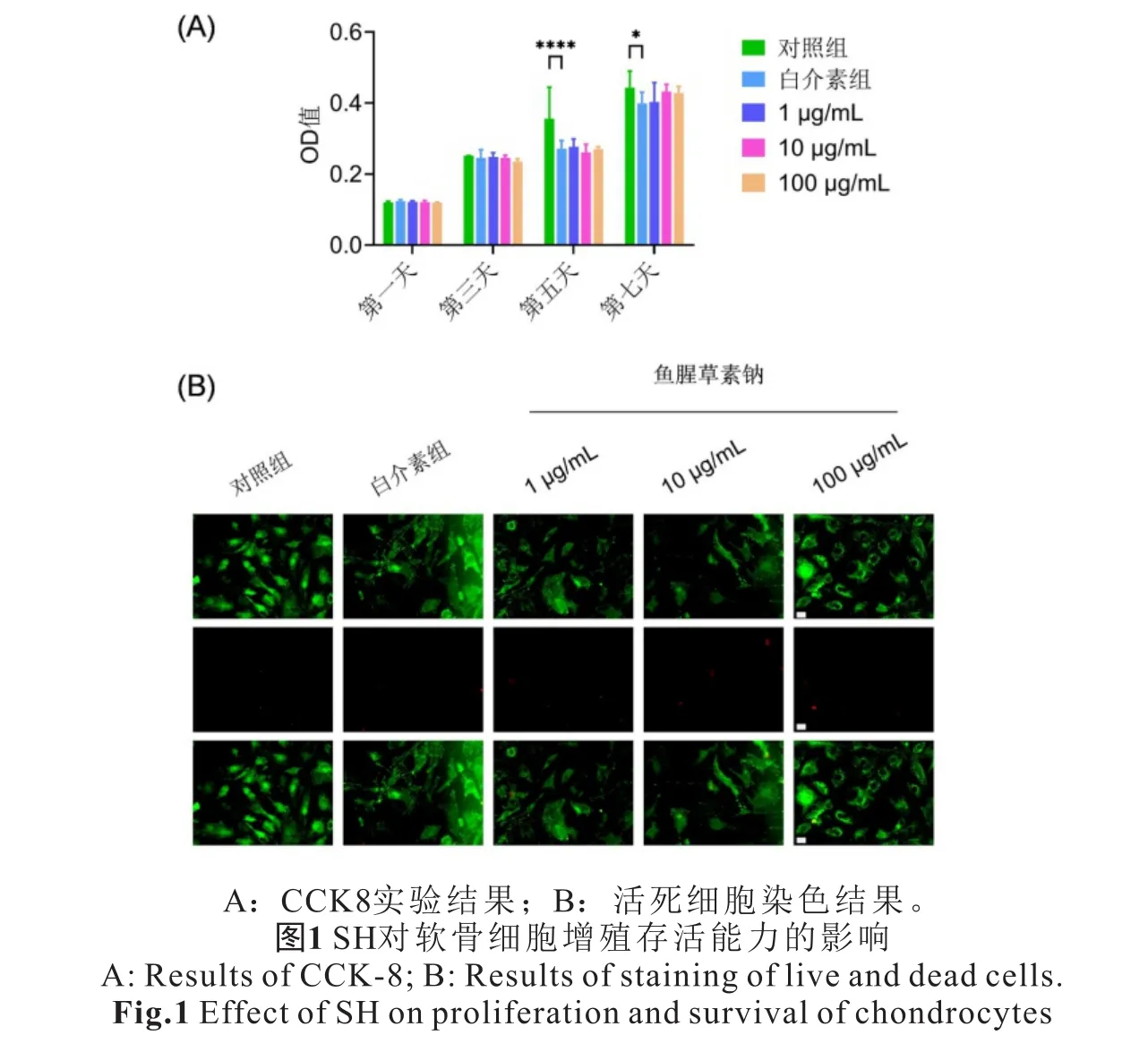
2.1 诱导刺激后的细胞增殖能力和存活率 细胞增殖实验结果显示小鼠软骨细胞加白介素刺激后有明显的增殖能力下降,差异有统计学意义(P<0.05),而SH组与白介素组相比,细胞增殖能力无明显下降,差异无统计学意义(P>0.05),这表明药物SH对于细胞无明显毒性作用(图1A,见封二)。活死染色结果同样显示小鼠软骨细胞加白介素刺激后有死细胞出现,细胞存活率明显下降,而SH组与白介素组相比,死细胞无明显增加,细胞存活率无明显下降,这再次表明药物SH对于细胞无明显毒性作用(图1B,见封二)。
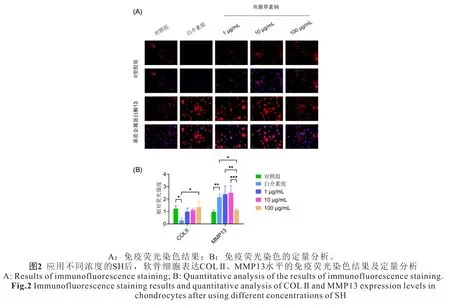
2.2 诱导刺激后的荧光染色结果 各组细胞经诱导刺激后的染色结果提示,软骨细胞应用白介素刺激后COL Ⅱ的表达比对照组表达明显减低,而在应用SH后COL Ⅱ表达增加(图2A,见封二);同时,软骨细胞应用白介素刺激后MMP13的表达比对照组表达明显增加,而在应用SH后MMP13表达降低(图2B,见封二)。
2.3 诱导刺激后的基质合成降解基因表达 各组细胞经诱导刺激后的RT-PCR结果显示,白介素组的细胞外基质合成相关基因COL Ⅱ、ACAN的表达比对照组表达明显减低,差异有统计学意义(P<0.05),而SH组COL Ⅱ、ACAN均明显高于白介素组,差异有统计学意义(P<0.05)(图3A)。同时白介素组的细胞外基质降解相关基因MMP13及ADAMTS5的表达明显高于对照组,差异有统计学意义(P<0.05),而SH组MMP13及ADAMTS5均明显低于白介素组,差异有统计学意义(P<0.05)(图3B)。
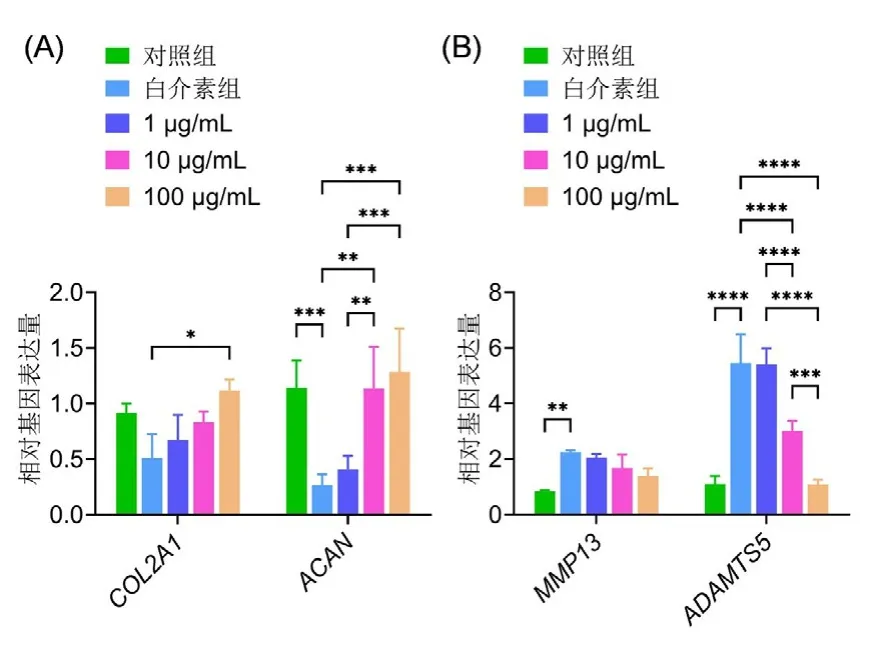
A:COL Ⅱ、ACAN的基因表达水平;B:MMP13、ADAMTS5基因表达水平。图3 应用不同浓度的SH后,软骨细胞表达COL Ⅱ、ACAN及MMP13、ADAMTS5的细胞外基质合成及降解相关基因水平A: The genes expression levels of COL Ⅱ and ACAN; B: The genes expression levels of MMP13 and ADAMTS5.Fig.3 The genes expression levels of COL Ⅱ, ACAN, MMP13 and ADAMTS5, which are related to extracellular matrix synthesis and degradation in chondrocytes after using different concentrations of SH
2.4 诱导刺激后的基质合成降解蛋白表达 各组细胞经诱导刺激后,在蛋白水平检测基质合成降解相关蛋白的表达量,结果显示,软骨细胞在白介素诱导后细胞外基质合成相关蛋白COL Ⅱ、ACAN的表达显著减低,而细胞外基质降解相关蛋白MMP13及ADAMTS5的表达明显升高(图4A、图4B)。应用SH能逆转这种变化,增加COL Ⅱ、ACAN的表达,降低MMP13及ADAMTS5的表达(图4A、图4C)。这表明SH可以影响IL-1β诱导的基质合成降解稳态,增加基质合成,抑制基质降解。
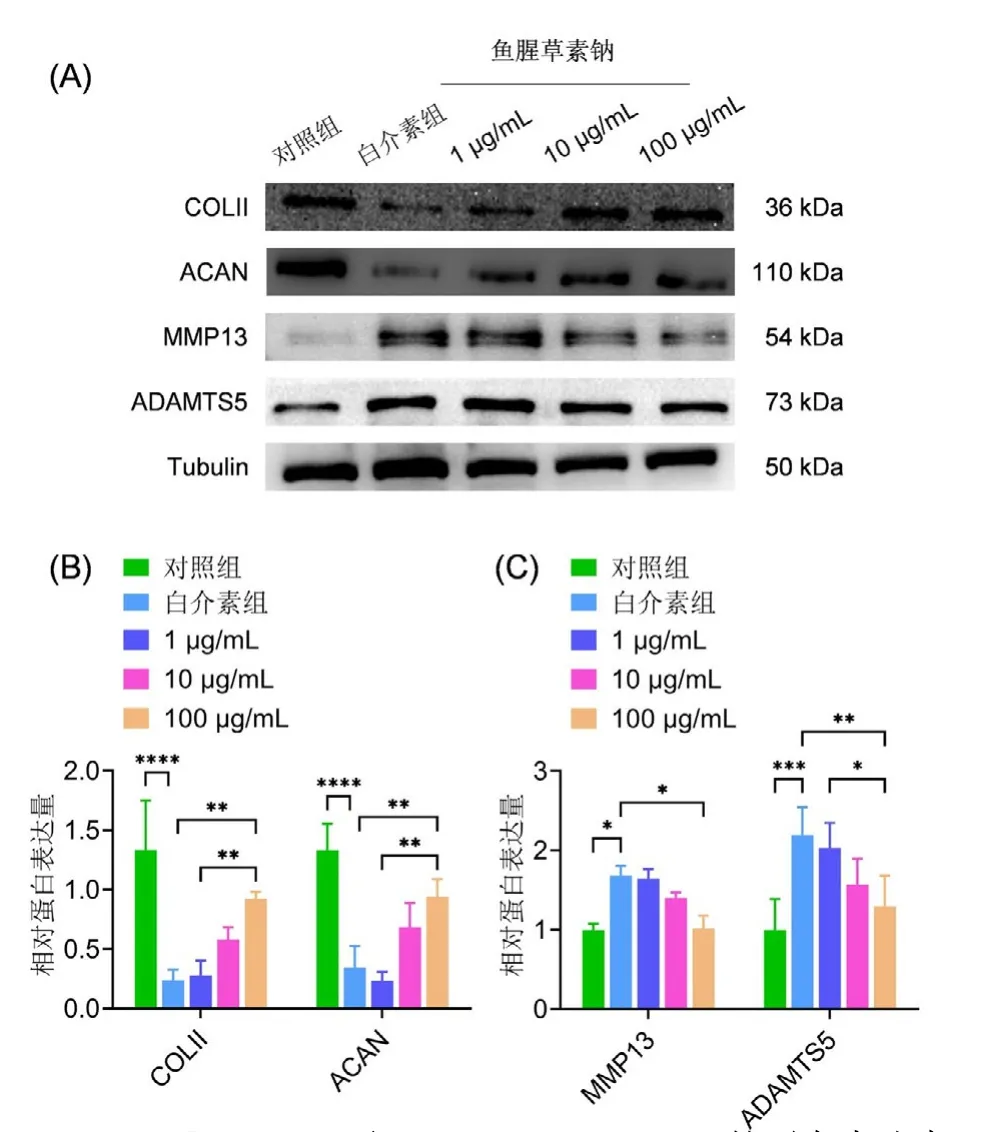
A:COL Ⅱ、ACAN及MMP13、ADAMTS5的蛋白表达水平;B:COL Ⅱ、ACAN蛋白表达水平的灰度值分析;C:MMP13、ADAMTS5蛋白表达水平的灰度值分析。图4 应用不同浓度的SH后,软骨细胞表达COL Ⅱ、ACAN及MMP13、ADAMTS5的细胞外基质合成及降解相关蛋白水平结果及定量分析A: Results of COL Ⅱ、ACAN、MMP13 and ADAMTS5 protein expression levels; B: Quantitative analysis of COL Ⅱand ACAN; C: Quantitative analysis of MMP13 and ADAMTS5.Fig.4 Results and quantitative analysis of COL Ⅱ, ACAN,MMP13 and ADAMTS5 protein expression levels, which are related to extracellular matrix synthesis and degradation in chondrocytes after using different concentrations of SH
3 讨论
骨关节炎是一种临床常见的关节退变性疾病,其发生和发展机制复杂[20]。通过文献研究,可以发现骨关节炎的发生发展与年龄、性别、遗传、代谢、创伤等因素密切相关[21]。其中软骨细胞外基质的降解被认为是骨关节炎的重要标志[22]。在生理状态下,细胞外基质的分解代谢和合成代谢之间保持着动态平衡,从而发挥软骨的正常生理功能[23]。而COL Ⅱ、Aggrecan、MMP13及ADAMTS5这些基因和蛋白表达水平与软骨细胞外基质稳态直接相关,在骨关节炎条件下,MMP13和ADAMTS5表达增加,COL Ⅱ、Aggrecan表达降低,破环细胞外基质稳态,从而导致软骨退变,这些表现不仅是骨关节炎的重要表现,也是骨关节炎发生发展的重要推动力,因此这些指标也被认为是评估骨关节炎进展和治疗效果的重要生物标志物,且人们普遍认为抑制MMP13表达,上调COL Ⅱ表达,维持细胞外基质稳态,将能够有效缓解骨关节炎[24-25]。鱼腥草素是一种从中药中提取出来的药物单体,作为其稳定形式的SH有着与其相似的药物活性,具有抗炎、抗氧化等多重功效[26]。应用SH能够显著降低炎症因子表达,降低氧化应激水平,从而保护细胞免受氧化应激损伤或炎症刺激损伤[27-28],因而应用SH可能会延缓骨关节炎的发生发展。
在本实验中,细胞增殖及活死染色结果表明,SH在体外条件下对于IL-1β刺激的软骨细胞无明显毒性。IL-1β可以诱导小鼠软骨细胞中细胞外基质成分的稳态变化,而应用SH刺激后显著降低软骨细胞中MMP13及ADAMTS5基因表达,并增加COLⅡ和ACAN基因的表达,相关蛋白的表达也同样证实了这一发现。而荧光染色的结果也同样显示SH会抑制骨关节炎条件下异常激活的MMP13,并促进COL Ⅱ表达。因而我们认为SH可以通过调节细胞外基质稳态缓解骨关节炎进程,但该研究主要评价了SH在体外对于骨关节炎的影响,并未对SH在体内的作用及其发挥功效潜在机制深入探讨,这也是该研究的不足之处,在后续的研究中会进一步深入探讨。
综上所述,SH在体外对软骨细胞无明显毒性,且能够抑制细胞外基质降解酶表达,促进细胞外基质合成,调节细胞外基质合成降解稳态。因此,SH可能会影响骨关节炎进程,可能会是骨关节炎的潜在药物。

