不同植物生长调节剂对青蒿种子萌发及幼苗生长的影响
廖建良,刘东权,贺握权
(1.惠州学院生命科学学院,广东 惠州 516007;2.广东第二师范学院 生物系,广东 广州 510303)
中国科学家屠呦呦和她的团队[1]从药用植物青蒿(Artemisia annuaL.)中提取分离得到一种无色的结晶体,并将这种无色的结晶物质命名为青蒿素。青蒿素及其衍生物是目前抗药性最低、疗效最好、应用前景最好的抗疟药物[2]。虽然青蒿生长期短,投资少,收益快,但是青蒿素含量较低,仅占干质量的0.1%~1.0%,且提取工艺复杂,导致青蒿素产量较低、生产成本较高[3]。近年来,随着国内外市场对青蒿素的需求不断增加,野生资源己渐渐满足不了市场需求。因此,需要选育和栽培青蒿素含量高的新品种以满足需求[4],青蒿种子个体质量差异大且体积小,在生产育苗时出现种子发芽率不高,发芽时间过长及出苗不齐等问题。
研究发现,植物生长调节剂可以打破种子的休眠,提高种子的萌发率,促进植株的生长发育[5],植物生长调节剂是一种与植物内源激素相似,有生理生化效应的人工合成物质,使用植物生长调节剂可调控植物的生长发育过程[6]。
青蒿药用价值很高,有清热解暑,截疟等作用,用于暑邪发热,阴虚发热,骨蒸劳热,夜热早凉,疟疾寒热,湿热黄疸。青蒿所含化学成分丰富,应用前景非常广泛,其有效成分青蒿素是一种含过氧化基团的倍半萜内酯类化合物,对由恶性疟原虫引起的疟疾有着显著的疗效,屠呦呦团队以青蒿素为基础的联合用药被世界卫生组织认为治疗疟疾,具有最佳的疗效[7]。
研究发现青蒿素及其衍生物可能对乳腺癌、肝癌、以及一些自身免疫疾病等方面具有潜在的功效[8-10]。近年来,有研究表明青蒿素在治疗糖尿病方面也具有潜在的功效[11]。在今后的研究中,进一步明确青蒿主要药理作用的抗病机制,无论在保证青蒿药材更为充分合理的应用,还是促进临床新药的开发都具有非常重要的意义[12]。
植物生长调节剂是一种具有与天然植物激素具有相似生理和生物学效应的物质,是人们根据天然植物激素的作用机制和结构后,通过人工合成的化合物,能够有效调控植物的生长发育过程,包括从细胞的增殖分裂,到生根、发芽、开花、结实、成熟以及脱落等一系列生命全过程。在中草药生产培育上,能够有效调控作物的生长发育过程,从而增强作物抗逆性,达到稳产增产以及改善品质等目的。
植物生长调节剂包括两大类物质:一种是植物体自身能够合成的物质,如赤霉素等;另一类是通过人工合成,在实际生产中应用的物质,如多效唑、乙烯利等[13],根据植物生长调节剂的作用效果可分为抑制型、促进型以及延缓型[14]。近年来,植物生长调节剂在农业培育生产中取得了重大的进展,与传统农业技术相比,植物生长调节剂具有微量,高效且费用低,以及在植物体和土壤中可迅速分解的特点,真正意义上做到环保绿色、可持续性强,对人类及环境危害极小,由此成为我国在中草药生产当中稳产、高产和高效农业新技术等方面的重要组成部分。但是有关植物生长调节剂和基质对青蒿种子萌发及幼苗生长的影响研究报道较少。为了探讨在不同植物生长调节剂处理下的青蒿种子萌发特性及幼苗生长指标的影响,对青蒿种子进行吲哚乙酸(IAA)、萘乙酸(NAA)和生根粉(ABT)以及赤霉素(GA3)不同质量浓度溶液处理,处理后采用不同培养基质作为青蒿种子的发芽床,采用清水对照,测定植物生长调节剂不同质量浓度处理及不同培养基质条件下青蒿种子的发芽势(Gv)、发芽率(Gr)、发芽指数(Gi)和活力指数(VI),从而选出最佳处理方法,为青蒿育苗提供技术依据和参考;选择在不同基质上发芽实验,目的是解决青蒿种子萌发问题,探讨不同发芽床条件,研究最佳方法、措施和效果,以便在栽培生产上推广应用。
1 试验材料与方法
1.1 种子
供试的青蒿种子均来源于惠州市博罗县罗浮山,惠州市象山药王谷科普园。
1.2 试剂及材料
吲哚乙酸(IAA)、生根粉(ABT)、赤霉素(GA3)和萘乙酸(NAA)均购于上海永生生物科技有限公司,体积分数为95%乙醇、蒸馏水、脱脂棉、滤纸、纱布、土壤(惠州学院后山赤红壤)等。
1.3 试验设计
本试验分别设置5 个不同质量浓度梯度的GA3、IAA、ABT、NAA处理(表1),以清水为对照。挑选大小均匀、颗粒饱满、优质完整的青蒿种子,先用w=10%的NaClO 消毒15 min,之后将种子分别浸泡在不同植物生长调节剂的不同质量浓度溶液中,浸种8 h后取出后用蒸馏水清洗残余植物生长调节剂3~4 次,用吸水纸擦干种子表面多余水分。
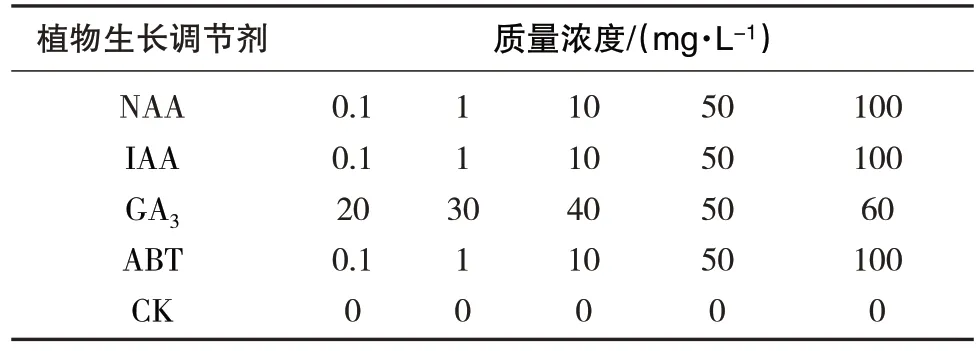
表1 不同植物生长调节剂处理的质量浓度
1.3.1 以脱脂棉为发芽基质
将脱脂棉铺满培养皿底部,将处理好的青蒿种子,按不同植物生长调节剂、不同质量浓度处理的种子均匀放置在脱脂棉上,共20组,做好标号。
1.3.2 以土壤为发芽基质
将土壤均匀铺满培养皿底部,将处理好的青蒿种子,按不同植物生长调节剂、不同质量浓度处理的种子均匀撒在土壤上,接着将少量土壤盖住种子,共20组,做好标号。
1.3.3 以滤纸为发芽基质
将2 层滤纸平铺在培养皿上,将处理好的青蒿种子,按不同植物生长调节剂、不同质量浓度处理的种子均匀放置在滤纸上,共20组,做好标号。
1.3.4 以纱布为发芽基质
将3 层纱布平铺在培养皿中,将处理好的青蒿种子,按不同植物生长调节剂、不同质量浓度处理的种子均匀放置在纱布上,共20组,做好标号。
以上每组试验放置100粒种子,重复3次试验。放置在恒温箱中培养,每天定时浇水,确保种子萌发过程在适宜的环境下,避免种子缺水失活而影响试验结果。
1.4 测定方法
1.4.1 种子萌发及出苗情况观察
种子移置发芽床后,以肉眼可观察到胚根为发芽标准,每隔1 d观察统计1次青蒿种子发芽数,连续3 d青蒿种子发芽数无变化视为发芽结束,第10 d时,各组种子发芽已全部完成。发芽试验结束后,测定幼苗的平均根长、平均茎高并计算发芽率、发芽势、发芽指数及活力指数[15],各指标的计算公式如下:
发发率(GP)=N1/N0×100%,
发芽势(GE)=Nm/N0×100%,
发芽指数(GI)= ∑(Gt/Dt),
活力指数(VI)=S×GI,
其中,N0为每组供试的种子数;N1为萌发的种子数;Nm为种子发芽达到最高峰时种子的发芽数;Gt为时间t天的种子萌发数;Dt为对应的萌发天数;S为胚根长。
1.4.2 幼苗生理指标测定
从每个试验组中随机取10 株幼苗进行生理指标的测定,结果取平均值,包括幼苗的根长、茎高的测定,其中根长和茎高是利用游标卡尺进行测定。选用每组青蒿幼苗的叶片部分测定叶绿素及可溶性蛋白质的质量分数。
叶绿素质量分数的测定是采用分光光度法[16],测定叶绿素提取液在波长665 nm和645 nm下的吸光度,以体积分数为95%乙醇作为对照,计算总叶绿素的质量分数。总叶绿素质量分数=(20.0A645+8.02A665)×V/(1 000×W),V表示样品提取液总体积,W表示样品质量,可溶性蛋白质的质量分数采用考马斯亮蓝法[17]测定。
1.5 数据分析
各组试验重复3次,取平均值,采用Microsoft Excel 2010软件计算平均值及标准误差。结果采用“平均值+标准误差”表示,用IBM SPSS Amos 22 进行单因素方差分析(One-wayANOVA),采用Duncan 法和LSD 法进行不同处理间的显著性检验。
2 结果与分析
2.1 不同植物生长调节剂及不同质量浓度对青蒿种子萌发及幼苗生长的影响
为探究最佳的植物生长调节剂及其最佳质量浓度,选用在同一种培养基质条件下(本数据选取的发芽基质为土壤),研究不同植物生长调节剂及不同质量浓度对青蒿种子萌发及幼苗生长的影响。
2.1.1 不同植物生长调节剂对青蒿种子发芽的影响
由表2 可知,在不同植物生长调节剂及不同质量浓度处理下,青蒿种子的发芽率、发芽势、发芽指数以及活力指数与对照组相比均有一定的提升,其中GA3处理下,青蒿种子各项萌发指标随质量浓度的增加而呈下降的趋势,而IAA、ABT 以及NAA 处理下,青蒿种子各项萌发指标则随质量浓度的增加呈先上升后下降的趋势。

表2 植物生长调节剂对青蒿种子萌发的影响(X±S)
在同种植物生长调节剂的不同质量浓度中,20 mg/L GA3、1 mg/L IAA、10 mg/L NAA 及 10 mg/L ABT 的处理效果最佳,其中20 mg/L GA3的发芽率、发芽势、发芽指数以及活力指数分别为0.69、36.7、13.5和44.3,比对照组分别提高35%、84%、45%和89%;1 mg/L IAA分别为0.68、36.0、14.4 和44.6,比对照组分别提高33%、80%、55%和91%;10 mg/L NAA 分别为0.72、32.3、14.4和48.6,比对照组分别提高41%、80%、55%和107%;10 mg/L ABT 分别为 0.76、36.7、15.8 和56.4,与对照组相比分别提高49%、85%、70%和141%。综上可知,4种植物生长调节剂对青蒿种子萌发均具有促进作用,其中,10 mg/L ABT促进效果显著高于其他组(p<0.05)。可见,10 mg/L ABT浸种处理效果较好。
2.1.2 不同植物生长调节剂对青蒿幼苗生长的影响
由表3 可知,不同植物生长调节剂及其不同质量浓度处理对青蒿幼苗生长的影响程度各不相同,与对照组相比,在不同质量浓度的GA3、IAA、NAA以及ABT浸种处理后青蒿幼苗的根长、茎高、总叶绿素的质量分数以及可溶性蛋白质的质量分数均有一定程度的提高。在GA3的处理下,青蒿幼苗的各项生理指标随质量浓度的增加而下降,因此,高质量浓度GA3会对青蒿幼苗生长产生抑制作用。在IAA、NAA 以及ABT 处理后,青蒿幼苗各项指标随质量浓度的增加呈先上升后下降的趋势。由表3 可见,20 mg/L GA3、1 mg/L IAA、10 mg/L NAA 以及10 mg/L ATB 对青蒿幼苗生长促进作用最佳。
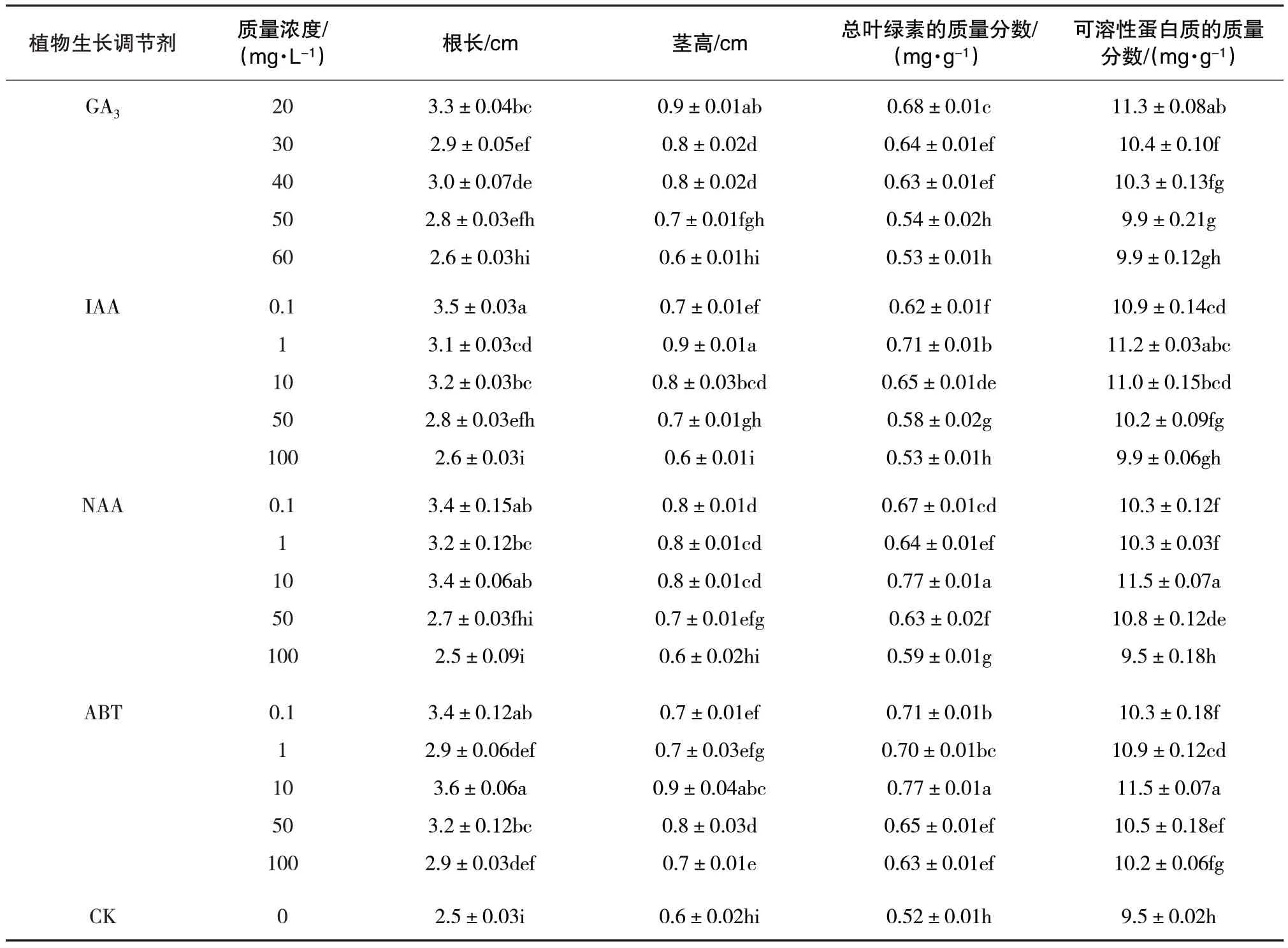
表3 植物生长调节剂对青蒿幼苗生长的影响(X±S)
由表 3 可知,20 mg/L GA3、1 mg/L IAA、10 mg/L NAA、10 mg/L ABT 处理后青蒿幼苗根长分别为3.3、3.1、3.4、3.6 cm,与对照组相比分别提高32%、24%、36%、44%。对青蒿幼苗根长的促进效果由高到低的顺序为 10 mg/L ABT、10 mg/L NAA、20 mg/L GA3、1 mg/L IAA。可见,10 mg/L ABT 处理对青蒿幼苗的根长促进效果最佳。
由表 3 可知,20 mg/L GA3、1 mg/L IAA、10 mg/L NAA、10 mg/L ATB 处理后青蒿幼苗茎高分别为0.9、0.9、0.8、0.9 cm,与对照组相比分别提高50%、50%、33%、50%。可见,10 mg/L ABT、1 mg/L IAA和 20 mg/L GA3处理对青蒿幼苗茎高有较好的促进效果。
2.2 不同植物生长调节剂对青蒿幼苗叶绿素质量分数的影响
由表 3 可知,20 mg/L GA3、1 mg/L IAA、10 mg/L NAA、10 mg/L ABT处理后青蒿幼苗总叶绿素的质量分数分别为0.68、0.71、0.77、0.77 mg/g,比对照组分别提高为31%、37%、48%、48%。可见,10 mg/L ABT 和10 mg/L NAA 处理对提高青蒿幼苗总叶绿素的质量分数有较好的促进效果。
2.3 不同植物生长调节剂对青蒿幼苗可溶性蛋白质质量分数的影响
由表 3 可知,20 mg/L GA3、1 mg/L IAA、10 mg/L NAA、10 mg/L ABT处理后青蒿幼苗可溶性蛋白质的质量分数分别为11.3、11.2 、11.5、11.5 mg/g,与对照组相比分别提高为19%、18%、21%、21%。可见,10 mg/L ABT 和10 mg/L NAA 处理对提高青蒿幼苗可溶性蛋白质的质量分数有促进效果,要优于20 mg/L GA3和1 mg/L IAA处理。
综上所述,10 mg/L ABT 处理后青蒿幼苗的根长、茎高、总叶绿素质量分数以及可溶性蛋白质质量分数均是各种试验中的最高数值。可见,10 mg/L ATB处理效果要优于1 mg/L IAA、10 mg/L NAA和20 mg/L GA3。
2.4 不同培养基质对10 mg/L ABT 处理的青蒿种子萌发及幼苗生长的影响
为探究青蒿种子萌发的最佳条件,选取促进效果最佳的植物生长调节剂及其最佳质量浓度下(10 mg/L ABT),研究不同培养基质(脱脂棉、滤纸、纱布及土壤)对青蒿种子萌发及幼苗生长的影响。
2.4.1 不同培养基质条件下青蒿种子萌发的状况
由表4 可得,青蒿种子萌发以土壤为培养基质的各项萌发指标显著高于其他组,青蒿种子的发芽率、发芽势、发芽指数以及活力指数分别为0.76、36.7%、15.8和55.4,效果显著高于其他组(p<0.05)。各组发芽指标由高到低的顺序为土壤、脱脂棉、纱布、滤纸,经过数据的差异性分析发现,土壤作为发芽床的各项发芽指标显著高于其他组,但纱布和脱脂棉各项发芽指标差异性不显著,但是各发芽指标都显著高于滤纸。可见,土壤是青蒿种子萌发较为理想的萌发基质。

表4 不同培养基质下青蒿种子萌发状况(X±S)
2.4.2 不同培养基质下青蒿幼苗生长的状况
由表5可知,不同培养基质下,青蒿幼苗生长状况差异不显著。但以土壤为培养基质的青蒿幼苗的根长、茎高、总叶绿素的质量分数及可溶性蛋白质的质量分数要略高于纱布、滤纸和脱脂棉处理,各项指标分别为3.5 cm、0.85 cm、0.77 mg/g和11.5 mg/g。
3 讨论与结论
植物种子萌发过程中,种子内部发生复杂的生理生化反应,不同植物激素不同质量浓度之间相互组合产生的效果不同。因此,在研究中可以尝试采用多种激素、不同质量浓度之间组合浸种,以期更全面的了解植物激素对种子萌发的作用机制[18]。植物生长调节剂除了对植物种子萌发影响外,对植物扦插和组培也有促进作用[19]。IAA、IBA、NAA、6-BA 对罗浮山五指毛桃种子萌发有显著影响,其中以6-BA 处理效果最好,可显著提高五指毛桃种子萌发率[20]。种子在萌发过程中由多种植物激素共同参与调节的,植物激素能够活化生长调节基因,进而打破种子的休眠期及促进细胞分裂,从而提高种子的萌发率[21-22]。利用ABT浸泡种子可以有效地调控和强化重要酶和种子内源激素的活性,打破种子休眠,加快种子内部生理生化过程,促进种子提早发芽,提高种子发芽率和发芽势,加快幼苗吸收营养和生长[23-25]。实验结果表明,不同植物生长调节剂及不同质量浓度处理对青蒿种子发芽的促进作用有明显差异,选择最佳的植物生长调节剂及最佳的质量浓度对青蒿种子发芽具有显著的促进作用。10 mg/L ABT 处理青蒿种子,其种子发芽特性和幼苗各项生理指标均显著高于其他处理,这说明ABT 在改善种子发芽特性和促进植株生长方面具有显著效果。IAA、GA3、NAA 处理后青蒿种子萌发及幼苗各项生长指标同样高于对照组,与张福平等[26]利用IAA 对紫罗勒种子发芽及幼苗生长影响的试验结果相类似;GA3可以解除种子休眠,使种胚周围的组织软化,有利于胚芽突破种皮促进种胚的生长,NAA对植物生长发育同样具有显著的调节作用,这与韦荣昌等[27]对黑草、贺红早等[28]对半夏的研究结果相类似。
GA3处理质量浓度在20~60 mg/L范围内,青蒿种子的各项指标随质量浓度的增加而下降,这与魏卫东等[29]对丸粒化披碱草种子萌发及幼苗生长的影响的研究结果相类似;在0.1~100 mg/ L 范围内的IAA、NAA以及ABT处理后,青蒿种子各项指标随质量浓度的增加呈先上升后下降的趋势,说明不同质量浓度植物生长调节剂对青蒿种子的萌发特性及幼苗生长影响不同,高质量浓度有抑制作用。
实验结果表明,青蒿种子萌发和生长效果较好的培养基质是土壤,与滤纸,纱布,脱脂棉相比,土壤的保水能力强且富含各种矿物质、有机质,相对于其他培养基质,更有利于青蒿种子的萌发及幼苗的生长,以土壤和脱脂棉为培养基质的青蒿幼苗根长要长于以滤纸和纱布为培养基质的青蒿幼苗根长,因为土壤是一个疏松多孔体而脱脂棉稀松存在缝隙,两者更利于青蒿幼苗根系的生长,两者根长均显著高于其他两组。
综上所述,IAA、GA3、NAA 和 ABT 4种植物生长调节剂对青蒿种子萌发及幼苗生长均具有显著影响,其中以10 mg/L ABT 浸种且以土壤为培养基质的效果最好,可显著提高种子萌发的各项指标并有效促进植株生物量的积累,这与马新等[30]对文冠果的研究中所得到的结果相类似。建议在栽培青蒿中以10 mg/L ABT浸种且以土壤为培养基质,这样能促进青蒿种子萌发及幼苗生长,在青蒿生产实践中推广应用,能够更好满足市场需求,为提取青蒿素提供原材料。

