A:L1型鸭源多杀性巴氏杆菌灭活疫苗制备及免疫效力研究
田宇杰,李 婷,代国滔,蒲 龄,张亚楠,袁 超,杨茂生,陈 强,李美娟,徐景峨
(1.贵州省农业科学院畜牧兽医研究所,贵阳 550005;2.贵州省农业科学院草业研究所,贵阳 550006)
多杀性巴氏杆菌(Pasteurellamultocida)隶属于巴氏杆菌科巴氏杆菌属,为革兰氏阴性兼性厌氧球杆状菌,包含5个荚膜血清型,8个脂多糖基因型[1-3]。多杀性巴氏杆菌为条件致病菌,可引起野生动物和各类畜禽产生以败血症和呼吸系统为主的疾病[4],如牛出血性败血症[5]、禽霍乱[6-7]、猪萎缩性鼻炎[8]等。多杀性巴氏杆菌病的致病性、免疫原性、宿主特异性等与血清型相关,A型可以导致禽霍乱和猪肺疫,B型、E型可引起猪和牛出血性败血病,而D型菌株则与猪萎缩性鼻炎有关[9-10]。该病的流行和暴发能够对养殖业造成难以估量的经济损失,威胁养殖业的健康发展[11]。
鸭多杀性巴氏杆菌病又称为鸭出血性败血症、鸭霍乱等,各日龄鸭均易感,临床上呈发病急、病程短、发病率及死亡率高的特点,传统养殖过程中常通过抗生素等药物来控制该病,从而导致细菌耐药性的增强和药物残留[12]。因此,通过疫苗免疫是从根本上实现防控该病的有效手段[13]。灭活疫苗因安全可靠、免疫效果良好等优点被广泛应用,常规灭活疫苗保护率为66.7%~83.3%[14]。研究表明,多杀性巴氏杆菌不同血清型菌株的生化特性、致病性、宿主嗜性和抗原性存在差异,不同血清型之间交叉保护力差[15],给该病的防控造成了困难,所以利用地区流行的优势血清型多杀性巴氏杆菌分离株研制疫苗,能取得理想的预防效果。
近年来,贵州三穗麻鸭在养殖过程中出现多杀性巴氏杆菌病的发生和流行,在造成经济损失的同时也严重阻碍了养鸭业的健康发展[16]。在对贵州省多杀性巴氏杆菌的流行病学调查时发现,三穗麻鸭养殖场中主要流行多杀性巴氏杆菌A:L1型(荚膜基因型:脂多糖基因型),本研究利用贵州地方流行的A:L1型多杀性巴氏杆菌菌株制备成灭活疫苗,通过与商品灭活疫苗的免疫效果及差异进行研究,以保障贵州三穗麻鸭养殖业的健康发展。
1 材料与方法
1.1 菌株及试验动物
A:L1 ST128型鸭源多杀性巴氏杆菌贵州分离株由贵州省畜牧兽医研究所畜禽疫病研究室分离鉴定和保存。7日龄健康三穗麻鸭91只,购自贵州省三穗县某养鸭场,血清母源抗体监测均为阴性。其中25只用于半数致死量测定试验,18只用于疫苗安全性检验,48只用于疫苗免疫试验。
1.2 主要试剂及仪器
白油、司本-80和吐温-80均由贵州福斯特生物科技有限公司馈赠;卡波姆(971 P)购自北京国人逸康科技有限公司;胰蛋白胨大豆琼脂培养基(TSA)和胰蛋白胨大豆肉汤(TSB)均购自广东环凯生物科技有限公司;胎牛血清(FBS)购自北京鼎国昌盛生物技术有限责任公司;无水乙醇、二甲苯均购自国药集团化学试剂有限公司;4%多聚甲醛溶液、HE染液均购自Servicebio公司;禽多杀性巴氏杆菌病灭活疫苗(批准文号:兽药生字151722015,生产批号201016,其佐剂为白油佐剂)购自山东滨州沃华生物工程有限公司。
台式离心机(D3024)购自浙江赛德仪器设备有限公司;恒温振荡培养箱(THZ-98A)购自上海一恒科学仪器有限公司;超净工作台(SW-CJ-1F)购自苏州安泰空气技术有限公司;立式压力蒸汽灭菌锅(YXQ-LS-50SII)购自上海博讯实业有限公司。
1.3 细菌生长曲线测定
取A:L1 ST128型鸭源多杀性巴氏杆菌分离株2.5 mL加入装有60 mL含5% FBS的TSB液体培养基的三角瓶中,混匀后分别吸取5 mL放入已编号的大试管中,分别标记0、2、4、6、8、10、12、14、16、18、20 h;37 ℃、180 r/min振荡培养,分别在相应时间取出,同时以涂板法进行细菌计数并绘制生长曲线[17]。
1.4 细菌半数致死量的测定
取多杀性巴氏杆菌分离株,于TSB液体培养基中增殖至菌液浓度为1.0×109CFU/mL后,分别按10倍倍比稀释,取10-5、10-6、10-7、10-8、10-9共5个稀释度,腿部肌内注射7日龄三穗麻鸭,0.5 mL/只,每组各5只,攻毒后观察并记录1周内发病死亡情况,应用改良寇氏法[18]计算细菌半数致死量(LD50)。
1.5 疫苗的制备
取多杀性巴氏杆菌分离株于含5% FBS的TSB液体培养基中,培养至终浓度为1×1010CFU/mL后,加入甲醛至终浓度为0.2%,37 ℃、180 r/min振荡24 h灭活备用。①白油佐剂灭活疫苗:取47 mL白油与3 mL司本-80混匀,作为油相;另取1.5 mL吐温-80加入25 mL抗原中搅拌均匀,作为水相;油相经乳化仪低速搅拌后加入水相,体积比为2∶1,再高速搅拌充分乳化后,制备成白油佐剂灭活疫苗(含菌量1010CFU/mL),分装保存于4 ℃备用。②卡波姆佐剂疫苗:用超纯水将称取的卡波姆粉末膨胀过夜,调节pH至7.0,灭菌PBS定容至6 mg/mL,高压灭菌后即为母液,将卡波姆母液与抗原按体积比2∶1混匀,制备成卡波姆终浓度为4 mg/mL的卡波姆佐剂灭活疫苗(含菌量1010CFU/mL)。
1.6 疫苗质量检验
1.6.1 疫苗无菌检验 将制备好的两种灭活疫苗分别接种于TSA平板,37 ℃培养48 h,进行无菌检验。
1.6.2 稳定性检验 取10 mL白油佐剂灭活疫苗于离心管中,3 000 r/min离心10 min,检查有无分层现象。由于卡波姆佐剂为水佐剂离心检验其稳定性无意义,所以未做稳定性检验。
1.6.3 疫苗保质期检验 将制备的白油佐剂灭活疫苗和卡波姆佐剂灭活疫苗4 ℃放置3个月,观察外观、性状有无变化及有无分层现象。
1.6.4 疫苗安全性检验 将18只20日龄健康三穗麻鸭随机3组,6只/组,分别为白油佐剂灭活疫苗组、卡波姆佐剂灭活疫苗组和空白对照组,2个疫苗组分别腿部肌内注射1 mL/只对应灭活疫苗,空白对照组腿部肌内注射1 mL/只无菌生理盐水。免疫后连续7 d观察各组鸭有无发病死亡情况和临床症状,第7天剖解免疫鸭观察是否有器官病变以及是否能分离出细菌。
1.7 动物免疫试验
1.7.1 攻毒保护试验 将32只健康试验鸭随机分为4组,8只/组,分别为自制白油佐剂灭活疫苗组、卡波姆佐剂灭活疫苗组、商品灭活疫苗组和空白对照组。7日龄时,3个疫苗组分别注射对应疫苗0.3 mL/只;空白对照组注射生理盐水0.3 mL/只。21日龄对3个疫苗组进行腿部肌内注射相应疫苗0.5 mL/只,加强免疫。分别于一免后10 d(17日龄)和二免后10 d(31日龄)按每只10 CFU剂量通过腿部肌内注射A:L1 ST128型多杀性巴氏杆菌活菌进行攻毒保护试验,攻毒后观察并记录1周内试验鸭发病死亡情况。
1.7.2 组织病理学变化 将16只健康三穗麻鸭随机分为4组,4只/组,分别为自制白油佐剂灭活疫苗组、卡波姆佐剂灭活疫苗组、商品灭活疫苗组和空白对照组,参照1.7.1中免疫程序免疫雏鸭。按每只10 CFU剂量分别于一免后10 d(17日龄)和二免后10 d(31日龄)通过腿部肌内注射A:L1 ST128型多杀性巴氏杆菌活菌进行攻毒,分别于一免及二免后第3天攻毒后并扑杀试验鸭,每组2只,取肺脏、脾脏及肝脏组织,将采集的组织保存于4%多聚甲醛溶液中固定48 h后进行常规处理,石蜡包埋切片,苏木素和伊红(HE)染色后观察病理组织学变化,观察记录病理性损伤情况。
2 结 果
2.1 多杀性巴氏杆菌的生长曲线和LD50测定结果
由图1可知,A:L1 ST128型多杀性巴氏杆菌在0~4 h细菌生长缓慢,从8 h开始细菌快速生长,12~14 h为对数生长期,至18 h到达峰值,此时的D600 nm值为0.91,活菌数为1.0×1010CFU/mL,18 h后多杀性巴氏杆菌的生长进入平台期。按照改良寇氏法计算其LD50为5 CFU。

图1 多杀性巴氏杆菌生长曲线
2.2 疫苗检验
2.2.1 疫苗无菌检验结果 将自制白油佐剂灭活疫苗和卡波姆佐剂灭活疫苗分别无菌接种于TSA平板,37 ℃培养48 h后,平板无细菌生长,表明疫苗灭活完全。
2.2.2 稳定性检验 取自制的白油佐剂灭活疫苗滴于水面上不扩散,离心后无分层现象,外观性状均无变化,表明乳化效果良好。
2.2.3 疫苗保质期检验 白油佐剂灭活疫苗和卡波姆佐剂灭活疫苗4 ℃条件下放置3个月,观察发现,2种疫苗外观、性状无变化、无分层现象。
2.2.4 疫苗安全性检验 将制备的2种灭活疫苗免疫鸭进行安全性检验,连续观察7 d,各免疫组鸭精神状况及食欲均正常,均无临床症状和发病死亡情况;免疫后第7天解剖观察,各组鸭内脏器官无明显病变;用脏器组织无菌接种TSA平板,37 ℃培养48 h后均无菌生长。表明自制的2种疫苗安全性良好。
2.3 动物免疫试验结果
2.3.1 攻毒保护试验结果 一免后卡波姆佐剂灭活疫苗组、白油佐剂灭活疫苗组、商品灭活疫苗组和空白对照组保护率分别为62.5%(5/8)、50.0%(4/8)、50.0%(4/8)、0(0/8);二次加强免疫后,卡波姆佐剂灭活疫苗组、白油佐剂灭活疫苗组、商品灭活疫苗组和空白对照组保护率分别为87.5%(7/8)、75.0%(6/8)、62.5%(5/8)、0(0/8)(表1),疫苗通过二次加强免疫后能明显提高保护率,且卡波姆佐剂灭活疫苗组保护率明显高于自制白油佐剂灭活疫苗组和商品灭活疫苗组。

表1 鸭免疫攻毒保护试验结果
2.3.2 不同组织病理学变化 由图2可知,一免后10 d(17日龄)攻毒后各组试验鸭肝脏多处均出现明显肝细胞灶性坏死,细胞核固缩碎裂;其中白油佐剂灭活疫苗组和商品灭活疫苗组出现明显的炎性细胞点状浸润,大量的肝窦淤血扩张,卡波姆佐剂灭活疫苗组胞质中可见微小的圆形空泡。各组试验鸭肺脏均出现明显的毛细血管淤血现象,其中白油佐剂灭活疫苗组肺组织毛细血管的管腔内可见明显红细胞;商品灭活疫苗组多见小灶性坏死;卡波姆组未见其他明显异常。各组试验鸭脾脏均可见明显坏死细胞胞核碎裂溶解现象,其中白油佐剂灭活疫苗组脾脏组织可见大面积的坏死,内实质细胞明显减少;商品灭活疫苗组白髓中淋巴细胞灶性坏死;卡波姆佐剂灭活疫苗组可见红髓中实质细胞数量减少,排列疏松。对照组各脏器均出现细胞坏死、细胞核溶解等现明显病理变化。
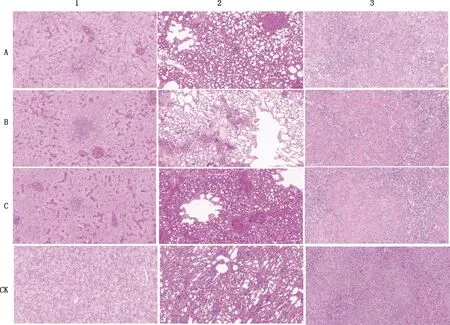
①A,白油佐剂灭活疫苗组;B,商品灭活疫苗组;C,卡波姆佐剂灭活疫苗组;CK,空白对照组。②1,肝脏,2,肺脏,3,脾脏。下同
由图3可知,二免后10 d(31日龄)各组攻毒后试验鸭肝脏均可见弥漫性的肝细胞气球样变,核居中,胞质空泡化,其中白油佐剂灭活疫苗组出现大量肝窦淤血扩张;商品灭活疫苗组汇管区周围多见炎性细胞小灶性浸润;卡波姆佐剂灭活疫苗组未见明显的炎性细胞浸润。各组试验鸭肺脏少量的副支气管周围可见炎性细胞小灶性浸润,白油佐剂灭活疫苗组可见副支气管出血,商品灭活疫苗组肺脏组织边缘可见炎性细胞灶性浸润,卡波姆组未见其他明显异常。各组试验鸭脾脏均可见组织白髓中轻度出血,其中白油佐剂灭活疫苗组红髓出现重度淤血;商品灭活疫苗组出现坏死细胞胞核固缩碎裂;卡波姆佐剂灭活疫苗组红髓出现轻度淤血。对照组各脏器均出现细胞坏死、细胞核溶解等现明显病理病变。
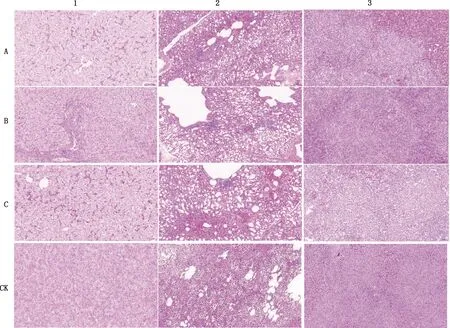
图3 二免后试验鸭肝脏、肺脏、脾脏病理组织学变化(200×)
3 讨 论
全球范围内流行的禽源多杀性巴氏杆菌血清型主要为A:L1型[19],中国部分地区禽源多杀性巴氏杆菌流行情况与此相同,LPS流行基因型有L1、L2、L3和L6,禽源主要为A:L1型[20-22],贵州地区报道的多杀性巴氏杆菌流行血清型也多为荚膜A型[23-25]。多杀性巴氏杆菌的感染具有宿主偏好的特性,A:L1型感染主要发生于禽类,A:L3型感染主要发生于兔,D:L6型感染主要发生于猪[26]。
荚膜和脂多糖与致病性和抗原性密切相关,是研发疫苗的重要免疫学基础。本研究前期在三穗县某鸭场病死鸭中分离鉴定得到血清型为A:L1型的多杀性巴氏杆菌分离株,分离株对氨苄西林、阿莫西林、左氧氟沙星和林可霉素产生耐药性,其耐药性的产生对贵州养鸭业的健康发展造成潜在威胁[27]。加之多杀性巴氏杆菌血清型众多,各血清型之间交叉保护力较弱,生产上难以选择合适的疫苗,因此通过以地区流行血清型菌株制备疫苗进行免疫预防,是有效防控该病的关键。
佐剂能够显著提高动物机体对多杀性巴氏杆菌抗原特异性应答水平,但是不同的佐剂对免疫效力的增强具有明显差异[28],有研究表明菊粉作为佐剂可增强禽多杀性巴氏杆菌DNA疫苗的免疫效果,提高Th1型免疫应答水平[29],为佐剂的应用提供了参考依据。不同佐剂的理化性质不同,导致疫苗免疫后机体抗体水平和免疫副反应也存在较大差异,通过佐剂的筛选可提高灭活疫苗的保护效果,减少免疫副反应造成的损失。传统灭活苗一般是以白油为主的油佐剂疫苗,保护期短、易造成免疫副反应的发生。卡波姆为多聚物类佐剂,具有良好的安全性和稳定性,作为疫苗佐剂可以通过储库作用增强疫苗免疫能力,目前已有多种商品化疫苗采用卡波姆作为水性佐剂或佐剂成分之一使用;卡波姆作为水佐剂可有效减少副反应的发生,所制备疫苗能取得理想的免疫效果[30]。本试验选取贵州地区主要流行的A:L1型多杀性巴氏杆菌分离株,通过以卡波姆、白油为佐剂分别制备A:L1型多杀性巴氏杆菌灭活疫苗。试验结果表明,一免后卡波姆佐剂灭活疫苗组保护率最高,为62.5%。二次加强免疫后,各疫苗组保护率显著提高,其中卡波姆佐剂灭活疫苗效果最佳,二次加强免疫后可使试验鸭获得87.5%的保护率,而白油佐剂灭活疫苗组保护率为75.0%,商品灭活疫苗组保护率仅为62.5%。病理组织学结果显示,卡波姆佐剂灭活疫苗能对主要组织器官提供更好的保护效果,表明自制多杀性巴氏杆菌灭活疫苗较市售商品疫苗更适于贵州省养鸭过程中对多杀性巴氏杆菌的免疫防控,卡波姆作为新型佐剂制备的灭活疫苗免疫效果最佳,可作为免疫防控该病的首选疫苗。
4 结 论
本研究针对贵州地区面临的多杀性巴氏杆菌防控风险,采用当地流行的A:L1型多杀性巴氏杆菌菌株制备卡波姆佐剂疫苗,免疫保护力最好,加强免疫后保护率可达87.5%,免疫副作用小,能有效防控该病在鸭群中的流行,具有广阔的应用前景。

