新西兰白兔CYP11A1基因的克隆、生物信息学分析及其对繁殖相关基因的影响
白少成,周 娟,靳荣帅,王 璠,卢婷婷,汤先伟,赵博昊,吴信生,陈 阳
(1.扬州大学动物科学与技术学院,扬州 225000;2.江苏省邳州市东方养殖有限公司,邳州 221300)
细胞色素P450家族成员11A1(CYP11A1)是一种胆固醇侧链裂解酶(P450scc),负责编码细胞色素P450超家族的线粒体酶,可以催化胆固醇为孕烯醇酮,是类固醇激素合成的关键限速酶[1]。研究发现,CYP11A1基因在人类孕期发生突变会影响胎儿的性别以及引发多囊卵巢综合征、子宫癌等多种繁殖疾病[2]。CYP11A1基因在家禽卵泡发育过程中受激素的调控出现明显的变化,Xu等[3]通过检测鹅卵巢组织中CYP11A1基因的相对表达水平,发现该基因在高产扬州鹅的卵巢组织中极显著高于低产的浙东鹅。张艳萍[4]研究表明,在低产蛋量鸡品种中CYP11A1基因mRNA相对表达水平显著高于高产蛋鸡,这可能是因为卵巢组织类固醇激素的增加,孕酮在卵巢中的积累抑制了CYP11A1基因的表达。综上所述,推断CYP11A1基因在动物的繁殖性能中发挥着重要作用。
颗粒细胞是卵泡中与卵母细胞相互作用的一类体细胞,其增殖与分化影响着卵泡的生长启动、发育、黄体形成以及维持激素分泌的能力,是一种用来检测卵巢功能的细胞[5]。有研究发现,CYP11A1基因在禽类卵巢颗粒细胞中的表达受激素调节而影响卵泡的发育[6]。羟基类固醇17-β脱氢酶1(HSD17B1)编码的蛋白可以催化雌酮生成雌二醇,雌二醇作为雌激素中活性最高的激素,其含量的高低影响卵泡颗粒细胞的质量。研究表明,HSD17B1基因在猪卵巢颗粒细胞中的表达受转录因子p53的调控[7]。骨形态发生蛋白15(BMP15)是一种卵母细胞分泌因子,Su等[8]发现,类固醇合成相关基因在BMP15基因敲除小鼠的卵丘颗粒细胞中异常降低,同时胆固醇合成减少,说明该基因可以调控卵泡类固醇激素的合成。促卵泡刺激素受体(FSHR)作为卵巢中调控促卵泡素(FSH)生成的关键因子,其在促进卵泡成熟、调控性激素分泌、维持性腺正常发育的过程中发挥着重要作用[9]。FSHR在雌性动物中的结合位点分布于颗粒细胞,且具有高度特异性,因此常被用于鉴定卵巢颗粒细胞[10]。因此,分析CYP11A1基因在卵巢颗粒细胞中对HSD17B1、BMP15、FSHR基因的调控作用,有助于揭示其在动物繁殖生理中的生物学功能。
CYP11A1基因作为卵泡类固醇合成过程中的重要因子,其在兔卵巢颗粒细胞中的调控机制鲜见报道。本研究通过克隆新西兰白兔CYP11A1基因并进行生物信息学分析,构建pcDNA3.1-CYP11A1过表达重组载体和siRNA-CYP11A1,分离并鉴定兔卵巢颗粒细胞,通过细胞转染技术在兔卵巢颗粒细胞中过表达和干扰CYP11A1基因的表达,分析其与繁殖性能相关基因HSD17B1、BMP15和FSHR的关系,以验证该基因是否参与调控卵巢功能。
1 材料与方法
1.1 材料
1.1.1 动物 3只体重(3.00±0.24)kg、健康的4~6月龄性成熟新西兰白兔母兔,由江苏省南京市金陵种兔场提供。
1.1.2 主要试剂 动物组织总RNA提取试剂盒(DP431)、无内毒素质粒小提中量(DP118)试剂盒均购自天根生化科技(北京)有限公司;HiScript Ⅲ 1st Strand cDNA Synthesis(+gDNA wiper)、ChamQ SYBR qPCR Master Mix、2×Phanta Max Master Mix以及ClonExpress Ⅱ One Step Cloning Kit均购自诺唯赞生物科技有限公司;pcDNA3.1(+)载体为扬州大学动物遗传资源实验室保存;TaKaRa MiniBEST Agarose Gel DNA Extraction Kit、限制性内切酶NheⅠ和XhoⅠ、大肠杆菌DH5α感受态细胞均购自宝日医生物技术有限公司;Lipofectamine 2000转染试剂购自Invitrogen公司;Opti-MEM培养基、胎牛血清购自Gibco公司;DMEM/F12培养基购自HyClone公司;双抗(青霉素-链霉素混合液,100×)、4%多聚甲醛固定液、Triton X-100均购自北京索莱宝科技有限公司;Anti-FSHR一抗和羊抗兔IgG H&L(FITC)二抗分别购自Affinity和Abcam公司。
1.2 方法
1.2.1CYP11A1基因克隆和pcDNA3.1-CYP11A1过表达重组载体构建 根据GenBank中兔CYP11A1基因的序列,利用CE Design软件设计含有NheⅠ和XhoⅠ酶切位点的一步克隆引物CDS-CYP11A1(表1),引物由北京擎科生物科技有限公司合成。以兔卵巢组织cDNA为模板,对CYP11A1基因CDS序列全长进行PCR扩增。PCR反应体系50 μL:cDNA 2 μL,上、下游引物(10 μmol/L)各2 μL,2×Phanta Max Master Mix 25 μL,ddH2O补至50 μL。PCR反应程序:94 ℃预变性5 min;94 ℃变性30 s,57 ℃退火30 s,72 ℃延伸3 min,共35个循环;72 ℃延伸7 min。PCR产物经1.0%琼脂糖凝胶电泳检测,切取目的条带用DNA凝胶回收试剂盒回收纯化。胶回收纯化后,在同源重组酶Exane®Ⅱ的作用下37 ℃反应30 min进行连接,将连接产物转化大肠杆菌DH5α感受态细胞,并涂匀在含氨苄西林的LB固体培养基中,37 ℃培养14 h。次日,随机挑选单克隆菌落,置于含氨苄西林的LB液体培养基中,200 r/min振荡12 h,利用无内毒素质粒小提中量试剂盒提取质粒,由北京擎科新业有限公司进行测序。
1.2.2 系统进化树构建 通过Mega 5.1软件比对家兔(登录号:XP_008251956.1)CYP11A1蛋白与鸡(登录号:NP_001001756.2)、猪(登录号:NP_999592.1)、家鼠(登录号:NP_001333716.1)、人(登录号:ALQ33469.1)、牛(登录号:AAI33390.1)、绵羊(登录号:NP_001087258.1)、马(登录号:NP_001075990.1)、猩猩(登录号:PNI37685.1)和犬(登录号:XP_038298856.1)的相似性,构建系统进化树。
1.2.3 CYP11A1生物信息学预测 用ProtParam在线软件(https:∥web.expasy.org/cgi-bin/protparam/)[11]分析CYP11A1蛋白的氨基酸组成;用ProtScale在线软件(https:∥web.expasy.org/cgi-bin/protscale/)[12]分析亲/疏水性;用PSORT Ⅱ在线软件(https:∥psort.hgc.jp/)[13]预测CYP11A1蛋白的亚细胞定位;用NetPhos在线软件(http:∥www.cbs.dtu.dk/services/NetPhos/)[14]预测磷酸化位点;用CDD database在线软件(https:∥www.ncbi.nlm.nih.gov/Structure/cdd/wrpsb.cgi)[11]预测保守结构域;用在线软件SOPMA(https:∥npsa-prabi.ibcp.fr/)[15]预测蛋白的二级结构;用SWISS-MODEL在线软件(https:∥swissmodel.expasy.org/)[16]预测蛋白的三级结构;用STRING数据库(https:∥string-db.org/cgi/input.pl)[17]进行CYP11A1蛋白互作分析。
1.2.4 兔卵巢颗粒细胞的分离与鉴定 3只母兔每只大腿肌肉外侧注射孕马血清促性腺激素80 IU,6 h后以耳缘静脉注射空气法处死,立即采集卵巢组织并置于含双抗的PBS中清洗。将卵巢置于含双抗的DMEM/F12培养基中,用1 mL注射器针头刺破卵泡,37 ℃沉降15 min,收集细胞液,用200目不锈钢细胞筛过滤,滤液1 000 r/min离心5 min,弃上清,用DMEM/F12(含15%胎牛血清、1%双抗)培养基吹打混匀细胞后接种到6孔板中,37 ℃、5% CO2培养箱中孵育24 h,PBS清洗3遍,4%多聚甲醛室温固定30 min;用PBS清洗3次,0.3% Trition X-100处理60 min;PBS洗3次,1% BSA室温封闭60 min;PBS清洗3次,加入Anti-FSHR一抗(1∶250)4 ℃过夜孵育,用PBST清洗后加入山羊抗兔IgG(FITC,1∶2 000),37 ℃孵育60 min;用PBST清洗,加入DAPI染色10 min,置于荧光显微镜下观察并拍照。
1.2.5 过表达和干扰兔颗粒细胞中CYP11A1基因的表达 根据兔CYP11A1基因的CDS序列,由苏州吉玛基因股份有限公司设计并合成3对siRNA(siRNA-1、siRNA-2、siRNA-3)及其阴性对照(NC)(表2)。待颗粒细胞汇合度达到70%时接种到24孔板中,按照Lipofectamine 2000说明书进行过表达和下调CYP11A1基因在颗粒细胞中的表达。用Opti-MEM稀释pcDNA3.1-CYP11A1质粒、pcDNA3.1(+)、3对siRNA、NC,分别与转染试剂混合孵育15 min后,加到DMEM/F12培养的颗粒细胞中,培养48 h后收集细胞备用。

表1 引物信息
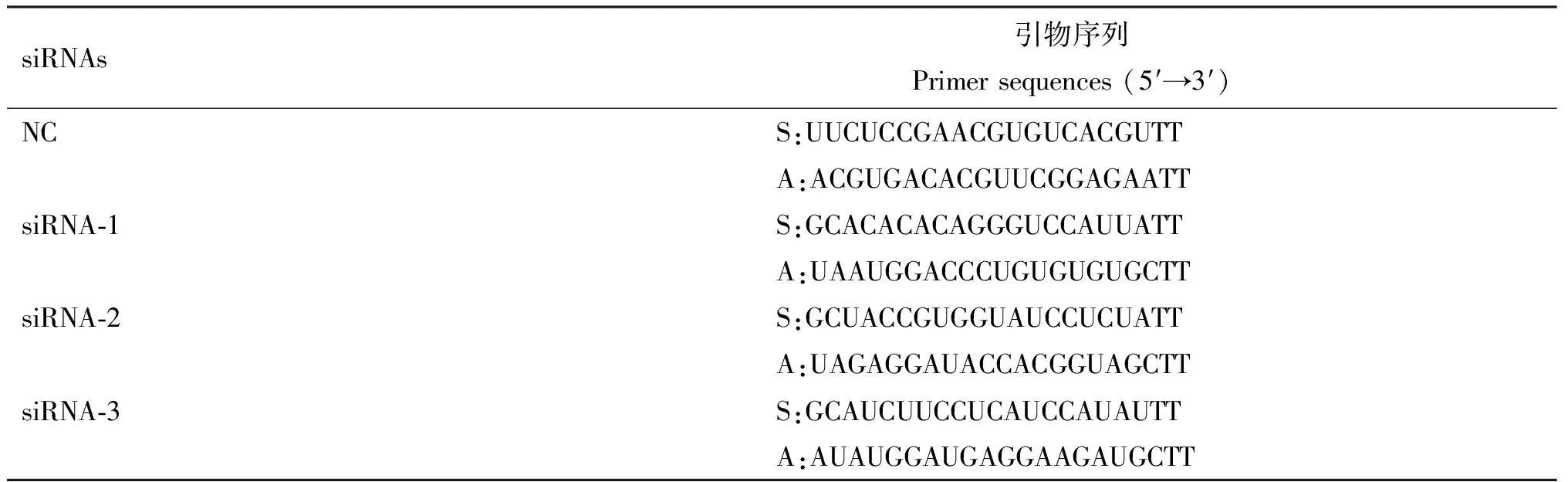
表2 siRNA信息
1.2.6 实时荧光定量PCR检测基因的表达 Trizol法提取兔卵巢组织以及各转染组颗粒细胞的总RNA并反转录合成cDNA。根据GenBank中家兔CYP11A1基因及繁殖相关基因HSD17B1、FSHR、BMP15的mRNA序列,利用Primer-BLAST设计引物,引物信息见表1。引物均由北京擎科新业生物技术有限公司合成。以GAPDH作为内参基因,进行实时荧光定量PCR。PCR反应体系20 μL:cDNA 1 μL,上、下游引物(0.5 μmol/L)各0.4 μL,50 × ROX Reference Dye 0.4 μL,2 × ChamQ SYBR qPCR Master Mix 10 μL,ddH2O补至20 μL。PCR反应程序:95 ℃预变性30 s;95 ℃变性10 s,60 ℃延伸30 s,共40个循环。熔解曲线:95 ℃ 15 s,60 ℃ 60 s,95 ℃ 15 s。
1.3 数据统计分析
在Excel中完成各类数据的统计,以2-△△Ct法计算基因相对表达量,用SPSS 25.0进行独立样本t检验,结果用平均值±标准差表示。P<0.05表示差异显著,P<0.01表示差异极显著。
2 结 果
2.1 CYP11A1基因克隆及表达载体的构建
1.0%琼脂糖凝胶电泳检测结果表明,CYP11A1基因克隆片段大小为1 557 bp(图1A),与预期大小相符;将其克隆至pcDNA3.1(+)载体,挑取阳性克隆,提取质粒后测序,所获序列长1 557 bp。将兔CYP11A1与pCDNA3.1(+)载体连接,获得pcDNA3.1-CYP11A1质粒(图1B)。通过BLAST比对测序结果与NCBI提供的CYP11A1基因序列,发现序列相似性达到100%。
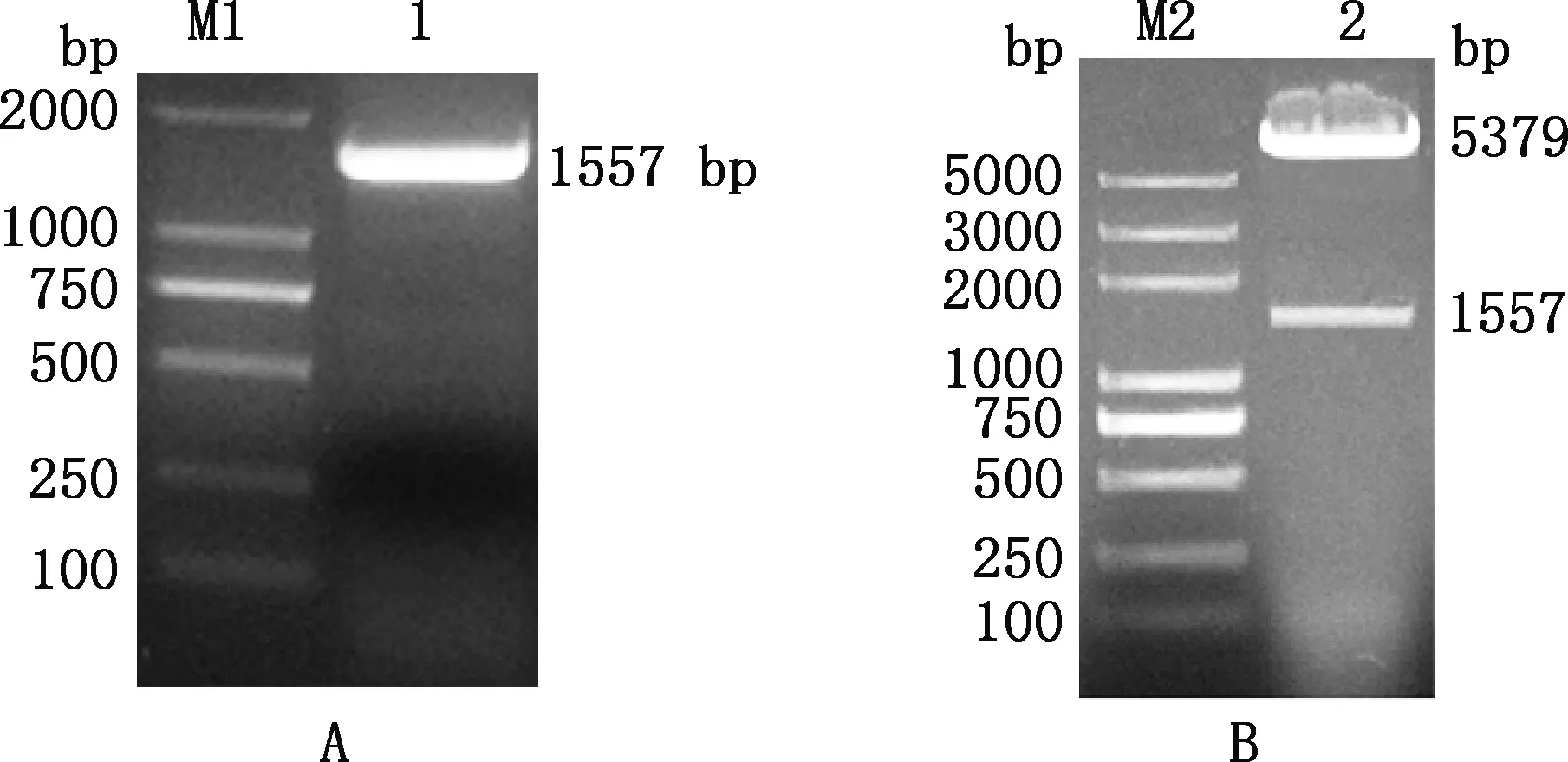
M1,DL2000 DNA Marker;1,CYP11A1基因PCR扩增结果;M2,DL5000 DNA Marker;2,pcDNA3.1-CYP11A1双酶切鉴定
2.2 系统进化树构建
CYP11A1蛋白系统进化树结果显示,鸡形成独立分支,家兔与猪、鼠、人、牛、绵羊、马、猩猩和犬构成另外一个分支,并与家鼠、人和猩猩的分子进化距离最近,表明亲缘关系最近(图2)。
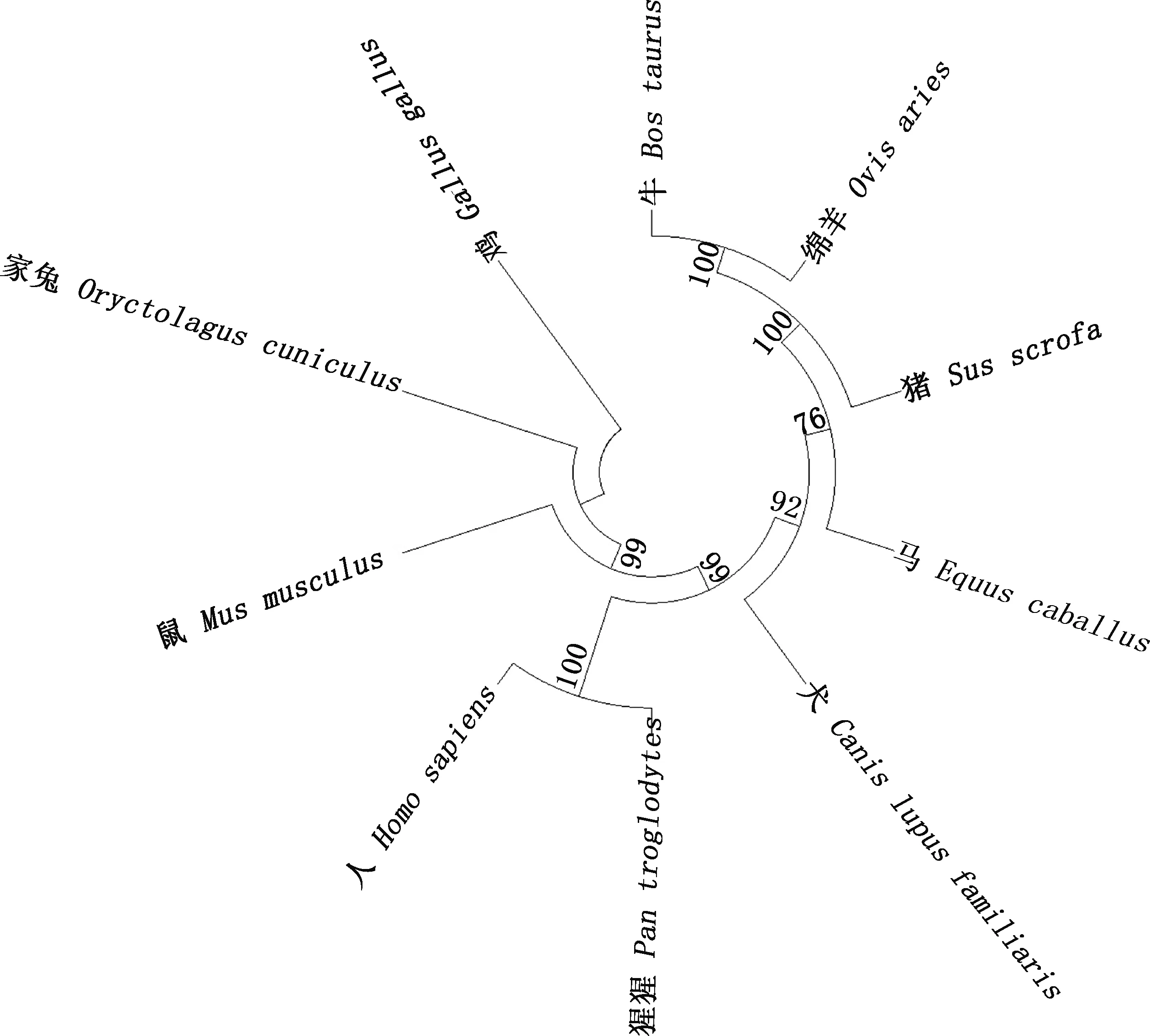
图2 CYP11A1蛋白系统进化树
2.3 CYP11A1基因生物信息学分析
2.3.1 基本理化性质 利用ExPASy在线软件对兔CYP11A1氨基酸序列进行分析发现,CYP11A1蛋白分子质量为51 016.38 u,分子式为C2297H3546N636O648S18。应用ProtParam在线软件分析显示,CYP11A1基因编码518个氨基酸,其中含量最高的为亮氨酸(Leu,10.6%),其次为精氨酸(Arg,7.6%)、缬氨酸(Val,7.4%)、丙氨酸(Ala,7.2%)(表3)。Protparam在线软件预测显示,CYP11A1蛋白理论等电点为7.40,正负电荷残基总数均为50个,脂肪族氨基酸指数为82.16,不稳定性指数为39.54,总平均亲水性―0.339。氨基酸序列中亲水性残基的数量多于疏水性残基(图3),说明CYP11A1蛋白为亲水性蛋白。
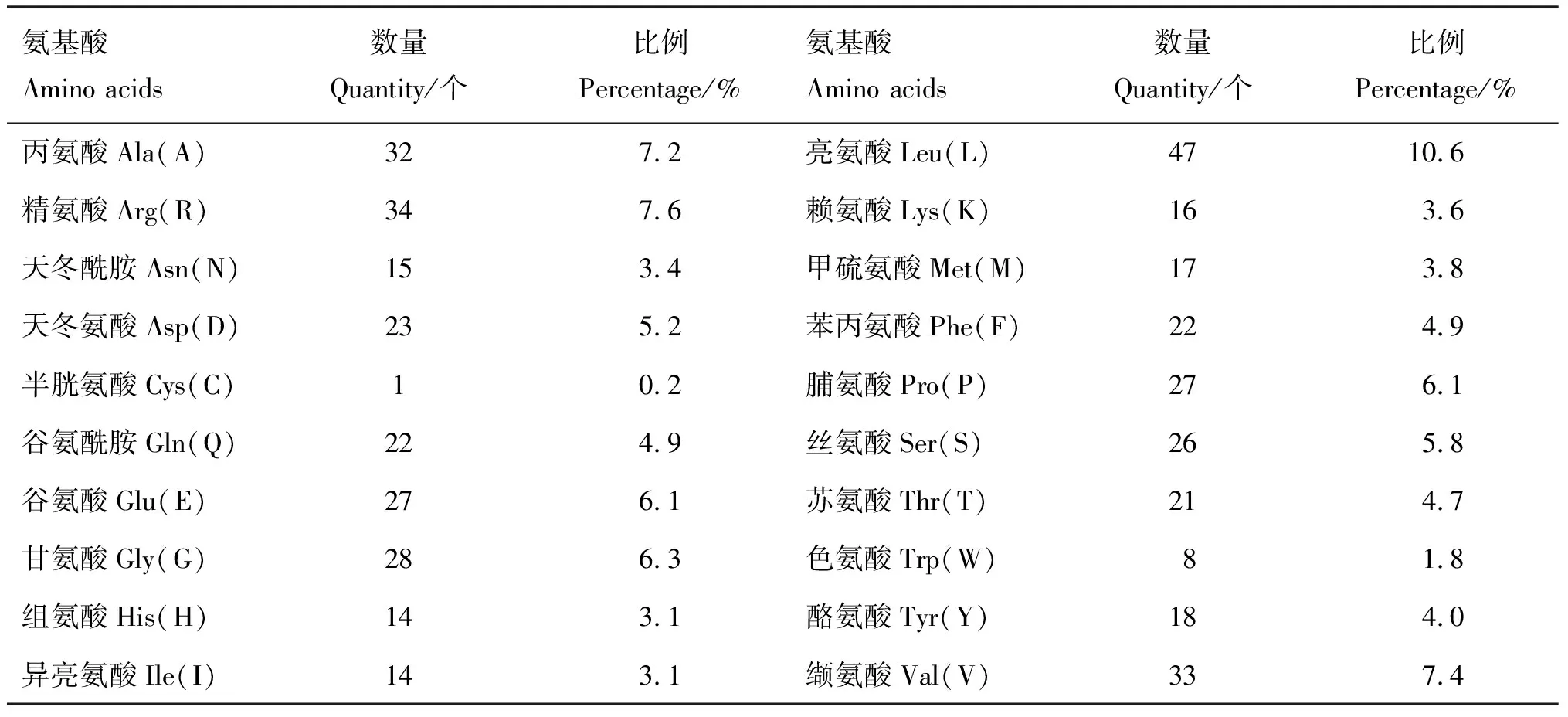
表3 兔CYP11A1蛋白氨基酸组成
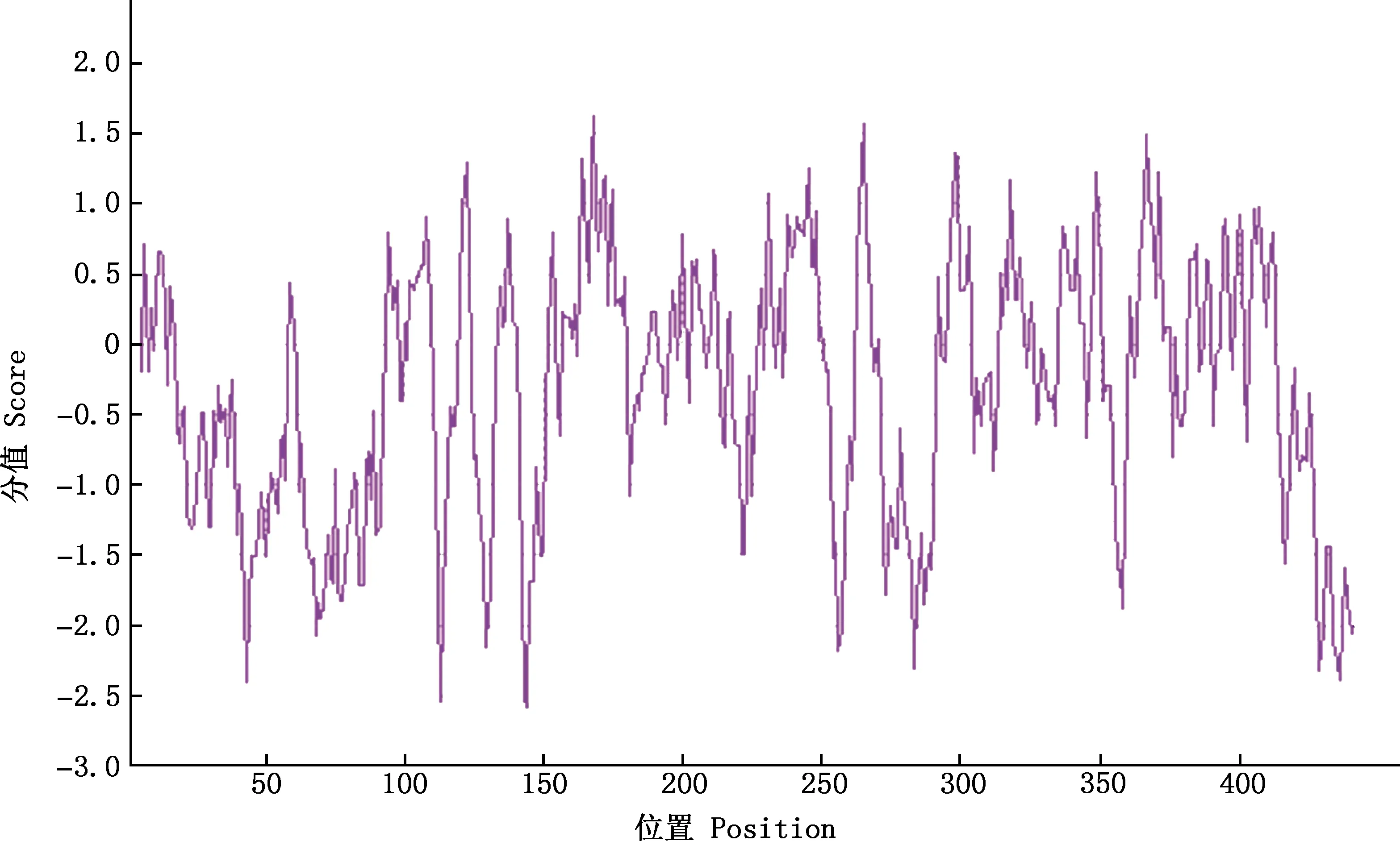
图3 兔CYP11A1蛋白亲水性分析
2.3.2 磷酸化位点和功能结构域预测 NetPhos在线软件预测显示,CYP11A1蛋白有40个潜在磷酸化位点,包括22个丝氨酸(Serine)、13个苏氨酸(Threonine)和5个酪氨酸(Tyrosine)(图4)。亚细胞定位预测结果显示,CYP11A1蛋白主要分布于线粒体(52.2%),其次为细胞核(13.0%)和细胞质(17.4%)(表4)。利用CDD工具预测发现,CYP11A1蛋白含有1个P450家族的结构域(图5)。
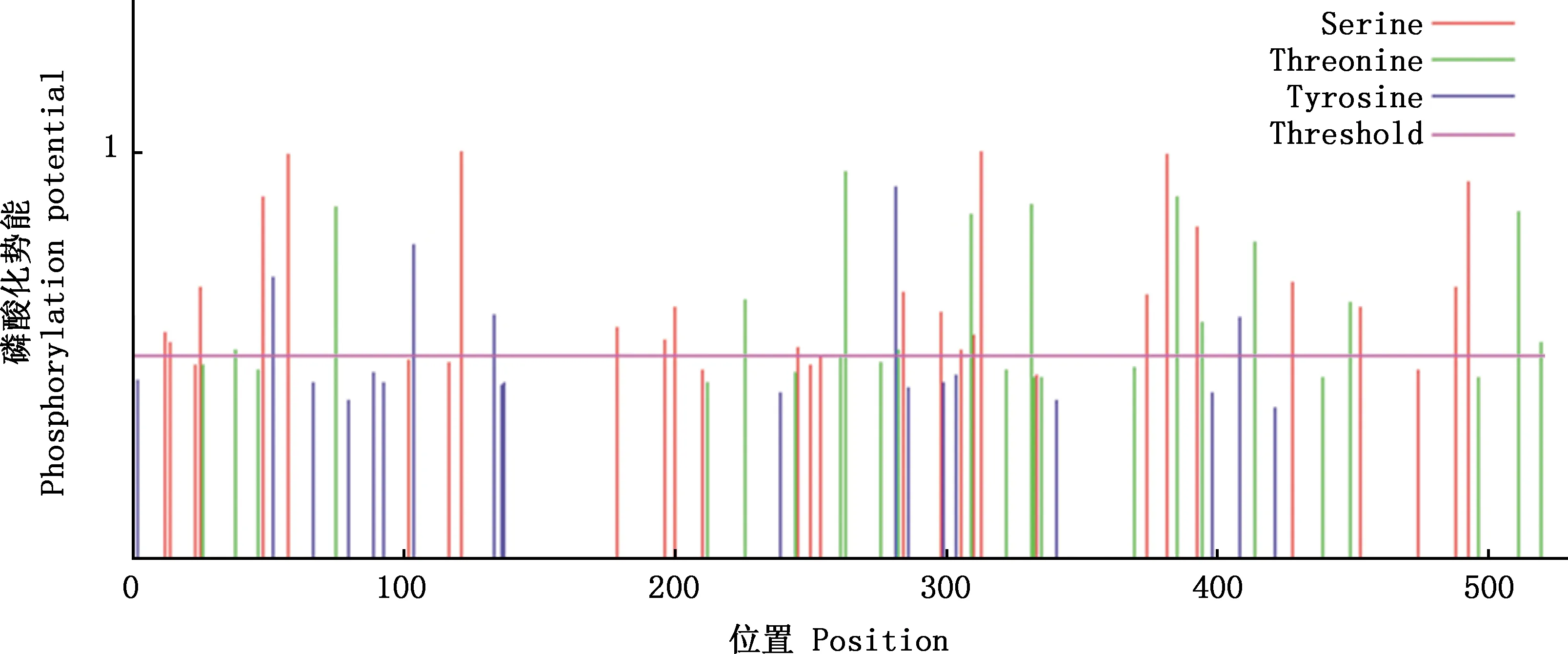
图4 兔CYP11A1蛋白磷酸化位点预测
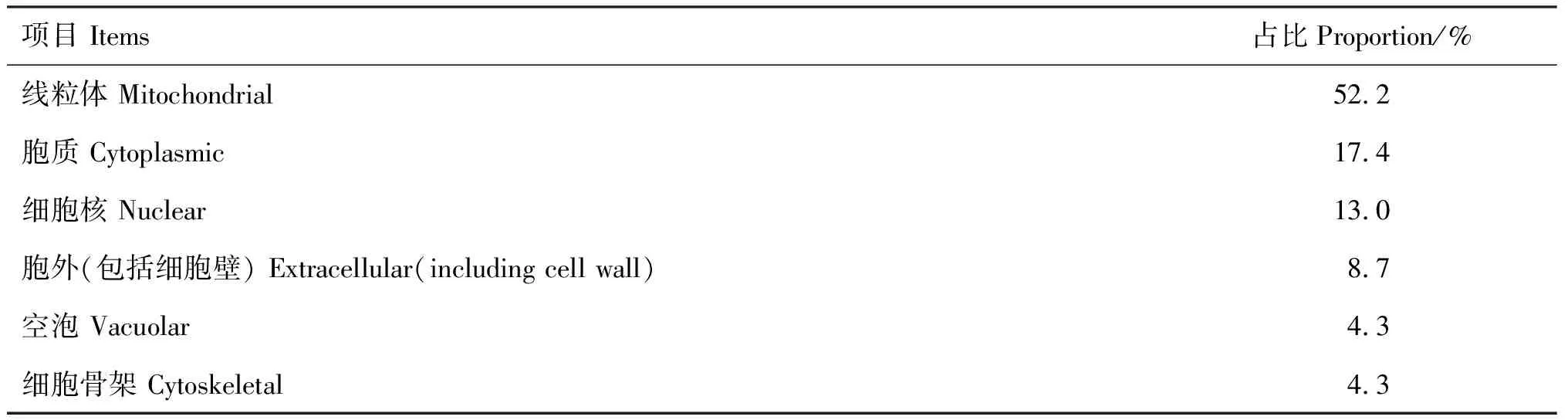
表4 兔CYP11A1蛋白亚细胞定位预测

图5 兔CYP11A1蛋白功能结构域预测
2.3.3 二级结构和三级结构预测 利用ExPASy软件预测CYP11A1蛋白二级结构显示,该蛋白包含α-螺旋(48.31%)、无规则卷曲(40.22%)、延伸链(7.42%)及β-转角(4.04%)(图6)。三级结构为弯曲螺旋状(图7),具体组成与二级结构一致。
线条由长到短分别为α-螺旋、延伸链、β-折叠和无规则卷曲
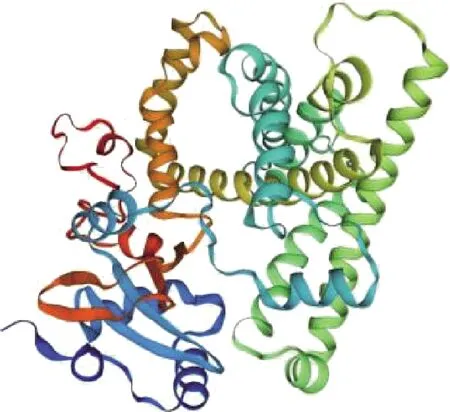
图7 兔CYP11A1蛋白三级结构预测
2.2.4 蛋白互作分析 根据STRING数据库分析得出,与CYP11A1蛋白互作的蛋白主要包括类固醇激素合成急性调节蛋白(STAR)、类固醇21-单加氧酶(CYP21A2)、类固醇17α单加氧酶(CYP17A1)和铁氧化还原蛋白1(FDX1)等(图8)。

图8 兔CYP11A1蛋白互作分析
2.3 兔卵巢颗粒细胞的分离与鉴定
分离的颗粒细胞培养24 h贴壁并呈梭形(图9A),传至第3代出现分化,细胞由梭形拉伸至多边形,且单个细胞面积变大(图9B)。免疫荧光鉴定发现,兔颗粒细胞胞质呈现绿色荧光(图10),表明兔颗粒细胞表达FSHR,可用于后续试验。

图9 兔原代颗粒细胞(A)和第3代颗粒细胞(B)形态(40×)

A,明场图;B,荧光图;C,DAPI染色;D,合并图
2.4 过表达和干扰CYP11A1基因对繁殖相关基因表达的影响
与pcDNA3.1组相比,pcDNA3.1-CYP11A1组CYP11A1、HSD17B1和FSHR基因的相对表达量均极显著增加(P<0.01),BMP15基因的相对表达量显著增加(P<0.05)(图11);干扰CYP11A1基因的表达后,其在颗粒细胞中的相对表达水平显著或极显著降低(P<0.05;P<0.01)(图12),选取效果最为显著的siRNA-1进行后续处理。siRNA-1干扰CYP11A1基因的表达后,HSD17B1基因的相对表达量显著下降(P<0.05),BMP15和FSHR基因的相对表达量均极显著下降(P<0.01)(图13)。
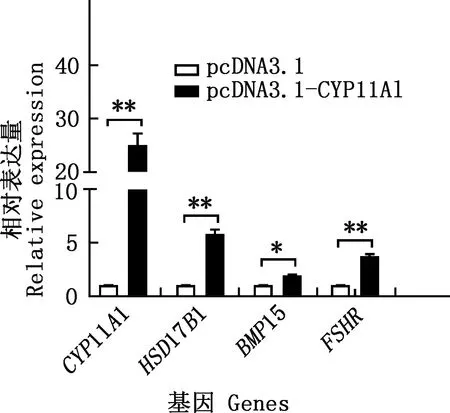
*,差异显著(P<0.05);**,差异极显著(P<0.01)。图13同
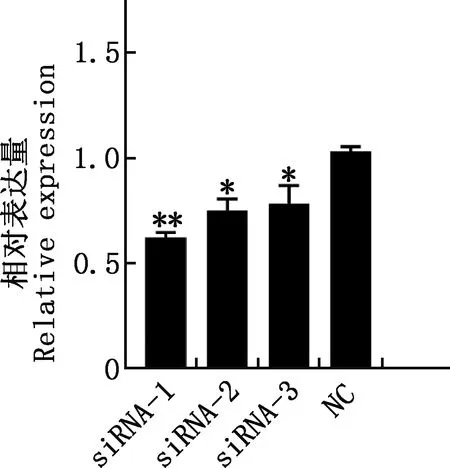
与NC组相比,*,差异显著(P<0.05);**,差异极显著(P<0.01);无*,差异不显著(P>0.05)
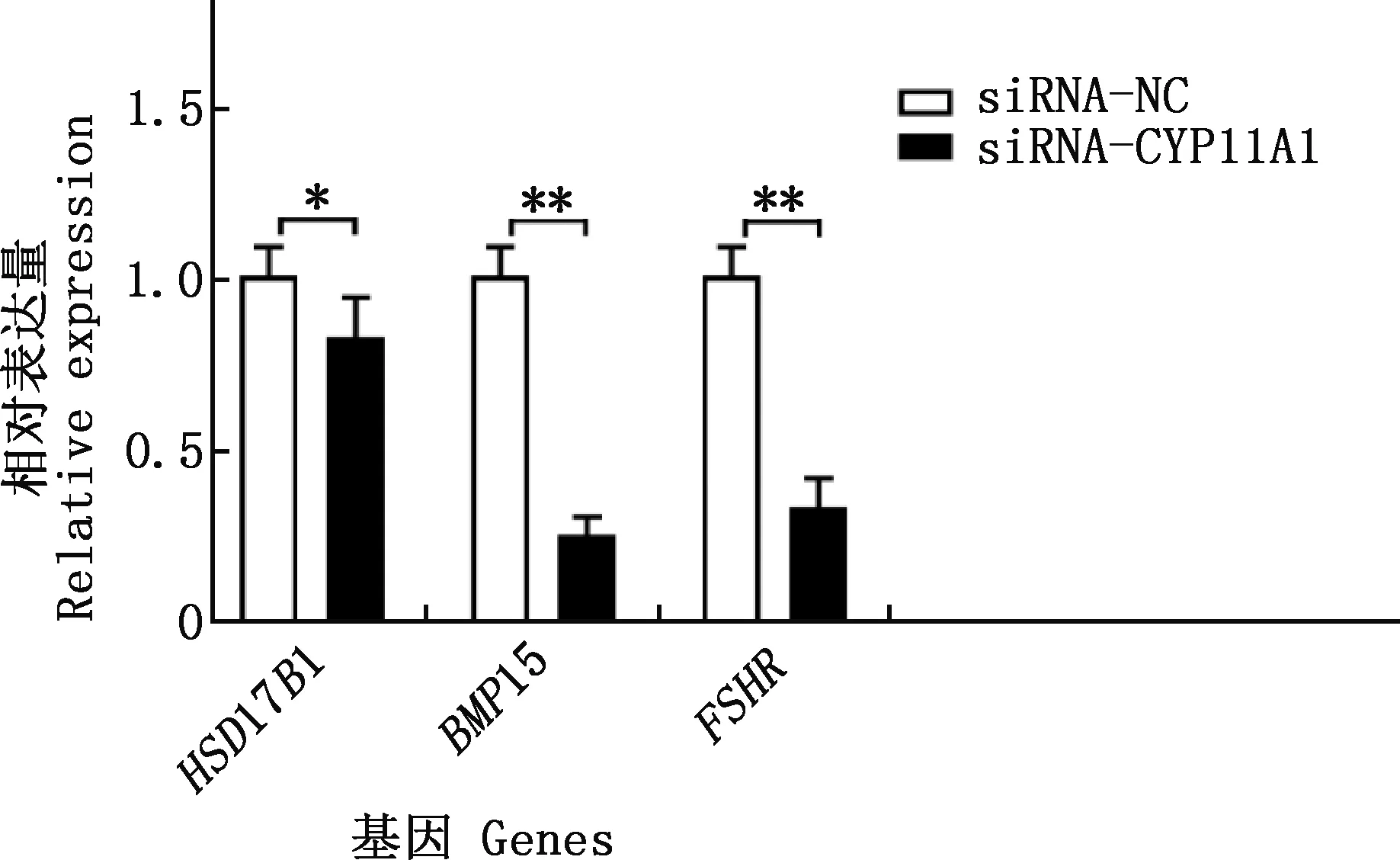
图13 干扰CYP11A1基因对繁殖相关基因的影响
3 讨 论
CYP11A1基因编码的胆固醇侧链裂解酶是一种线粒体酶,这种酶可以水解胆固醇侧链生成孕烯醇酮,而孕烯醇酮会转化成类固醇激素,从而影响性腺激素的合成[18]。本研究发现,CYP11A1是1个相对稳定的亲水性蛋白,且磷酸化位点较为丰富,说明其可能与细胞信号转导或细胞周期有关[19]。CDD软件预测发现,CYP11A1包含1个亚铁血红素蛋白超家族结构域P450,有研究报道该家族在生物合成和抗氧化方面具有重要作用[20]。蛋白互作分析显示,CYP11A1与STAR、FDX1、CYP21A2以及CYP17A1蛋白联系密切,而此类蛋白大多都与类固醇激素合成有关[21-22]。因此,CYP11A1作为类固醇合成激素中的第一个关键限速酶,其表达量的高低可能会影响其他蛋白的表达。系统进化树分析在一定程度上可以反映物种间的亲缘关系,本研究结果发现,兔CYP11A1蛋白与猪、鼠、人、牛、绵羊、马、猩猩和狗构成同一分支,说明该蛋白在这些物种进化过程中相对保守。以上结果说明,CYP11A1是稳定、亲水、相对保守且具有抗氧化和类固醇激素合成功能的蛋白。
颗粒细胞是卵巢的重要功能细胞,它可以在FSH的作用下分泌雌激素,并通过卵巢缝隙向卵母细胞输送营养物质[23]。本研究成功分离并鉴定了兔的卵巢颗粒细胞。颗粒细胞作为卵泡内主要的类固醇激素分泌细胞,在卵泡发育过程中起着重要作用。已知HSD17B1基因负责调控人和啮齿类动物体内性激素的合成,其可以通过脱氢酶将3α转化为雄激素,而雄激素可以影响哺乳动物卵泡的发育和闭锁,在卵泡发育过程中起重要作用[24]。BMP家族可以诱导骨组织形成、控制动物生长发育,在生殖系统中具有十分重要的作用[25]。BMP15基因作为卵泡分泌生长因子,在卵泡早期发育过程扮演重要角色[26]。研究表明,在小鼠中敲除BMP15基因后,导致其繁殖力低下,排卵率和受精率显著降低[27]。FSHR基因是FSH的受体,由于FSH无法直接穿透细胞膜,所以需要借助FSHR传递到靶细胞内[28],表明FSHR基因的表达水平可以直接调控FSH的活性,进而影响激素生成、刺激卵泡发育和成熟等。综上所述,HSD17B1、BMP15和FSHR基因的表达影响着卵巢发育的过程。本研究结果表明,CYP11A1基因可以正向调控HSD17B1、BMP15和FSHR基因的表达,说明CYP11A1基因可以影响繁殖性能相关基因的表达水平。因此,CYP11A1基因可能为调控母兔卵巢繁殖性能的新靶点。
4 结 论
本研究克隆了新西兰白兔CYP11A1基因,其CDS全长为1 557 bp,编码518个氨基酸。生物信息学分析表明,CYP11A1是稳定、亲水、相对保守且具有抗氧化和类固醇激素合成功能的蛋白。在兔卵巢颗粒细胞过表达CYP11A1基因后,HSD17B1、BMP15和FSHR基因的表达水平显著上调,而干扰CYP11A1基因可显著下调这些基因的表达。说明CYP11A1基因可以影响繁殖相关基因的表达,提示其在母兔的繁殖过程中可能发挥作用。

