复合酶法油莎豆多孔淀粉的制备及其性质研究
包尕红,司美双,吴修利
(长春大学食品科学与工程学院,吉林 长春 130022)
油莎豆(Cyperus esculentus L.)属莎草科一年生植物,原产地是非洲及地中海沿岸国家,具有极强的适应性,在我国南北各地的沙滩、丘陵、岗地等均有大量种植[1]。油莎豆可食块茎中脂肪含量21%~25%,淀粉含量高达26%~30%[2],在老化和冻融稳定性方面,油莎豆淀粉优于马铃薯或玉米淀粉[3],因此,具有很大的潜在开发价值。
近年来,对于油莎豆的研究主要集中在油脂特性等方面,而对油莎豆淀粉的研究主要是提取工艺的优化和理化性质分析。王璐阳等[4]对脱皮油莎豆压榨饼提取淀粉的研究表明,油莎豆淀粉的颗粒大小、分布比较均匀,且凝胶质构特性优于玉米淀粉。于淑艳等[5]研究发现,油莎豆淀粉具有较低的透明度、溶解度和膨胀度,但其冻融稳定性和老化性优于玉米淀粉,蓝值也显著高于马铃薯淀粉。目前,有关以油莎豆淀粉为原料制备多孔淀粉的探索研究报道较少,张铁华等[6]发明了一种高压脉冲电场辅助酶法制备油莎豆多孔淀粉的方法,以高压脉冲电场作为酶解预处理方式,使用糖化酶水解油莎豆淀粉,得到孔径小、吸附力强、应用范围广的油莎豆多孔淀粉。
目前为止,多孔淀粉的制备方法主要包括物理、化学、酶和协同法。酶法具有反应条件温和,催化效率和底物特异性高等优点,常被选择用来进行多孔淀粉的制备[7-8]。本试验以油莎豆淀粉为原料,采用复合酶法对油莎豆淀粉进行改性处理制备多孔淀粉,复合酶可以产生协同效应,能够更好地促进淀粉表面和内部发生水解,形成更多的孔隙结构,为油莎豆淀粉的深加工产业提供理论依据。
1 材料与方法
1.1 材料与试剂
油莎豆淀粉:长春大学化学实验室制;大豆油(食品级):九三集团哈尔滨惠康食品有限公司;α-淀粉酶(10 000 U/g)、葡萄糖淀粉酶(100 000 U/mL)、磷酸氢二钠(分析纯)、柠檬酸(分析纯)、氢氧化钠(分析纯)、溴化钾(光谱纯):上海麦克林生化科技有限公司;猪胰α-淀粉酶(50 U/mg)、糖化酶(100 000 U/g):大连美仑生物技术有限公司;氢氧化钾、冰醋酸、无水乙酸钠、3,5-二硝基水杨酸(均为分析纯):北京化工厂。
1.2 仪器与设备
台式高速冷冻离心机(H-1850R):长沙湘仪离心机有限公司;扫描电子显微镜(S-3400N):日本Hitachi公司;傅里叶红外光谱仪(Nicolet iS5):美国赛默飞世尔科技有限公司;质构仪(EZ-SX):日本岛津公司;快速黏度分析仪(3JK-1):澳大利亚Perten公司。
1.3 方法
1.3.1 多孔淀粉的制备
称取20.0 g油莎豆原淀粉于250 mL锥形瓶中,加入pH值为4.73的磷酸氢二钠-柠檬酸缓冲溶液60 mL,置于50℃恒温水浴锅中搅拌预热10min,按质量分数3%加入复合酶,α-淀粉酶与糖化酶质量比1∶5,于50℃恒温培养摇床中(120 r/min)反应10 h后加入5mL的4%氢氧化钠溶液终止反应,将悬浮液3000r/min离心10 min,去掉上清液,沉淀水洗3次,最后用乙醇洗1次,在50℃烘箱干燥24 h,研磨后过孔径0.150 mm标准筛,得油莎豆多孔淀粉[9]。
1.3.2 吸油率、吸水率的测定
准确称取油莎豆原淀粉和油莎豆多孔淀粉各1.0 g(m1),置于已知质量的15 mL离心管中,恒温下与10 mL的大豆油或去离子水混合搅拌30 min,以4 000 r/min转速离心10 min,倒掉上层液体(油或水),直至无油滴或水滴滴下,称取离心管的质量。根据式(1)计算吸油率(ω)。

式中:m1为淀粉样品质量,g;m2为离心后管与样品的总质量,g;m0为离心管质量,g。
1.3.3 淀粉比容积的测定
准确称取2.0 g淀粉于10 mL量筒中,使淀粉自由落下,晃动量筒保持淀粉面水平,读数,计算每克淀粉所占的体积,即为淀粉的比容积[10]。
1.3.4 抗性淀粉含量的测定
根据McCleary法[11]测定抗性淀粉含量,准确称取0.1 g样品于离心管中,加入4.0 mL猪胰α-淀粉酶和糖化酶混合液,涡旋混匀,水平放置于恒温振荡器中,在37℃、200 r/min处理16 h。取出离心管,加入4 mL无水乙醇,涡旋混匀,3 500 r/min离心10 min,倒出上清液。加2 mL 50%乙醇,漩涡混匀,再加6 mL 50%乙醇,3 500 r/min离心10 min,倒出上清液,重复此步骤。漩涡混匀后加2 mL 2 mol/L的KOH溶液,将沉淀冰浴20 min。然后加入8 mL醋酸钠缓冲液(pH3.8),并立即加入0.1 mL糖化酶酶液,50℃水浴30 min,期间间歇混匀。处理后的溶液3 500 r/min离心10 min。
吸取0.1 mL待测液于25 mL比色管中,加入1 mL蒸馏水和5 mL 3,5-二硝基水杨酸(3,5-dinitrosalicylic acid,DNS)溶液,沸水浴5 min后,迅速流水冷却,并定容至25 mL,在波长510 nm处测其吸光值。采用DNS法测葡萄糖含量,抗性淀粉(resistant starch,RS)含量按式(2)计算。

式中:G为葡萄糖含量,mg;V为吸取的待测液体积,mL;M为待测样品质量,g。
1.3.5 扫描电子显微镜
将样品均匀地撒在样品台的导电胶上,喷金后置于电子显微镜样品室中,在15 kV的加速电压下对样品放大10 000倍进行观察,并选取有代表性的图片拍照[12]。
1.3.6 傅里叶变换红外光谱
采用溴化钾压片法,在波数4 000 cm-1~400 cm-1,以4 cm-1的分辨率绘制样品的红外光谱。
1.3.7 黏度测定
使用快速黏度分析仪(rapid visco analysis,RVA)测定样品糊化特性[13]。取2.5 g淀粉样品(校正为12%水分基准)加入18.5 mL蒸馏水中,并在RVA样品铝罐中搅拌。升温-降温循环:加热至50℃并保持1 min,以12℃/min在3.75 min内升温至95℃,在95℃下保持2.5 min,然后在3.75 min内冷却至50℃,并保持100 s。在测量过程中,桨叶转速设置为160 r/min。
1.3.8 质构特性测定
参考刘佳等[14]的方法并加以改动,将糊化后的油莎豆淀粉在室温条件下冷却,密封,4℃条件下冷藏24 h,用于质构测定。测试条件:TPA模式,P 0.5探头,探头下行速度模式为测试前速率1.0 mm/s,测试速率1.0 mm/s,测试后速率1.0 mm/s;压缩变形为样品高度的40%;触发值5 g。观察凝胶硬度、弹性、内聚性、胶黏性和咀嚼性能的变化。
1.4 数据处理
作图和数据处理与分析使用Origin 2019b和SPSS 22.0软件进行,试验3次重复取平均值。
2 结果与分析
2.1 油莎豆原淀粉与多孔淀粉的性质比较
对油莎豆原淀粉和油莎豆多孔淀粉的性质进行测定,结果如表1所示。

表1 油莎豆原淀粉与多孔淀粉的性质比较Table 1 Comparison of the properties of original starch and porous starch of Cyperus esculentus
从表1可知,油莎豆多孔淀粉样品吸油和吸水率显著提升,吸油率和吸水率提升至原淀粉的2倍多;吸水率和吸油率可以在一定程度上反映多孔淀粉的成孔情况,随着部分油莎豆结构发生改变,使得多孔淀粉孔洞增多,比表面积增大,吸附性能得到明显提高。油莎豆多孔淀粉的比容积为3.40 g/cm3,近似为原淀粉的2倍,这是因为在同等质量下,由于多孔淀粉内部中空结构的形成,体积相比于原淀粉变大,使得比容积也发生明显改变。有些淀粉天然具有抗消化性,油莎豆原淀粉抗性淀粉含量24.82%,经复合酶法处理后降低为17.30%,王金花等[15]采用α-淀粉酶和葡萄糖淀粉酶处理玉米淀粉,在不同酶解时间下,抗性淀粉含量相比于玉米原淀粉也呈下降趋势。
2.2 扫描电子显微镜分析
对油莎豆原淀粉和油莎豆多孔淀粉进行扫描电镜分析,结果如图1所示。
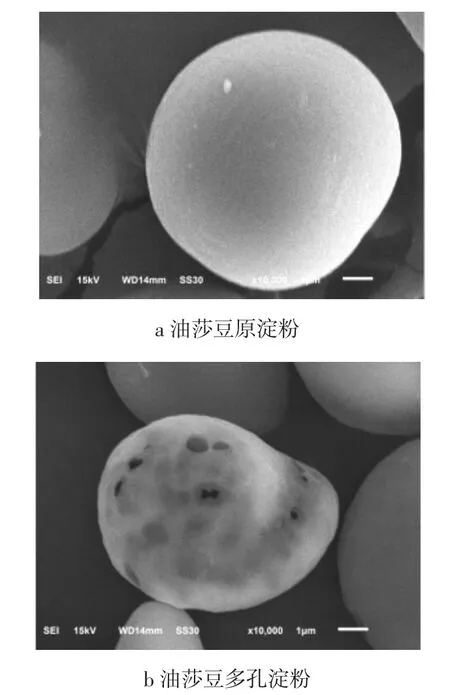
图1 油莎豆原淀粉及其多孔淀粉电镜图Fig.1 SEM images of original starch and porous starch of Cyperus esculentus
由图1a可知,油莎豆原淀粉呈球形或椭圆形,表面光滑且圆润。图1b显示,经双酶法处理制备的油莎豆多孔淀粉表面产生了少量不均匀、大小不一的孔洞,比表面积增大。将两种不同类型的酶结合在一起使用可产生协同效应,提高孔隙形成的效率,α-淀粉酶能有效地水解α,1-4糖苷键,这是非晶态区的主要结构,且α-淀粉酶和糖化酶两者都能提供内切和外切效应[8]。
2.3 傅里叶变换红外光谱分析
为了研究酶解对淀粉结构的影响,进行了傅里叶变换红外光谱分析,油莎豆原淀粉和油莎豆多孔淀粉的红外光谱如图2所示。

图2 油莎豆原淀粉及其多孔淀粉红外光谱图Fig.2 Infrared spectra of original starch and porous starch of Cyperus esculentus
由图2可知,酶促反应后,油莎豆多孔淀粉基本分子结构保持不变,光谱带最大值没有偏移。油莎豆原淀粉的FT-IR光谱特征吸收峰在3 439 cm-1处出现—OH振动形成的吸收峰,在2 921、1 415 cm-1处的特征峰分别归属于—CH2的伸缩振动和变形振动,在1643cm-1处的特征峰归属于C—O—O的伸缩振动峰,在1 156 cm-1处的特征峰归属于C—C,C—O的伸缩振动峰,在1 081cm-1处的特征峰归属于C—O—H的伸缩振动峰[16]。试验发现,双酶法制备的油莎豆多孔淀粉光谱与原淀粉相似,特征吸收峰无明显差异,证明酶解并未改变淀粉的基本化学结构。
2.4 RVA黏度分析
油莎豆原淀粉和油莎豆多孔淀粉的糊化参数如表2所示。

表2 油莎豆原淀粉及其多孔淀粉的糊化特性参数Table 2 Gelatinization characteristic parameters of original starch and porous starch of Cyperus esculentus
淀粉颗粒在加热过程中受热膨胀,从而导致淀粉悬浮液黏度增加,然后淀粉颗粒发生膨胀破裂,黏度也因此下降。由表2中数据可知,油莎豆多孔淀粉的峰值黏度和谷值黏度均低于油莎豆原淀粉,这可能是由于淀粉的无定形区发生酶解,使得淀粉的颗粒结构被削弱。多孔淀粉在糊化过程中溶胀不能达到最大,导致其黏度下降[17]。崩解值反映了淀粉的耐剪切性能,崩解值越大耐剪切能力越差,油莎豆多孔淀粉崩解值较油莎豆原淀粉降低。回升值与淀粉在冷却过程中的重结晶和重排有关[18],油莎豆多孔淀粉的回升值低于油莎豆原淀粉,表明多孔淀粉相比于原淀粉不易老化。
2.5 油莎豆淀粉凝胶质构分析
淀粉的凝胶质构特性通常与富含淀粉类食品的加工品质和速食性能有直接关系,因为淀粉糊化后形成半透明凝胶,凝胶的黏弹性和强度会发生一定程度的改变[19],油莎豆原淀粉和油莎豆多孔淀粉质构特性参数结果如表3所示。

表3 二次压缩模式测定参数值Table 3 Parameters by texture profile analysis
由表3可知,油莎豆多孔淀粉的硬度、内聚性、胶黏性、咀嚼性指标均明显高于油莎豆原淀粉,说明油莎豆多孔淀粉的凝胶质构特性优于原淀粉;而其弹性数值略有下降,凝胶弹性大小显示出对外界破坏抵抗能力的强弱,油莎豆原淀粉和油莎豆多孔淀粉经糊化后形成半透明凝胶,淀粉分子的部分链段会发生位移产生黏性流动,而黏性流动一定程度上会影响到淀粉凝胶的弹性性质[20]。
3 结论
以油莎豆原淀粉为原料,采用复合酶法制备油莎豆多孔淀粉。结果表明,油莎豆多孔淀粉的吸油率、吸水率和比容积增大为油莎豆原淀粉的2倍左右,糊化后抗性淀粉含量降低,油莎豆多孔淀粉表面产生部分新的孔洞。油莎豆多孔淀粉与油莎豆原淀粉相比,峰值黏度、谷值黏度和终值黏度降低,峰值时间增长,硬度、内聚性、胶黏性和咀嚼性增大。试验结果为油莎豆淀粉的改性提供了理论基础。

