小龙虾下脚料中虾青素和甲壳素提取工艺研究
张乐宏,盖永强*,王鹏,王耀宗,程致远,甄天元,朴美子,李岩*
(1.青岛农业大学食品科学与工程学院,山东 青岛 266109;2.济宁海关,山东 济宁 272000;3.潍坊英轩实业有限公司,山东 潍坊 262499;4.青岛农业大学海洋科学与工程学院,山东 青岛 266109)
小龙虾,作为一种淡水虾,其肉质鲜美,且肉中蛋白质与必需氨基酸含量丰富,脂肪含量低,深受广大人民群众的欢迎[1]。由于其庞大的销量,每年会产生大量的虾壳(含12%~16%的钙、10%~15%的甲壳素和7%以上的壳聚糖)[2]、虾头等下脚料(含有丰富的虾青素[3]、蛋白质[4]、氨基酸[5]等)。这些下脚料如处理不当,会造成环境污染和资源浪费。目前,关于小龙虾下脚料精深加工方面的研究主要集中在提取虾青素和虾红素、提取甲壳素和壳聚糖、制作小龙虾调味料、提取蛋白质及类脂、提取虾油、提取抗氧化小肽类与生物钙类等方面[6]。然而,由于小龙虾下脚料中不同成分的提取工艺存在差异性,实际生产过程中,一般仅对某种成分进行提取,难以做到对多种成分连续、高效提取,制约了小龙虾产业可持续发展。
虾青素,是一种经济价值非常高的类胡萝卜素[7]。研究表明,虾青素素有“超级维生素E”[8]的美誉,其具有抗氧化[9]、抗炎[10]、抑制肿瘤[11]、养眼[12]、增进机体免疫力[13]等生理功能。目前,虾青素提取的方法分为两大类:天然提取、化学合成。化学合成工艺复杂,生成副产物,且化学合成的虾青素在生物活性、生物吸收以及着色性能等方面都比不上天然虾青素。提取天然虾青素的方法有以下几种:油溶法、有机溶剂提取法、碱提法、超临界CO2流体萃取法[14]。甲壳素,又称几丁质,是一种线性高分子多糖[15]。研究表明,甲壳素可调节机体pH值、提高免疫力、预防癌变[16]、控制血糖[17]等。常见的甲壳素提取方法主要有以下几种:化学法(工业常用,易对环境造成危害)、乙二胺四乙酸(ethylene diamine tetraacetic acid,EDTA)法(成本过高)、酶解法(成本高、耗时长)[18]、微生物发酵法(耗时长)[19]、离子液体提取法(不可回收循环,存在安全风险)[20]等。
本研究通过有机溶剂(乙酸乙酯)浸提法提取虾青素,之后利用浸酸浸碱法提取甲壳素。连续浸提工艺可以最大程度利用下脚料资源,有利于工业化连续生产。本研究利用小龙虾下脚料中的虾壳,经单因素和响应面试验分别优化了虾青素、甲壳素最佳提取工艺,实现两种成分的高效、连续提取,为小龙虾副产物高值化利用提供数据支撑。
1 材料与方法
1.1 材料与试剂
小龙虾:市售;虾青素标准品:上海江莱生物科技有限公司;盐酸(HCl)、氢氧化钠(NaOH)、无水乙醇、草酸(分析纯):莱阳市康德化工有限公司;乙酸乙酯、高锰酸钾(KMnO4)、二氯甲烷(分析纯):天津市富宇精细化工有限公司。
1.2 仪器与设备
高速万能粉碎机(FW135):北京市永光明医疗仪器有限公司;电热恒温水浴锅(HHW-21CU-600):上海福玛实验设备有限公司;恒温振荡器(SHA-B):武汉格莱莫检测设备有限公司;高速台式冷冻干燥机(TGL-16M):浙江赛德仪器设备有限公司;冷冻干燥机(FD-A10N-50):冠森生物科技有限公司;紫外可见分光光度计(WFZUV-2000):美国贝克曼公司;电热恒温鼓风干燥箱(DHG-9023A):上海廷翌仪器设备厂;酸碱指示计(PHS-3C)、电子分析天平(AR1140):上海奥豪斯国际贸易有限公司;循环水真空泵(SHZ-D):上海贝仑仪器设备有限公司。
1.3 虾青素提取工艺操作要点
虾壳预处理:将小龙虾壳肉分离,小龙虾壳用清水洗净、沥干、-80℃冷冻,然后置于冷冻干燥机中冻干处理24 h,干燥后的虾壳于粉碎机中24 000 r/min破碎1 min,获得208 g虾壳粉,干燥保存待用。
蛋白质的去除:将虾壳粉放入烧杯,用pH2.5的HCl溶液浸泡,放入60℃保温箱水解1 h,抽滤所得粉末进行冷冻干燥,保存待用。
虾青素浸提液制备:称取0.5 g虾壳粉于离心管,加入10 mL浸提液(乙酸乙酯、二氯甲烷、无水乙醇),于35℃浸提2 h,离心,取上清液得虾青素浸提液。
以虾青素提取量为指标,选择浸提试剂(乙酸乙酯、二氯甲烷、无水乙醇)、料液比[1∶10、1∶20、1∶30、1∶40、1∶50、1∶60(g/mL)]、浸提温度(15、25、35、45、55 ℃)、浸提时间(30、60、90、120、150、180 min)和浸提次数(1、2、3次)5个因素进行单因素试验,分析各因素对小龙虾下脚料中虾青素提取量的影响。
1.4 虾青素提取量的测定
准确称取0.5 g虾壳粉,用10mL乙酸乙酯将其充分溶解,在35℃环境下分别振荡水浴2h后在4℃、6 000 r/min条件下离心10min,取其上清液在最大吸收波长471nm处测定吸光度,虾青素提取量计算公式如下。
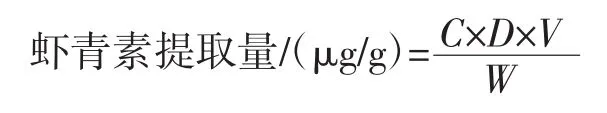
式中:C为样品吸光值;D为提取液测定时的稀释倍数;V为提取液测定前定容的体积,mL;W为虾粉的干重,g。
1.5 响应面试验优化虾青素提取条件
基于单因素试验,以虾青素提取量为指标,对虾青素提取的料液比、浸提温度、浸提时间进行响应面优化设计。依据Box-Behnken的中心组合设计原理,试验因素及水平见表1。
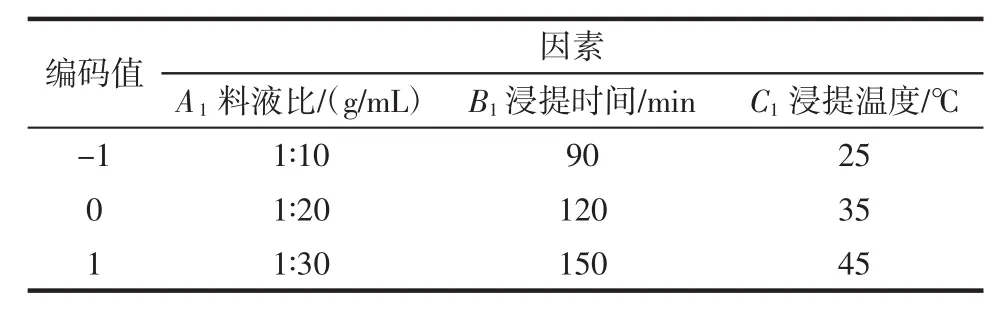
表1 虾青素提取量Box-Behnken试验因素编码值Table 1 Encoding values of astaxanthin extraction amount Box-Behnken test factors
1.6 甲壳素提取工艺操作要点
将提取虾青素后所得剩余固体用清水洗净,干燥后进行以下处理。
矿物质的去除:在常温下,在小龙虾壳粉中分别加入不同浓度的HCl溶液,在1∶20(g/mL)料液比条件下于40℃恒温水浴锅中反应一定时间,用玻璃棒不断搅拌至不产气为止,弃溶液,水洗固体至中性。
蛋白质的去除:向锥形瓶中加入不同浓度的NaOH溶液,在1∶30(g/mL)料液比条件下于80℃恒温水浴锅中加热一定时间。静置,冷却,过滤得固体,水洗固体至中性,抽滤后得甲壳素粗品。
甲壳素的精制:根据试验因素,每个试验因素分3组,每组称取0.5g甲壳素粗品于锥形瓶中,加入10mL 0.1 mol/L的KMnO4溶液,浸泡1 h,抽滤,水洗至无色,然后加入20 mL草酸溶液,水浴加热,直到样品皆为白色,静置至室温,水洗剩余固体至中性,室温放至真空干燥箱中干燥24 h,得白色精制甲壳素固体。
以甲壳素提取率为指标,选择HCl浓度(0.6、0.8、1.0、1.2、1.4 mol/L)、HCl浸泡时间 (10、20、30、40、50 min)、NaOH 浓度(0.6、0.8、1.0、1.2、1.4 mol/L)和 NaOH 浸泡时间(3.5、7.0、10.5、14.0、17.5 min)4 个因素进行单因素试验,分析各因素对小龙虾下脚料中甲壳素提取率的影响。
1.7 甲壳素提取率的测定
称取得到的精制甲壳素固体质量,通过以下公式计算甲壳素的提取率。

1.8 响应面试验优化甲壳素提取条件
基于单因素试验,以甲壳素提取率为指标,根据Box-Behnken的中心组合设计原理,对甲壳素提取工艺中HCl浓度、HCl浸泡时间、NaOH浓度、NaOH浸泡时间4个因素进行响应面设计,试验设计因素和水平见表2。
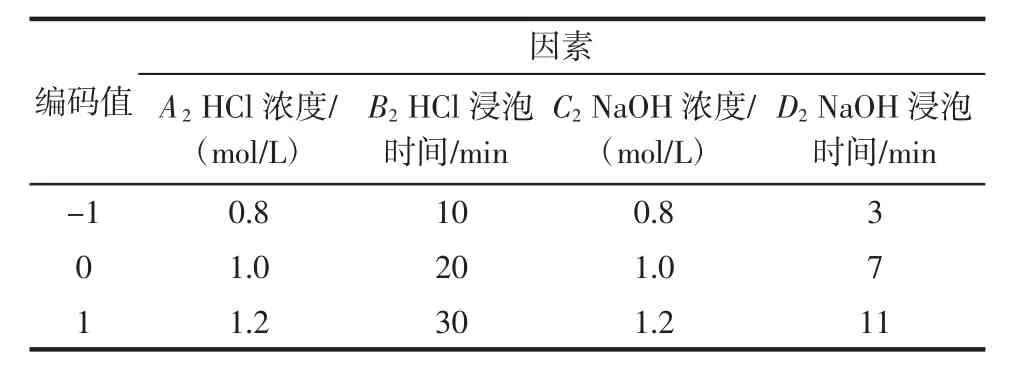
表2 甲壳素提取率Box-Behnken试验因素编码值Table 2 Encoding values of chitin extraction ratio Box-Behnken test factors
1.9 数据处理
利用SPSS Statistics 26和OriginPro 9.1进行数据统计分析及绘图,采用Design-Export10软件对Box-Behnken中心组合试验设计的试验数据进行回归分析,P<0.05表示存在显著性差异。
2 结果与分析
2.1 小龙虾下脚料中虾青素提取工艺单因素试验
小龙虾下脚料中虾青素提取工艺单因素优化结果如图1所示。
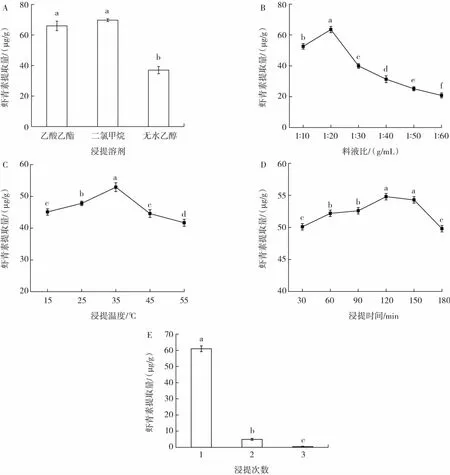
图1 小龙虾下脚料中虾青素提取工艺单因素优化结果Fig.1 Single-factor optimization results of extraction process of astaxanthin from crayfish leftovers
由图1A可以看出,二氯甲烷作为提取溶剂时虾青素提取量最高,无水乙醇作为提取溶剂时提取量最低,且与二氯甲烷、乙酸乙酯作为浸提溶剂时的虾青素提取量存在显著性差异(P<0.05);由于乙酸乙酯与二氯甲烷作为浸提溶剂时的虾青素提取量差值较小,且二氯甲烷有麻醉作用,大量吸入会引起呼吸和循环中枢麻痹,不利于身体健康,为了保证试验的持续性与安全性,将乙酸乙酯作为后续试验中虾青素的提取溶剂。
由图 1B 可以看出,在料液比 1∶20(g/mL)时,虾青素提取量最高,且与其他料液比组别的虾青素提取量存在显著性差异;当溶剂添加量较低时,虾青素提取量较少,浸提效果不佳;当溶剂添加量过多时,虾青素提取量呈下降趋势。这可能是因为溶剂添加量较高时,提取出的虾青素浓度低稳定性较差。因此,选取料液比为 1∶20(g/mL)进行后续试验。
由图1C可以看出,浸提温度为15℃~35℃时,随着浸提温度的增大,虾青素提取量也随之增加,当浸提温度为35℃时,虾青素提取量达到最大值后,随着浸提温度增加,虾青素提取量减少。这表明在一定范围内,升温有利于虾青素的提取,而温度过高会造成溶剂的汽化,导致提取效率降低,再者高温会影响虾青素的稳定性。因此,选取浸提温度35℃进行后续试验。
由图1D可以看出,浸提时间在30 min~120 min时,随着浸提时间的增加,虾青素提取量也提高;当浸提时间为120 min时,虾青素提取量达到最大值;当浸提时间大于120 min时,虾青素提取量下降。这可能因为浸提时间过长,虾青素的稳定性会遭到破坏,导致虾青素提取量的降低。因此,选取浸提时间120 min进行后续试验。
由图1E可以看出,此工艺提取1次的虾青素提取量高达60.93 μg/g,2次提取的虾青素的提取量为4.92 μg/g,3 次提取的虾青素提取量仅有 0.41 μg/g。考虑到提取的工作效率和试验成本,决定对虾青素提取1次。
2.2 响应面法优化提取小龙虾下脚料中虾青素工艺
利用小龙虾下脚料提取虾青素的响应面试验结果如表3所示,方差分析如表4所示。合较好,可解释97.34%的响应值变化。料液比(A1)对虾青素提取量有显著影响(P<0.05);浸提时间(B1)、浸
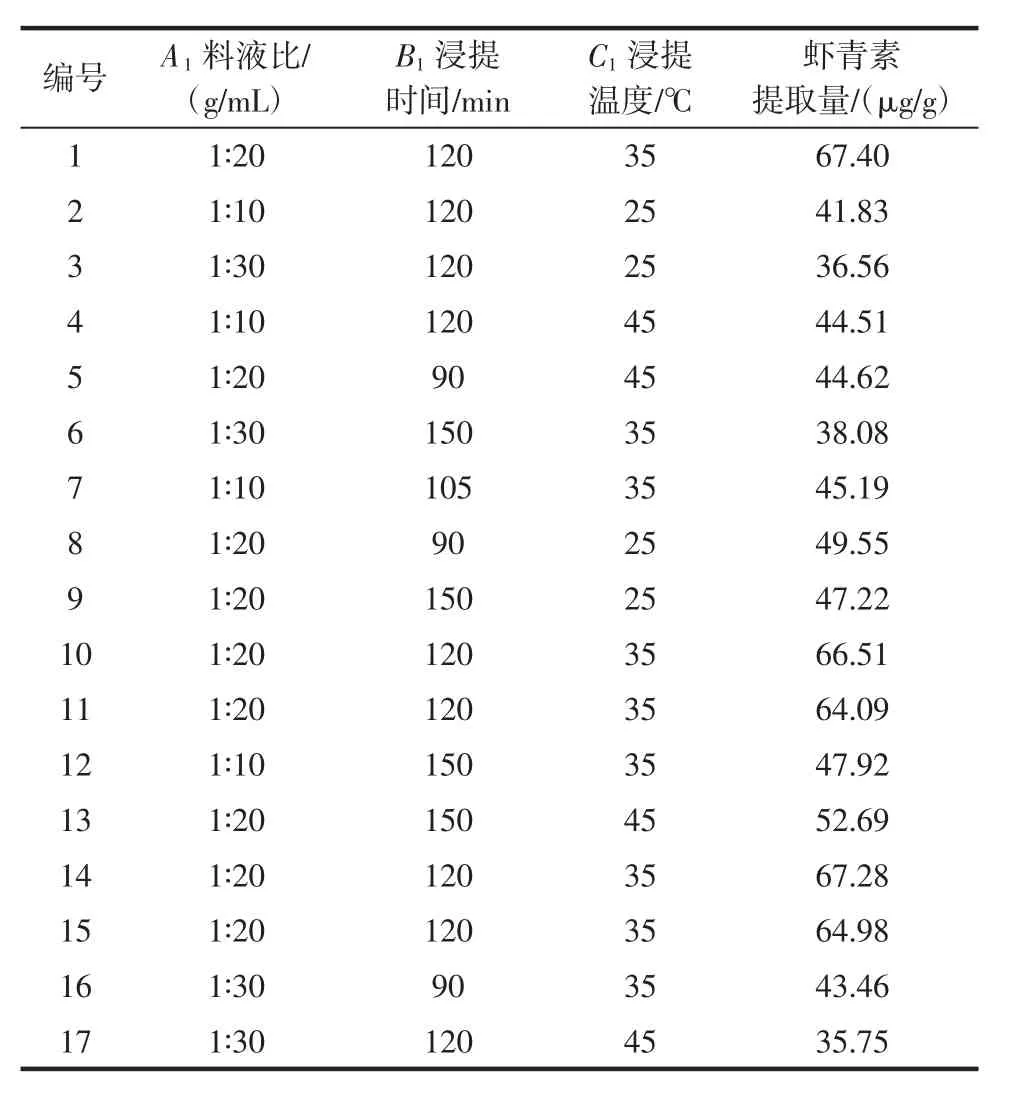
表3 虾青素提取量响应面试验结果Table 3 Results of astaxanthin extraction amount by response surface methodology optimization
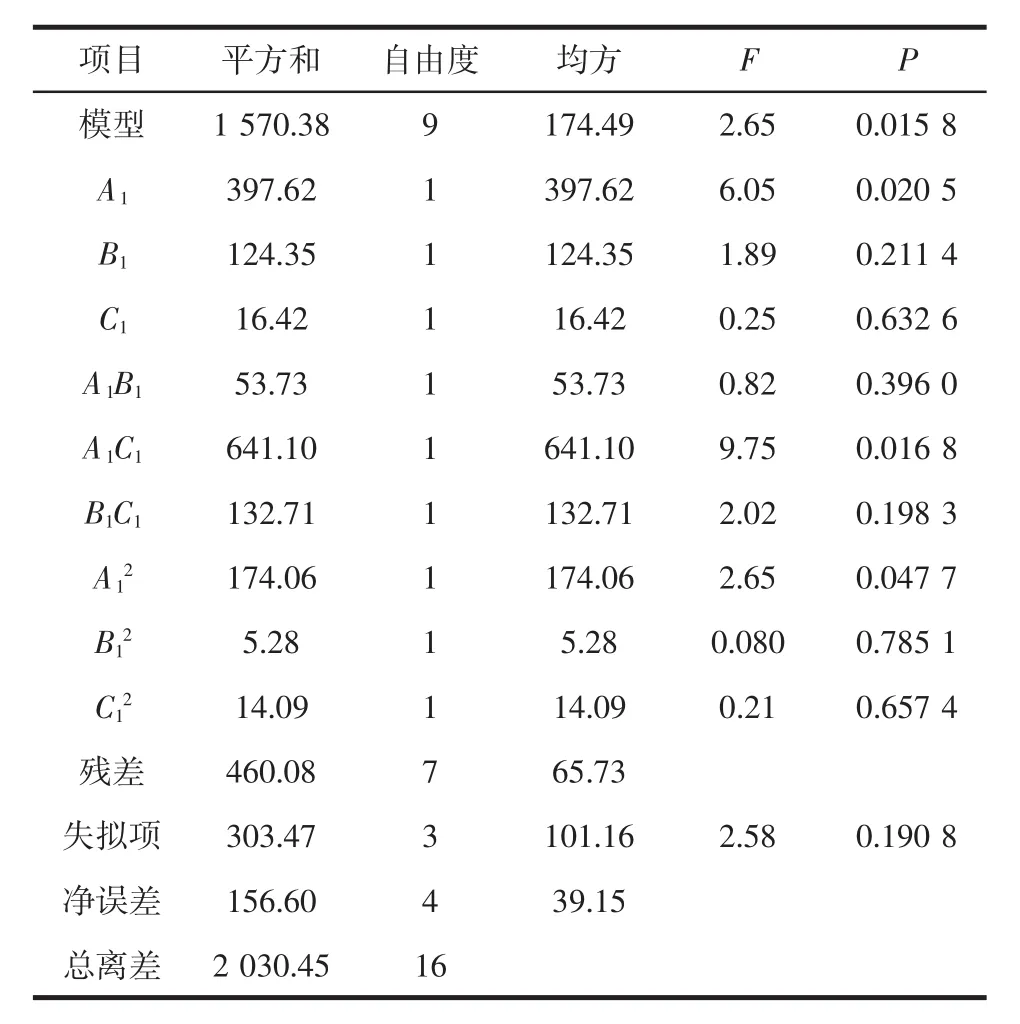
表4 方差分析结果Table 4 Results of variance analysis
在Box-Behnken Design试验结果的基础上将所得数据进行多元回归拟合,得到如下回归方程:Y=46.4+7.05A1+3.94B1+1.43C1-3.67A1B1+12.66A1C1+5.76B1C1+6.43A12+1.12B12+1.83C12。
模型F=2.65,P<0.05意味着该回归模型具有统计学意义,可以用模型分析预测虾壳粉虾青素提取方法的结果。失拟项F=2.58,P=0.190 8>0.05,表示失拟项不显著。相关决定系数R2=0.973 4,表明该模型与试验拟提温度(C1)对虾青素提取量影响不大,且三者对虾青素提取量影响大小为:A1>B1>C1。
料液比(A1)、浸提时间(B1)、浸提温度(C1)之间的交互作用关系如图2所示。
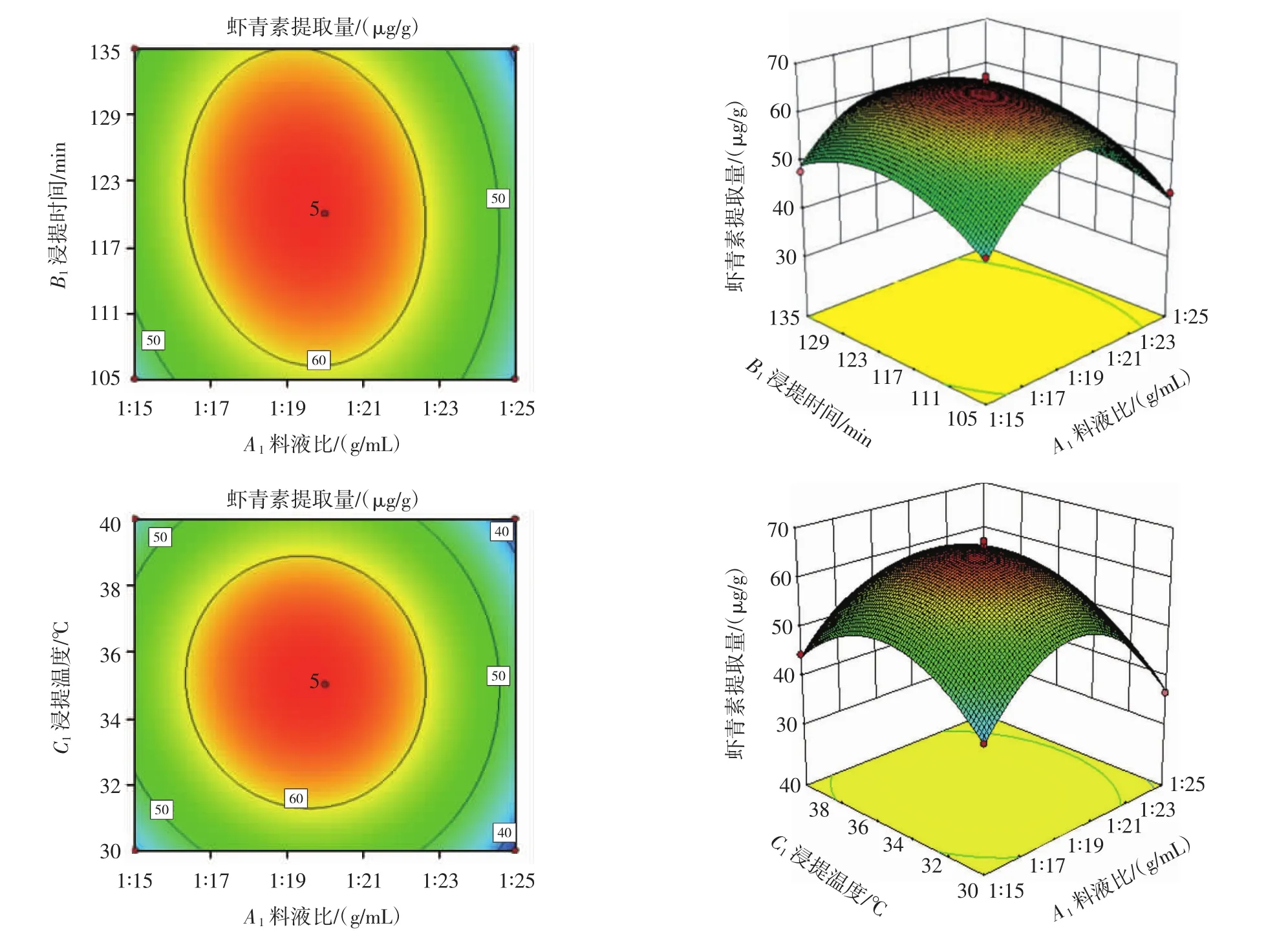
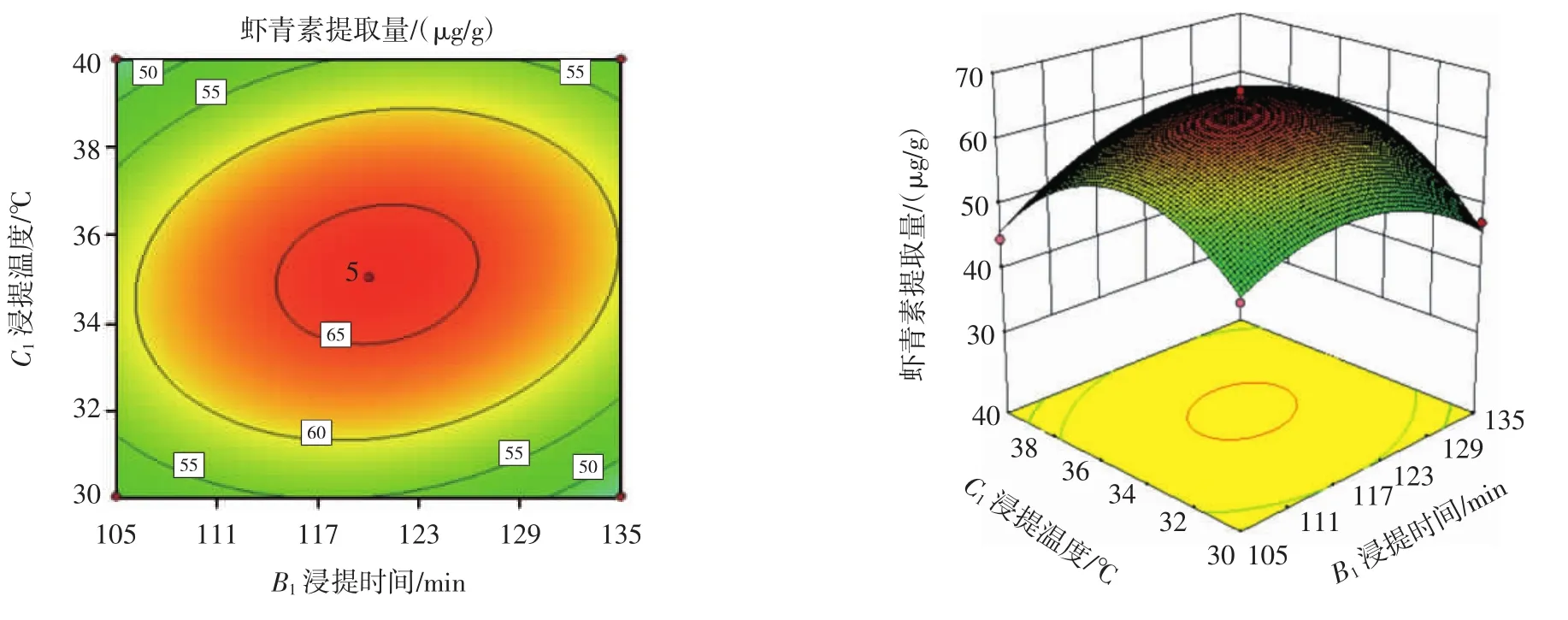
图2 各因素交互作用对虾青素提取量的影响Fig.2 Effects of interaction of various factors on the extraction amount of astaxanthin
其中料液比(A1)与浸提温度(C1)交互作用对虾青素提取量的影响显著(P<0.05),料液比(A1)与浸提时间(B1)、浸提时间(B1)与浸提温度(C1)交互作用不显著(P>0.05),料液比(A1)与料液比(A1)交互作用显著(P<0.05)(见表4和图2)。综上,料液比(A1)是从小龙虾下脚料中提取虾青素的影响最显著因素。这说明,控制好料液比(A1)有利于小龙虾下脚料虾青素的最大幅度提取;可适当减少浸提时间,降低浸提温度,既能减少时间成本,又能降低能耗,且不会显著影响虾青素提取量。
响应面试验得到虾青素最佳提取工艺条件为料液比 1∶19.05(g/mL)、浸提时间 119.46 min、浸提温度34.19℃。小龙虾下脚料中虾青素预测值Y为69.13μg/g。
为验证响应面法所得结果的准确性,考虑到实际操作的可能性,将提取参数调整为料液比1∶19(g/mL)、浸提时间120min、浸提温度34℃。在此条件下重复3次,得虾青素提取量为67.40 μg/g,为预测值的97.50%。与理论预测值相比,其相对误差小于10%。因此,本试验所得的最佳提取工艺可靠,具有实用价值。
目前,宋庆洋等[21]研究表明,以丙酮作为虾青素的浸提溶剂,潜江小龙虾虾壳中虾青素提取量达到148.2 μg/g[料液比 1∶20(g/mL)、温度 30 ℃、时间 2 h]。何立坚等[22]研究表明,以乙酸乙酯作为虾青素的浸提溶剂,明虾虾壳中虾青素提取量为 38.285 μg/g[料液比 1∶20(g/mL)、温度60℃、时间2 h]。陈西广等[23]研究表明,以乙酸乙酯作为虾青素的浸提溶剂,海虾虾壳中虾青素提取量为 45.5 μg/g[料液比 1∶2(g/mL)、温度 60 ℃、时间 3 h]。上述研究表明,不同虾种类、不同提取工艺下所得虾壳中虾青素提取量存在差异。考虑到浸提溶剂安全性和虾青素氧化问题,在保证提取效率的同时,相对安全的乙酸乙酯和低温(30℃)更有利于虾青素的提取及其稳定性,这与本试验结果一致。
2.3 小龙虾下脚料中甲壳素提取工艺单因素试验
小龙虾下脚料中甲壳素提取工艺单因素优化结果如图3所示。
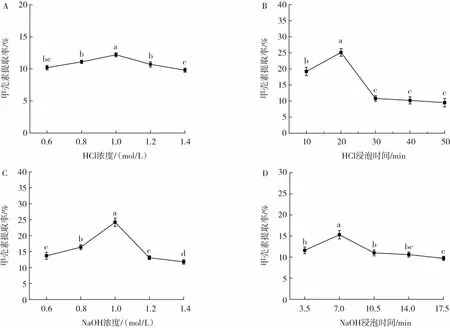
图3 小龙虾下脚料中甲壳素提取工艺单因素优化结果Fig.3 Single-factor optimization results of extraction process of chitin from crayfish leftovers
由图3A可以看出,在HCl浓度逐渐增大的过程中,甲壳素的提取率出现了先升高后下降的现象,这可能是浓度过高的HCl会对甲壳素造成破坏,进而甲壳素的提取率随之下降。因此,确定1.0 mol/L为HCl提取甲壳素的最佳浓度。
由图3B可以看出,随着浸泡时间的增加,甲壳素的提取率随着时间的增加出现了先升高后降低逐渐趋于平稳的趋势,在20 min之前,甲壳素的提取率随时间的延长而增加,20 min达到最大值以后,出现了较大幅度的下降。这可能是由于随着HCl浸泡时间的延长,会使得虾粉中的甲壳素遭到破坏。因此,试验将20 min作为最佳HCl浸泡时间。
由图3C可以看出,NaOH溶液浓度为0.6 mol/L~0.8 mol/L时,甲壳素的提取率不断升高;NaOH溶液浓度为1.0 mol/L时,甲壳素的提取率最大,且与其他NaOH浓度下甲壳素的提取率存在显著性差异(P<0.05);超过1.0 mol/L时,甲壳素的提取率有较大幅度的下降。这可能是由于小龙虾下脚料中的甲壳素在NaOH溶液作用下逐渐溶出,使得甲壳素的提取率增加;但在NaOH浓度过大时,甲壳素也会被分解,使得甲壳素的提取率下降。因此,本试验选择1.0 mol/L作为NaOH溶液的最佳浓度。
由图3D可以看出,NaOH溶液浸泡时间在3.5min~7 min时,甲壳素的提取率不断上升;NaOH溶液浸泡时间为7 min时,甲壳素的提取率达到最大值,且此时的甲壳素提取率与NaOH溶液其他浸泡时间的甲壳素提取率存在显著性差异(P<0.05);NaOH溶液浸泡时间大于7 min时,甲壳素提取率处于下降趋势。这可能是由于随着时间的推移,虾壳粉中的甲壳素在NaOH溶液作用下被逐渐溶出分解,使得甲壳素的提取率增加;但是随着NaOH溶液浸泡时间的延长,甲壳素存在被分解的风险,使得甲壳素的提取率下降。因此,试验将7 min作为NaOH溶液的最佳浸泡时间。
2.4 响应面法优化提取小龙虾下脚料中甲壳素工艺
利用小龙虾下脚料提取虾青素的响应面试验结果如表5所示,方差分析如表6所示。
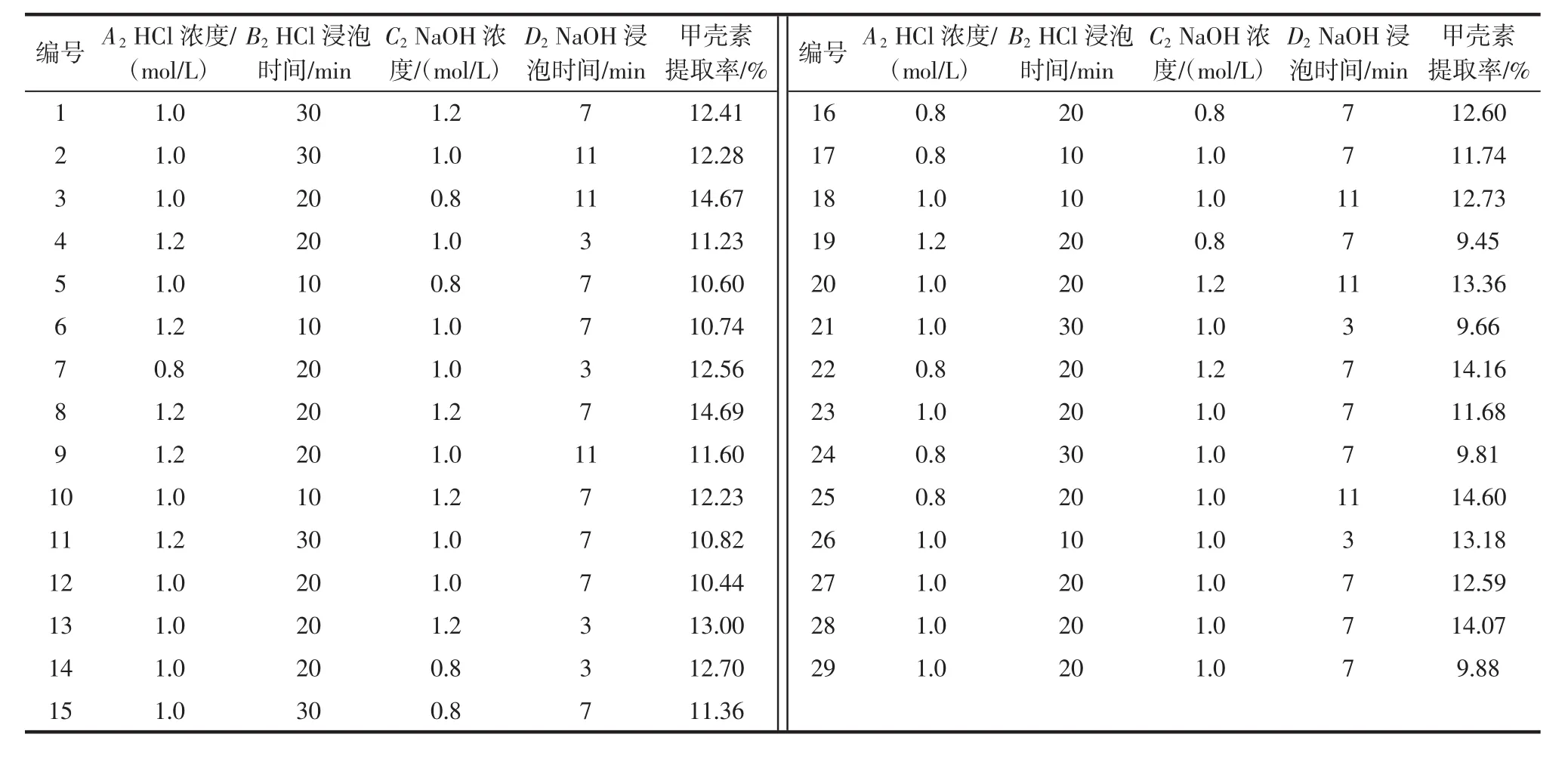
表5 甲壳素提取率响应面试验结果Table 5 Results of chitin extraction ratio by response surface methodology optimization
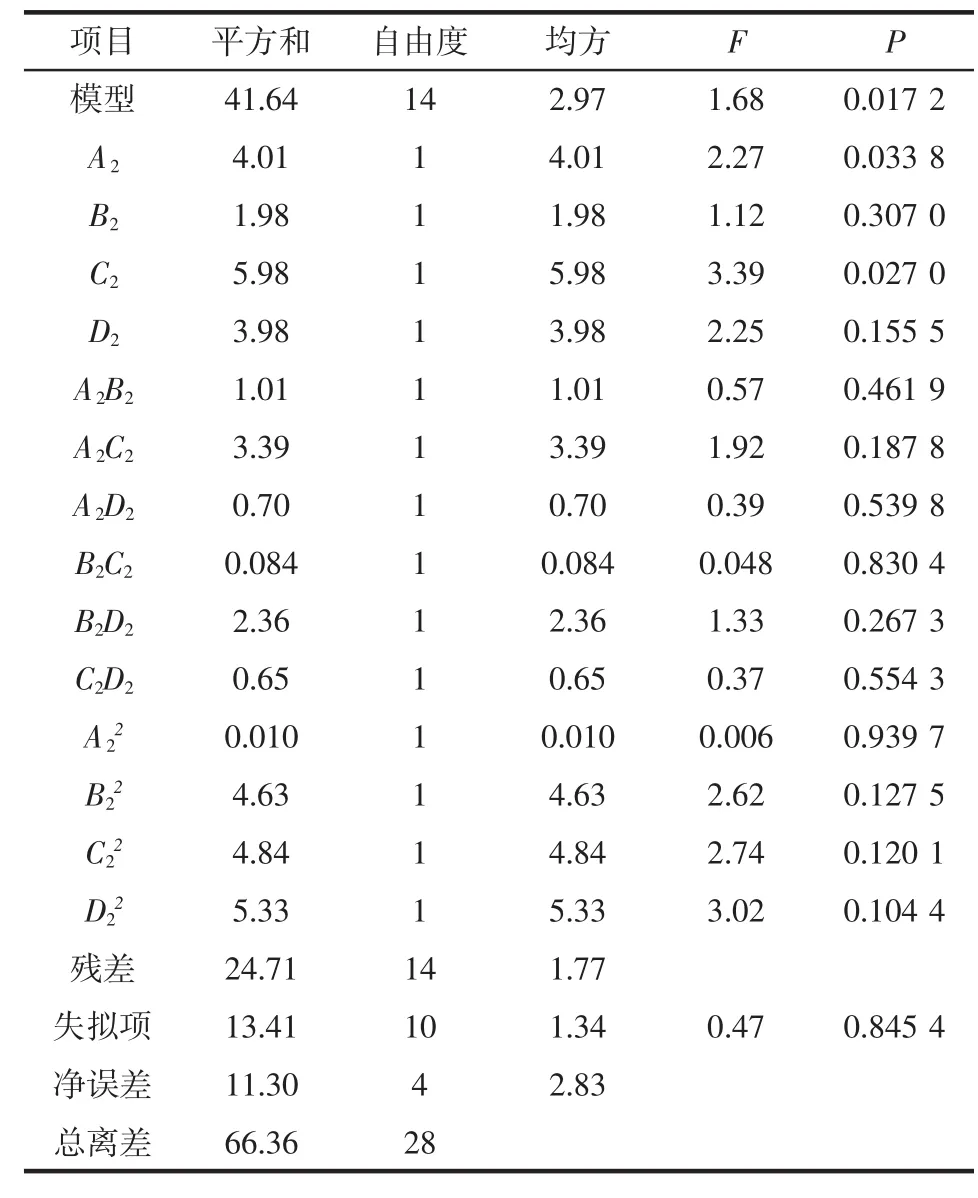
表6 方差分析Table 6 Variance analysis of test results
对试验数据进行多元回归拟合,得到如下回归方程:Y=11.73-0.58A2-0.41B2+0.71C2+0.58D2+0.50A2B2+0.92A2C2-0.42A2D2-0.15B2C2+0.77B2D2-0.40C2D2-0.040A22-0.85B22+0.86C22+0.91D22。
该模型中 F=1.68,P<0.05,R2=0.972 6,说明模型具有很好的拟合度,二次回归方程显著。而且HCl浓度(A2)、NaOH 浓度(C2)项 P 值均小于 0.05,说明对响应值影响显著,尤其 HCl浓度(A2)和 NaOH 浓度(C2)的交互作用显著。相关决定系数R2=0.972 6,表明该模型与试验拟合较好,可解释97.26%的响应值变化。HCl浸泡时间(B2)、NaOH浸泡时间(D2)对甲壳素提取率影响不大,且四者对甲壳素提取率影响大小为C2>A2>D2>B2。
HCl浓度 (A2)、HCl浸泡时间(B2)、NaOH 浓度(C2)、NaOH浸泡时间(D2)之间的交互作用关系如图4所示。
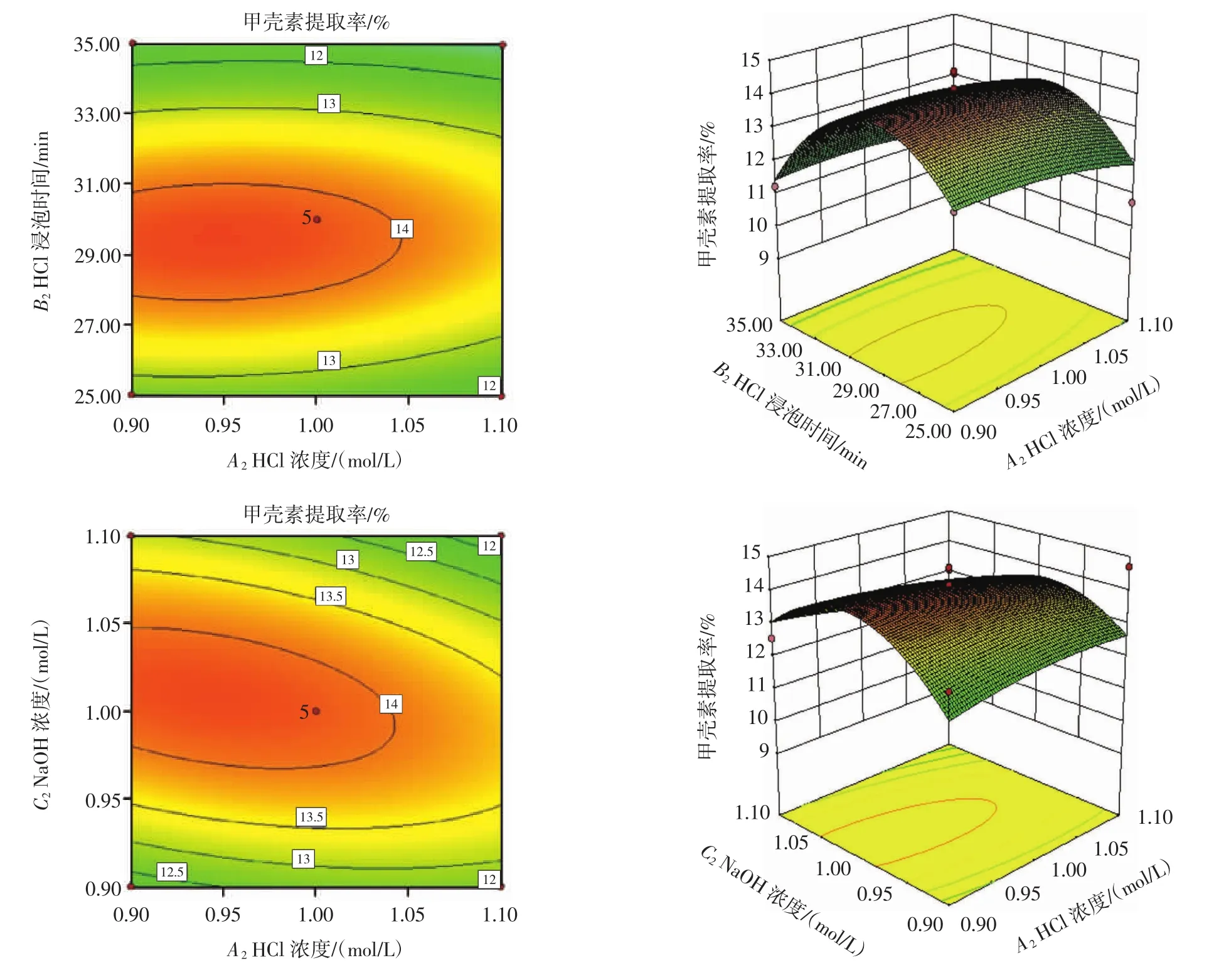
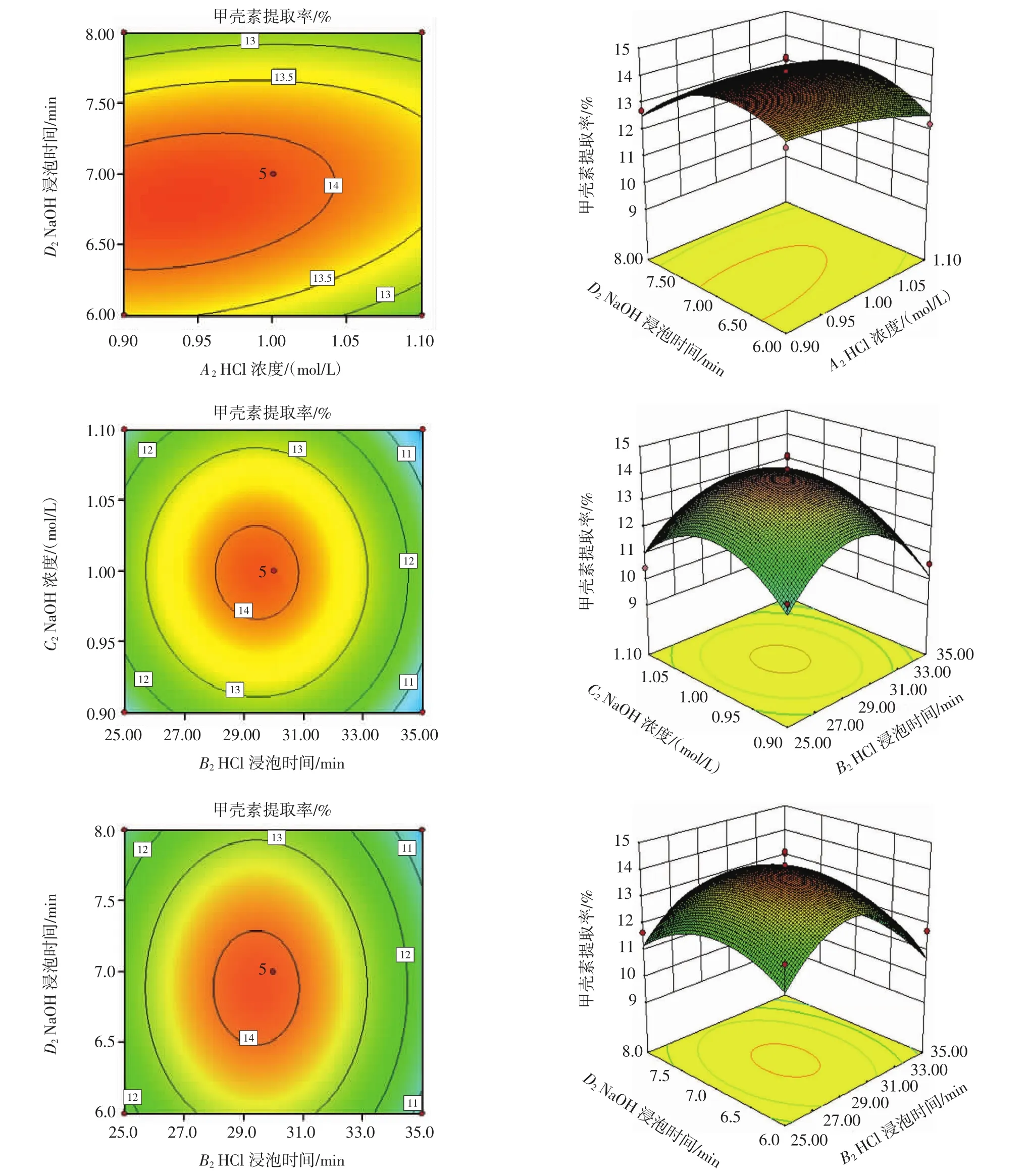
图4 各因素交互作用对甲壳素提取率的影响Fig.4 Effects of interaction of various factors on the extraction ratio of chitin
由图 4 可知,HCl浸泡时间(B2)与 HCl浓度(A2)交互作用、HCl浓度(A2)与 NaOH 浓度(C2)交互作用、HCl浓度(A2)与 NaOH 浸泡时间(D2)交互作用的等高线图呈椭圆型,且等高线椭圆分别指向HCl浸泡时间(B2)、NaOH 浓度(C2)、NaOH 浸泡时间(D2)。虽然,HCl浸泡时间(B2)与 HCl浓度(A2)交互作用、HCl浓度(A2) 与 NaOH 浓度 (C2) 交互作用、HCl浓度 (A2)与NaOH 浸泡时间(D2)交互作用、NaOH 浓度(C2)与 HCl浸泡时间(B2)交互作用、NaOH 浸泡时间(D2)与 HCl浸泡时间(B2)交互作用、NaOH浸泡时间与NaOH浓度交互作用对甲壳素提取率影响不显著(P>0.05)(见表6和图4),但可适当减小NaOH浓度,减少HCl浸泡时间与NaOH浸泡时间,既不会显著影响甲壳素的提取率,又能够减少NaOH的使用与时间成本。
响应面试验得到最佳甲壳素提取工艺条件为HCl浓度 0.98 mol/L、HCl浸泡时间 20.2 min、NaOH 浓度0.94 mol/L、NaOH浸泡时间6.49 min。小龙虾下脚料中甲壳素预测响应值Y为25.12%。
为验证响应面法所得结果的准确性,考虑到实际操作的可能性,将提取参数调整为HCl浓度1 mol/L、HCl浸泡时间20 min、NaOH浓度1 mol/L、NaOH浸泡时间6.5 min。在此条件下重复3次,甲壳素提取率为24.13%,为预测值的96.06%。与理论预测值相比,其相对误差小于10%。因此,本试验所得的最佳提取工艺可靠,具有实用价值。
3 结论
本文通过单因素试验与响应面试验设计,对小龙虾下脚料中虾青素和甲壳素的连续提取工艺条件进行优化,研究表明,以乙酸乙酯为提取溶剂,料液比为1:19(g/mL),在34℃条件下浸泡虾粉120 min后得到虾青素的最大提取量为67.40 μg/g;将提取完虾青素的固体水洗干燥后置于1 mol/L的HCl中浸泡20 min,然后置于1 mol/L的NaOH溶液浸泡6.5 min后得到甲壳素的最大提取率为24.13%。本研究对小龙虾下脚料中虾青素和甲壳素进行提取,即实现了资源回收利用,又为虾青素和甲壳素的连续提取提供了参考。

