血清维生素D代谢物与成年女性睡眠时间的相关性分析
龚和杨子, 邢丽菲, 康毅敏, 王 帆, 3, 4
(1. 内蒙古医科大学 基础医学院, 内蒙古 呼和浩特, 010110;2. 国药北方医院 神经介入科, 内蒙古 包头, 014030;3. 北京回龙观医院 精神医学研究中心, 北京, 100871;4. 新疆医科大学第二附属医院 新疆神经系统疾病研究重点实验室, 新疆 乌鲁木齐, 830063)
近年来,成年人平均睡眠时间呈明显缩短趋势[1-2]。中国成人平均睡眠时间仅为6.5 h[3], 中国职业人群睡眠时间少于7 h的占比为11.6%, 而女性较男性更易出现睡眠问题,失眠占比高达41%[4-6]。维生素D是人体必需营养素,通过皮肤紫外线合成和饮食摄入,随后经肝脏和肾脏代谢[7]。25-羟基维生素D[25(OH)D]被广泛用于评估机体内维生素D的状态,其循环代谢物主要形式为25-羟基维生素D3[25(OH)D3]和25-羟基维生素D2[25(OH)D2][8]。针对青少年和老年人群的观察性研究报道显示,自我报告睡眠时间均与血清25(OH)D含量呈正相关[9-10], 然而成年女性的血清维生素D水平与睡眠时间关系的研究较少。本研究分析成年女性血清维生素D代谢物水平与睡眠时间的关系,为临床早期干预女性睡眠状况提供参考依据,现报告如下。
1 资料与方法
1.1 一般资料
本研究数据来源于美国国家健康与营养调查 (NHANES) 数据库,NHANES是由美国疾病预防控制中心发起,2年为1个调查周期。2007—2008年开始,NHANES数据库使用特异度和灵敏度均较好的液相色谱-串联质谱法检测参与者血清维生素D及其代谢物的浓度。本研究纳入2007—2018年6个调查周期中检测血清25(OH)D、25(OH)D3和25(OH)D2含量及报告睡眠时间的20~65岁的12 361例女性为研究对象,排除怀孕、哺乳期女性(319例),排除患有肝脏、肾脏疾病及传染病者(569例),排除一般资料[种族、受教育程度、收入与贫困基线比值、体质量指数(BMI)]缺失者(1 081例)和9项患者健康问卷(PHQ-9)数据缺失者1 039例,最终纳入研究对象9 353例。NHANES数据库收集协议均获得国家卫生统计研究中心伦理审查委员会的批准,所有受试者均签署知情同意书。本研究数据文件在线公布并供下载使用(https://www.cdc.gov/nchs/nhanes/index.htm)。
1.2 方法
1.2.1 基线资料收集方法: 研究对象在专业调查员的指导下使用计算机辅助个人访谈(CAPI)系统接受问卷调查,收集自我报告的睡眠信息以及年龄、种族、受教育程度、婚姻状况、经济状况等信息。在移动检查中心(MEC)由卫生技术人员测量BMI,并用专业记录仪收集数据。血液标本采集的时间为11月—次年4月和同年5—10月。收入与贫困基线比值定义为家庭收入与调查年份的贫困水平阈值的比值。PHQ-9量表用于抑郁症的筛查,在MEC中按标准化方案进行采集,该量表共9项,总分0~27分,总分≥10分表示存在抑郁风险[11-12]。
1.2.2 睡眠时间记录与评价: 采用睡眠问卷收集研究对象自我报告的每晚平均睡眠时间。按照美国国家睡眠基金会成年人每天正常睡眠时间7~9 h的建议[13],本研究将睡眠时间<7 h/晚定义为睡眠不足。根据每晚平均睡眠时间将研究对象分为睡眠不足(<7 h/晚)女性和非睡眠不足(≥7 h/晚)女性。
1.2.3 实验室检测: 利用液相色谱-串联质谱法定量检测血清中25(OH)D3和25(OH)D2的浓度,血清维生素D的活性形式25(OH)D的总量为两者浓度的总和。本研究纳入的血清25(OH)D及25(OH)D3浓度均高于检测浓度的下限,仅部分血清25(OH)D2浓度高于检测浓度的下限(2.05 nmol/L), 当低于检测下限时, NHANES使用检测浓度下限/√2作为估计值。
1.3 统计学分析

2 结 果
2.1 一般资料
本研究共纳入9 353例成年女性研究对象, 3 189例(34.1%)女性睡眠不足,包括20~44岁女性1 627例(51.0%)和45~65岁女性1 562例(49.0%)。除血液标本采集月份外,睡眠不足女性和非睡眠不足女性的基线资料比较,差异有统计学意义(P<0.05), 见表1。
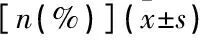
表1 2007—2018年20~65岁女性不同睡眠时间比较
2.2 不同睡眠时间女性血清维生素D循环代谢物浓度比较
睡眠不足女性血清25(OH)D及25(OH)D3浓度分别为56.2(39.2, 75.0)、51.9(35.4, 70.4) nmol/L, 分别低于非睡眠不足的女性的62.5(44.2, 80.9) nmol/L和59.0(40.3, 77.7) nmol/L。由于25(OH)D2总体检出率为21.0%, 低于50.0%, 因此不再进行分析,见表2。

表2 20~65岁不同睡眠时间女性的血清维生素D代谢物比较[M(P25, P75)] nmol/L
2.3 血清维生素D循环代谢物浓度与睡眠时间的相关性
以年龄、种族、婚姻状况、受教育程度、收入与贫困基线比值、BMI、采集月份、高血压、糖尿病、PHQ-9评分作为协变量,分别拟合Logistic回归模型分析探讨血清25(OH)D3和25(OH)D与睡眠状况的关系。校正以上混杂因素后,血清25(OH)D3及25(OH)D每增加10 nmol/L, 睡眠不足发生的可能性分别下降5.5%与5.7%[OR=1.005 5, 95%CI为1.003 6~1.007 3;OR=1.005 7, 95%CI为1.003 9~1.007 6)], 见表3。探索血清维生素D浓度与睡眠时间的非线性关系的限制性立方样条回归模型中,调整协变量后,两者相关性几乎与调整协变量前一致。当血清25(OH)D3≤70 nmol/L时,睡眠时间随着血清25(OH)D3浓度的升高而明显延长,两者呈正相关; 当血清25(OH)D3>70 nmol/L时,血清25(OH)D3浓度升高睡眠时间并未明显延长,两者的正相关关系变弱。同样,血清25(OH)D浓度与睡眠时间呈正相关关系,且当25(OH)D浓度≤60 nmol/L时两者的相关性更显著,见图1。
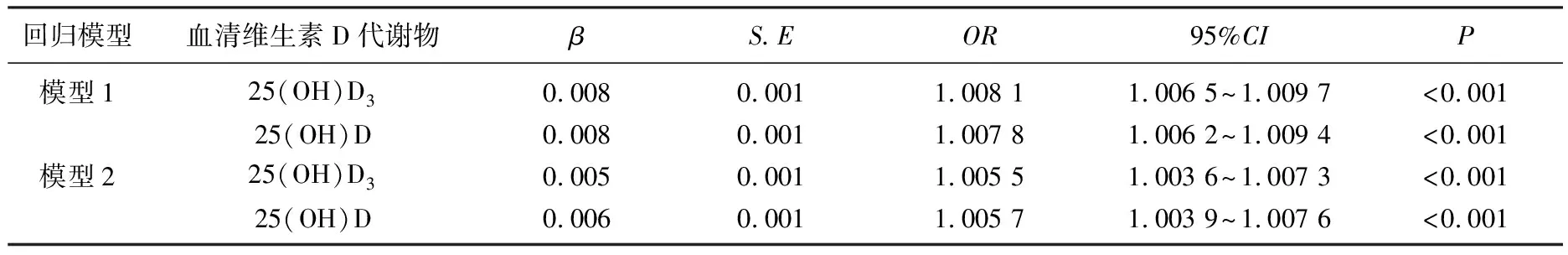
表3 睡眠不足女性血清维生素D代谢物浓度的Logistic回归模型结果
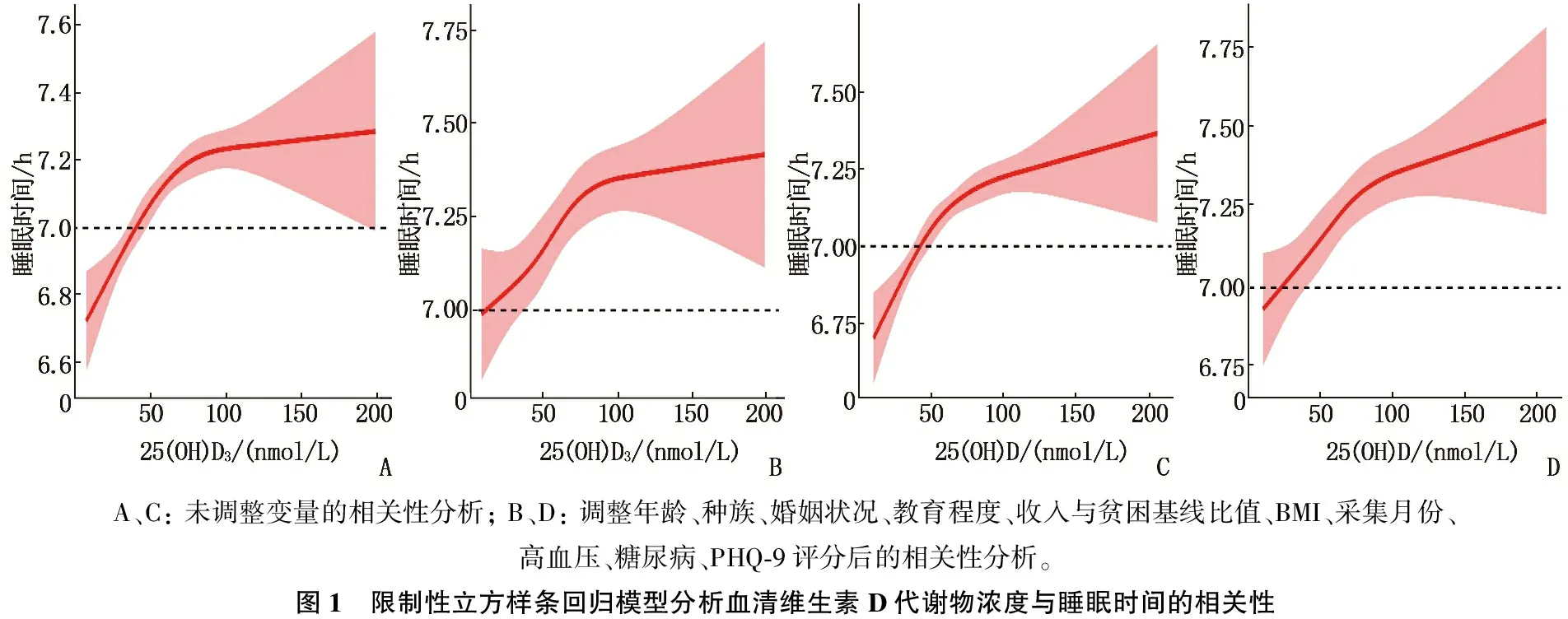
A、C: 未调整变量的相关性分析; B、D: 调整年龄、种族、婚姻状况、教育程度、收入与贫困基线比值、BMI、采集月份、高血压、糖尿病、PHQ-9评分后的相关性分析。图1 限制性立方样条回归模型分析血清维生素D代谢物浓度与睡眠时间的相关性
3 讨 论
基于2007—2018年NHANES的调查数据,本研究结果发现, 20~65岁女性血清维生素D代谢物浓度与睡眠时间呈正相关,血清25(OH)D3和25(OH)D浓度越高,睡眠不足的风险越低。本研究发现,在限制性立方样条回归模型中,调整协变量前后的血清25(OH)D3、25(OH)D浓度与睡眠时间均呈正相关,睡眠时间的延长会随着维生素D代谢物浓度的增高呈“先快后慢”的趋势,即体内维生素D浓度较低时,升高维生素D浓度对延长睡眠时间的作用相对明显,而当体内维生素D浓度达到一定水平后,提高其水平对延长睡眠时间的效应不显著,可能原因为在下丘脑、前额叶皮质、中脑中央灰质、黑质和中缝核等调节睡眠的大脑区域存在维生素D受体[14-15], 随着维生素D浓度的升高,其与受体的结合也逐渐趋于饱和,因此延长睡眠时间的作用有限。
维生素D参与睡眠调控,但机制尚不清楚[16]。人体靠皮肤光照内源性合成维生素D的占比为90%, 仅有少量维生素D来源于膳食摄入和补充[17-18]。血清25(OH)D广泛用于机体维生素D水平的评估,其中25(OH)D3约占循环25(OH)D总量的95%, 并且在人体内25(OH)D3生物活性明显高于25(OH)D2[19]。在细胞培养物中施用25(OH)D3活性代谢物会影响昼夜节律基因的表达[20], 维生素D有助于调节褪黑素的产生,褪黑素是一种松果体激素,能够延长睡眠时间[21-22]。另外有报道[17, 23-24]显示, 19岁以上短睡眠时间的成年人维生素D摄入量较低,充足的维生素D水平有助于改善睡眠质量。
本研究发现, 20~44岁睡眠不足的女性占比略高于45~65岁女性。有研究[25-27]发现,睡眠不足不仅与过早死亡有关,还会导致严重的社会经济损失。女性面对工作、家庭等多方面压力,更容易产生负面情绪,较男性有更多的睡眠问题[5, 28]。本研究中睡眠不足的抑郁女性占比更高,血清维生素D可以改善负面情绪,因此该类人群可通过增加户外日晒活动以及适当补充维生素D, 提高体内维生素D水平,从而在一定程度上减轻情绪对睡眠的影响[29-30]。
本研究存在一定局限性。首先,睡眠时间是基于研究对象夜间睡眠的主观报告,缺乏客观测量,不能反映实际睡眠时间,可能与实际睡眠不足的划分存在偏差,但是本研究数据来源于NHANES大样本的调查,因此具有较好的覆盖面与代表性。其次,阳光照射是内源性维生素D水平的主要影响因素,NHANES将血液标本采集的月份信息分为2个时间段,除此之外未公布或纳入其他与阳光照射的相关信息,故本研究仅将血样采集的月份信息纳入分析。
综上所述,成年女性睡眠状况与体内血清维生素D代谢物浓度存在相关性,当血清维生素D代谢物浓度较低时,提高血清维生素D浓度对睡眠时间的延长有益。

