叶酸调控对高尿酸血症大鼠肠道微生物的影响
孙雪微, 赵 伟, 罗进城, 张光欣, 李佳琳*, 文 洁, 侯佳宁, 李 杰
(1.佳木斯大学 公共卫生学院,黑龙江 佳木斯 154007;2.黑龙江省痛风研究重点实验室,黑龙江 佳木斯 154007;3.天津农学院 动物科学与动物医学院,天津 300384;4.诸暨市疾病预防控制中心,浙江 杭州 311800)
尿酸是人体嘌呤代谢的终产物,而高尿酸血症则是由机体嘌呤代谢障碍引起的一种慢性代谢性疾病[1]。随着人类生活质量的提高,由营养过剩和日运动量过低等因素导致高尿酸血症及相关疾病的发病率直线上升[2-4],不仅危害人类健康,也给社会带来公共健康问题。健康人体内大部分尿酸会通过肾脏排出,而剩余三分之一经由肠道排泄[5],肠上皮细胞中的尿酸转运蛋白负责将尿酸从血液转运至肠腔,并直接排出体外或者由肠道微生物分解[6]。Yu等[7]研究发现部分肠道微生物会参与尿酸代谢,同时其肠道微生物结构也发生了显著变化。任科雨等[8]通过试验研究证实,高尿酸血症患者肠道菌群中拟杆菌、大肠埃希菌所占比例增高,而双歧杆菌、乳酸菌比例减少。越来越多的证据表明肠道微生物及其代谢产物在高尿酸血症及相关疾病的发病机理中起着重要作用[9-11]。因此,以肠道微生物作为研究目标将会成为高尿酸血症治疗的新方法。目前,高尿酸血症治疗方案主要采用药物治疗,主要药物为黄嘌呤氧化酶抑制剂和促尿酸排泄药,例如,苯溴马隆、别嘌呤醇和非布司他等,虽然药物降低血尿酸效果显著,但均存在不良反应和副作用[12]。叶酸是一种水溶性B族维生素,广泛存在于动植物类食品中,参与嘌呤、DNA和血红蛋白等蛋白质的合成[13]。Zhang等[14]基于人群大数据的研究发现,叶酸的摄入与高尿酸血症的患病风险呈相关性,但叶酸是否具有稳固高尿酸血症患者肠道结构的功能尚未有相关报道。因此,本研究通过构建高尿酸血症大鼠模型,检测不同处理组肠道微生物的多样性、群落组成和丰度差异,探究叶酸对高尿酸症大鼠肠道微生物的影响,为进一步探究高尿酸血症治疗方案提供参考。
1 材料与方法
1.1 材料
1.1.1 实验动物 SPF级雄性大鼠30只,每只体重(200±20) g,购自长春亿斯实验动物技术有限责任公司(许可证号:SCXK(吉)-2018-0007),饲养于佳木斯大学动物实验中心。
1.1.2 主要试剂与仪器设备 腺嘌呤(索莱宝,中国);叶酸 (sigma,美国);DNA提取试剂盒 (QIAGEN,德国);核酸纯化试剂盒(QIAGEN,德国);PCR产物回收试剂盒(QIAGEN,德国)。超微量分光光度计(Thermo Fisher Scientific,美国);PCR仪(Bio-Rad,美国);凝胶成像仪(Bio-Rad,美国);MiSeq 测序仪(Illumina,美国)。
1.2 方法
1.2.1 大鼠模型构建、实验动物分组及给药 大鼠适应性喂养1周后,采用随机数表法分为空白对照组、模型组及叶酸组,每组10只。模型组和叶酸组均自由摄食10%的高嘌呤饲料(酵母膏与标准饲料按照质量比1∶9 均匀混合),并每日按 100 mg/kg 的腺嘌呤混悬液灌胃,同时氧嗪酸钾悬液100 mg/kg 皮下注射。建模成功后,空白对照组及模型组给予蒸馏水2 mL灌胃,叶酸组给予叶酸84 μg/kg 灌胃干预。实验连续进行10周,整个实验期间,所有大鼠均自由饮水及采食。
1.2.2 血液样品采集及血尿酸水平检测 所有大鼠最后一次给药处理后,禁食12 h,使用乙醚吸入麻醉,麻醉后的大鼠取仰卧位固定在操作台上。75%酒精消毒后,打开大鼠腹腔,肝门静脉处采血4 mL收集至真空采血管中。静置10 min后,在4 ℃、2 500 r/min离心15 min,分离出的血清采用全自动生化分析仪测定大鼠血尿酸(SUA)指标。
1.2.3 粪便样品采集及储存 最后一次给药处理后,禁食12 h,收集粪便样本。新鲜的粪便样本直接收集于1.5 mL 冻存管中,储存于-80 ℃冰箱,用于肠道微生物DNA的提取。
1.2.4 粪便总DNA提取及16S rRNA 测序分析 采用DNA extraction kit按照试剂盒说明书提取粪便样本的总DNA。提取的DNA采用超微量分光光度计检测其浓度和纯度。以16S rRNA 基因的可变区V3~V4作为模板进行 PCR 扩增。扩增引物对为338F:ACTCCTACGGGAGGCAGCAG,806R:GGACTACHVGGGTWTCTAAT。通过Illumina测序平台进行16S rRNA微生物多样性测序分析,所有原始序列提交至NCBI,序列号为PRJNA721594。
1.2.5 生物信息处理 测序的原始数据经过 Fast QC 软件进行质量控制,PRINSEQ软件过滤小于250 bp序列,得到优化序列。将相似性大于 97% 的优化序列划分为一个操作分类单元(Operational taxonomic unit,OTU);基于Mothur软件对Alpha多样性包括Chao1 指数、Ace 指数、 Shannon 指数以及 Simpson 指数进行分析,同时基于Unifrac metric计算方法对其Beta多样性指数进行分析。采用RDP classifier贝叶斯算法对97%相似水平的OTU代表序列进行分类学分析,并在各个分类水平上统计每个样品的群落组成。

2 结果与分析
2.1 各组大鼠SUA水平比较
各组大鼠SUA检测结果见表1,与空白组比较,模型组和叶酸组大鼠SUA含量均显著升高, 差异有统计学意义 (P<0.05)。与模型组比较,叶酸组SUA含量明显降低,差异有统计学意义 (P<0.05)。
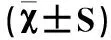
表1 各组大鼠SUA检测结果情况Table 1 Test results of SUA in rats in each
2.2 粪便微生物群落结构测序分析
通过大鼠粪便16S rRNA测序,三组样本共获得497 883条有效序列,平均每个样本获得55 320 条有效序列。由图1A稀释曲线可知,抽取的序列条数达到 40 000 条以上,曲线趋于平坦,表明各组样本测序数据合理,间接说明各组样本当前测序深度足够反映该群落样本所包含的微生物多样性。Rank-abundance曲线可用来解释多样性的两个方面,即物种丰度和物种均匀度。图 1B显示,随着 Rank 值的增加,丰度减少的趋势逐渐趋于平稳,表明样品中物种的均匀度和丰度较好。

图1 样品中物种的均匀度和丰度分析 Fig.1 Analysis of uniformity and abundance of species in samplesA:样品的稀释曲线图;B:样品的rank-abundance曲线图A: The dilution curve of the samples; B: The rank-abundance curve of the samples
2.3 粪便微生物群落多样性
微生物群落Alpha 多样性用于分析粪便样本微生物群落多样性,在97%序列相似水平上计算菌群多样性指数(Shannon、Simpson)和菌群丰度指数(Chao1、Ace)。由图 2 可知,模型组的Simpson、Shannon、Ace 和Chao1指数均高于空白对照组和叶酸组(P<0.05)。

图2 样品粪便微生物 Alpha 多样性指数 Fig.2 Sample fecal microbial Alpha diversity index*P<0.05,**P<0.01
粪便微生物群落Beta多样性通过主坐标分析(principal co-ordinates analysis, PCoA)与非度量多维尺度法(non-metric multidimensional scaling, NMDS)进行分析,通过对不同粪便样本群落的物种多样性进行组间比较分析,探索不同分组样本间群落组成的相似性或差异性。Beta多样性分析基于 OTU 水平群落PCoA (图3A),结果发现,在OTU水平,主成分1 (PC1) 与主成分2 (PC2) 分别解释方差为 26.67% 和 21.47%,累计解释能力达48.14%。三组样本的重复试样均比较聚集,不同样本组间分化明显。NMDS能够从高维数据中提取出能够最大程度反映样品间差异的主成分,揭示复杂背景下的简单规律,利用Bray-Curtis计算距离矩阵的算法,从OTU水平进行NMDS分析,图3B结果表明,不同组粪便样本组间存在差异(Stress=0.129),且各组聚集比较分散。PCoA与NMDS分析共同验证了不同组粪便样本群落组成差异明显。
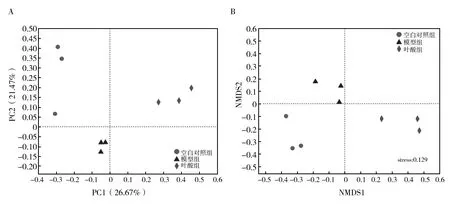
图3 样品粪便微生物 Beta 多样性指数 Fig.3 Sample fecal microbial beta diversity indexA:基于OTU水平的PCoA分析;B:基于OTU水平的NMDS分析A:PCoA analysis based on OTU level; B:NMDS analysis based on OTU level
2.4 粪便微生物物种组成
比对NCBI数据库测序序列,共得到763 个OTUs,分属于13门19纲48目81科177属321种。三元相图(图4)显示,OTU数目占总OTU数目的比例分别为乳杆菌属(Lactobacillus)占26.6%,其中空白对照组、模型组、叶酸组所占比例分别为32.8%、26.7%和40.5%;Muribaculaceae属占12.1%,其中空白对照组、模型组和叶酸组所占比例分别为17.7%、42.6%和39.7%;拟杆菌属(Bacteroides)占8.43%,其中空白对照组、模型组和叶酸组所占比例分别为26.7%、30.2%和43.1%;柯林斯菌属(Collinsella)占5.54%,其中空白对照组、模型组和叶酸组所占比例分别为4.10%、14.5%和 81.4%;Clostridium属占5.21%,其中空白对照组、模型组和叶酸组所占比例分别为65.7%、32.5%和1.80%;罗姆布茨菌属(Romboutsia)占3.25%,其中空白对照组、模型组和叶酸组所占比例分别为63.8%、33.1%和3.09%;布劳特氏菌属(Blautia)占2.94%,其中空白对照组、模型组和叶酸组所占比例分别为24.7%、14.7%和60.6%;毛螺旋菌科NK4A136群(Lachnospiraceae NK4A136_group)占2.10%,其中空白对照组、模型组、叶酸组所占比例分别为79.9%、17.1%和2.40%;Others(其他属)占33.9%,其中空白对照组、模型组和叶酸组所占比例分别为32.6%、41.9%和25.5%。相对于空白对照组和模型组,叶酸组中乳杆菌属、拟杆菌属、柯林斯菌属和布劳特氏菌属显著升高(P<0.05)。

图4 基于不同样品粪便微生物属水平三元相图 Fig.4 The ternary phase diagram based on the genus level of gut microbes in different samples
通过在不同分类水平上,对测序所得有效序列进行物种注释,本研究主要在门、属分类水平上进行物种分析。
2.4.1 门分类学水平 基于门分类水平研究发现(图5A),厚壁菌门(Firmicutes)和拟杆菌门(Bacteroidetes)为各组粪便样品微生物中的主要组成菌门,其中厚壁菌门相对丰度最高(空白对照组:83.33%,模型组:68.10%,叶酸组:55.68%);拟杆菌门次之,相对丰度在空白对照组中为14.07%,模型组中为25.08%,叶酸组中为28.33%。放线菌门(Actinobacteria)、脱硫菌门(Desulfobacterota)、变形菌门(Proteobacteria)和Campilobacterota菌门在空白对照组的相对丰度分别为1.10%、1.08%、0.14%、0.14%,在模型组的相对丰度分别为3.34%、2.26%、0.32%、0.51%,在叶酸组的相对丰度分别为14.59%、0.36%、0.85%、0.04%。在空白对照组、模型组和叶酸组中厚壁菌门的菌群丰度呈显著下降趋势,拟杆菌门的菌群丰度呈显著上升趋势。

图5 基于不同分类学水平物种组成分析图 Fig.5 Species composition analysis diagram based on different taxonomic levelsA:门分类水平物种相对丰度;B:属分类水平物种相对丰度A:The relative abundance of phylum taxonomic level species; B:The relative abundance of genus taxonomic level species
2.4.2 属分类学水平 由图5B可知,三组粪便样本微生物群落结构在属水平上均由乳杆菌属、Muribaculaceae、拟杆菌属、柯林斯菌属、梭菌属(Clostridium)、罗姆布茨菌属、劳特氏菌属和毛螺菌科 NK4A136群等菌属组成,这些菌属的相对丰度之和分别占空白对照组、模型组和叶酸组微生物菌群总量的66.87%、57.48%和74.08%。其中,乳杆菌属和Muribaculaceae相对丰度最高(空白对照组:29.34%和6.40%,模型组:21.31%和15.39%,叶酸组:29.18%和14.37%)。其中,乳杆菌属和布劳氏菌属的丰度在空白对照组、模型组和叶酸组中呈现显著先降后升的趋势;Muribaculaceae菌属的丰度呈现显著先升后降的趋势,拟杆菌属和柯林斯菌属的丰度呈上升趋势,梭菌属、罗姆布茨菌属和毛螺菌科NK4A136群菌属呈下降趋势。
3 讨 论
肠道菌群是人体中的第二大基因组,肠道中细菌的总含量超过了人体的总细胞量,因此,被称之为人体的另一个“器官”[15]。Buzard等[16]早在1952年率先通过经典抑菌实验证明,肠道菌群能够将排入肠道的尿酸进行分解。2014年,还发现在维吾尔族、汉族人群中,正常人与高尿酸血症患者肠道优势菌属存在显著差异[17];2016年,Guo等[18]的研究中发现,血尿酸升高患者与健康人群比较,其肠道菌群组成和分布上存在显著差异;越来越多肠道菌群的相关研究表明,其在慢性代谢性疾病中扮演着极其重要的角色[19-21];这些研究结果证实了高尿酸血症的发生跟肠道菌群呈相关性。本研究通过叶酸干预高尿酸血症雄性大鼠,探讨在高尿酸状态下,肠道微生物在群落组成和结构上的变化,为从肠道微生物的角度治疗高尿酸血症提供参考。
本研究采用高嘌呤饮食联合氧嗪酸钾的方法,成功构建了高尿酸血症大鼠模型,在叶酸的干预下,高尿酸血症大鼠血尿酸水平显著降低,说明叶酸具有降低血尿酸水平的潜能。有研究发现同型半胱氨酸水平对肠道菌群种类和数量有影响[22],Cohen等的研究也提到HUA与同型半胱氨酸存在显著相关性[23],而叶酸是治疗高同型半胱氨酸血症的临床用药,由此推论,由高嘌呤饮食引起的大鼠肠道微生态的紊乱,在叶酸干预后,通过影响同型半胱氨酸,从而使肠道微生物群落结构和丰度在一定程度复原,直接或间接降低血尿酸水平,但尚未有相关文献进行分析,需更深入的研究来证实这一推论。
过往的研究结果表明,肠道微生物物种丰度变化显著的宿主患代谢性疾病的风险更高[24]。根据本研究Alpha多样性和Beta多样性的分析结果可知,空白对照组、模型组和叶酸组在肠道微生物菌群结构和物种丰度上均具有明显差异,高尿酸血症大鼠肠道微生物的物种多样性及丰度高于空白对照组,这与Liu等[9]的研究结果相符。经叶酸干预后,叶酸组肠道微生物的物种多样性较模型组有所降低,这在牛晓曼[25]的研究结果中也得到了证实,说明叶酸的摄入缓解了大鼠肠道微生物群落结构的紊乱,稳定了肠道微生物菌群的生态环境,增强了抵抗疾病的能力。由此可知,叶酸的摄入改善了肠道微生物菌群的丰度和结构,在一定程度上为肠道微生物稳固了适宜的生态环境。
肠道中微生物种类繁多且数量庞大,厚壁菌门和拟杆菌门占90%以上[26],其中,厚壁菌门是健康宿主的优势菌群[27],这与本研究的结果相符;在门分类水平上,肠道微生物主要由厚壁菌门和拟杆菌门组成[28];在属分类水平上,肠道微生物的优势菌属分别为乳杆菌属、Norank-f-Muribaculaceae、拟杆菌属、柯林斯菌属、Clostridium-sensu-stricto、罗姆布茨菌属、布劳特氏菌属和毛螺旋菌科NK4A136群等。高尿酸血症大鼠肠道中乳杆菌属和罗姆布茨菌属等厚壁菌门的物种丰度呈现下降趋势,经叶酸干预后,乳杆菌属的丰度呈上升趋势且接近空白对照组大鼠,这是由于乳杆菌属是肠道内的有益菌,可在大量的肠道微生物间形成生物膜,以便在恶劣的环境中长时间生存并维持足够的丰度,一定程度上也起到了抑制病原菌定植的作用[29],所以,叶酸的摄入可能为乳杆菌属生存和生长繁殖提供了必需的营养成分;但罗姆布茨菌属经叶酸干预后,物种的丰度并未增加,在有关报道中也证实了罗姆布茨菌属在健康宿主的肠道黏膜中物种丰度最为丰富,否则,其物种丰度会呈下降趋势[30],这与本研究结果相符,说明罗姆布茨菌属在患有高尿酸血症大鼠的肠道中扮演着关键角色,一旦其生存的微生态环境遭到破坏,罗姆布茨菌属的物种丰度就会下降,在叶酸干预后,也并未出现显著的上升趋势,这可能是罗姆布茨菌属对生存环境要求较为苛刻,因此,肠道中罗姆布茨菌属的丰度可以作为检测慢性代谢性疾病发生的微生物指示物[31]。高尿酸血症大鼠肠道中的Muribaculaceae菌属丰度显著高于空白对照组大鼠,随着叶酸的干预,Muribaculaceae菌属的丰度有所降低。朱晓敏等[32]的研究表明,在肠道疾病的黏膜中检测到Muribaculaceae菌属会大量增加,这与本研究的结论一致,随着大鼠肠道中的Muribaculaceae菌属丰度的增加,会导致肠道菌群的紊乱,可能是引起高尿酸血症发病的一个诱因。在本研究中,肠道微生物随着叶酸的摄入,其优势有益微生物的丰度上升,也在一定程度上降低了条件致病菌的丰度,从而达到稳固肠道微生态平衡的目的。
本研究基于16S rRNA测序技术探究叶酸对调控高尿酸血症大鼠血尿酸及肠道微生物的作用,发现叶酸干预对降低大鼠血尿酸水平具有明显效果,并对失调的肠道微环境具有一定的稳固作用,这为水溶性维生素叶酸治疗高尿酸血症提供了参考。但肠道菌群组成十分复杂,叶酸对高尿酸血症的干预机制仍需更深入的研究。