响应面法优化超声波-微波协同辅助酸法提取猕猴桃皮果胶工艺及果胶理化性质分析
陈怡君,王晓慧,陈艳萍,邓敏,伊帕尔·开斯尔,龙元爱,杨万根, *
1(吉首大学 林产化工工程湖南省重点实验室,湖南 张家界,427000)2(吉首大学 食药两用资源研究与高值化利用湖南省重点实验室,湖南 吉首,416000)3(湖南省周生堂生物科技有限公司,湖南 凤凰,416200)
猕猴桃富含维生素C等营养成分,我国猕猴桃产量居世界第一[1]。随着我国食品加工业的发展,猕猴桃加工产品如果汁、果酒、果酱和果脯等的产量持续增长,但由此产生的猕猴桃皮渣(原料的20%~30%)却未能得到充分利用,不仅造成资源浪费,而且也存在污染环境的风险,成为了亟需解决的难题。
果胶是广泛存在于植物初生细胞壁和细胞内层的一类复杂天然高分子聚合物,根据酯化程度的不同,可分为高酯果胶和低酯果胶。果胶在食品中用途广泛,可作食品加工中的胶凝剂、增稠剂、胶体稳定剂和脂肪替代品等。果胶还具有降血脂、降胆固醇、抑制脂肪酶活性等生理活性,可用于药品的合成。随着对果胶在食品及医药行业的研究不断深入,世界需求量以每年5%的速度增长[2],而我国果胶的产量不足,年需求缺口达1 200 t,且呈上涨趋势[3],因此果胶资源的开发迫在眉睫。目前,商业果胶大多来源于柑橘皮和苹果渣。近年来其他植物来源果胶也受到关注,如柿子、柠檬皮、葵花籽等。猕猴桃皮渣果胶同样是果胶的良好来源,如苗壮等[4]以猕猴桃皮渣为原料,采用亚临界法提取果胶,果胶得率为11.4%;蒋治卫等[5]以红心猕猴桃果皮为原料,采用草酸铵法提取果胶,得率为13.0%。但是这些报道均集中于单一辅助提取技术研究,果胶得率不高。
传统的果胶提取采用热水提取法,该法耗时长、能耗高且效率低。近年出现超声波辅助提取技术,其利用强烈的空化效应快速破坏植物细胞,能缩短提取时间,提高提取效率,但其热效应不强,提取过程很难达到足够的提取温度。超声波-微波协同作用是将超声波的机械振荡和空化效应与微波的热效应结合,使反应过程中整个体系受热均匀,加速分子运动,促使分子间氢键更容易断裂,并能破坏大分子物质的共价键而促其降解,同时提高溶剂穿透力,加速提取的进程,其提取效率比单独用超声波或微波更高。另外,与传统酸法提取相比,超声波-微波辅助提取所得果胶中的蛋白质含量低,而半乳糖醛酸含量高,设备损耗成本低[6]。
目前,采用超声波-微波协同辅助酸法提取猕猴桃皮果胶的研究还未见报道。本研究以果胶得率为指标,利用超声波-微波协同辅助酸法提取猕猴桃皮中的果胶,在单因素试验基础上,采用Plackett-Burman试验及Box-Behnken响应面试验优化工艺参数以提高果胶得率,并对所得果胶的理化性质进行分析,为猕猴桃皮渣资源的高值化利用提供技术和理论支撑。
1 材料与方法
1.1 材料与试剂
猕猴桃皮,湖南周生堂生物科技有限公司;柠檬酸、苯酚、浓硫酸、酚酞、NaOH、无水乙醇,国药集团化学试剂有限公司;D-半乳糖醛酸、牛血清白蛋白、考马斯亮蓝、咔唑等,北京索莱宝科技有限公司;三氟乙酸、NaCl,比利时Acros公司;甘露糖、鼠李糖、半乳糖醛酸、半乳糖、葡萄糖、葡萄糖醛酸、阿拉伯糖、木糖、岩藻糖、盐酸氨基葡萄糖、N-乙酰-D-氨基葡萄糖、D-果糖、D-核糖、氨基半乳糖盐酸盐、L-古洛糖醛酸、D-甘露糖醛酸,Sigma-Aldrich公司。
1.2 仪器与设备
PHSJ-4A型pH计,上海雷磁精科有限公司;TG165型台式高速离心机,长沙平凡仪器仪表有限公司;JA2003型电子天平,上海舜宇恒平科学仪器有限公司;XH-300PE型超声波高压微波协同组合工作站,北京祥鹄科技发展有限公司;TENSOR 27型傅里叶红外光谱仪,德国Bruker公司;UV-2500型紫外分光光度仪、LC-10A型高效液相色谱仪,日本岛津有限公司;JSM-6700F型扫描电子显微镜,日本JEOL公司;ICS5000型离子色谱仪(IC),美国Thermo Fisher公司。
1.3 实验方法
1.3.1 猕猴桃皮渣粉制备方法
猕猴桃皮渣在沸水中漂烫5 min,使其中的果胶酶失活。在45 ℃烘箱中烘24 h,干燥后的皮渣粉碎后过80目筛,装入塑封袋,4 ℃下保存,备用。
1.3.2 猕猴桃皮渣果胶提取工艺
1.3.2.1 超声波-微波协同辅助酸法提取法
称取3.0 g猕猴桃皮渣粉,以不同pH的柠檬酸溶液为提取溶剂,按照设定参数在超声波高压微波协同组合工作站中提取果胶。提取完成后,提取液迅速冷却至室温,4 000 r/min离心10 min,抽滤上清液,收集滤液,加入2倍体积95%乙醇,4 ℃静置16 h,4 000 r/min离心10 min,收集沉淀。沉淀物用95%乙醇洗涤3次,去除单糖、双糖、低聚糖和色素等物质[7]。最后,将沉淀冻干至恒重,所得样品为猕猴桃皮果胶,果胶得率计算如公式(1)所示:
(1)
式中:m,果胶干燥品质量,g;m0,猕猴桃皮干粉质量,g。
1.3.2.2 传统热水提取法
按照NGUYEN等[8]的方法提取。取3.0 g猕猴桃皮渣粉,加入90 mL pH 2.0的柠檬酸溶液,85 ℃下连续搅拌提取30 min。提取完成的后续操作同1.3.2.1。
1.3.3 单因素试验
设定单因素试验中的常规量为:提取液pH 2.0,超声波功率150 W,微波功率250 W,提取时间30 min,提取温度85 ℃,液料比30∶1(mL∶g)。依次考察微波功率(50、100、150、200、250、300 W)、超声波功率(50、100、150、200、250、300 W)、液料比(20∶1、25∶1、30∶1、35∶1、40∶1、45∶1)、提取液pH(1.6、2.0、2.4、2.8、3.2、3.6)、提取时间(20、25、30、35、40、45 min)、提取温度(45、55、65、75、85、95 ℃)对果胶得率的影响。
1.3.4 Plackett-Burman 试验
根据单因素试验结果,设计N=12的Plackett-Burman试验对提取液pH、液料比、超声功率、微波功率、提取温度和提取时间等因素进行考查,筛选关键因素。
1.3.5 响应面优化试验
根据Plackett-Burman试验结果,对筛选出的关键因素进行Box-Behnken试验。
1.3.6 果胶半乳糖醛酸含量测定方法
采用咔唑比色法测定猕猴桃皮渣果胶中半乳糖醛酸含量[9]。
1.3.7 果胶总糖含量测定方法
采用苯酚-硫酸法测定猕猴桃皮渣果胶中总糖含量[10]。
1.3.8 果胶酯化度测定方法
采用滴定法测定果胶酯化度[11]。
1.3.9 果胶蛋白质含量测定方法
采用考马斯亮蓝法测定蛋白质含量[12]。
1.3.10 果胶分子质量测定方法
采用高效凝胶渗透色谱法测定果胶分子质量。色谱检测条件:RI-10A示差检测器;BRT105-104-102串联凝胶色谱柱(8 mm×300 mm);流动相0.05 mol/L NaCl溶液;流速0.6 mL/min;柱温40 ℃;进样量20 μL。果胶样品配制成5 mg/mL溶液,12 000 r/min离心10 min,上清液用0.22 μm微滤膜过滤后进样。
1.3.11 果胶单糖组成测定方法
称量10.0 mg样品置于安瓿瓶中,加入3 mol/L三氯乙酸10 mL,120 ℃水解3 h。吸取2 mL酸水解溶液转移至玻璃瓶中氮吹干,加入10 mL超纯水涡旋混匀,吸取100 μL加入900 μL去离子水,12 000 r/min离心5 min。取上清液进IC分析。色谱条件:色谱柱DionexCarbopacTMPA20(3 mm×150 mm);流动相A:H2O, B:15 mmol/L NaOH,C:15 mmol/L NaOH+100 mmol/L NaOAc;流速0.3 mL/min;进样量5 μL;柱温30 ℃;检测器:电化学检测器。
1.3.12 光谱分析
配制10 μg/mL的果胶溶液,取适量溶液于石英比色皿中,用紫外分光光度计进行扫描,扫描波长为200~400 nm,扫描频率为2 nm/s,得紫外光谱。
称量1.0 mg猕猴桃皮果胶样品和100.0 mg溴化钾,置于玛瑙研钵中混匀,研磨成细粉后制成透明压片,用傅里叶红外光谱仪进行扫描,扫描范围4 000~500 cm-1,分辨率为4 cm-1,累积扫描64次,得红外光谱。
1.3.13 电镜扫描
果胶样品经过粘台、喷金等步骤后,在加速电压为10 kV条件下用扫描电子显微镜进行观察。
1.4 数据处理方法
试验重复3次,结果表示为平均值±标准差。用Design-Expert 8.0.6 软件分析响应面试验结果,SPSS Statistics 22.0软件开展ANOVA多重比较(least significant difference,LSD),显著性水平为0.05,Origin 2019b软件作图。
2 结果与分析
2.1 单因素试验结果
如图1显示,随微波功率增大,果胶得率先升高后降低,在微波功率200 W时,达到最大值28.63%。这是因为当微波功率较小时,热效应较弱,导致原料内部的温度过低,不利于果胶的溶出和扩散。当微波功率过大时,导致细胞内部温度过高,使果胶分子链降解,从而使果胶得率下降[13]。在微波功率150 与200 W及200 与400 W之间,果胶得率差异显著(P<0.05),在其他水平之间,差异不显著(P>0.05)。

a-微波功率;b-超声波功率;c-液料比;d-提取液pH;e-提取时间;f-提取温度图1 不同因素对果胶得率的影响Fig.1 The effects of different factors on the yield of pectin
随超声功率增大,果胶得率先升高后降低,在超声功率为250 W时,达到最大值29.08%。这是由于超声波功率增大,空化作用增强,使细胞内容物更加充分析出,但超声波功率过大,导致果胶因分子链断裂而降解[14]。在超声波功率50 与150、200、250 及200、250 与300 W之间,果胶得率差异显著(P<0.05),在其他水平之间,差异不显著(P>0.05)。
随液料比提高,果胶得率先升高后降低,之后基本无变化。在液料比为30∶1时,达到最大值31.48%。这是因为溶剂量少时,提取液黏度较大且浓度梯度小,果胶分子扩散慢;而溶剂量过大时,提取出的果胶在溶液中浓度太低,沉淀效果不理想,导致果胶得率降低[15]。在液料比20∶1、30∶1之间及它们与其他水平之间,果胶得率差异显著(P<0.05),在其他水平之间,差异不显著(P>0.05)。
随提取液pH升高,果胶得率降低,pH 1.6时果胶得率达到最大,为31.60%。这是由于酸度增强有利于原果胶的水解,使更多的原果胶转化为水溶性果胶,因此提高了果胶的得率[16]。pH升高时由于酸性减小,断裂的a-1, 4-糖苷键较少,一部分果胶分子较大,不易溶解于水中,所以pH升高时果胶的得率下降[16]。在pH 2.8与3.2之间果胶得率差异不显著(P>0.05),其他水平之间均差异显著(P<0.05)。
随提取时间延长,果胶得率先升高后降低,在提取时间为35 min时达到最大值33.93%。这是由于提取体系中积累的热量逐渐增加,为原果胶的水解提供了更多的能量,原果胶中化学键断裂,溶解于水中[17],因此果胶的得率增加。随着提取时间进一步延长,由于果胶大分子结构被过度破坏,使提取液中的果胶不能在乙醇溶液中析出,部分果胶被过滤掉,使果胶得率降低[18]。在提取时间40与45 min之间果胶得率差异不显著(P>0.05),其他水平之间均差异显著(P<0.05)。
随提取温度升高,果胶得率增大,当提取温度上升至95 ℃时,果胶得率达到最大值34.00%。当浸提温度低时,原果胶水解不彻底,不利于水溶性果胶的提取。温度升高后,分子热运动加剧,同时柠檬酸的解离程度也增强,氢离子浓度增加,细胞壁和表皮组织更加松弛,使得提取液与原料间的物质交换加快,而果胶不会在此温度范围内降解,因此得率增大[19]。在提取温度65与75 ℃之间果胶得率差异不显著(P>0.05),其他水平之间均差异显著(P<0.05)。
2.2 Plackett-Burman试验结果
Plackett-Burman试验结果见表1,其方差分析结果见表2。

表1 Plackett-Burman试验结果Table 1 The results of the Plackett-Burman experiment

表2 Plackett-Burman试验各因素效应评价Table 2 The effect evaluation of the factors of Plackett-Burman experiment
由表2可知,提取液pH、提取温度、微波功率对果胶得率的影响均达到显著水平(P<0.05),根据P值大小,可知重要性依次为:提取温度(b)>提取液pH(a)>微波功率(f)。故选择提取液pH、提取温度和微波功率开展下一步的响应面优化试验。考虑到提取效率与节约成本,在响应面优化试验中将液料比、超声功率、提取时间分别固定为30∶1,250 W、35 min。
2.3 Box-Behnken响应面试验结果


表3 Box-Behnken响应面试验结果Table 3 The results of the Box-Behnken experiment

表4 回归模型方差分析结果Table 4 The results of variance analysis of response surface quadratic model
运用 Design-Expert 8.0.6 软件由模型分析得出,超声波-微波协同辅助酸法提取猕猴桃皮果胶的最优工艺参数为:提取液pH 1.73,提取温度91.17 ℃,微波功率214.35 W。此条件下的果胶得率理论值可达35.23%。为了在实际中具有可操作性,将最优工艺参数确定为:提取液pH 1.7、提取温度91 ℃、微波功率215 W。根据修正后的最优工艺进行3次验证试验,果胶得率为34.88%,与预测值十分接近,表明响应面法优化提取工艺可行。参照NGUYEN等[8]的传统热水提取法,得到猕猴桃皮果胶提取率为6.87%,该值远低于本研究所采用超声波-微波协同辅助酸法提取工艺的果胶得率。
各因素之间的交互作用对响应值的影响见图2。响应面曲面坡度越陡峭,等高线图越偏椭圆形,因素之间交互作用越显著,反之则表示两因素间的交互作用不显著。图2显示,3D响应面图均成抛物状,曲面有最高点,容易出现最大值。AB的响应面曲线最陡,且等高线密集,因此AB的交互作用对果胶得率的影响最为显著。交互作用对果胶得率的影响大小顺序为:AB>BC>AC。

图2 两因素间交互作用响应面图Fig.2 The response surface plots of interaction between two factors
2.4 果胶的基本化学组成及酯化度
如表5所示,果胶的主要化学成分为半乳糖醛酸,其含量可以反映果胶的纯度,经测定,猕猴桃皮渣果胶的半乳糖醛酸含量为67.85%,符合GB 25533—2010《食品添加剂果胶》要求(半乳糖醛酸含量>65%),说明本实验果胶已达到商品果胶纯度的要求。总糖含量为60.83%,蛋白质含量为1.78%,酯化度为54.5%,为高酯果胶。

表5 猕猴桃皮渣果胶基本化学组成及酯化度 单位:%Table 5 The basic chemical composition and the degree of esterification of pectin from kiwifruit peel
2.5 分子质量测定
图3显示,猕猴桃皮果胶多糖的主要洗脱峰单一且较对称,说明果胶纯度较高,通过线性回归方程计算,其重均分子质量Mw为741.8 kDa,数均分子质量Mn为410.3 kDa,峰值分子质量Mp为503.8 kDa,分子量分布系数Mw/Mn为 1.81。苗壮等[4]用亚临界水提取法从猕猴桃皮与果渣中得到的果胶分子质量Mw为88.4 kDa。顾晓俊等[20]测定猕猴桃果的果胶分子质量Mw最高为524.31 kDa。与两者相比,本研究得到的果胶分子质量较大,可能是果胶来源部位不同所致。
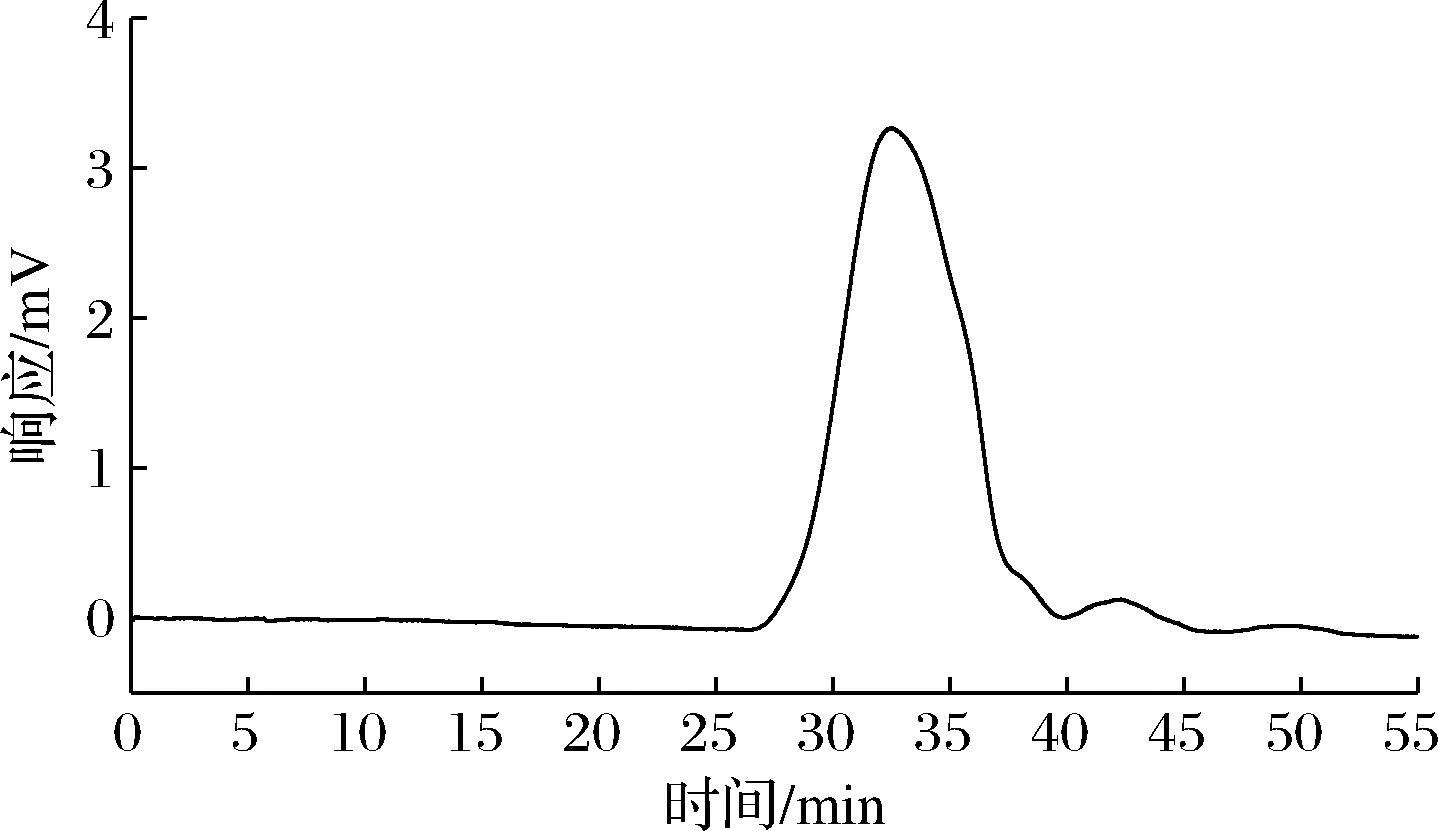
图3 猕猴桃皮渣果胶分子质量色谱图Fig.3 The chromatogram of molecular weight of pectin from kiwifruit peel
2.6 单糖组成测定
图4显示,猕猴桃皮渣果胶中含有鼠李糖、阿拉伯糖、半乳糖、葡萄糖、半乳糖醛酸等5种单糖。各单糖摩尔百分含量为:鼠李糖4.2%,阿拉伯糖18.2%,半乳糖13.6%,葡萄糖5.5%,半乳糖醛酸58.5%。与苗壮等[4]采用亚临界水提取猕猴桃皮渣中果胶相比,本研究果胶的单糖种类基本相同,但前者阿拉伯糖所占比例较高。

1-岩藻糖;2-盐酸氨基半乳糖;3-鼠李糖;4-阿拉伯糖;5-盐酸氨基葡萄糖;6-半乳糖;7-葡萄糖;8-N-乙酰-D氨基葡萄糖;9-木糖;10-甘露糖;11-果糖;12-核糖;13-半乳糖醛酸;14-古罗糖醛酸;15-葡萄糖醛酸;16-甘露糖醛酸a-16种单糖混合标准品;b-果胶水解物单糖组成图4 猕猴桃皮渣果胶的单糖组成色谱图Fig.4 The chromatogram of monosaccharide composition of pectin from kiwifruit peel
根据分子主链和支链结构的不同,果胶分子可分为4类:同型半乳糖醛酸聚糖(homogalacturonan,HG)、鼠李半乳糖醛酸聚糖Ⅰ(rhamngalacturonan Ⅰ,RG-Ⅰ)、鼠李半乳糖醛酸聚糖Ⅱ(rhamngalacturonan Ⅱ,RG-Ⅱ)和木糖半乳糖醛酸聚糖(xylogalacturonan,XG)[21]。SCHOLS等[22]曾提出,当果胶分子的Rha/GalA值在0.05~1.00时,其结构主要为RG-Ⅰ型;当比值低于0.05时,结构主要为HG和RG-Ⅱ型。此果胶Rha/GalA的比值为0.072,因此可推断本研究所得猕猴桃皮果胶多糖以RG-Ⅰ型结构域为主。马媛媛[23]研究3种不同品种的猕猴桃果实的果胶组分,发现其Rha/GalA值范围在0.002~0.04,结构以HG和RG-Ⅱ型为主。说明猕猴桃果实与皮的果胶结构存在差异。FERREIRA等[24]提出,根据(Gal+Ara)/Rha值可估计RG-I型果胶分子结构的侧链长度,其值越大,表明通过鼠李糖连接到RG-I主链上的侧链越长。本研究所得猕猴桃皮果胶的(Gal+Ara)/Rha为7.51,而马媛媛[23]研究中的(Gal+Ara)/Rha值在7.07~14.17,因此推断猕猴桃皮果胶中通过鼠李糖连接到RG-I主链上的侧链较果实果胶的短。
2.7 果胶光谱分析
2.7.1 紫外光谱
图5为猕猴桃皮渣果胶溶液在200~400 nm紫外波长范围的吸收曲线。可看出,果胶溶液在280 nm处有吸收峰,215、260 nm处无吸收峰,表明果胶样品含有少量蛋白质,但不含核酸、多肽。

图5 猕猴桃皮渣果胶紫外光谱Fig.5 The UV spectra of pectin from kiwifruit peel
2.7.2 傅里叶红外光谱特征


图6 猕猴桃皮渣果胶的傅里叶红外光谱图Fig.6 The FT-IR spectroscopy of pectin from kiwifruit peel
2.8 果胶电镜扫描观察结果
如图7所示,放大1 000倍条件下,果胶表面呈现凹凸不平形貌特征,并且表面有大小均一的颗粒状微球存在,故果胶在乙醇溶液中可能是以微球颗粒的形态沉淀出来。当放大10 000倍时,可以更加明显看出果胶表面结构致密,由大量颗粒状微球组成,且微球直径约为0.2 μm。

a-×1 000;b-×10 000图7 猕猴桃皮渣果胶的电子扫描显微图像Fig.7 The scanning electron microscopy images of pectin from kiwifruit peel
3 结论
本文优化了超声波-微波辅助酸法提取猕猴桃皮渣中果胶的工艺参数,并分析所得果胶样品的理化性质。优化得到的工艺参数为:提取液pH 1.7、提取温度91 ℃、微波功率215 W、超声波功率250 W、提取时间35 min、液料比30∶1。在此工艺条件下,果胶得率实际值为34.88%。相比其他方法,超声波-微波辅助酸法提取的果胶得率有显著的提升。所得果胶的总糖含量为60.83%,蛋白质含量为1.78%,酯化度为54.53%,半乳糖醛酸含量为67.85%,重均分子质量(Mw)为741.78 kDa,单糖组成及其摩尔百分比为鼠李糖4.2%、阿拉伯糖18.2%、半乳糖13.6%、葡萄糖5.5%、半乳糖醛酸58.5%。猕猴桃皮渣果胶分子以RG-I结构域为主。电镜扫描显示果胶表面粗糙,由结构紧致的微球颗粒构成。紫外与红外光谱分析显示,猕猴桃皮渣果胶符合果胶特征。本研究所采用的技术节能、高效,对环境友好,研究结果可为猕猴桃皮渣资源的高值化利用提供技术和理论支撑。本研究尚需进一步开展果胶的乳化、胶凝等功能特性及应用研究。

