离子液体预处理/硫酸水解协同制备纳米纤维素及其稳定Pickering乳液初步研究
张书敏,刘玥,刘洪龙,张宇昊,陈媛,余永,戴宏杰*
1(西南大学 食品科学学院,重庆,400715)2(食品科学与工程国家级实验教学示范中心(西南大学),重庆,400715)
纳米纤维素(nanocellulose,NC)是指一维尺度上具有纳米尺寸(<100 nm)的纤维素材料,具有高比表面积、高长径比、低热膨胀系数、高机械强度、易修饰、无毒性、可降解等优异特性,在食品领域如乳液稳定剂、包装膜、食品调节剂、凝胶和载体材料等方面受到广泛关注[1-2]。根据纤维素来源、形貌和制备方法,纳米纤维素可分为细菌纳米纤维素(bacterial nanocellulose, BNC)、纤维素纳米晶体(cellulose nanocrystals, CNC)和纤维素纳米纤丝(cellulose nanofibrils, CNF)[3]。目前制备CNC的方法主要是酸水解法,此外氧化法、酶解法的研究也较多;而制备CNF的方法主要是机械法(如球磨、超声和高压均质等)[4-5]。其中通过无机酸水解(主要包括硫酸、磷酸和盐酸)是制备CNC的最常用方法,获得的CNC具有较好的稳定性且尺寸相对均一,但在制备过程中存在酸溶液浓度过高(如常用的硫酸质量分数64%,磷酸质量分数85%和盐酸质量分数37%)的问题,不仅生产成本高,且易产生工业废水污染环境并对机器造成耗损腐蚀;此外,酸水解法制备CNC还存在得率较低的缺点[6]。而机械法制备CNF耗时较长,能耗高,机器磨碎严重且易堵塞或升温,同时获得的纳米纤维素形貌均一性较差[7]。因此,研究纳米纤维素的高效稳定制备方法具有重要意义。
离子液体是指在室温或接近室温下呈现液态的、完全由阴阳离子所组成的盐类物质,具有出色的溶解能力、高热稳定性、可回收性及低毒性等特性,是纤维素溶解和加工的“绿色溶剂”[8-9]。MAO等[10]采用酸性离子液体1-丁基-3-甲基咪唑硫酸氢盐([Bmim][HSO4])在120 ℃条件下处理微晶纤维素(microcrystalline cellulose,MCC)制备得到CNC。本课题组前期研究发现,以离子液体1-丁基-3-甲基咪唑氯化物([BMIM]Cl)为球磨介质和柠檬籽纤维素为原料,可制备CNF,同时球磨介质中的[BMIM]Cl含量能够调控纳米纤维素结构[7]。有研究表明,通过离子液体对纤维原料进行预处理,可以削弱原纤维素内部的氢键并破坏其内部结构,增加纤维素分子的反应可及性[11]。因此,对于酸水解制备纳米纤维素而言,过高的酸浓度是产品工业化生产的主要瓶颈。通过离子液体预处理,提高其在较低浓度硫酸溶液中的水解程度,进一步促进纳米化效率和提高产品得率具有一定的可行性和巨大潜力。
相较于表面活性稳定的传统乳液,固体颗粒稳定的Pickering乳液由于固体颗粒在界面处的不可逆吸附而具有高稳定性(抗奥氏熟化)、界面和结构可调控等特点,在食品领域受到广泛关注[5]。作为最广泛的生物质资源,纳米纤维素具有良好的生物相容性、两亲性和独特的纳米结构,在构建食品级Pickering乳液中具有极大潜力,如脂肪替代物、3D打印食品和营养载体等方面的应用[12-13]。基于以上研究背景,本研究以MCC为原料,采用离子液体预处理/硫酸水解协同制备纳米纤维素,考察不同质量分数硫酸溶液对纳米纤维素结构的影响,同时探究其在稳定Pickering乳液方面的潜力。
1 材料与方法
1.1 材料及试剂
微晶纤维素,上海源叶生物科技有限公司;葵花籽油,佳格投资有限公司;1-丁基-3-甲基咪唑氯盐、[Bmim]Cl)离子液体、中科院兰州化学物理研究所;NaCl,重庆川东化工有限公司;H2SO4、HCl、NaOH,成都市科隆化学品有限公司。所有试剂均为分析纯。
1.2 仪器与设备
XHF-DY高速分散器、JY 92-IIN超声波细胞粉碎机,宁波新芝生物科技股份有限公司;BX53立式显微镜,日本OLYMPUS公司;PE 20实验室酸度计,上海梅特勒-托利多仪器有限公司;Heraeus Multifuge X3R台式高速冷冻离心机,美国赛默飞世尔科技公司;FD-1-50冷冻干燥机,北京博医康实验仪器有限公司;Spectrun 100红外光谱仪,美国铂金埃尔默股份有限公司;ZEN3690纳米粒度及Zeta电位分析仪,英国马尔文公司;Nano Man VS原子力显微镜,美国Bruker公司;X’Pert3 Powder10300 X射线衍射仪,荷兰帕纳特仪器有限公司;TGA550热重分析仪,美国TA公司。
1.3 纳米纤维素的制备
取2 g MCC和60 g离子液体[BMIM]Cl进行混合,置于90 ℃的油浴锅中搅拌2 h进行预处理,然后加入60 mL不同质量分数的硫酸(10%、20%、30%和40%),超声破碎均匀后,再置于90 ℃的油浴锅中继续水解3 h,然后加入5倍体积蒸馏水终止反应,用蒸馏水多次离心(5 000 r/min,5 min)洗涤以除去残留的酸液和离子液体,收集悬浮液超声(300 W,10 min)并在蒸馏水中透析72 h(4 ℃),获得纳米纤维素悬浮液并测定其得率,部分样品冷冻干燥用于结构表征。根据制备过程中使用的硫酸溶液质量分数分别命名纳米纤维素为NC10%、NC20%、NC30%和NC40%。
1.4 结构表征
1.4.1 Zeta电位测定
准确配制质量浓度为1 g/L的纳米纤维素悬浮液,采用马尔文仪器测定其Zeta电位值。测定温度为室温,每个样品重复测定3次。
1.4.2 原子力显微镜(atomic force microscope,AFM)
将纳米纤维素悬浮液(0.2 g/L)滴在新鲜剥离的云母片上,室温干燥2 h后通过原子力显微镜观察其形貌。用Nano measure1.2软件进行纳米纤维素样品长度和直径的测量。
1.4.3 傅立叶转换红外光谱(Fourier transform infrared spectroscopy,FT-IR)
将干燥的样品和溴化钾按质量比1∶70研磨混合均匀后进行压片,用红外光谱仪对其进行红外光谱分析,测量的波长为4 000~400 cm-1。
1.4.4 X射线衍射(X-ray diffraction,XRD)
采用X射线衍射仪表征微晶纤维素和纳米纤维素的结晶结构。扫描范围为10°~50°,扫描速度0.02 °/s。其中,纤维素Ⅰ型和Ⅱ型晶体结构的比例计算如公式(1)所示[14]:
(1)
式中:I22.7为2θ=22.7°衍射峰强度;I20.4为2θ=20.4°衍射峰强度。
1.4.5 热失重分析(thermogravimetric analysis,TGA)
通过热重分析仪对样品进行热失重分析,实验中选取的测试温度为20~500 ℃,升温速度为10 ℃/min,气体环境N2,气流速度为20 mL/min。
1.5 纳米纤维素稳定Pickering乳液研究
1.5.1 Pickering乳液的制备
取一定体积的纳米纤维素溶液于10 mL离心管中,然后加入一定量的葵花籽油,用高速分散器在9 000 r/min下均质1 min得到新鲜乳液,密封放置于4 ℃冰箱备用。考察乳液制备过程中纳米纤维素质量浓度(1.0~5.0 g/L)和油相体积分数(30%~70%)以及乳液不同储藏时间(1和7 d)对乳液微观结构的影响。
1.5.2 乳液微观结构观察
采用光学显微镜观察。吸取20 μL的乳液样品于干净载玻片上,轻盖盖玻片,防止液滴破裂,在10倍镜下观察乳液液滴大小。
2 结果与分析
2.1 纳米纤维素得率和稳定性
如图1所示,通过离子液体预处理/硫酸水解制备纳米纤维素时,其得率随硫酸溶液质量分数的增加而逐渐降低,但仍能达到30%以上,高于常规酸水解法。硫酸质量分数的增加导致氢离子的浓度增加,使得无定型区的氢键破坏,无定型区纤维素水解生成水溶性糖类物质[15-16]。纳米纤维素悬浮液(2 g/L)在室温下静置1 h后,NC10%和NC20%出现明显分层,而NC30%和NC40%则保持较好的静置稳定性,无分层现象发生。一般来说,当电位绝对值趋于25 mV时,粒子之间静电作用力增强,纳米纤维素悬浮液趋于稳定[17]。Zeta电位分析结果表明NC30%和NC40%电位绝对值均接近30 mV,而NC10%和NC20%电位绝对值相对较低(<20 mV)。这是由于硫酸溶液质量分数的增加有利于硫酸与纤维分子中的羟基酯化形成酯基,从而增加纳米纤维素悬浮液的电位绝对值,进而提高纳米纤维素的稳定性和分散性,最终导致纳米纤维素悬浮液体系越来越稳定。当前研究表明,通过离子液体预处理,在相对较低的硫酸质量分数(<64%)下也能获得稳定的纳米纤维素悬浮液,其得率高于常规酸水解法。

图1 纳米纤维素悬浮液的静置稳定性、Zeta电位和得率Fig.1 The static stability, Zeta potential and yield of the obtained nanocellulose suspension
2.2 AFM分析
由图2可以看出,随着硫酸溶液质量分数的增加,纳米纤维素的形态发生明显变化。NC10%呈现纤丝状网络结构,其直径和长度分别为(18±8) nm和(1 500±246) nm;NC20%仍呈现一定程度的相互缠结网络结构,其直径增加至(23±7) nm,长度减少至(680±85) nm;但NC30%形貌发生明显变化,呈现短纤丝结构,网络结构明显减弱,其直径继续增加至(35±10) nm,长度减少至(280±55) nm;继续增加硫酸溶液质量分数至40%时,获得的NC40%呈短棒状,其直径和长度分别为(50±8)和(150±25) nm。总体上,随着硫酸溶液质量分数的增加,纳米纤维素形态从长纤丝状结构变为短棒状结构且直径逐渐增加。在离子液体预处理/硫酸水解协同制备纳米纤维素过程中,调节硫酸溶液浓度能够调控纳米纤维素的形态结构,这对纳米纤维素的应用具有重要意义。

图2 纳米纤维素的AFM图Fig.2 AFM images of the obtained nanocellulose
2.3 XRD分析
图3为MCC和纳米纤维素的XRD图谱。MCC在2θ=15.01、22.57、34.61 °处出现明显的衍射峰,分别对应纤维素(1-10)/(110)、(002)和(004)晶面,属于纤维素Ⅰ型晶体结构的特征衍射峰[18]。经过离子液体预处理/硫酸水解后,制备的纳米纤维素晶体结构发生明显变化,属于(002)晶面的衍射峰强度明显降低,但2θ=20.28°处属于(110)晶面的衍射峰强度明显增加,表明纳米纤维素的无定型结构增加。此外,纳米纤维素在2θ=12.37°出现一个新的衍射峰,属于纤维素I和II型晶体结构共存衍射吸收峰,表明存在I型向纤维素Ⅱ型晶体结构的转变现象[16,19-20]。MCC中纤维素Ⅰ型与Ⅱ型晶体结构的比例为2.22,随硫酸溶液浓度增加,纳米纤维素的纤维素Ⅰ型与Ⅱ型晶体结构的比例为0.81~0.91。这主要是由于离子液体预处理能够破坏MCC之间的氢键作用,导致纤维素原有晶体结构的破坏和转变,纤维素II型晶体结构增加;而硫酸溶液浓度增加导致纤维素无定型区水解增加,进而Ⅰ型晶体结构相对增加[21]。

图3 MCC和纳米纤维素的XRD图谱Fig.3 XRD patterns of MCC and the prepared nanocelluloses
2.4 FT-IR分析
图4为MCC和纳米纤维素的FT-IR图谱。由图4可以看出,MCC和制备的纳米纤维素在3 400 cm-1左右处均存在纤维素中O—H的伸缩振动吸收峰,但是纳米纤维素中O—H吸收峰强度较MCC相对降低,这是由于离子液体预处理过程中纤维素氢键结构部分断裂[22]。此外,在2 904和1 429 cm-1处分别为C—H的伸缩振动和弯曲振动峰,1 635 cm-1处的吸收峰与吸收水的O—H基团弯曲振动有关,1 065 cm-1处为吡喃糖环中的C—O—C伸缩振动吸收峰,895 cm-1处为β-糖苷键的特征吸收峰。以上特征峰在所有纳米纤维素中都存在,表明离子液体预处理/硫酸水解制备纳米纤维素过程没有破坏纤维素的结构[23]。此外,制备的纳米纤维素在2 904、1 635、1 429 cm-1处的峰强度均明显低于MCC,说明尽管纤维素的分子结构没有发生改变,但是晶体结构和氢键遭到破坏,这与XRD分析结果一致。

图4 MCC和纳米纤维素的FT-IR图谱Fig.4 FT-IR spectra of MCC and the prepared nanocelluloses
2.5 热稳定性分析
图5为MCC和制备的纳米纤维素的TG和DTG曲线。所有样品在100 ℃以下出现轻微的重量损失,这是样品中吸附水或结合水的质量损失造成的[21]。在200~400 ℃所有样品均出现了大量的质量损失,这与纤维素自身受热分解有关,对应DTG曲线上280~350 ℃出现的最大降解峰。继续升高温度,在400 ℃以上的质量损失是纤维素的进一步高温碳化造成的。MCC的初始降解和最大降解温度分别为294、333 ℃,NC10%、NC20%、NC30%和NC40%的初始分解温度分别为262、260、257、251 ℃,最大降解温度分别为321、310、310和300 ℃,其初始分解温度和最大降解温度均随硫酸溶液质量分数的增加而降低,且均低于MCC,这是由于离子液体预处理后增加酸质量分数将降低纳米纤维素聚合度和结晶度,同时增加无定形区酯化度造成的[24]。当温度达到500 ℃时,MCC的残余量为6.60%,而随硫酸溶液质量分数增加纳米纤维素残余质量明显增加(10.24%~12.53%)。硫酸溶液质量分数的增加导致纳米纤维素中磺酸基团逐渐增加,其具有阻燃作用,导致高温后纳米纤维素残余质量增加[25]。
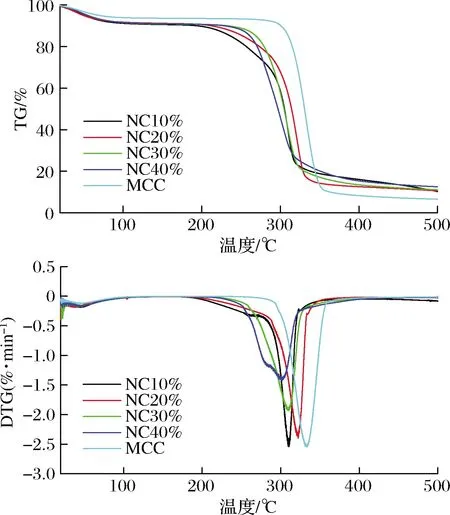
图5 MCC和纳米纤维素的TG和DTG曲线Fig.5 TG and DTG curves of MCC and the prepared nanocelluloses
2.6 稳定Pickering乳液性能分析
2.6.1 不同纳米纤维素浓度下稳定的Pickering乳液
图6为固定油相体积分数为40%,不同纳米纤维素质量分数稳定的Pickering乳液在4 ℃下储存1和7 d后的光学显微镜图片。对于NC20%、NC30%和NC40%,随着纳米纤维素质量分数逐渐增加,所制备乳液的粒径逐渐减小。这主要是因为固体颗粒质量分数的增加导致更多颗粒可以吸附到油滴表面,形成紧密的网状层和界面膜结构,有效防止了乳滴之间聚集现象,最终形成较小尺寸的乳滴,也降低了发生奥氏熟化的几率[26]。乳液放置1周后,乳液液滴尺寸变化较小,表明当前制备的乳液具有较好的储存稳定性。这主要是由于纳米纤维素稳定的乳滴之间的静电作用和空间排斥作用,使其具有良好的稳定性[27]。但是NC10%在1 g/L时形成的乳液出现很多细小液滴,储藏1周后细小液滴减少且乳液液滴不明显,这可能是NC10%在油滴表面的吸附程度较弱,此时液滴之间的空间排斥作用较低,导致其不能形成稳定的界面层造成的;此外,NC10%在3~5 g/L下稳定的乳液,粒径也相对较大。相比NC10%,NC20%、NC30%和NC40%稳定的乳液具有更好的储藏稳定性和更小的乳液粒径,这可能是更高的硫酸质量分数导致纳米纤维素具有更好的悬浮稳定性和适宜的尺寸造成的,其更有利于颗粒吸附和乳液界面稳定[28]。总体来看,NC40%在不同质量分数下均具有最小的乳液粒径,稳定乳液效果较好。

图6 不同纳米纤维素浓度下稳定的Pickering乳液的光镜图片Fig.6 Optical images of Pickering emulsions stabilized by the prepared nanocelluloses with different concentrations
2.6.2 不同油相质量分数下纳米纤维素稳定的Pickering乳液
图7是固定纳米纤维素质量浓度为5 g/L,在不同油相体积分数(30%~70%)下制备的Pickering乳液在4 ℃下储存1和7 d后的光学显微镜图片。随着油相比例的增加,所有乳液的粒径逐渐增加,但均保持较好的油滴形状,说明制备的纳米纤维素在质量浓度5 g/L下能稳定较高油相比例的乳液。随着油相比例的增加,此时连续相中的纳米纤维素不足以稳定大量的油滴,此时通过增加液滴的碰撞频率,以达到减少界面总面积从而维持稳定,减少液滴凝聚的可能,最终形成较大尺寸的乳液液滴[29]。对比不同纳米纤维素稳定的乳液,NC10%稳定的乳液液滴尺寸相对较大,尤其是在高油相比例下(>60%);而NC20%、NC30%和NC40%稳定的乳液随油相体积分数增加(30%~70%),其乳液粒径也逐渐增加,但均小于NC10%。所有乳液在贮藏7 d后液滴保持完整,具有较好的储藏稳定性。而NC40%稳定的乳液的粒径仅在高油相下(>60%)增大,具有更好的乳化性能和乳液稳定性。

图7 不同油相浓度下纳米纤维素稳定的Pickering乳液的光镜图片Fig.7 Optical images of Pickering emulsions stabilized by the prepared nanocelluloses with different oil phase ratio
3 结论
本研究以MCC为原料,采用离子液体预处理/硫酸水解协同制备纳米纤维素。研究发现调节硫酸溶液质量分数能够对纳米纤维素结构进行调控,包括电位值、形貌、晶体结构和热稳定性。随着硫酸溶液质量分数增加(10%~40%),纳米纤维素从长纤丝状结构变为短棒状结构,晶体结构发生变化;其初始分解温度和最大分解温度均降低,但高温残余量较高,具有较好的阻燃性能。当前制备的纳米纤维素均能有效稳定Pickering乳液,且随着硫酸溶液质量分数的增加,制备的纳米纤维素在不同颗粒质量分数和不同油相比例下稳定乳液性能提升,乳液粒径逐渐降低且乳液储藏稳定性增加。本研究提供了一种有效制备纳米纤维素基Pickering稳定剂的方法,可降低传统酸水解制备纳米纤维素的酸质量分数并提高产品得率。后续研究应重点探究纳米纤维素在油水界面的分布和环境条件对乳液稳定性的影响,揭示其稳定Pickering乳液机制。

