分子质量和极性对菜籽多肽包封β-胡萝卜素的影响研究
袁富欢,蓝妙传,付余,戴宏杰,朱瀚昆,冯鑫,张宇昊,2*
1(西南大学 食品科学学院,重庆,400715)2(西南大学 生物学研究中心,重庆,400715)
油菜是重要的油料作物,主要分布在加拿大、印度、中国,在国内种植面积超过亿亩,种植面积在主要油料作物中位居第2[1]。据统计,2018年度我国菜籽油的消费量约742.1万 t,占全球菜籽油消费量25.9%[2]。菜籽粕为油菜籽榨油后的主要加工副产物,富含菜籽蛋白,粗蛋白含量为35%~45%,营养价值较高,具有较高的市场价值和潜力。但是,菜籽粕中含有的一系列“抗营养化合物”,降低了其利用价值。为提高菜籽粕的生物利用率和油菜籽副产物的价值,可将菜籽粕进行酶解得到菜籽多肽(rapeseed peptides,RPs)。通常,RPs可由菜籽粕经酶法水解、化学法和固态发酵[3]等方法制得。由于酶法水解的条件温和,对蛋白质营养价值破坏较小以及利于小分子活性肽的产生[4],被广泛应用于食品领域中RPs的制备。
β-胡萝卜素是广泛存在于自然界中的天然色素,其能降低心血管疾病、皮肤病、癌症和眼病等的风险[5]。由于β-胡萝卜素属于脂溶性物质,人体直接摄入通常会造成吸收性差,生物利用率低等不良影响。既往研究表明,蛋白或多肽可作为有效的包封载体,进而提高β-胡萝卜素的稳定性和生物可及性[6]。ZHANG等[7]研究表明乳清蛋白原纤维是一种有效的脂溶性活性化合物的递送系统,并且能显著增加β-胡萝卜素的包封效率和保护作用。因此,利用RPs对β-胡萝卜素进行包封具有一定理论依据。
在生物活性成分的包封过程中,包封载体的理化性质(如分子质量、两亲性、pH、温度)都会对包封效果造成影响,其中分子质量和两亲性的影响最为显著。包封载体的分子质量会影响包封结构的形态以及生物活性成分的保留、保护和释放。STLOUKAL等[8]研究表明与低分子质量的包封载体相比,高分子质量可以形成粒径更小且均匀的颗粒,有较高的包封率,在水中的分散性较好。此外,包封载体的极性会影响其亲疏水性,进而影响生物活性成分的相互作用,从而影响包封效果。MOHAN等[9]探究了乳清肽的疏水性对大豆卵磷脂脂质体包封的潜在影响,研究表明,与未分离的肽水解物相比,疏水肽的包封率显著更高,并且形成的颗粒粒径也较小且均匀。因此,基于包封材料结构特性,对包封材料进行分离纯化,可对具有良好包封能力的材料进行富集,从而能更好地制备包封复合物[10],这对RPs包封β-胡萝卜素具有十分重要的意义。
因此,本研究以碱性蛋白酶酶解后的RPs为原料,探究了超滤和极性分离纯化处理(乙醇、乙腈、异丙醇)对RPs包封能力的影响。通过测定表面疏水性(S0)、接触角、包封率、负载量确立最佳的分子质量和极性溶剂,然后将最佳分子质量和极性溶剂联合处理后的RPs进行傅里叶红外光谱(Fourier transform infrared spectroscopy,FTIR)、透射电镜(transmission electron microscope,TEM)和激光共聚焦(laser scanning confocal microscopy,CLSM)等结构表征,以期为不同分子质量和极性的多肽包封β-胡萝卜素提供理论依据。
1 材料与方法
1.1 材料与试剂
菜籽粕,西南大学农学与生物技术学院;β-胡萝卜素,北京索拉宝生物科技有限公司;碱性蛋白酶Alcalase 2.4 L,诺维信公司(丹麦);乙醇,重庆市川东化工有限公司;乙腈、异丙醇、NaOH、二甲基亚砜(dimethyl sulfoxide,DMSO)、正己烷,成都科隆化学品有限公司试剂厂;人血清白蛋白(human serum albumin,HSA)、8-苯胺基-1-萘磺酸盐(8-aniline-1-naphthalene sulfonate,ANS),Sigma;源自牛心脏的细胞色素C,上海阿拉丁生化技术有限公司;Gly-Gly-Tyr-Arg,上海源叶生物技术有限公司;其余试剂均为分析纯。另外,实验用水均为通过Milli-Q系统(美国密理博公司)的纯水。
1.2 仪器与设备
BNGM2097有机膜分离实验机,济南博纳生物技术有限公司;XD-52AA旋转蒸发器,上海贤德实验仪器有限公司;DSA100接触角测量仪,德国Kruss公司;PE20实验室pH计,上海梅特勒-托利多仪器有限公司;Heraeus Multifuge X3R高速冷冻离心机,美国赛默飞世尔科技公司;BSA124S-CW电子天平,德国赛多利斯生物技术公司;CJ-78-1磁力搅拌器,上海将任实验设备有限公司;Spectrun100 FTIR仪,美国PerkinElmer公司;HT7800透射电镜,日本日立仪器有限公司;HH-4数显恒温搅拌水浴锅,上海新诺仪器设备有限公司;FD-1-50真空冷冻干燥机,北京博医康实验仪器有限公司。
1.3 RPs的制备
菜籽粕打粉后过100目筛,以料液比1∶25(g∶mL)将其分散在纯水中,在碱性蛋白酶Alcalase 2.4 L的最佳反应温度下(55 ℃)预孵育10 min。用1 mol/L NaOH溶液将菜籽粕溶液调至碱性蛋白酶最佳pH 8.5,将酶加入菜籽粕溶液中(酶与底物体积比为1∶100),在酶解过程中使用0.5 mol/L的NaOH溶液将pH稳定在8.5,水解60 min后得到菜籽粕酶解液,置于沸水中15 min以终止酶解反应。冷却至室温后,将酶解液在5 000 r/min下离心10 min,上清液过0.22 μm的水相膜,冻干后获得RPs干粉。
1.4 基于分子质量差异多肽的分离制备
根据HE等[11]的方法制备不同分子质量的肽组分。将制备得到的多肽酶解液,使用有机膜分离实验机在40 psi的恒定压力下,通过分子质量阻隔为1 kDa的超滤膜,收集生成的渗透液(即分子质量<1 kDa肽组分),并将截留液(>1 kDa肽)在同样的条件下通过3 kDa分子质量阻隔超滤膜,以回收其中的1~3 kDa肽组分,3~5 kDa的肽组分用相同的步骤获得。最终将得到的肽组分溶液冷冻干燥得到多肽粉末并保存在干燥皿中备用。
1.5 多肽平均分子质量的测定
采用高效液相色谱法,色谱条件为色谱柱:BioBasic SEC120(7.8 mm×300 mm,5 μm);检测波长214 nm;样品质量浓度1 mg/mL;柱温25 ℃;流动相:乙腈∶水∶三氟乙酸= 30∶70∶0.1(体积比);流速0.5 mL/min;进样量20 μL;所选用的分子质量标准品包括HSA(66 000 Da),细胞色素C(12 500 Da),杆菌肽(6 511.51 Da)和Gly-Gly-Tyr-Arg(451.48 Da),将标准品的保留时间(retention time,RT)和分子质量log(MW)绘制标准曲线,以获得回归方程y=-0.207 6x+7.007 8,再根据分子质量标准曲线方程计算样品的MW。多肽的平均分子质量计算如公式(1)所示:
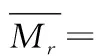
(1)
式中:Mrn,色谱图中第n个峰的分子质量,Da;an色谱图中总峰面积中第N个峰的百分比,%。
1.6 表面疏水性的测定
根据LAN等[6]的方法,使用疏水荧光探针ANS测定了多肽的S0。将多肽溶液(4 mL)与在DMSO中制备的20 μL、16 mmol/L ANS混合,并在室温条件下避光放置15 min。使用荧光分光光度计在390 nm的激发波长和470 nm的发射波长下测量混合物的荧光强度,激发和发射狭缝宽度均设置为5 nm。最终,以蛋白质质量浓度(0.05、0.1、0.2、0.4、0.5 mg/mL)为横坐标,对应的荧光强度为纵坐标所得到的直线,其斜率即为多肽的S0(R2≥0.991)。
1.7 基于极性差异多肽的分离制备
将1.3制备的多肽酶解液,在磁力搅拌下分别加入不同极性的溶液(乙醇、乙腈、异丙醇)(1∶3,体积比),并在4 ℃的冰箱中放置一段时间,使其充分混合。然后,将得到的混合溶液离心(10 000 r/min,10 min),取上清液在50 ℃的条件下旋转蒸发除去其中所含有的有机试剂。最后,将不同极性的多肽溶液冷冻干燥备用。
1.8 静态三相接触角的测量
根据FENG等[12]的方法进行不同极性多肽接触角的测量。首先使用红外压片机将冷冻干燥的RPs粉末以2 MPa的压力压制成型,然后使用高精度注射器将1滴去离子水(5 μL)沉积在颗粒表面上。通过使用电荷耦合器件(charge-coupled device,CCD)照相机和图像分析系统,记录吸水过程并在4 min后对其进行定量以达到平衡。接触角的值是3个重复的平均值。
1.9 多肽分离纯化对β-胡萝卜素的包封
1.9.1 多肽超滤后对β-胡萝卜素的包封
配制5 mL(6 mmol/mL)不同分子质量(<1、1~3、3~5 kDa)的RPs溶液,并将pH调节至7.0,加入15 mg β-胡萝卜素粉末,然后在25 ℃条件下磁力搅拌12 h。测量包封率(encapsulation efficiency,EE)和负载量(loading amount,LA)。
1.9.2 多肽极性处理后对β-胡萝卜素的包封
配制5 mL不同极性(乙醇、乙腈、异丙醇)处理后的多肽溶液(5 mg/mL),加入15 mg β-胡萝卜素粉末,然后在25 ℃条件下磁力搅拌12 h。测量包封率和LA。
1.10 包封率和LA的测定
包封率定义为捕获在载体核心中或表面的生物活性物质的量与生物活性物质的初始量相比的值。根据LIU等[13]的方法测定包封率。为使游离的β-胡萝卜素分离出来,将包封后的多肽溶液加入一定量(10 mL)的正己烷,涡旋振荡3 min,重复数次,直到正己烷层变为无色,进一步测量正己烷中未被包封的β-胡萝卜素的含量。首先制作标准曲线,配制质量浓度为0.001~0.005 mg/mL 5个梯度的溶液,用酶标仪测量450 nm处的吸光度,得到其标准曲线为y=0.843 5x-0.000 2,R2=0.998 7。以正己烷溶液为空白,根据标准曲线测量游离β-胡萝卜素的含量。包封率和LA计算如公式(2)(3)所示:
EE/%=[1-β-c(free)]/[β-c(total)]×100
(2)
LA/(mg·mg-1)=[1-β-c(free)]/m(RPs)
(3)
式中:EE,包封率;LA,负载量;β-c(free),游离β-胡萝卜素的含量,mg;β-c(total),添加的β-胡萝卜素的总含量,mg;m(RPs),添加的RPs的质量,mg。
1.11 微观结构表征
1.11.1 FTIR
称取适量的KBr,分别与RPs、β-胡萝卜素,RPs包封β-胡萝卜素形成的复合物RPs(β-c)混合并研磨压制成薄片。通过比较4 000~400 cm-1化合物的吸光度获得光谱信息,以探究复合物价键的变化[14]。
1.11.2 TEM
将样品分散在水中,然后将液滴滴加在由碳支撑膜覆盖的铜栅上。5 min后用1张滤纸吸走多余的液体。随后,将0.01 mg/mL的磷钨酸液体滴放在铜栅上,在室温下稍微干燥,并在1 min后再次用滤纸除去。最终,使用TEM在100 kV的电压下观察铜栅。
1.11.3 CLSM
使用CLSM表征RPs(β-c)的微观结构。将多肽和β-胡萝卜素分别用0.001 mg/mL的尼罗蓝(溶剂为水)和0.001 mg/mL尼罗红(溶剂为异丙醇)染色。观察时使用10×目镜和40×物镜的放大倍数。尼罗红和尼罗蓝分别由488 nm的氩激光和633 nm的He-Ne激光激发[15]。
1.12 数据统计分析
使用SPSS软件对数据进行单因素方差分析(one-way analysis of variance,ANOVA),选择的显著性差异为P<0.05。每个实验重复3次,结果用平均值±标准差表示。
2 结果与分析
2.1 RPs平均分子质量的分析

表1 不同组分的平均分子质量Table 1 Average molecular weight of different components
2.2 分子质量分布对多肽包封能力的影响
不同分子质量的多肽在肽链长度和摩尔质量方面存在差异,为消除由于分子质量引起的肽链摩尔数的不同对多肽包封能力的影响,根据表1测得的对应的平均分子质量,各组分称取浓度为6 mmol/mL的多肽进行包封实验。根据公式(2)计算得到包封率,并测定各组分S0(图1)。在相同摩尔质量的情况下,3个组分(<1、1~3、3~5 kDa)的包封率分别为85.71%、89.66%、85.82%,S0分别是360.15、501.50、385.77。相较于其他2个组分,组分2(1~3 kDa)多肽包封率和S0最高,说明在此分子质量条件下的多肽表面暴露了更多的疏水基团,有利于β-胡萝卜素的包封[16]。由此表明,经过超滤分离纯化得到的分子质量1~3 kDa的多肽包封β-胡萝卜素能力最佳。
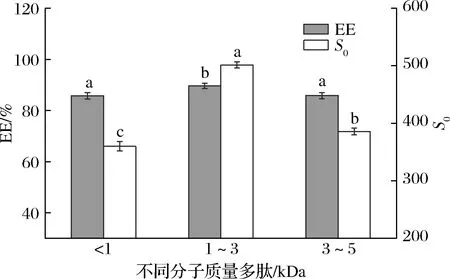
图1 不同分子质量(<1、1~ 3、3~5 kDa)多肽的包封及表面疏水性Fig.1 Encapsulation and surface hydrophobicity of peptides with different molecular weights (<1,1~ 3,3~5 kDa)
2.3 极性对多肽包封能力的影响
不同极性溶剂对多肽包封能力的影响如图2-a所示。选用的溶剂极性大小顺序为乙醇(6.8)>乙腈(6.2)>异丙醇(4.3),经异丙醇处理后的接触角最大(61.05°),乙腈(51.20°)和乙醇(49.30°)次之,接触角越大,表明样品的两亲性越强,得到的接触角结果与溶剂极性规律相符[17]。
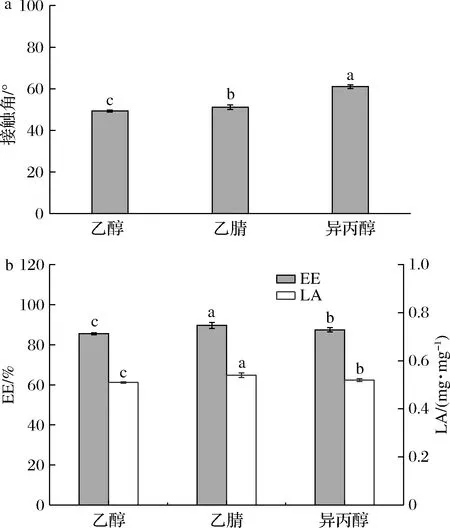
a-接触角;b-包封率和负载量图2 不同极性溶剂处理后的多肽三相接触角和包封率及负载量Fig.2 Three-phase contact angle, encapsulation efficiency and loading capacity of peptides treated with different polar solvents
极性影响着多肽的两亲性,并可能进一步影响多肽对疏水性物质β-胡萝卜素的包封。图2-b为不同极性多肽包封β-胡萝卜素的结果。随着处理溶剂的极性减小,用乙醇和乙腈分离纯化后的多肽包封β-胡萝卜素,包封率从85.49%提高到89.62%,而由异丙醇处理后的多肽包封率发生下降,仅为87.41%,在乙腈到异丙醇处理多肽组包封结果出现了拐点,可能的原因是在经过异丙醇的处理后多肽本身的极性过小,在包封的过程中多肽容易自身先发生聚集,从而对β-胡萝卜素的包封能力会有所下降,最终导致包封率显著降低(P<0.05)[18]。另一方面,乙醇、乙腈、异丙醇处理后的多肽的LA分别为0.51、0.54、0.52 mg/mg,其中乙腈处理后的LA最高。因此,经过乙腈分离纯化处理后多肽包封β-胡萝卜素的能力最佳。
2.4 包封复合物的结构表征
2.4.1 FTIR分析
RPs包封β-胡萝卜素前后的FTIR如图3-a所示。透射率在3 200~3 500 cm-1反映的是氢键的变化[19],而在这个区域未发生明显变化,说明在此实验过程中没有氢键参与反应,而根据β-胡萝卜素的结构(图3-b)分析可得,其不含有O原子等能提供电子的元素,与多肽之间也不能形成氢键。通过比较RPs(β-c)和RPs-A(β-c)在区域1 200~1 600 cm-1的变化,RPs包封后在此区域的峰朝着高波方向移动,说明RPs经超滤和极性分离纯化处理后,与β-胡萝卜素的相互作用效果较好[20-21],包封率和LA有较大程度的提升。
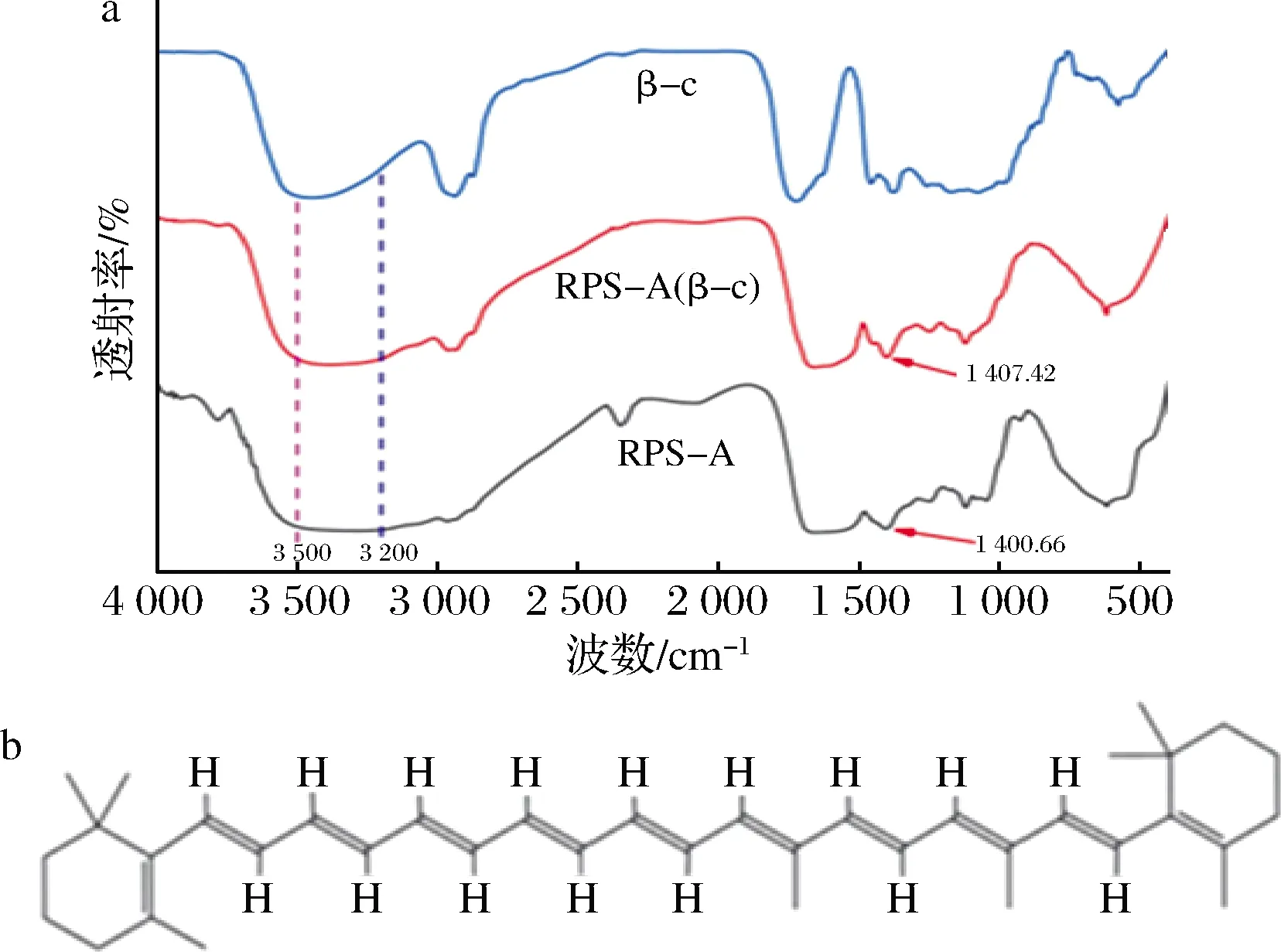
a-RPs包封β-胡萝卜素前后FTIR图谱;b-β-胡萝卜素二维结构图图3 β-c、RPs-A、RPs-A(β-c)的FTIR图谱和β-胡萝卜素的二维结构图Fig.3 The FTIR spectra of β-c, RPs-A, RPs-A(β-c) and two-dimensional structure diagram of β-carotene
2.4.2 微观结构表征分析
RPs、β-胡萝卜素、RPs-A(β-c)的CLSM结果如图4所示。图4-C中大部分的图像颜色都呈现为橙黄色,说明绝大多数的RPs与β-胡萝卜素形成了包封复合物,这与较高包封率的结果相符[22]。同时,经过一系列分离纯化后,用于包封β-胡萝卜素所形成复合物的结构粒径明显变小很多,说明多肽分子质量会对复合物的粒径产生明显的影响。此外,观察图中荧光颜色的分布可知,大部分形成的复合物颗粒分布都比较均匀,只有少量复合物形成了聚集体,可能是经过极性分级处理后,在此条件下不容易聚集形成大颗粒[23]。因此,对多肽进行超滤和极性的分离纯化处理,不仅能提高包封率,而且有利于形成分布均匀且易消化吸收的包封复合物。
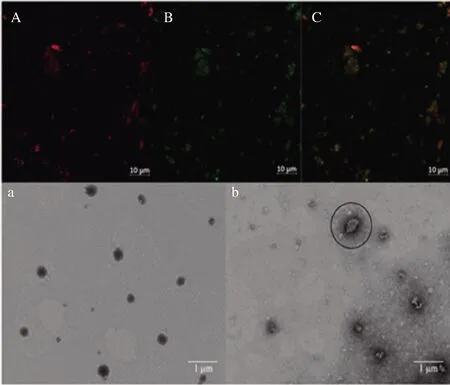
图4 RPs-A(A)、β-胡萝卜素(B)和RPs-A(β-c)(C)的CLSM图像以及RPs-A(a)、RPs-A(β-c)(b)的TEM图像Fig.4 The CLSM images of RPs-A(A), β-carotene(B), RPs-A(β-c)(C) and the TEM images of RPs-A(a) and RPs-A(β-c)(b)
RPs-A和RPs-A(β-c)的TEM结果如图4所示。由图4-a可知,RPs-A为实心颗粒状,颗粒大小和分布都较为均匀,粒径为200~300 nm。图4-b中的圆圈部分,可以看到RPs-A(β-c),形成了明显的空心状颗粒且具有明显的外壳,同时也观察到形成的RPs-A颗粒内部包封有β-胡萝卜素[13]。再纵观整个的TEM视野,RPs-A(β-c)虽伴有少量的聚集但形成的颗粒也都分散均匀且外形大致为球状。
综上,对包封前后的多肽进行FTIR、CLSM、TEM等一系列结构表征,表明RPs经超滤和极性处理后,与β-胡萝卜素的相互作用进一步增强,并且在经分离纯化处理后,聚集现象有明显的改善,整体分布也较为均匀,所形成的包封复合物大致为球状。但是,RPs包封形成的复合物颗粒粒径大小不均匀,可能与所用多肽的氨基酸序列和相互作用位点的不同有关,这个方向有待进一步探究。
3 结论
本研究以酶解60 min的RPs为原料,探究不同分子质量和两亲性对β-胡萝卜素包封的影响。研究结果表明,分子质量为1~3 kDa的RPs对β-胡萝卜素的包封能力最佳。不同极性溶剂处理下,经乙腈处理后的RPs包封β-胡萝卜素的效果最佳。将超滤和极性溶剂联合分离纯化后的多肽用于包封β-胡萝卜素,包封率由单独处理的89.66%和89.62%,显著提升到95.79%。FTIR结果表明,联合处理后的多肽与β-胡萝卜素的相互作用效果较好,使得包封率和LA有较大程度的提升。进一步分析包封体系CLSM和TEM的变化,与未经过分离处理的多肽包封电镜图相比,形成的包封复合物结构粒径有明显变小。因此,多肽分子质量和两亲性不仅影响其对β-胡萝卜素的包封能力,而且对包封所形成的复合物粒径也有较大的影响。

