接种新型冠状病毒灭活疫苗后感染Delta变异株的新型冠状病毒肺炎患儿临床特征分析
苏杭 张霞 段凤阳 任献青 闫永彬 丁樱
(河南中医药大学第一附属医院儿科/河南中医药大学儿科医学院,河南郑州 450000)
2019 年末,新型冠状病毒肺炎(coronavirus disease 2019,COVID‐19)疫情迅速蔓延,现已成为国际关注的突发公共卫生事件。疫情发生后,我国迅速采取强有力的防控和救治措施,积极开展疫苗接种,战“疫”初步取得阶段性胜利。但由于新型冠状病毒在不断变异,疫情防控形势仍然严峻。与成人相比,儿童COVID‐19 发病率较低[1],然而,印度发现的Delta 变异株已被世界卫生组织证明是最易传播的变异毒株,且出现儿童易感性,值得关注。
当前COVID‐19 治疗仍缺乏特效药,接种疫苗成为防御新型冠状病毒的重要手段。根据技术研发路线,可将新型冠状病毒疫苗(简称新冠疫苗)大致分为4类:(1)使病毒丧失致病性,但基本呈现其完整形式,包括减毒疫苗、灭活疫苗;(2)利用病毒遗传物质的核酸类(DNA 和mRNA)疫苗;(3)将抗原基因通过无害的病毒载入人体内的病毒载体疫苗;(4)采取基因工程手段制备出病毒的蛋白抗原,包括病毒样颗粒疫苗、蛋白亚单位疫苗[2]。目前接种的新冠疫苗大部分是灭活疫苗,据统计灭活疫苗保护效力达79.34%[3]。国外学者研究发现,新冠疫苗刚接种完成时保护力很强,患者高病毒负荷状态降低,但很快会对Delta 毒株易感,说明新冠疫苗接种不会完全防止Delta 毒株感染,但进展至重症的风险减小[4]。然而,针对接种新冠疫苗后患COVID‐19 患儿的临床特征,目前国内外研究较少,故本研究总结河南省2021年11月3日至12月17日确诊的接种灭活新冠疫苗后的11 例儿童感染Delta 变异株的COVID‐19 病例的临床特征,希望能对临床中此类患儿的诊疗提供参考。
1 资料与方法
1.1 病例资料
选取2021年11月3日至12月17日河南省定点救治医院收治的接种灭活新冠疫苗后因感染新型冠状病毒Delta 变异株确诊COVID‐19 患儿11 例纳入接种疫苗组,同期住院的未接种新冠疫苗的因感染新型冠状病毒Delta变异株确诊COVID‐19患儿31 例纳入未接种疫苗组。COVID‐19 诊断标准严格按照国家卫生健康委员会办公厅和国家中医药管理局办公室联合印发的《新型冠状病毒肺炎诊疗方案(试行第八版修订版)》[5]执行。
1.2 研究方法
回顾性收集两组患儿的流行病学资料,血常规、肝肾功能、心肌酶学、炎症指标、T 细胞亚群、新型冠状病毒抗体、Delta 变异株的核酸Ct 值等实验室指标和胸部CT 等影像学资料,并进行比较分析。新型冠状病毒Delta 变异株由河南省疾控预防与控制中心采用江苏硕世生物科技股份有限公司生产的新型冠状病毒B.1.617 变异株检测试剂盒(ARMS‐PCR 探针法,批号:JC10315N)检测,检测过程和结果判断依据说明书进行。
1.3 统计学分析
采用SPSS 26.0 统计软件对数据进行统计学分析,正态分布计量资料以均数±标准差(±s)表示,两组间比较采用两样本t检验;非正态分布计量资料用中位数和四分位数间距[M(P25,P75)]表示,两组间比较采用Mann‐WhitneyU检验。计数资料以例数和百分率(%)表示,两组间比较采用χ2检验。P<0.05为差异有统计学意义。
2 结果
2.1 流行病学资料
11例接种疫苗组患儿中,男5例(45%),女6例(55%),31 例未接种疫苗组患儿中,男13 例(42%),女18 例(58%),两组性别构成比较差异无统计学意义(χ2=0.000,P=1.000)。在病例分型方面,接种疫苗组中轻型10 例(91%),普通型1例(9%);未接种疫苗组中轻型25 例(81%),普通型6 例(19%),两组间比较差异无统计学意义(χ2=0.099,P=0.754)。
接种疫苗组患儿均为两次单剂注射(两次间隔3~4 周),末次疫苗接种至确诊时间间隔为56~68 d,平均间隔时间(59±3)d。患儿接种疫苗的生产商为北京科兴中维生物技术有限公司。
2.2 临床症状
接种疫苗组患儿的主要症状有咳嗽、咳痰、鼻塞流涕,仅1例患儿出现味觉嗅觉异常,无发热症状;未接种疫苗组患儿的主要症状有咳嗽、咳痰、发热、鼻塞流涕,无味觉嗅觉异常症状。两组间临床症状发生率比较差异均无统计学意义(P>0.05)。见表1。
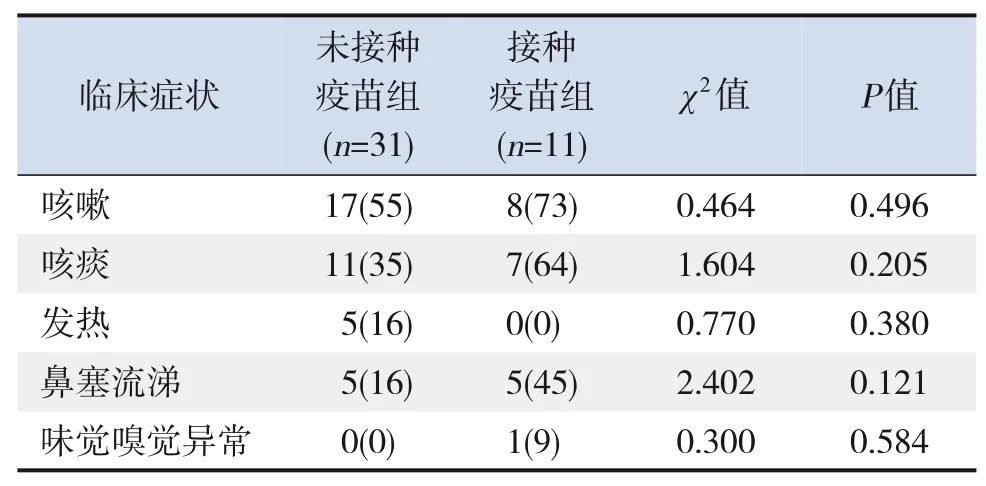
表1 两组患儿的临床症状发生率比较 [例(%)]
2.3 实验室检查
两组患儿白细胞计数、淋巴细胞百分比、丙氨酸氨基转移酶水平比较,差异均无统计学意义(P>0.05)。接种疫苗组患儿血小板计数低于未接种疫苗组(P<0.001),但两组均未出现血小板计数减少病例。接种疫苗组患儿天冬氨酸氨基转移酶、乳酸脱氢酶(lactate dehydrogenase,LDH)、肌酸激酶同工酶(creatine kinase isoenzyme,CK‐MB)水平明显低于未接种疫苗组(P<0.05)(表2),且未接种疫苗组出现6 例(19%,6/31)CK‐MB 水平升高,7 例(23%,7/31)LDH 水平升高,而接种疫苗组CK‐MB 和LDH 水平均在正常范围内。接种疫苗组有1 例(9%,1/11) 患儿出现血肌酐(creatinine,Cr)水平升高,未接种疫苗组有9 例(29%,9/31)Cr 水平升高,但两组比较差异无统计学意义(χ2=0.850,P=0.356)。

表2 两组患儿的部分实验室检查结果比较
在炎症指标中,两组患儿C反应蛋白、降钙素原水平增高发生率比较,差异均无统计学意义(P>0.05)。在外周血细胞因子水平方面,两组患儿均表现为白细胞介素(interleukin,IL)‐10 和IL‐17a水平升高,但差异无统计学意义(P>0.05)。其他细胞因子,如IL‐2、IL‐4、IL‐6、肿瘤坏死因子‐α、干扰素‐γ、IL‐12p70在两组间比较差异亦无统计学意义(P>0.05)。见表3。
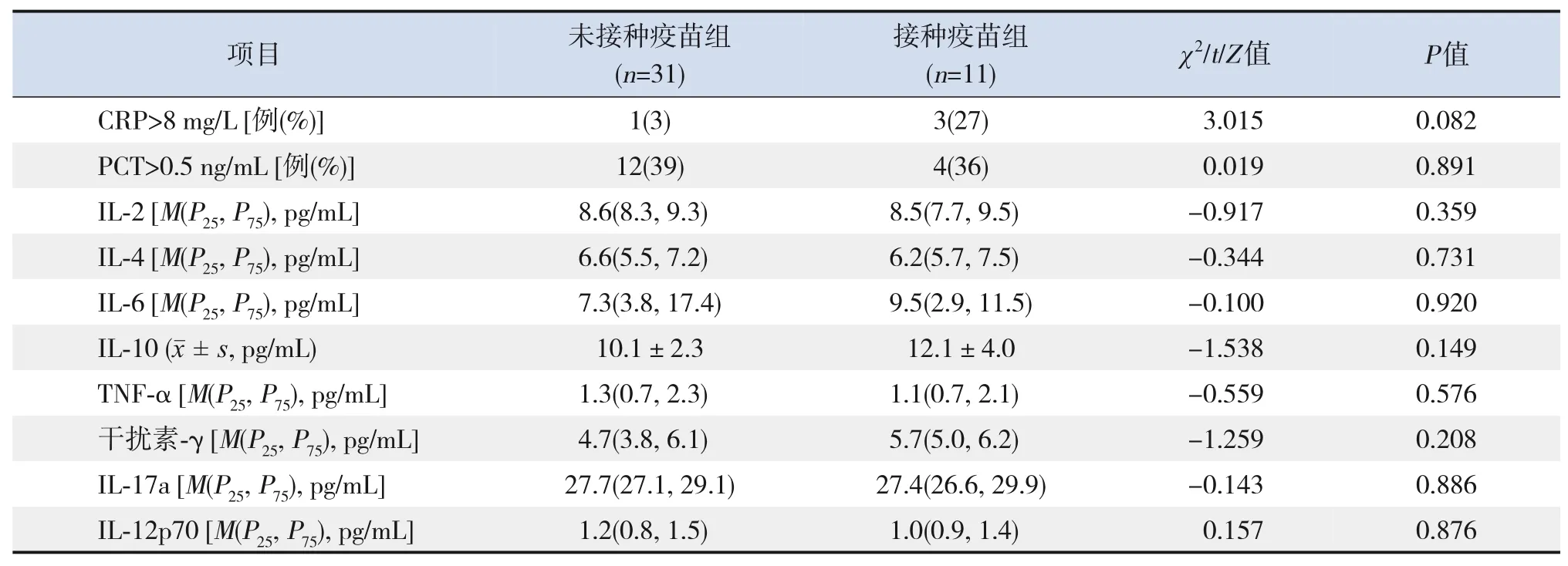
表3 两组患儿的炎症指标比较
在外周血淋巴细胞亚群计数中,接种疫苗组患儿B淋巴细胞和总T淋巴细胞(CD3+)计数较未接种疫苗组降低(P<0.05)。而NK细胞及T淋巴细胞(包括CD3+CD4+和CD3+CD8+)计数在两组间比较差异无统计学意义(P>0.05)。见表4。
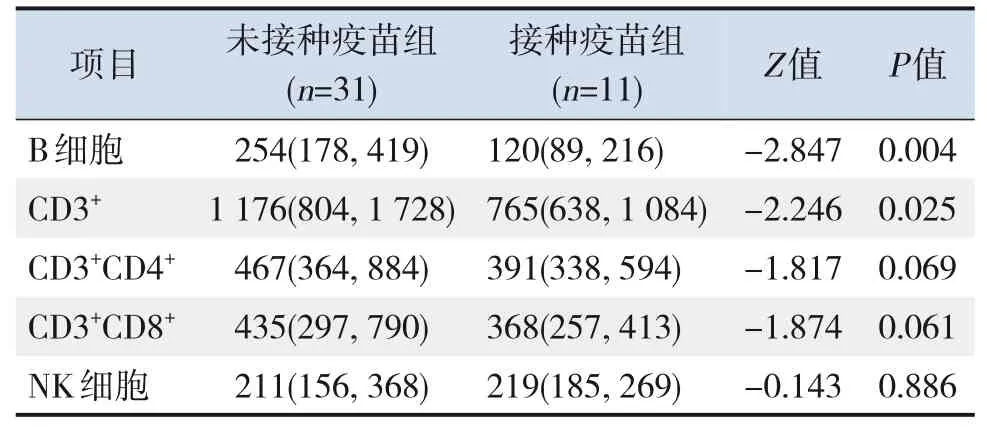
表4 两组患儿的外周血淋巴细胞亚群结果比较[M(P25,P75)]
2.4 不同时间截点新型冠状病毒抗体水平变化
新型冠状病毒抗体检测结果中,入院时、病程第2周、病程第3周接种疫苗组患儿新型冠状病毒抗体IgG 阳性率分别为82%、100%、100%,而未接种疫苗组分别为16%、58%、84%。两组比较,接种疫苗组患儿在入院时、病程第2 周的IgG阳性率均高于未接种疫苗组(P<0.05)。见表5。
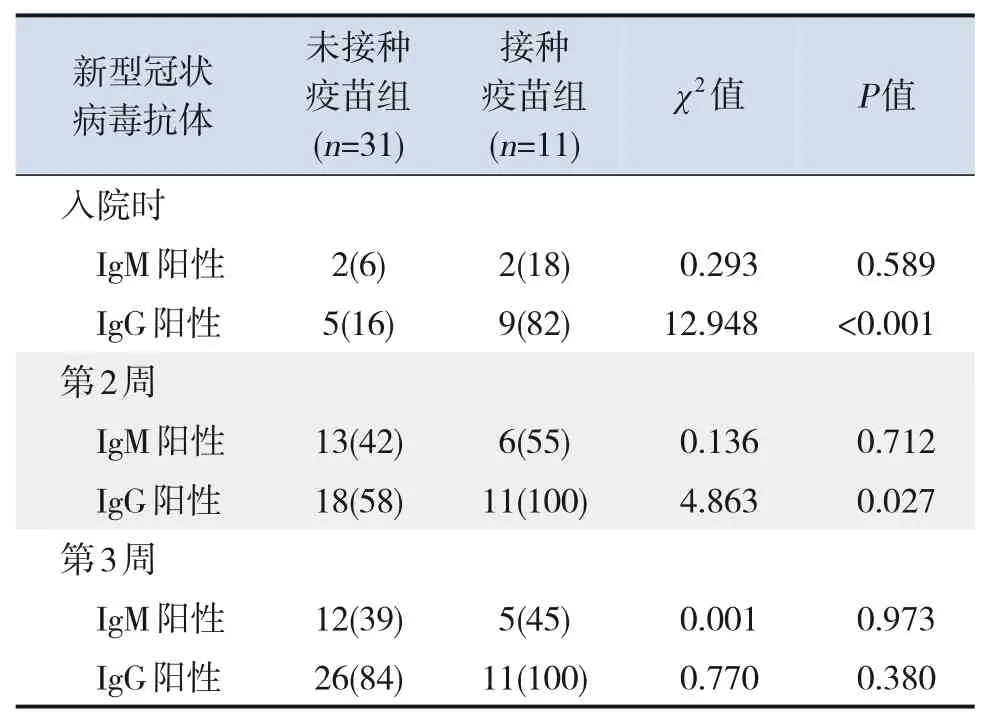
表5 两组患儿不同时间截点新型冠状病毒抗体检测结果比较 [例(%)]
2.5 不同时间截点新型冠状病毒核酸Ct值
接种疫苗患儿中新型冠状病毒最低核酸Ct值N序列为14,Lab序列为15;未接种疫苗患儿中最低核酸Ct值N序列为16,Lab序列为18。入院后患儿核酸Ct值持续升高,病毒载量处于持续减少态势。在病程第1周、第2周接种疫苗组患儿核酸Ct值较未接种疫苗组升高(P<0.001)。见表6。
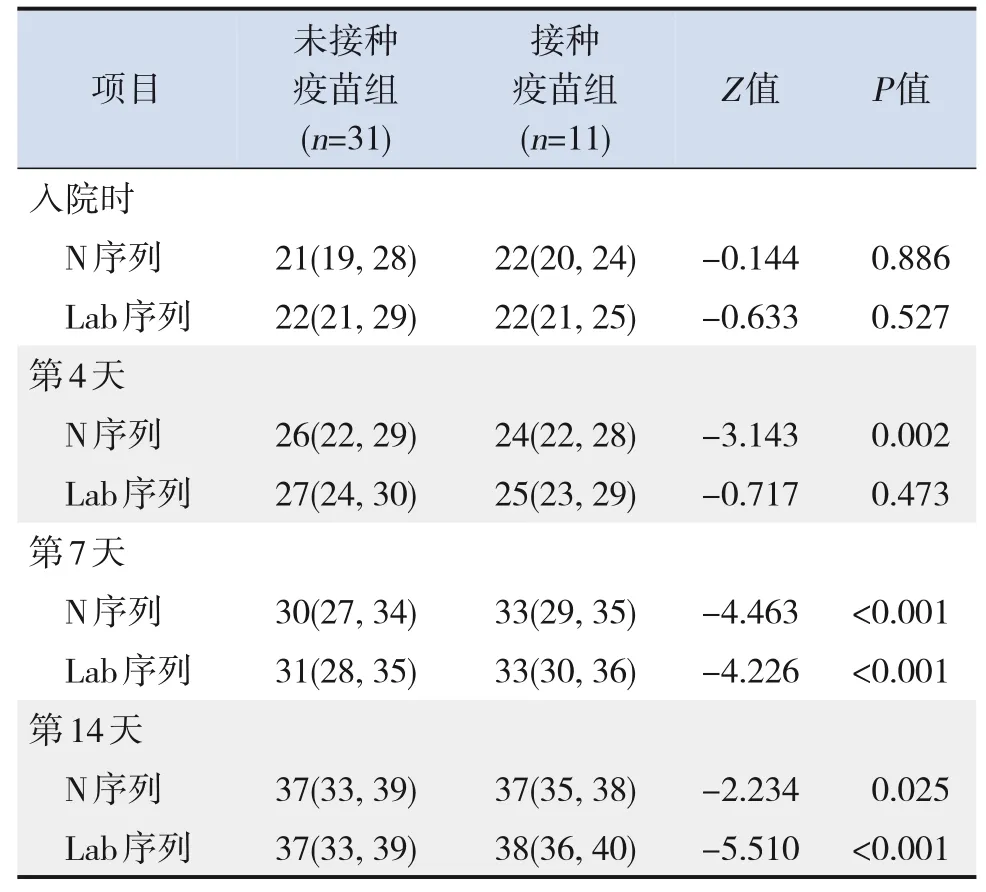
表6 两组患儿不同时间截点新型冠状病毒核酸Ct值结果比较 [M(P25,P75)]
2.6 影像学表现
11 例接种疫苗后感染新型冠状病毒Delta 变异株的COVID‐19 确诊患儿中,有2 例(18%)胸部影像学出现肺炎病灶,均表现为右肺下叶斑片状影。而31例未接种疫苗患儿中,有8例(26%)患儿胸部影像学出现肺炎病灶,其中1例表现为双侧肺炎,7例表现为单侧肺炎;4例表现为斑片状影,4 例为磨玻璃影。两组患儿影像学改变比例比较,差异无统计学意义(χ2=0.010,P=0.922)。
3 讨论
COVID‐19 是由新型冠状病毒引起的一种新发的急性呼吸道传染性疾病。2020 年10 月在印度首先被发现的新型冠状病毒变异Delta毒株B.1.617.2,是目前许多国家的主要流行毒株。2021 年8 月18日,世界卫生组织指出Delta 变异株的传染性强,已出现接种疫苗后仍然感染病毒的病例。但疫苗可以有效防止Delta变异株导致的重症和死亡。
随着新冠疫苗在全世界广泛应用,疫苗接种后儿童COVID‐19 病例临床特点值得关注。本研究中,接种疫苗后感染新型冠状病毒Delta 变异株患儿大多数为轻型患儿,临床症状以咳嗽、咳痰、鼻塞流涕为主,较少数有味觉嗅觉异常表现,与未接种疫苗组患儿相比,差异无统计学意义,说明疫苗接种对Delta 变异株引起的临床症状并无明显改变。其次,两组患儿病程中白细胞计数、淋巴细胞百分比、外周血细胞因子及炎症指标升高比例,差异无统计学意义。胸部影像学改变均以累及单侧或双侧的磨玻璃影及斑片状影为主,两组构成比差异无统计学意义。因此,本研究结果提示接种疫苗组患儿的一般情况、临床表现、炎症指标及影像学改变与本研究中的未接种疫苗组患儿大致相同。
目前研究提示血管紧张素转化酶2(angiotensin‐converting enzyme 2,ACE2)是新型冠状病毒的功能受体[6],在COVID‐19 患者发病过程中起着至关重要的作用。新型冠状病毒可直接损害心肌细胞[7],表现为通过S 蛋白作用于ACE2 受体攻击细胞进行膜融合,通过内吞作用进入细胞后翻译病毒基因组[8]。有报道显示新型冠状病毒感染患者急性心肌损伤发生率高达21.4%[9]。本研究中,未接种疫苗组患儿天冬氨酸氨基转移酶、LDH、CK‐MB 水平明显高于接种疫苗组,差异有统计学意义,提示疫苗接种后可能会减少新型冠状病毒对患儿心肌的损伤,具体机制有待进一步研究。由新型冠状病毒引起的心肌炎与COVID‐19患者的较高病死率直接相关,其很容易导致COVID‐19 患者迅速恶化[10]。且Delta 变异株对心肌的损害可能高于普通COVID‐19[11]。因此,临床医生应该警惕未接种新冠疫苗患儿出现心肌炎的可能性。据推测新型冠状病毒可以直接结合肾近曲小管上皮细胞ACE2,引起肾近曲小管上皮细胞病变,导致肾脏损伤[12]。有研究显示0.5%~29%COVID‐19患者合并肾功能损伤[13],且Cr异常人群与患者的重症化及病死率有显著的关联[14]。本研究中两组均有Cr 水平增高患儿,未接种新冠疫苗患儿Cr 水平增高发生率较接种疫苗组高,但差异无统计学意义。由此推测疫苗接种可能不会影响新型冠状病毒对肾脏的损伤。
相关报道认为,儿童COVID‐19 病情相对较轻主要是由于儿童的免疫系统发育不完善,没有成人的超强免疫反应所致[15]。本研究通过外周血淋巴细胞亚群比较发现,接种疫苗组患儿B淋巴细胞和总T 淋巴细胞(CD3+)计数低于未接种疫苗组,提示疫苗接种后的COVID‐19 患儿早期更易出现免疫功能受损,考虑可能与疫苗接种后体内病毒的清除较慢有关。但接种新冠疫苗是否会造成T细胞亚群紊乱有待进一步研究。
在新型冠状病毒抗体水平及核酸Ct 值变化方面,两组患儿血清抗体的总体趋势为IgM 先升后降,而IgG为持续上升后保持稳定,与以往研究结果相似。部分接种疫苗患儿入院时检测IgG抗体阴性,但在病程2周内即可全部检测到IgG抗体阳性;而未接种疫苗组患儿直至病程3 周才全部检测到IgG抗体阳性。其次,发病时两组患儿新型冠状病毒核酸Ct值无明显差异,但在病程第1周、第2周接种疫苗组患儿核酸Ct 值高于未接种疫苗组,提示疫苗接种后再感染新型冠状病毒患儿,较未接种疫苗患儿,在病程早期(1周)核酸Ct值快速升高,同时2周内迅速产生IgG抗体。
综上所述,疫苗接种后感染新型冠状病毒Delta 变异株儿童,临床分型以轻型为主,常见临床症状有咳嗽、咳痰、鼻塞流涕等,胸部影像学可出现单侧或双侧的磨玻璃影及斑片状影。接种疫苗可能会减少新型冠状病毒对患儿心肌的损伤,影响患儿免疫功能。疫苗接种后再感染新型冠状病毒患儿,较未接种疫苗患儿,在病程早期(1周)核酸Ct 值快速升高,同时2 周内迅速产生IgG抗体。

