土鳖虫调控黏结合蛋白聚糖3改善非酒精性脂肪性肝炎的作用机制
杨广越, 陶 乐, 张 玮, 刘旭凌, 马文婷, 吴 柳, 孙田甜, 姜 浩, 刘 成,
上海中医药大学附属普陀医院 a.肝病实验室, b.感染科, c.实验中心, 上海 200062
非酒精性脂肪性肝炎(NASH)是非酒精性脂肪性肝病(NAFLD)发病过程中由单纯性脂肪肝发展至肝纤维化的重要中间阶段。NASH患者易发生肝纤维化、肝癌。近年来,国内外对中医药[1]及其有效成分[2]干预NASH进行大量研究,但缺乏临床有效治疗NASH药物,因此开展NASH研究具有重要的意义。
下瘀血汤出自东汉张仲景的《金匮要略》,由大黄、桃仁和土鳖虫三味中药组成,是抗肝纤维化经典方剂,前期本研究组发现下瘀血汤可显著抑制四氯化碳[3]、胆管结扎导致的肝纤维化[4],对胆碱蛋氨酸缺乏[5]和高脂[6]诱导的小鼠NASH具有显著抑制作用。已有研究表明中药大黄[7]、桃仁或组分配伍抑制纤维生成[8]作用明确、成分清晰。而土鳖虫对胆碱缺乏(choline deficient amino acid-defined,CDAA)诱导的NASH中有何作用,尚未研究。
黏结合蛋白聚糖3(syndecan 3,SDC3)是一种细胞表面乙酰硫酸肝素盐蛋白聚糖,与细胞间黏附、生长因子信号传导能量平衡有关[9]。研究[10]表明SDC3在饮食诱导的肥胖中具有重要调节作用。但SDC3在CDAA的模型中致纤维生成作用未见报道。本研究通过建立CDAA诱导的小鼠NASH模型,探讨土鳖虫对CDAA所致的NASH干预作用,进一步以SDC3为切入点,研究探讨土鳖虫抑制NASH作用机制,以期为土鳖虫治疗NASH提供理论依据。
1 材料与方法
1.1 材料
1.1.1 动物 雄性C57BL/6小鼠,6~8周龄,体质量20 g左右;购自上海斯莱克实验动物公司,动物生产许可证号:SYXK(沪)2019-0006。所有小鼠均饲养于上海中医药大学附属普陀医院实验动物中心,使用许可证号:SYXK(沪)2019-0020。饲养室温度(22±1)℃ ,相对湿度30%~60%,12 h光照/12 h黑暗,适应性喂养1周,动物自由进食和饮水。
1.1.2 药物与试剂 土鳖虫参照2020年版《中华人民共和国药典》规定,采用道地药材,生药学专家鉴定。制备流程:土鳖虫2.4 g,粗粉末;加20%乙醇8倍量,浸泡1 h,回流提取2次,第1次加20%乙醇回流提取30 min,滤过取汁;药渣再加6倍量的20%乙醇回流提取1 h,滤过取汁,合并2次提取液,减压回收溶剂至干获得土鳖虫浸膏粉。土鳖虫2.4 kg,干燥后重量为0.525 kg,每克提取物浸膏粉相当于生药4.57 g。统一由上海中医药大学中药制剂中心一次制备后冷冻干燥保存。
主要试剂:ALT(C009-2-1)、AST(C010-2-1)、TG(P001)、TC(P002)检测试剂盒购自南京建成生物科技有限公司; Trizol(9109)、High-Capacity cDNA 反转录试剂盒(RR037A)及SYBR 荧光染料(RR420)均购自TaKaRa公司;天狼星红染液由上海中医药大学刘平教授课题组馈赠,油红购自国药集团化学试剂有限公司(20161128)。BCA蛋白定量试剂盒购自Thermo Scientific公司(23227)。DAB购自北京中杉金桥(批号:ZLI-9018);引物[转化生长因子(TGFβ1)、α-平滑肌肌动蛋白(α-SMA)、Ⅰ型胶原(Col1α1)、SDC3]购自上海生工(表1)。免疫组化SDC3(ab191308)抗体、α-SMA(ab5694)抗体购自Abcam公司,免疫印迹用SDC3抗体(10886-1-AP)购自Proteintech公司,β-Actin抗体(ab8226)购自Abcam公司。SABC免疫组化试剂盒(PK-6100)购自Vector公司;EZ-ECL pico化学发光液(AP34L025-A)购自上海李记生物科技有限公司;CDAA饲料(TP3014)和对照胆碱充足(choline sufficient amino acid-defined, CSAA)饲料(TP3014C)购自南通特洛菲饲料科技有限公司。Procll(40501ES60)购自翊圣生物科技有限公司;D-Hanks(PYG0075)购自博士德生物公司;Nycodenz(1002424)购自Alere Technologies公司;链霉蛋白酶(9036-06-0)购自Roche公司;DNA酶(DN25-1G)、胶原酶(V900893-1G)购自Sigma公司;MEM(SH30024.01)、1640(SH30809.01)购自Cytiva公司。

表1 RT-PCR引物序列
1.1.3 细胞 人原代肝星状细胞(HSC,5300)、原代肝细胞(Hepato,5200)、肝脏Kupffer细胞(5340)和肝窦内皮细胞(LSEC,5000)均购自美国ScienCell Research Laboratories;LX2细胞 (SCC640) 购自德国Merck公司;小鼠肝细胞由本实验室分离[11]。
1.2 研究方法
1.2.1 分组、造模和给药 将18只雄性C57BL/6小鼠随机分为CSAA饲料喂养(CSAA组,n=6)、CDAA饲料喂养(CDAA组,n=6)和CDAA饲料+土鳖虫喂养(CDAA+T组,n=6)3组。造模第12周开始,CDAA+T组小鼠给予0.108 g/kg土鳖虫灌胃,每日1次。CSAA、CDAA组以相应剂量的生理盐水灌胃。
1.2.2 小鼠取材 造模结束后以戊巴比妥钠腹腔注射麻醉小鼠,下腔静脉取血,摘取肝组织,切取一叶冰冻,一叶用10%中性福尔马林固定后用于组织学观察,其余液氮冻存后-80 ℃保存备用,提取总RNA及蛋白。
1.2.3 血清学及肝组织指标检测 血液样本于室温静置1 h,3000 r/min离心10 min,取血清。参照试剂盒说明书步骤检测小鼠血清ALT、AST、TC、TG及肝组织TC、TG水平。
1.2.4 肝组织病理学观察 组织处理方法、天狼星红染色、油红染色及免疫组化方法详见本课题组前期已发表文章[5,12-13]。HE染色观察组织学损伤。由本院两位病理科医师盲法阅片计算NAS评分以评判造模是否成功[14]。
1.2.5 实时定量PCR(RT-PCR) Trizol法提取肝脏RNA,测RNA浓度。逆转录:按Takara逆转录试剂盒(RR037A)说明书进行。反应条件:37 ℃ 15 min,85 ℃ 5 s,4 ℃ 15 min。扩增:取cDNA 3 μL 加SYBR Green 5 μL,上游引物0.4 μL,下游引物0.4 μL,ddH2O 1.2 μL,制成10 μL体系,反应条件为:95 ℃ 30 min预变性,95 ℃ 5 s变性,60 ℃ 30 s退火,40个循环,60 ℃ 1 min延伸。PCR结束采用2-ΔΔct法分析计算目的基因表达。
1.2.6 免疫印迹 Western Blot检测SDC3蛋白表达。将肝组织加入预冷的RIPA(含蛋白酶抑制剂)匀浆,4 ℃ 12 000 r/min离心15 min。蛋白定量后10%SDS-PAGE电泳,100 V转移1 h至PVDF膜,封闭1 h;一抗SDC3 4 ℃过夜,二抗室温孵育60 min,ECL显影,采用Image J分析灰度值。
1.2.7 小鼠原代细胞分离 HSC分离方法:小鼠麻醉仰卧位固定,解剖暴露门静脉及下腔静脉,24G留置针插入门静脉固定,前灌流液(约30 mL)充分灌注后;更换为链霉蛋白酶(约30 mL)灌注约5 min,再更换为Ⅳ型胶原酶溶液灌注约5 min;灌流完毕后取肝脏(呈脓包状)至培养皿,眼科镊剔除肝包膜,移入分散液,37 ℃消化15 min,用70 μm孔径的滤网过滤肝组织悬液,加入1%FBS 2 mL终止消化。细胞悬液在37 ℃、1700 r/min离心5 min,取沉淀;加入30 mL无血清GBSS/B悬混匀后再次离心,加入10 mL MEM培养基、1.5 mL DNA酶Ⅰ、8.5 mL 28.7%密度梯度分散液(Nycodenz)混匀成细胞悬液,缓慢铺10 mL GBSS/A,24 ℃ 2951 r/min离心22 min,取中间白膜层,加入MEM,1700 r/min离心5min重复2次,PBS洗细胞,细胞重悬加入20%FBS的DMEM培养。
Kupffer细胞分离方法:溶液配制、肝脏灌流、消化、振荡分散、过滤、洗涤离心等过程均同HSC分离方法。梯度离心:洗涤后的细胞悬液分成2管,分别加入1/1体积和1/2体积的33%Nycodenz,使Nycodenz终浓度分别为16.5%和11%,然后按16.5%Nycodenz、11%Nycodenz和MEM顺序缓慢铺加于离心管中,10 ℃ 2900 r/min 离心20 min。取白色的细胞层,以含20%FBS的DMEM培养液重新悬浮细胞,接种细胞,孵育30 min,洗除未贴壁的细胞,贴壁为Kupffer细胞。
LSEC分离方法:从门静脉灌注37 °C预温的D-Hanks(不含Ca2+),灌流至肝脏颜色为棕白色。灌流预温的胶原酶A,消化结缔组织成分。20~25 min灌流结束取肝脏。PBS洗2次,去除肝包膜和血管。置于胶原酶B,水浴振荡器消化、过滤。细胞悬液以775 r/min,5 min离心去除肝细胞。取上清,1450 r/min离心10 min,弃上清,重复2次后PBS重悬细胞,吸取3 mL细胞悬液缓慢加入到Percoll离心液中,2325 r/min离心20 min。收集含LSEC的中间层,用PBS重悬细胞,2325 r/min离心10 min。细胞团块用含20%FBS的1640培养基重悬。24 h后更换培养基。
肝细胞分离方法:前灌流液冲洗肝脏,待肝脏变为棕白色后,灌流预温的Ⅳ型胶原酶溶液,约10 min后停止灌流。快速摘下肝脏,置于预冷的 MEM 中,剪碎后的细胞悬液用细胞滤网过滤至50 mL离心管中,500 r/min离心1 min 。重复3次后,第3次将2管并入1管,500 r/min离心3 min,弃上清,用含20%FBS的培养液重悬,接种于培养皿中。
1.2.8 细胞培养 土鳖虫处理细胞参照本课题组既往发表文献[3]。转染siRNA:细胞饥饿处理6 h,配制Opti-MEM+LTX+si-RNA质粒(终浓度100 pmol)混合液。静置20 min后将混合液加到培养皿中,处理6 h后换成DMEM-10%胎牛血清+1%双抗培养液,培养细胞48 h后处理。TGFβ使用终浓度为5 ng/mL。
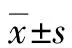
2 结果
2.1 土鳖虫有效治疗CDAA诱导的NASH 与CSAA组相比,CDAA组小鼠血清肝功能(ALT、AST)、血脂(TC、TG)及肝组织TC、TG水平均显著升高(P值均<0.01);而CDAA+T组与CDAA组相比小鼠血清ALT、AST、TC、TG及肝组织TC、TG均显著降低(P值均<0.05)(表2)。
HE染色结果显示:CSAA组肝细胞索从中央静脉呈放射状排列,CDAA组肝小叶间炎性细胞浸润明显,土鳖虫可显著抑制炎性细胞浸润,CDAA+T组肝脏炎性细胞浸润较CDAA组明显减少(图1a)。CDAA组NAS评分>4,显著高于CSAA组,CDAA+T组NAS评分较CDAA组明显降低(P值均<0.05)(表2)。
油红染色结果显示:与CSAA组相比,CDAA组可见大量红色脂滴填充,排列紧密,脂肪沉积明显;CDAA+T组脂滴明显减少,脂肪沉积显著减少(图1b)。与CSAA组相比,CDAA组油红染色阳性面积显著增加,CDAA+T组较CDAA组显著减少(P值均<0.05)(表2)。
天狼星红染色结果显示:CSAA组小鼠肝组织仅在汇管区和中央静脉壁可见少量胶原纤维,CDAA组小鼠肝组织可见大量增生的胶原纤维;CDAA+T组小鼠肝组织纤维显著减少(图1c)。与CSAA组相比,CDAA组天狼星红面积显著增加,CDAA+T组较CDAA组显著减少(P值均<0.05)(表2)。

表2 各组肝功能、血脂、肝脏脂肪表达及病理学改变
RT-PCR结果显示:与CSAA组相比,CDAA组TGFβ、Col1α1的mRNA表达显著升高;与CDAA组相比,CDAA+T组TGFβ、Col1α1的mRNA表达显著降低,差异均有统计学意义(P值均<0.01)(表3)。
免疫组化结果显示:CSAA组α-SMA仅在汇管区有少量分布,CDAA组在胶原纤维增生处可见α-SMA大量表达,比CSAA组显著增多,颜色呈棕褐色;与CDAA组相比,CDAA+T组α-SMA表达则显著减少(P值均<0.05)(图2,表3)。
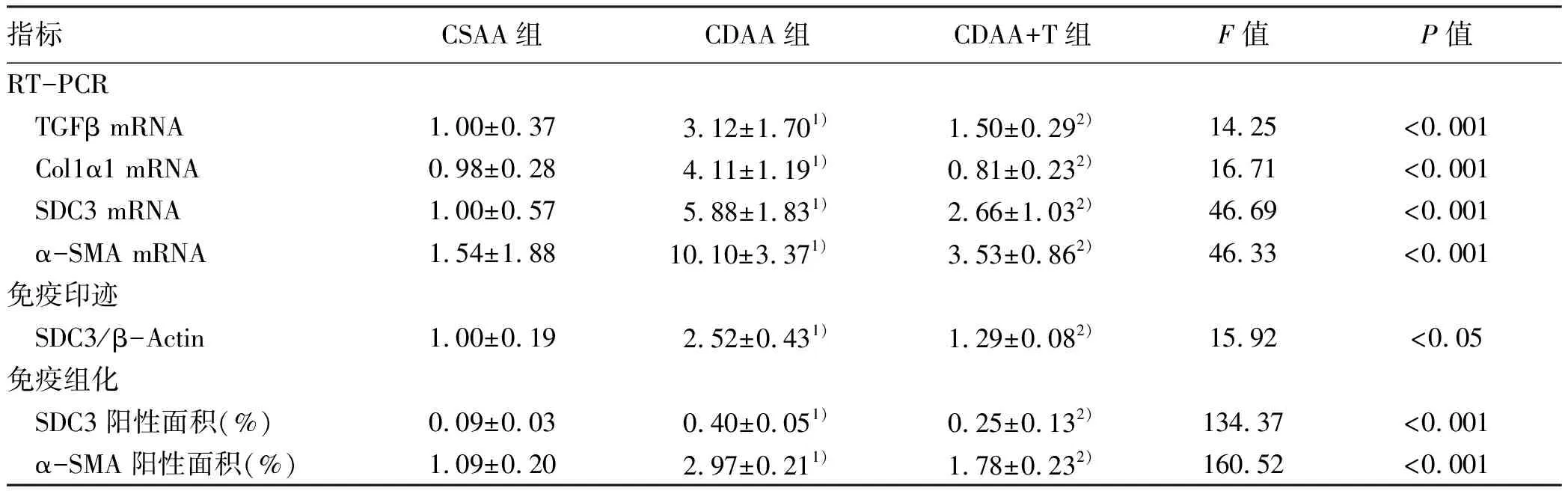
表3 纤维化指标和SDC3在CDAA模型中表达
2.2 SDC3 mRNA表达情况 为明确SDC3是否在肝纤维化中发挥作用,本研究检测了肝脏各类细胞中(HSC、Hepato、LSEC和Kupffer细胞)SDC3的表达,结果表明,SDC3在HSC中的表达最高(表4)。

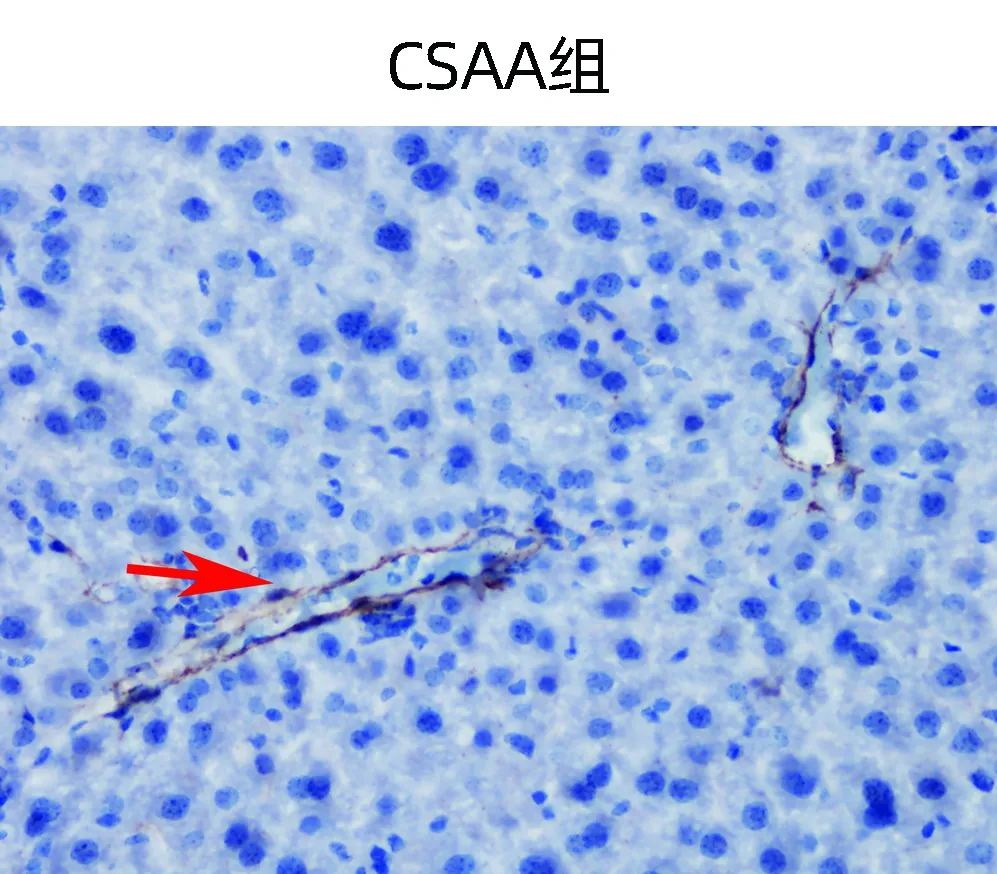
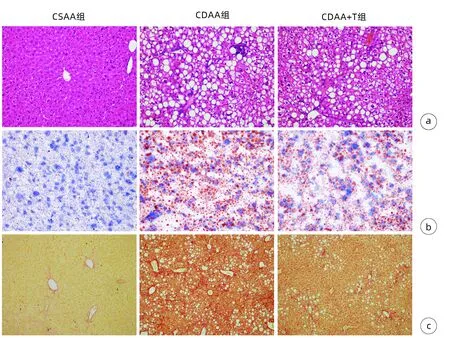
注:a,HE染色(×200);b,油红染色(×400);c,天狼星红染色(×100)。

注:红色箭头表示α-SMA阳性(×400)。
表4 SDC3在肝脏各类细胞中表达
2.3 土鳖虫调控CDAA模型中SDC3抗肝纤维化 与CSAA组相比,CDAA组α-SMA、SDC3 mRNA水平显著升高(P值均<0.001),且SDC3与α-SMA两者的表达呈显著性正相关(P<0.001);经土鳖虫干预后的CDAA中(CDAA+T组)SDC3 mRNA表达显著降低(P<0.001)(图3)。进一步免疫组化发现,CDAA组SDC3主要分布于炎症细胞浸润区和肝窦区;与CDAA组相比,CDAA+T组SDC3的表达显著减少(图4,表3)。免疫印迹结果显示,与CSAA组相比,CDAA组SDC3蛋白表达明显增多,土鳖虫干预后SDC3表达显著减少(图5,表3)。

图3 α-SMA 与SDC3 mRNA表达及其相关性
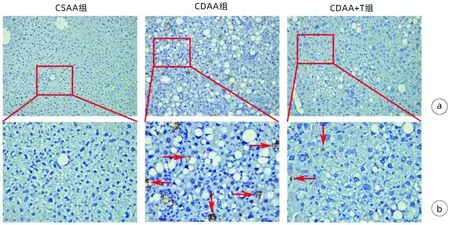
注:a,×200;b, 上图方框内的放大(×400),红色箭头表示SDC3阳性。
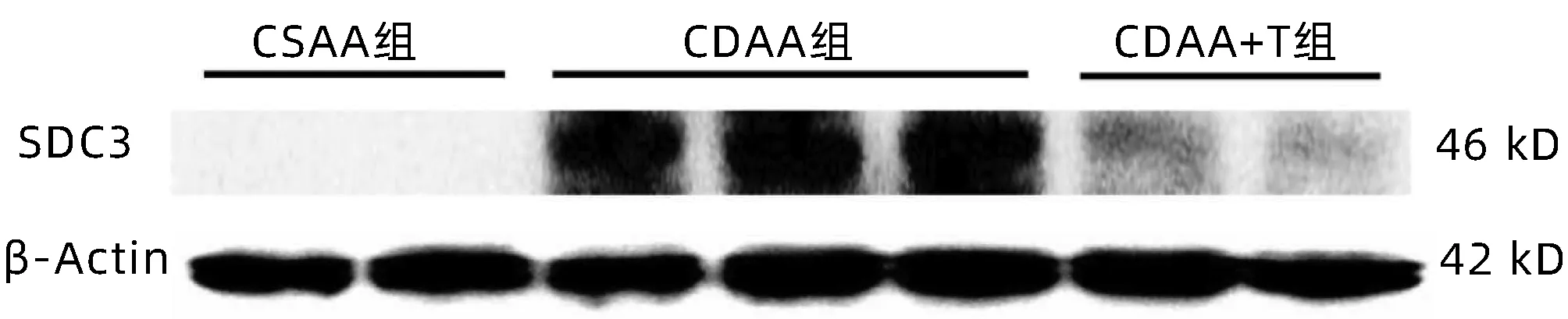
图5 SDC3在CDAA模型中的蛋白表达
2.4 土鳖虫调控HSC中SDC3表达发挥抗肝纤维化作用 为验证SDC3在肝纤维化中的作用及土鳖虫的干预效应,采用培养LX2细胞,基因沉默SDC3后,土鳖虫(60 ng/mL)提前1 h干预,后用TGFβ(5 ng/mL)处理48 h。RT-PCR检测发现,与Si-NC-PBS-TGFβ组相比,土鳖虫干预后,α-SMA、Col1α1 mRNA表达水平均显著降低(P值均<0.001);基因沉默SDC3后,与Si-NC-PBS-TGFβ组相比,Si-SDC3-PBS-TGFβ组的α-SMA、Col1α1 mRNA表达水平均显著升高(P值均<0.001);与Si-NC-PBS-TGFβ组相比,Si-SDC3-T-TGFβ组α-SMA、Col1α1 mRNA表达水平未见显著降低(P值均>0.05)(表5)。

表5 土鳖虫提取物抑制TGFβ诱导的LX2纤维化
3 讨论
NASH是NAFLD的一种严重类型[15],是除酒精及明确的肝损伤等其他因素引起的以肝细胞脂质沉积和变性、炎症反应、不同程度纤维化为特征的临床综合征[16]。近年来生活习惯的改变诱发的NASH发病率逐年迅速攀升,若控制不佳会进一步引发肝纤维化、肝硬化及肝细胞癌等[17]。有研究[18-19]表明,在CDAA诱导的NASH中,由于CDAA导致肝脏磷脂合成减少,TG肝输出减少,在肝脏累积,引起脂肪变性;胆碱进一步缺乏,引起肝细胞膜及线粒体膜等损伤,导致脂质过氧化,引起肝组织炎症和纤维化。NASH的病理原因复杂,临床也少有有效的治疗NASH药物,因此进一步探究NASH发病的分子机制,寻找有效治疗NASH药物是临床急需解决的关键问题[20]。
下瘀血汤由大黄、桃仁和土鳖虫三味中药组成。方中土鳖虫为鳖蠊科昆虫地鳖或冀地鳖的雌虫干燥体,味咸、性寒,归肝经,具有破血逐瘀之效。研究[21]表明土鳖虫具有抗凝血和调节血脂等作用。本研究中土鳖虫改善CDAA诱导的肝功能、血脂和肝脏脂肪,减轻炎症细胞浸润和细胞外基质形成,减少脂肪沉积,表明土鳖虫可抑制CDAA诱导NASH形成。基因水平上,土鳖虫能有效抑制α-SMA、Col1α1、TGFβ mRNA表达。细胞水平上,土鳖虫干预后能显著降低TGFβ诱导的α-SMA、Col1α1 mRNA表达,提示土鳖虫能有效改善纤维生成。这为单味中药土鳖虫改善NASH提供了理论依据。
SDC是一类在成纤维细胞和表皮细胞质膜的硫酸乙酰肝素蛋白聚糖,家族有4个成员。SDC3在海马区的中枢神经系统中具有重要的功能[9]。本研究表明,在小鼠NASH模型中,PCR显示CDAA组SDC3 mRNA表达显著升高,并与HSC活化指标α-SMA呈正相关,而土鳖虫组则显著降低,提示土鳖虫抑制纤维生成作用可能通过SDC3实现的。进一步结果显示:在人和小鼠肝脏的各种细胞中,SDC3在HSC细胞的表达最高。TGFβ可诱导HSC的SDC3和纤维化指标表达显著升高,土鳖虫可显著抑制TGFβ诱导HSC活化和纤维化的表达,基因沉默SDC3后土鳖虫不能有效抑制HSC活化,提示土鳖虫抑制HSC活化和纤维生成是通过调控SDC3实现的。总之,土鳖虫可改善CDAA诱导的NASH形成,其机制可能是通过调控HSC细胞SDC3表达实现的,土鳖虫抑制NASH形成的具体物质基础和更深层次机制有待进一步研究。
伦理学声明:本研究方案于2016年3月8日经上海中医药大学实验动物伦理委员会审批,批号:PTEC-A-2016-4(G)-1。符合实验室动物管理与使用准则。
利益冲突声明:本研究不存在研究者、伦理委员会成员、受试者监护人以及与公开研究成果有关的利益冲突。
作者贡献声明:杨广越负责课题设计,资料分析,撰写论文;张玮、刘旭凌、孙田甜、姜浩参与实验操作及数据分析;陶乐、马文婷、吴柳参与收集数据,修改论文;刘成负责拟定写作思路,指导撰写文章并最后定稿。

