河北部分地区猪圆环病毒2型分离鉴定及遗传变异分析
赵云环,赵 强,刘 莹,张 帅,郭 禹,左玉柱,2*,范京惠,2* (.河北农业大学 动物医学院,河北 保定 0700; 2.河北省兽医生物技术创新中心,河北 保定 0700)
猪圆环病毒 2 型 (porcine circovirus type 2,PCV2)是引起断奶仔猪多系统衰竭综合征(postweaning multisystemic wasting syndrome,PMWS)、皮炎和肾病综合征(porcine dermatitis nephropathy syndrome,PNDS)及猪圆环病毒相关疾病(porcine circovirus associated diseases,PCVAD)的主要病原体[1],也被认为是目前影响全球养猪业的最古老且最普遍的病原体。PCV2感染猪后,主要存在猪的腹股沟淋巴结、扁桃体、胸腺等免疫器官,以淋巴组织的细胞凋亡为特征,使宿主产生严重的免疫抑制效应[2]。此外,该病还可导致感染猪群发生持续性感染,使得疫病长期存在,难以根除[3],是困扰养猪业发展的一大难题。
PCV2是圆环病毒科圆环病毒属的成员,是已知感染哺乳动物的最小病毒。PCV2基因组为单股、封闭、环状DNA,大小为 1 766,1 768或1 777 nt,预测具有11个重叠开放阅读框(ORF)。根据 FRANZO等[4]描述的 PCV2 毒株更新的系统发育基因型定义,PCV2可分为8种基因型(PCV2a~PCV2h)。PCV2的ORF2基因编码的Cap蛋白存在较多抗原表位区,加速了PCV2的变异速率,因此,ORF2基因常常作为PCV2遗传变异分析的标记基因。
由于PCV2的遗传变异速率较快,自2000年PCV2首次在我国报道以来[5],在我国广泛流行,且保持着快速进化的趋势,当前的疫苗不能够提供全面的保护。因此,进一步探究当前PCV2流行株的遗传变异特性,从而为制备有效的PCV2疫苗提供适宜的疫苗株,对PCV2的防控具有重要理论意义。本研究对本实验室获得的8株PCV2进行分离鉴定及遗传进化分析,解析其遗传变异规律及流行特性,为本地区PCV2的预防、治疗及疫苗研究提供理论依据。
1 材料与方法
1.1 主要试剂PK-15细胞株、鼠源PCV2多抗由本实验室保存;DNA/RNA提取试剂盒购自哈尔滨国生生物科技股份有限公司;琼脂糖凝胶DNA/RNA回收试剂盒购自杭州倍沃医学科技有限公司;DL2000 DNA Marker购自宝日医生物技术(北京)有限公司;胎牛血清购自美国Gibco公司;4%细胞固定液、BSA购自北京索莱宝科技有限公司;FITC标记羊抗小鼠IgG (H+L)抗体购自Affinity公司。
1.2 病料采集及处理32份疑似PCV2组织采集自河北省衡水、保定、邢台、石家庄、沧州、唐山6个不同地区的规模化养殖厂。将采集的组织充分剪碎,加入适量生理盐水于研磨器研磨呈匀浆状,转移至离心管,8 000 r/min离心5 min,取上清液储存于-80℃备用。
1.3 引物设计根据GenBank中已登录的PCV2、PRV和CSFV分离株的基因序列,应用Primer Premier 5.0软件分别设计病毒检测的特异性引物以及PCV2 Cap全基因引物(表1),由生工生物工程(上海)有限公司合成,使用浓度为10 μmol/L。

表1 引物序列及相关信息
1.4 核酸提取及检测将本实验室收集的来自河北省不同地区的32份疑似PCV2阳性组织分别按照真瑞生物病毒DNA/RNA提取试剂盒和TRIzol使用说明提取总DNA和总RNA,利用本实验室已有的检测方法进行PCV2、PRV、CSFV的检测。
1.5 PCV2全基因扩增与测序以鉴定为PCV2阳性的样品DNA为模板,使用PCV2C-R/F全基因引物,参照文献[6]进行全基因扩增,将PCV2阳性样品中扩增出的清晰特异的产物条带进行纯化后送生工生物工程(上海)有限公司进行序列测定。
1.6 病毒分离与鉴定
1.6.1病毒分离 将1.4中筛选出的仅PCV2阳性且序列测定正确的病料悬液进行10倍稀释后无菌接种至单层生长的PK-15细胞,同时以未接种PCV2病料悬液的细胞作对照组。每天观察细胞状态,直至出现大量细胞脱落。将细胞液进行3次反复冻融后收集病毒液并于-80℃保存备用,同时接种PK-15细胞连续传代培养。分别将收集的第1,5,10代病毒液(F1,F5,F10)进行DNA提取,并通过实验室已建立的方法进行PCV2 的PCR特异性扩增。
1.6.2间接免疫荧光鉴定 将PK-15细胞接种到96孔细胞培养板,待细胞生长至40%左右,试验组每孔加入100 μL1.6.1收集的F10细胞病毒液,对照组每孔加入等量PBS液,37℃吸附90 min,加入100 μL含1%青链霉素的细胞培养液,24 h后用4%细胞固定液室温固定15 min;0.2% Triton X-100室温通透10 min;PBS清洗2次,使用5%牛血清白蛋白(BSA),37℃封闭1 h;PBS清洗3次,每次5 min,按100 μL/well加入鼠源PCV2多抗(5% BSA的PBS作稀释液,1∶100稀释),37℃孵育2 h;PBS清洗4~5次,每次5 min,按100 μL/well加入FITC-羊抗鼠IgG荧光抗体(5% BSA作稀释液,1∶200稀释),37℃孵育45 min;PBS清洗3次,50%甘油封片后,在倒置荧光显微镜下观察试验结果。
1.6.3透射电镜观察 取1.6.1收集的F10细胞病毒液,4℃ 5 000 r/min 离心20 min去除细胞碎片,收集上清进行冷冻超速离心,弃去上清,用ddH2O重悬沉淀,经磷钨酸负染色后,通过JEM-1400透射电镜观察病毒粒子形态。
1.7 PCV2遗传进化分析选取国内外已发布的PCV2 疫苗毒株、各基因型标准参考毒株、国内外不同国家和地区毒株作为参考,分别用DNAStar的MegAlign程序和MEGA 10.0软件对测序正确的全基因组及分离毒株的全基因序列和ORF2基因序列进行核苷酸同源性比对并构建系统发育进化树,同时对ORF2基因编码的Cap蛋白氨基酸同源性和突变位点进行分析。
2 结果
2.1 样品筛选及PCV2全基因扩增使用检测引物对本实验室收集的来自河北省不同地区的32份疑似PCV2感染的组织进行初步检测,结果显示,其中1份组织仅感染PCV2,12份组织为PCV2和PRV和/或CSFV共感染,PCV2阳性率为40.63%。部分检测结果见图1。对检测为PCV2阳性的组织进行PCV2全基因扩增,琼脂糖凝胶电泳结果显示,共9份组织扩增出1 790 bp的预期片段(图2)。对PCV2全基因扩增产物纯化后进行测序,用DNAStar的SeqMan程序对测序结果进行拼接,最终获得8株全基因序列,分别命名为CH/HB/CZ01、CH/HB/CZ02、CH/HB/XJ01、CH/HB/HS01、CH/HB/HD01、CH/HB/HD02、CH/HB/HD03、CH/HB/XT01。
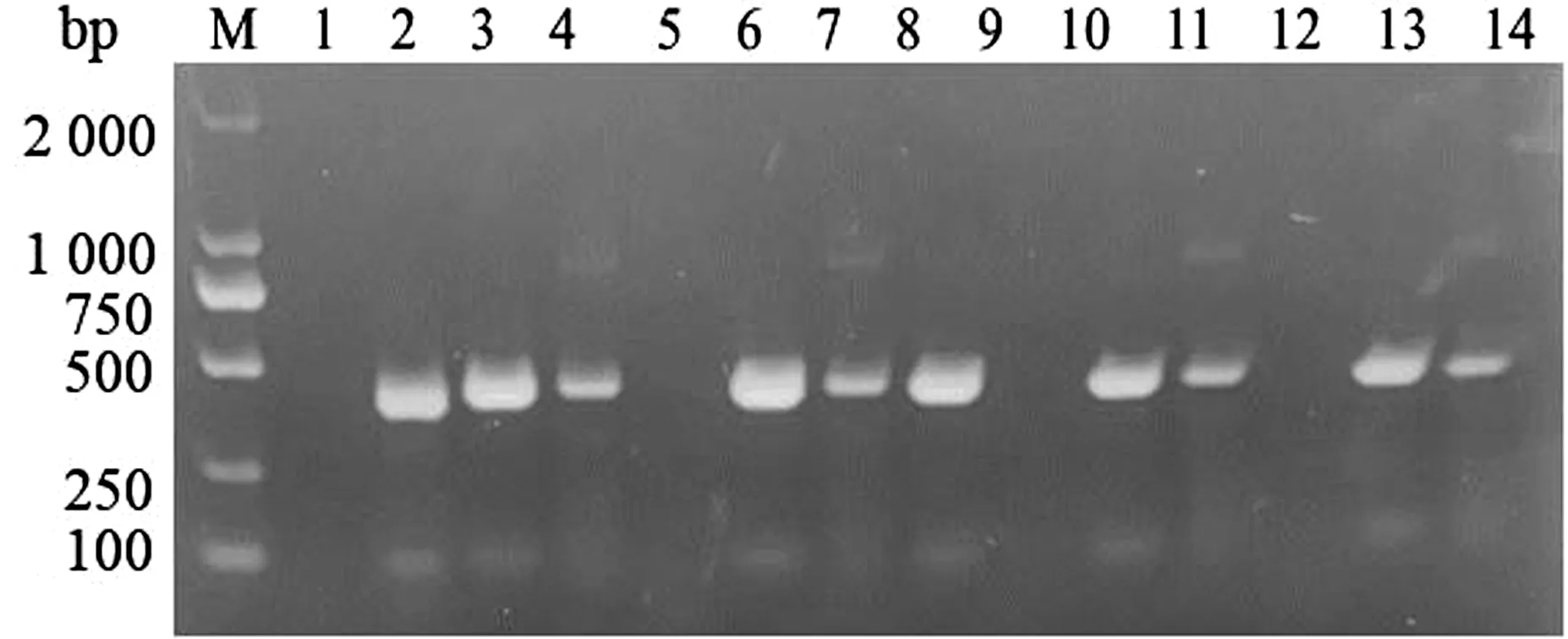
M.DL2000 DNA Marker;1.阴性对照;2~14.32份疑似组织部分检测结果图1 PCV2检测结果

M.DL2000 DNA Marker;1.阴性对照;2~13.PCV2全基因扩增结果图2 PCV2全基因扩增结果
2.2 分离毒株生物学鉴定将筛选出的仅有PCV2 CH/HB/XT01株感染的组织进行研磨,制备组织悬液,过滤除菌后接种PK-15细胞,盲传10代后进行生物学鉴定。
2.2.1分离毒株PCR特异性鉴定 以收集的CH/HB/XT01株的F1,F5,F10细胞病毒液提取的DNA为模板,使用PCV2 F/R进行特异性扩增,琼脂糖凝胶电泳结果显示,PCV2 F/R扩增出1条大小为400 bp左右的电泳条带,与预期片段(422 bp)大小相符(图3)。
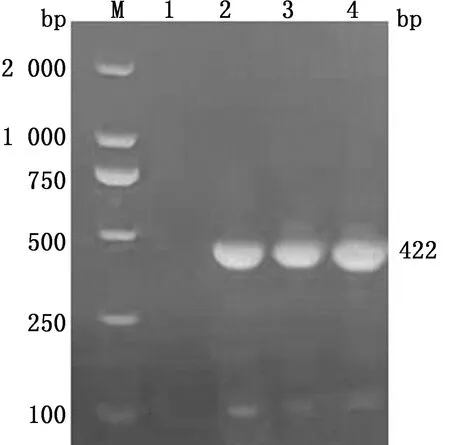
M.DL2000 DNA Marker;1.阴性对照;2.F10病毒液;3.F5病毒液;4.F1病毒液图3 分离毒株PCR鉴定结果
2.2.2间接免疫荧光鉴定 通过间接免疫荧光试验检测CH/HB/XT01株F10细胞病毒液,以实验室保存的鼠源PCV2多抗分别处理感染F10细胞病毒液的PK-15细胞和经PBS处理的对照组PK-15细胞。荧光显微镜下观察到F10细胞病毒液感染的PK-15细胞胞浆内有典型的特异性亮绿色荧光(图4B),而PBS处理的对照组PK-15细胞则未见特异性亮绿色荧光(图4A)。
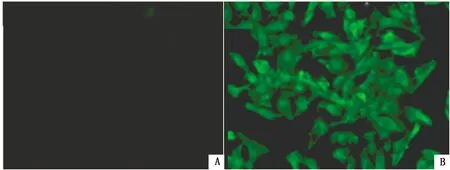
A.阴性对照;B.CH/HB/XT01 F10细胞病毒液感染的PK-15细胞图4 间接免疫荧光鉴定(200×)
2.2.3透射电镜观察 将收集的CH/HB/XT01株F10细胞病毒液通过超高速离心及磷钨酸负染处理后,透射电镜下可观察到球形,边缘清晰,无囊膜,直径约为20 nm的病毒粒子(图5)。

图5 病毒粒子透射电镜观察结果
2.3 分离毒株全基因遗传进化分析将获得的8株PCV2全基因组序列与GenBank中登录的45株PCV2全基因通过MegAlign的Clustal W方法进行核苷酸同源性比对,结果显示获得的8株PCV2全基因序列之间同源性为95.0%~99.8%,与参考序列比对同源性为94.6%~99.0%。使用MEGA 10.0软件采用邻比法构建系统发育进化树(图6),结果显示获得的8株PCV2全基因序列分属于PCV2a、PCV2b和PCV2d分支,其中CH/HB/XT01株同中国山西株SXJX(GenBank登录号:MH922991)处于PCV2a同一分支;CH/HB/CZ01、CH/HB/CZ02、CH/HB/XJ01与朝鲜毒株A4099(GenBank登录号:JF317566)亲缘关系较近,同属于PCV2b分支;CH/HB/HS01、CH/HB/HD01、CH/HB/HD02、CH/HB/HD03与中国吉林株PCV2/NM/NM2/2016(GenBank登录号:MT-302499)同属于PCV2d分支。
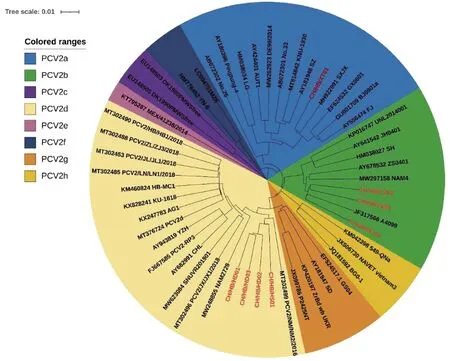
红色字体为本研究毒株图6 PCV2全基因系统进化树
2.4 分离毒株ORF2遗传进化分析获得的8株PCV2 ORF2基因全长均为702 bp,编码233个氨基酸,通过MegAlign的Clustal W方法进行核苷酸同源性比对,结果显示分离的8株PCV2 ORF2基因组序列之间同源性为94%~100%,与GenBank中登录的52株PCV2 OFR2基因参考序列之间同源性为83.5%~99.6%。使用MEGA 10.0软件采用邻比法构建系统发育进化树(图7),结果显示CH/HB/XT01株属于PCV2a分支,同中国山西SXJX株、上海BJ0901a株、北京GX0601株、江苏FJ株亲缘关系较近;CH/HB/CZ01、CH/HB/CZ02和CH/HB/XJ01与朝鲜毒株A4099亲缘关系较近,同属于PCV2b分支;CH/HB/HS01、CH/HB/HD01、CH/HB/HD02和CH/HB/HD03均属于PCV2d分支,其中CH/HB/HS01与中国吉林株PCV2/JL/JL98/2018亲缘关系较近,CH/HB/HD01、CH/HB/HD02和CH/HB/HD03与朝鲜株SNUVR201901亲缘关系较近。
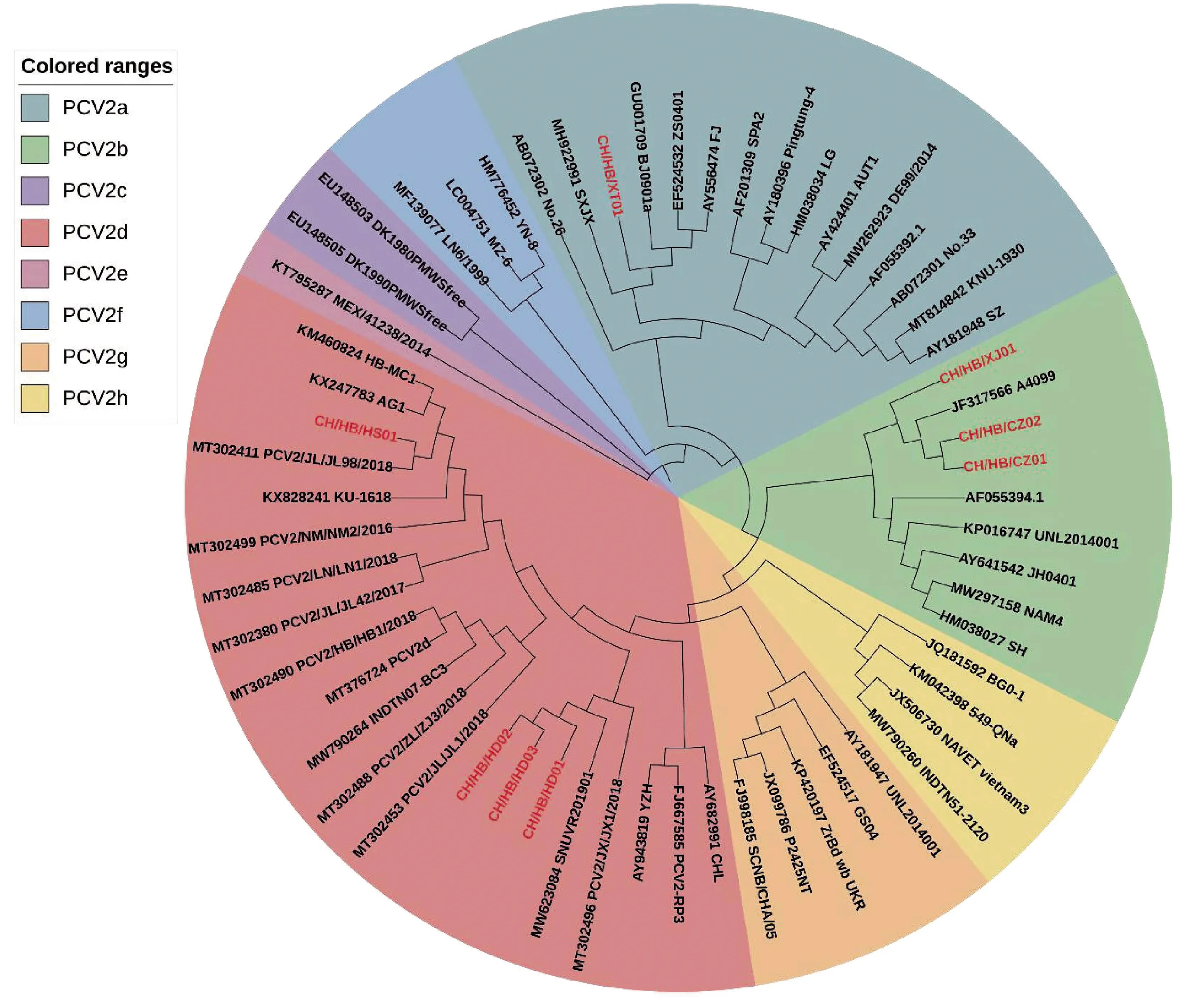
红色字体为本研究毒株图7 PCV2 ORF2基因系统进化树
2.5 分离株ORF2遗传变异分析应用DNAStar软件的MegAlign程序对获得的8株PCV2 ORF2基因编码的Cap蛋白的氨基酸序列同源性及氨基酸突变位点进行分析(图8)。结果显示获得的8株PCV2 Cap蛋白氨基酸同源性为88.5%~100.0%,同属于PCV2b分支的CH/HB/CZ01、CH/HB/CZ02和CH/HB/XJ01, 3株氨基酸序列之间同源性为100%,同属于PCV2d分支的CH/HB/HS01、CH/HB/HD01、CH/HB/HD02和CH/HB/HD-03,4株氨基酸同源性为99.6%~100.0%,与GenBank中登录的52株PCV2 Cap氨基酸参考序列之间同源性为88.5%~100.0%。对氨基酸突变位点进行分析可知,获得的8株PCV2 Cap蛋白氨基酸序列之间存在多处突变,且存在一处变异程度较高的区域,即47~63 aa。CH/HB/HS01、CH/HB/HD01、CH/HB/HD02和CH/HB/HD03第53位的苯丙氨酸(F)突变为异亮氨酸(I),第169位(S)突变为(R);CH/HB/CZ01、CH/HB/CZ02、CH/HB/XJ01第57位的(V)突变为异亮氨酸(I),第59位丙氨酸(A)突变为赖氨酸(K);CH/HB/XT01第57位苏氨酸(T)突变为丝氨酸(S),第63位精氨酸(R)突变为苏氨酸(T),第185位亮氨酸(L)突变为甲硫氨酸(M),第187位亮氨酸(L)突变为异亮氨酸(I),第190位苏氨酸(T)突变为丝氨酸(S),第191位甘氨酸(G)突变为赖氨酸(K),第231位亮氨酸(L)突变为赖氨酸(K)。

红框代表主要抗原表位区域图8 PCV2 Cap蛋白氨基酸序列分析
3 讨论
近年来,由于猪圆环病毒疫苗的普遍使用,猪圆环病毒病在一定程度上得到了有效的控制,但大多数生猪养殖厂仍存在生长猪群感染PCV2的状况,仍困扰着养猪业的发展。本试验首先通过本实验室建立的PCR病原检测方法对收集的32份疑似PCV2感染的样品进行初步筛选,共13份样品呈PCV2阳性结果,其中1份样品为仅PCV2感染,12份样品为PCV2和PRV和(或)CSFV共感染,提示PCV2感染引起猪呼吸道疾病综合征(porcine respiratory disease complex,PRDC)及免疫功能下调,从而削弱PRV 和CSFV疫苗诱导的保护性细胞免疫应答[7-9];PCV2阳性感染率为40.63%,与闫春春[10]运用荧光定量PCR方法对河北省部分地区规模化猪场抽样检测发现PCV2感染率为 65%~89%的结果存在一定差异,该差异可能与地域因素有关。
CH/HB/XT01株病毒液的间接免疫荧光鉴定结果表明感染的PK-15细胞的胞浆内有典型的特异性亮绿色荧光,一定程度上验证了细胞发生大量脱落时处于PCV2感染PK-15细胞的中后期,导致病毒抗原转移到了细胞浆中或病毒借助细胞内的酶系统在细胞浆中合成了病毒抗原,产生PCV2特异性荧光[11-12]。透射电镜结果显示病毒粒子直径约为20 nm,球形,边缘清晰,呈无囊膜包裹的典型圆环病毒结构,该结果与苏金存等[13]分离的安徽株PCV2病毒粒子结构一致。
为进一步了解获得毒株的遗传进化情况,本研究根据PCV2基因组和ORF2基因构建遗传进化树,发现获得的8株PCV2基因组全长均为1 768 bp,分属于PCV2a、PCV2b和PCV2d分支,其中CH/HB/XT01株属于PCV2a分支,与中国山西毒株SXJX株同源性较高;CH/HB/CZ01、CH/HB/CZ02、CH/HB/XJ01同属于PCV2b分支;CH/HB/HS01、CH/HB/HD01、CH/HB/HD02、CH/HB/HD03均属于PCV2d分支。近年来针对河北省PCV2遗传变异分析的研究不是很多,LI等[14]对2004-2014年间分离的12株PCV2阳性毒株进行分析,发现2009年以前PCV2分离株属于PCV2b基因型,2009年以后转向PCV2d基因型;刘玄福等[15]对2015-2017年河北北部的38份PCV2阳性组织进行分析,结果表明河北北部地区以PCV2b和PCV2d毒株流行为主;HAN等[16]对河北省2016-2019年PCV2进行回顾性调查发现179份PCV2阳性组织中普遍存在PCV2a、2b、2d和2e 4种基因型。由此推断,河北省近年来PCV2基因型呈多样性发展,这可能是由于不同规模化养殖场外来引进种猪造成的。
目前,国内使用的PCV2商品化疫苗主要有PCV2a和PCV2b 2个基因型,但由于PCV2抗原的多变性,使得疫苗对该病的防控效果存在一定局限性[15]。PCV2 ORF2基因较短,相对于PCV2全长基因组而言较容易进行基因组测序,因此常常作为遗传进化分析的主要靶基因[17]。ORF2基因编码的Cap蛋白是PCV2的主要抗原结构蛋白和免疫保护性抗原,被认为是PCV2中最易发生变异的结构蛋白,该氨基酸区域含有3个主要抗原表位(分别位于47~63 aa、165~200 aa和230~233 aa)[18],在该区域中最容易发生基因变异,导致毒株致病力增强[19],这也使其成为PCV2遗传变异分析的主要结构区域之一。Cap蛋白的第59位丙氨酸、190位苏氨酸和191位谷氨酸是构象中和表位的组成部分[20-21],第77位天冬酰胺和206位异亮氨酸是抗体识别的关键残基[22]。有研究表明,如果表位中的一个氨基酸发生突变,突变后的病毒不能被该表位的抗体识别[23]。因此,本试验进一步对ORF2基因编码的Cap蛋白氨基酸序列进行分析,结果表明获得的8株PCV2的Cap蛋白氨基酸序列同源性为88.5%~100%,变异程度较大,多数存在6~7个单碱基的点突变,突变位置主要集中在53~90 aa区域,未发现基因插入或缺失突变。与国内外其他参考序列相比变异程度不均一,所有变异均为点突变。本研究获得的PCV2a毒株的氨基酸变异区主要集中在47~63 aa、165~200 aa和230~233 aa抗原表位区域,还有一些集中在71~90 aa非抗原表位区。该结果与薛瑞雪等[24]对山东部分地区流行的PCV2a的氨基酸序列分析结果一致;且本研究获得的PCV2a毒株氨基酸变异区与PCV2a疫苗株氨基酸变异区相似,导致这一结果的原因可能是PCV2a型疫苗免疫效果不理想,无法对宿主产生100%的免疫保护。3株PCV2b毒株氨基酸变异区主要在47~63 aa区域,该结果与LYU 等[25]对中国南部地区PCV2分析略有差异,存在这种差异的原因可能与地域因素及种猪引进有关。PCV2d株的Cap蛋白序列中含有7个独特的氨基酸(53 I、59 K、68 N、89 L、90 T、134 N、169 R),这些氨基酸主要分布在病毒核衣壳表面,不能与SH株疫苗和LG株疫苗刺激机体产生的中和抗体反应。4株PCV2d毒株氨基酸突变主要集中在47~63 aa 和165~200 aa区域,其中包括第53位点的F突变为I,第169位点S突变为R,这些突变可能直接导致PCV2逃脱宿主免疫防御,从而促进PCV2在猪群中传播。虽然目前PCV2疫苗被广泛应用,但PCV2主要抗原表位区的点突变加速了病毒变异,从而使得PCV2逃逸宿主免疫系统的攻击,致使PCV2仍在猪群中流行。因此,为有效防控PCV2传播,应加强对河北省不同区域内PCV2遗传进化的掌控。

