N端截短CBM41对枯草芽孢杆菌来源普鲁兰酶酶学性质的影响
付巧 林啟兰 薛强 熊海容 王亚伟,2
(1. 中南民族大学生命科学学院,武汉 430074;2. 武汉轻工大学生命科学与技术学院,武汉 430048)
普鲁兰酶(pullulanase,EC 3.2.1.41)是一种重要的生物催化剂和脱支酶,能高效裂解普鲁兰多糖、支链淀粉和其它支链多糖的α-1,6-糖苷键[1]。在糖化过程中,普鲁兰酶与糖化酶或β-淀粉酶复配使用来生产麦芽糖糖浆[2-3],除了提高产糖率,还缩短了反应时间。在工业淀粉发酵生产酒精、氨基酸、核苷酸以及抗生素的过程中,应用普鲁兰酶可提高淀粉水解的效率[4-5]。
为了满足工业生产的需求,研究人员对普鲁兰酶的3D结构进行解析,进而改变酶的结构以期获得酶学性质的改良。在Protein Data Bank(PDB)数据库中可以检索到多个已解析的不同来源普鲁兰酶晶体结构。根据Thermotoga petrophila普鲁兰酶[6]、Bacillus subtilis普鲁兰酶[7]、Bacillus naganoensis普鲁兰酶[8]和Bacillus acidopullulyticus普鲁兰酶[9]的3D晶体结构对比发现,普鲁兰酶的保守功能区域具有较高的相似性,在N端结构中普遍存在着一种仅能与底物糖链分子结合却不具有催化功能的结构域,即碳水化合物结合模块(carbohydrate binding modules,CBMs),其中CBM41是普鲁兰酶分子中存在最广泛的CBM结构域家族[10-11]。近年来随着对普鲁兰酶研究的深入,科学家们取得了一些成果,发现N端结构对其酶学性质、酶的表达和动力学参数等显示出不同程度的影响。例如Duan等[12]构建了Bacillus deramificans普鲁兰酶的N端截短突变体,截断CBM41和X25后,酶的比活力提高到野生型的1.1倍,底物亲和力下降。Jiao等[13]通过删除Bacillus megaterium普鲁兰酶CBM41a-CBM41b-X结构域,将突变体的比活力提高8.7倍,且具有更好的热稳定性。Chen等[14]截短B. acidopullulyticus普鲁兰酶N端的结构域CBM41-X25-X45,得到的突变体酶活力提高了2.9倍,热稳定性和pH稳定性也有所提高。对普鲁兰酶CBM41的改造虽然获得了一些性质得到改良的突变体,但对CBM41的关键作用位点及其催化功能的影响机制还有待进一步研究。
课题组前期以枯草芽孢杆菌168(Bacillus subtilis 168)的全基因组为模板,扩增出普鲁兰酶PulB基因序列,与已报道的普鲁兰酶(PDB:2E8Y)序列相似性高达99.72%,其中除第365位的氨基酸由K变为M,第553位的氨基酸由V变为A外,其余序列均一致。根据2E8Y模拟普鲁兰酶3D结构,发现在CBM41结构域的N端出现1-6个氨基酸形成的无规则片段,此区域柔性较大,易受温度和pH的影响,通过删去CBM41结构域N端前2、4、6个氨基酸,构建不同形式的N端截短突变体,以期获得性质更加优良的菌株,对比截短突变体与野生型普鲁兰酶(WT)酶学特性上的差异,为简化Bacillus subtilis 168普鲁兰酶编码基因,解析CBM41结构域与功能的关系等方面的研究工作提供方法和思路。
1 材料与方法
1.1 材料
1.1.1 菌种与质粒 枯草芽孢杆菌168菌株由本实验室保藏。表达载体pET-22b(+)和大肠杆菌Escherichia coli BL21(DE3)均获赠于中国农业科学院饲料研究所。
1.1.2 工具酶及试剂 限制性内切酶Nco I(1160A)、Xho I(1094A)、连 接 酶T4 DNA Ligase(2011A)、DNA分子量标记和蛋白质分子量标记均购于宝日医生物技术(北京)有限公司,SDS-PAGE凝胶快速配制试剂盒(P0012AC)购自上海碧云天生物技术有限公司,质粒小量试剂盒和DNA凝胶回收试剂盒购自天根生化科技(北京)有限公司,底物支链淀粉(KV370014)购自上海源叶生物科技有限公司,牛肉膏(LP0029B)、酵母浸粉(LP0021)和蛋白胨(LP0042)购于赛默飞世尔科技(Thermo Fisher Scientific)公司,其余试剂均是国产分析纯。
1.2 方法
1.2.1 序列分析和结构模拟 使用SignalP5.0 (http://www.cbs.dtu.dk/services/SignalP/)分析预测已收录于NCBI数据库中Bacillus subtilis 168来源的普鲁兰酶(GenBank Accession No. NP_390871.2)蛋白质序列的信号肽,推断该酶的胞内/外释放特征。使用PyMOL软件(http://pymol.org/)模拟研究中所获得重组普鲁兰酶PulB的立体结构。
1.2.2 普鲁兰酶截短突变体的设计和构建 以枯草芽孢杆菌Bacillus subtilis 168基因组中普鲁兰酶基因(GenBank:QJR47579.1)为参考,采用引物如表1,通过PCR技术扩增目的基因PulB、PulBΔN2、PulBΔN4和PulBΔN6,使用限制性内切酶Nco I和Xho I对目的基因与载体pET-22b(+)进行双酶切,酶切产物通过T4 DNA Ligase连接后转化至大肠杆菌BL21中[15],挑取阳性单克隆送交武汉擎科生物技术有限公司测序验证,将测序正确的重组菌株培养保藏,分别标记为BL21-pET-22b(+)-PulB、BL21-pET-22b(+)-PulBΔN2、BL21-pET-22b(+)-PulBΔN4和BL21-pET-22b(+)-PulBΔN6。

表1 野生型及其截短突变体扩增用引物Table 1 Primers for amplification of wild-type and truncated mutants
1.2.3 截短突变体的诱导表达和纯化 将转化成功的阳性重组菌株接种到LB培养基中,37℃、220 r/min条件下振荡培养,当菌液的OD600达到0.6-0.8时,加入终浓度为0.1 mg/mL的IPTG,30℃、220 r/min诱导16-20 h。将发酵液在4℃、5 000 r/min下离心5 min,离心得到的上清液作为胞外组分,收集离心后菌体并在高压细胞破碎仪下破碎,4℃,8 000 r/min下离心10 min,得到的上清液作为胞内可溶组分。重组蛋白带有组氨酸标签,使用镍柱亲和层析法纯化蛋白并进行SDS-PAGE电泳分析,检测目的蛋白的表达情况[16]。
1.2.4 截短突变体的酶活性分析 采用3,5-二硝基水杨酸方法(简称DNS方法)[17]对普鲁兰酶酶活力进行鉴定,以0.5%支链淀粉为底物。在相应的温度、pH下,取0.9 mL的底物放入到试管中,预热5 min后,加入0.1 mL酶液与其反应30 min,迅速加入1.5 mL的DNS试剂终止酶解反应,并于沸水浴中煮沸5 min进行显色反应,将上述反应液置于冰水中冷却后测定OD540吸光度。一个酶活力单位定义为在pH 6.0和40℃条件下,每分钟催化产生1 μmol葡萄糖所需的酶量。其计算公式如下:普鲁兰酶酶活(U/mL)=W×N×1 000/(180.16×30×0.1)。其中W(mg)为酶解产生的葡萄糖量,N为稀释倍数,1 000为单位mmol转换为μmol的系数,180.16 (g/mol)为葡萄糖分子量,30(min)为反应时间, 0.1(mL)为适当稀释后酶液体积。
1.2.5 截短突变体的酶学性质分析
1.2.5.1 最适pH及pH稳定性测定 配制不同pH的缓冲液:50 mmol/L柠檬酸-磷酸氢二钠(pH 4.0-8.0)和50 mmol/L Tris-HCl(pH 7.0-9.0)。在最适温度下,分别测定不同pH下的酶活力,酶活力最高点为最适反应pH,以最大酶活力值为100%计算其他pH下的相对酶活力。在室温条件下,将粗酶液分别置于pH 4.0-9.0缓冲液中处理1 h后,以未处理的样品作为对照,于最适温度下测定其剩余酶活力。
1.2.5.2 最适反应温度及热稳定性测定 在pH 6.0反应条件下,分别测定不同温度梯度(30-60℃)下的酶活力,酶活力最高点为最适反应温度,以普鲁兰酶的最大酶活值为100%,计算不同温度下的相对酶活力。将粗酶液分别置于30-60℃条件下处理1 h,处理后的酶液加入到底物中,于最适温度下反应30 min,以未处理的样品作为对照,分别测定其剩余酶活力。
1.2.5.3 表观解链温度值测量 Tm值的测定采用差示扫描荧光定量法(differential scanning fluorometry,DSF)[18],将20 μL纯 化 后 的 蛋 白 质 与5 μL的100×SYPRO Orange染料混合离心,实时荧光定量PCR系统中以1℃/min的速度从20℃到80℃加热样品来测定Tm值。
2 结果
2.1 截短突变体的构建
如图1,依据普鲁兰酶PulB的立体结构设计3种突变体,分别是依次删除CBM41结构域N端的甲硫氨酸和缬氨酸的突变体PulBΔN2(M1),删去甲硫氨酸、缬氨酸、丝氨酸、异亮氨酸的突变体PulBΔN4(M2)以及删去甲硫氨酸、缬氨酸、丝氨酸、异亮氨酸和两个精氨酸的突变体PulBΔN6(M3)。

图1 枯草芽孢杆菌168来源普鲁兰酶结构示意图Fig.1 Structure of pullulanase from B. subtilis 168
对构建的截短突变体菌株进行菌落PCR鉴定,如图2所示,在2 000 bp条带附近有一条约为2.1 kb的特异性条带,与目的条带大小相当,同时将获得的重组突变体质粒送武汉擎科生物技术有限公司测序验证,测序结果表明突变位点和设计位点完全一致,N端截短突变体构建成功。
图2 截短突变体菌落PCR鉴定图Fig.2 PCR identification of truncated mutants colonies
2.2 截短突变体的表达、纯化及动力学参数测定
将带有截短突变体基因的重组表达载体转入大肠杆菌BL21中,加入IPTG诱导表达,发酵上清液中检测不到酶活。SignalP5.0预测普鲁兰酶信号肽结果显示该酶不含有信号肽,且普鲁兰酶的分子量约为80 kD,分子量太大也可能使其难以在胞外表达。超声破碎菌体并进行镍柱纯化,使用SDS-PAGE凝胶电泳检测表达情况,结果如图3所示,野生型及截短突变体的胞内可溶组分中均出现1条分子量约80 kD的条带,此条带大小与目标蛋白的大小相当,说明普鲁兰酶PulB及其截短突变体在大肠杆菌中的表达为可溶性的蛋白形式。

图3 野生型普鲁兰酶及其截短突变体纯化后SDS-PAGEFig.3 SDS-PAGE analysis of the purified wild-type pullulanase and the truncated mutants
通过测定纯化后重组蛋白酶活及蛋白浓度,计算得到比酶活,WT、M1、M2和M3比酶活分别为2.30、2.72、3.69和5.62 U/mg。以支链淀粉为底物分别对重组蛋白Km和Vmax值进行测定,WT、M1、M2和M3的Km值分别为23.89、29.01、17.29和19.08 mg/mL;Vmax值分别为4.06、2.35、3.92和 7.24 U/mg。
2.3 最适pH及酸碱稳定性
3个截短突变体最适pH均为6.0(图4-A),与野生型一致。野生型和不同突变体的酸碱稳定性有一定差异(图4-B),相比于WT,M1提高了pH稳定性,在磷酸缓冲液pH 5.0-8.0处理1 h后,M1剩余酶活力皆可达到50%以上,而WT剩余酶活力只剩不足43%;M2和M3在磷酸缓冲液pH 4.0-8.0处理1 h后,剩余酶活力普遍低于WT。

图4 野生型及其截短突变体的最适pH及pH稳定性Fig.4 Optimal pH and pH stability of wild-type pullulanase and the truncated mutants
2.4 最适温度及温度稳定性
如图5所示,截短突变体对最适温度影响较小,野生型和截短突变体最适温度曲线变化趋势大致相同,最适温度都在40-45℃。热稳定性结果显示野生型及突变体普鲁兰酶在30-50℃下稳定性很好,但是当处理温度大于50℃剩余酶活力迅速下降,如在55℃下处理1 h后WT、M1、M2和M3剩余酶活力分别为45.29%、63.19%、51.75%和47.33%,各突变体比野生型残余酶活有所提高,尤其是M1比WT残余酶活提高了17.90%。
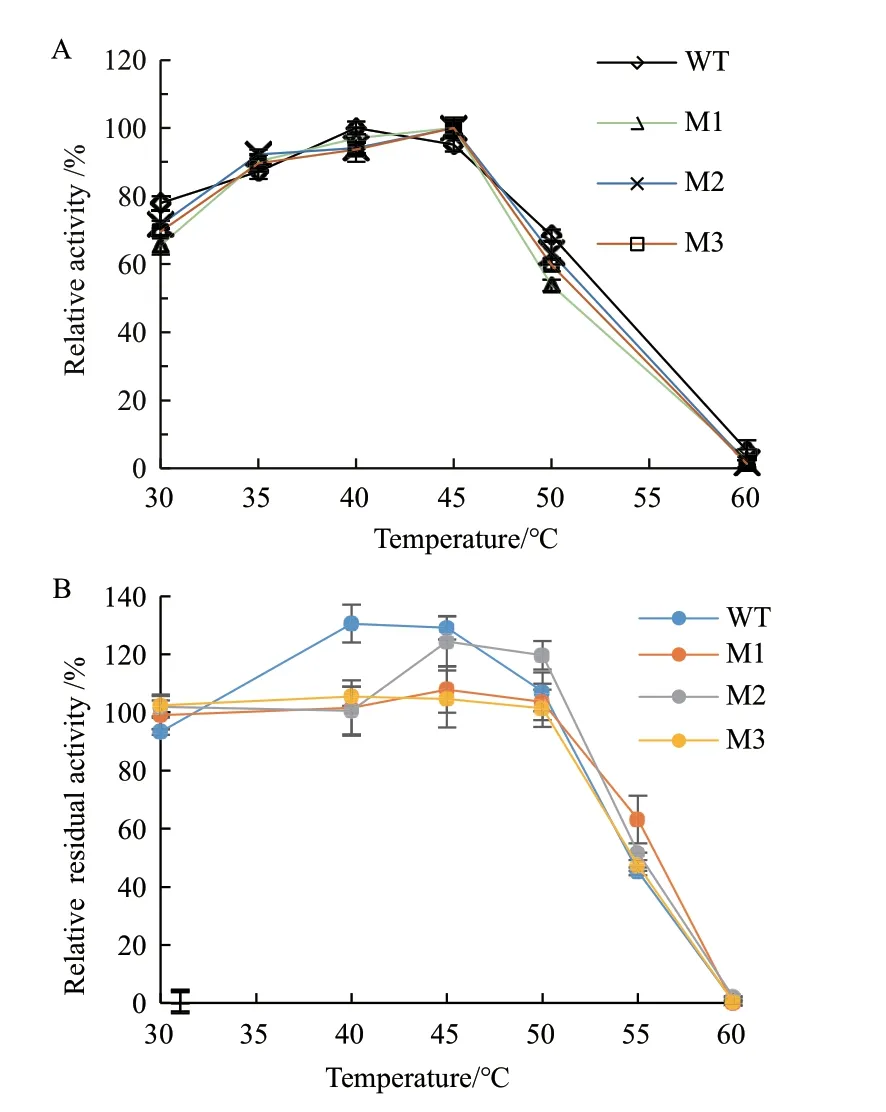
图5 野生型及其截短突变体的最适温度及热稳定性Fig.5 Optimal temperature and thermostability of wildtype pullulanase and the truncated mutants
2.5 表观解链温度值测量
使用DSF法测定野生型和突变体普鲁兰酶表观解链温度Tm值,图中的峰值所对应的温度即为蛋白质的Tm值,提高热稳定性的突变,其峰形右移;而降低热稳定性的突变,其峰形左移。如图6所示,与野生型WT进行比较,突变体M2峰形几乎没有变化,突变体M1和M3峰形右移。WT、M1、M2和M3的Tm值分别为48.57℃、50.03℃、48.43℃和49.50℃。

图6 野生型及其截短突变体Tm值测定Fig.6 Tm determination of wild-type pullulanase and the truncated mutants
归纳上述结果如表2,相比于WT,突变体的比活力均有不同程度的提高,M1、M2和M3的比活力分别为WT的1.18、1.60和2.44倍;M2和M3的Km值分别降低0.72和0.80 mg/mL,M3的Vmax增加3.18 U/mg;M1和M3的Tm值比WT增加了1.57℃和0.93℃。

表2 普鲁兰酶及其截短突变体比酶活、动力学参数及Tm值比较Table 2 Comparison of specific activity,kinetic parameters and Tm of pullulanase and the truncated mutants
3 讨论
CBM41是CBM家族中存在最广泛的家族之一,它主要与降解糖原的催化结构域连接,CBM41形成一个β-三明治结构,其C-末端包埋在β-片层的内部,而N-末端位于β-片层的侧面,直接暴露在亲水环境中,因此N-末端结构对于酶的整体稳定性起重要作用[19]。
本研究通过删去CBM41结构域N端氨基酸,获得突变体M1、M2和M3。实验结果表明,N端氨基酸截短在一定程度上增强酶的热稳定性以及底物亲和力,与野生型相比M1和M3的Tm值分别提高1.57℃和0.93℃,M1和M2的Km降低。这一观点与前人的研究结果一致,王馨叶[20]截短Bacillus naganoensis普鲁兰酶N端不同长度氨基酸,获得截短突变体ΔN5和ΔN106的半衰期增长,Km值减小。Nisha等[21]通过截短Geobacillus thermoleovorans普鲁兰酶的N端氨基酸,构建了N端1-257位氨基酸缺失的突变体,其酶活和热稳定性都有明显提高。分析Bacillus subtilis168来源普鲁兰酶蛋白结构发现,CBM41结构域的N端氨基酸没有形成规则二级结构同时在三级结构中处于N端游离的末端。二级结构中无规则片段柔性较大,易受温度、pH的影响,更容易失活,叶延欣等[22]发现影响热稳定性的主要因素是α-螺旋含量和无规则片段含量,降低二级结构中无规则片段的含量使螺旋的含量增加可以提高酶的热稳定性。CBM41结构域与酶-底物结合相互作用密切相关,去除N端氨基酸所形成的无规则片段使其结构更加紧凑,同时也使酶与底物结合的空间位阻变小[23],因此增强底物的亲和力。
与M1相比M3的Km值增加,Tm降低0.53℃。M3多删除的4个氨基酸中有两个为精氨酸,精氨酸侧链为长链,可更好的维持蛋白结构,删除精氨酸可能使蛋白分子更容易变性,从而降低底物亲和力。普鲁兰酶N端第6位精氨酸与第84位天冬氨酸形成氢键,Li等[24]的研究表明氢键是稳定蛋白二级结构的重要作用力,对维持热稳定性有着重要意义,增加一个氢键,能使酶获得0.6 Kcal/mol的能量来维持稳定性。因此M3的Tm值低于M1可能是由于其氢键损失导致。
4 结论
CBM41结构域N端截短6个氨基酸,普鲁兰酶最适反应温度和pH无变化,提升了酶活性和Tm。与野生型普鲁兰酶相比,3个截短突变体中M3性质改良综合优势较为明显,比活力是WT的2.44倍,Tm提高0.93℃,Km降低0.80倍。M2的底物亲和力最强,然而比活力和热稳定性低于M3;M1的Tm最高,然而酶活性最低。因此,经截短改造的突变体酶学性质有一定程度的改良,为解析普鲁兰酶结构与功能的关系提供了相关实验依据和分析方法。

