牦牛TGF-β1基因克隆及在雌性生殖系统主要器官中的表达定位
王楠 张瑞 潘阳阳 何翃宏 王靖雷 崔燕 余四九
(甘肃农业大学动物医学院/甘肃省牛羊胚胎工程技术研究中心,兰州 730070)
牦牛(Bos grunniens)分布在以中国青藏高原为中心的“3 000-6 000”米的高海拔地区,素有“高原之舟”“世界屋脊”的美称[1],能够在强辐射、酷寒、空气稀疏的恶劣生态环境中活动自在,繁殖后代,又可为当地牧民提供肉、奶、毛和役力等生产和生活所需品,是当地不可或缺的重要畜种。可是牦牛相比平原牛种,繁殖力低下,性成熟晚,成为了影响高寒地区牧民经济收入的重要因素[2]。
TGF-β超家族是一类生物活性很高,临床应用前景很好,对细胞增殖和分化有多种调节作用的多肽生长因子[3]。其主要包括TGF-Bs、骨形态发生蛋白(bone morphogenetic proteins,BMP)、活化素、生长和分化因子、AMH和抑制素。这类生长因子已被表明在细胞生长、增殖分化、黏附、迁移及Th17反应的极化、ROS的产生和凋亡中发挥重要作用[4-8]。TGF-β存在4种亚型,为TGF-β1、TGF-β2、TGF-β3及TGF-β5,存在哺乳动物体内仅有TGF-β1、TGF-β2和TGF-β3三种变异体,这3种结构相似的变异体高度保守,在生物反应中作用相似[9]。TGF-β1作为生长因子家族的原型成员,其活性最强,对其的研究最深。TGF-β1最早发现与1978年,是首次发现的一种多肽细胞因子[10-11]。机体多种组织和细胞均可产生TGF-β1,其在不同的条件下发挥不同的生物学效应。目前已发现TGF-β1参与的生物学作用主要有细胞的增殖、分化、迁移、黏附、凋亡、细胞外基质的形成、胚胎的生长发育、创伤后的修复、骨重建等重要过程[12]。其中TGF-β1对哺乳动物生殖发育过程至关重要,通常具有调控胚胎生长发育和细胞稳态的重要功能。有研究表明,TGF-β1作为哺乳动物胚胎发育过程中最关键的形态发生物质,参与胚胎肢端发芽、脊椎骨形成、面骨形成和心脏瓣膜生成等重要步骤[13]。近年来,随着对该因子的深入研究,人们又发现TGF-β1在卵巢中也发挥着不可小觑的作用,可参与排卵发生、细胞外基质调控的自分泌旁分泌、调节卵母细胞卵泡发育、与颗粒细胞之间的信号传递等[14]。研究表明,正常情况下,TGF-β1主要位于窦卵泡的卵泡膜细胞(granular cell TC)、初级卵泡的卵母细胞、颗粒细胞(ovarian granulosacell,GC)及卵巢间质中,在卵泡发育末期,TGF-β1可以通过诱导TC及GC的增殖分化,细胞凋亡,进而参与卵泡闭锁过程,并可维持卵巢黄体,刺激孕酮产生[15]。而TGF-β1作为卵巢中重要的自分泌/旁分泌因子,可通过激活SMAD通路促进颗粒细胞透明质酸的合成,进而参与COC细胞外基质形成的调控[16-17]。据报道,敲除小鼠体内TGF-β1 I型受体,阻断TGF-β1信号通路,会导致小鼠输卵管及子宫发育异常,致小鼠不孕[18]。但其在牦牛生殖发育中的研究,鲜见报道。因此,本实验成功克隆牦牛TGF-β1基因,并进行生物学信息分析,探讨牦牛TGF-β1基因与其他牛种之间的差异性。利用qRT-PCR、IHC、WB等方法检测正常生理条件下TGF-β1在雌性牦牛发情期和妊娠期卵巢、输卵管和子宫的表达,为进一步研究TGF-β1参与牦牛生殖发育的分子机制提供了基础数据,对改善牦牛的繁殖力,增加牧民收入具有重要的意义。
1 材料与方法
1.1 材料
TranZol、E.coli DH5α感受肽细胞均购自(全式金,北京),SYBR®Premix Ex TapTMEraserTM、Taq PCR Master Mix and pMDTM19-T Vector Cloning Kit均购自(TaKaRa,大连)、通用型DNA纯化回收试剂盒(北京,天根),SP试剂盒、IPTG、4×蛋白上样缓冲液均购自(Solarbio公司,北京)、TGF beta1 Antibody(AF1027)(Affinity公司,美国)、GAPDH(武汉三鹰)、Goat anti-rabbit IgG-HRP antibody(博奥森,北京),普通PCR仪(艾本德公司,德国)、实时荧光定量PCR仪(LightCycler® 96 SW 1,loch1公司,瑞士)、恒温培养箱(松下,日本)、显微镜(DP71,Olympus,日本)。
1.2 方法
1.2.1 样品的采集 试验所用的样品于2020年9月采集青海省西宁市马佳肴屠宰场,选取健康且年龄(3-6岁)的发情期和妊娠期的雌性牦牛各4头,颈动脉致死后,分别取不同时期(卵泡期、黄体期、妊娠期)的不同部位(卵巢、输卵管、子宫),用生理盐水冲洗后浸泡于4%的多聚甲醛固定(修剪组织块大小为1 cm3)用于后期免疫组化的实验,其他剩余组织锡箔纸包裹放于液氮罐,-80℃保存,用于后期分子实验。
1.2.2 牦牛TGF-β1基因克隆
1.2.2.1 引物的设计 参照GenBank公布的普通牛(Bos taurus)TGF-β1基因和牦牛内参基因甘油醛-3-磷酸脱氢酶基因(glyceraldehyde-3-phosphate dehydrogenase,GAPDH),利 用NCBI Primer-BLAST设计牦牛的TGF-β1基因上下游引物用于基因序列的克隆,引物D-TGFβ1、TGF-β1用于实时荧光定量检测。内参引物为GAPDH,所用引物均在上海生工合成,具体引物信息见表1。
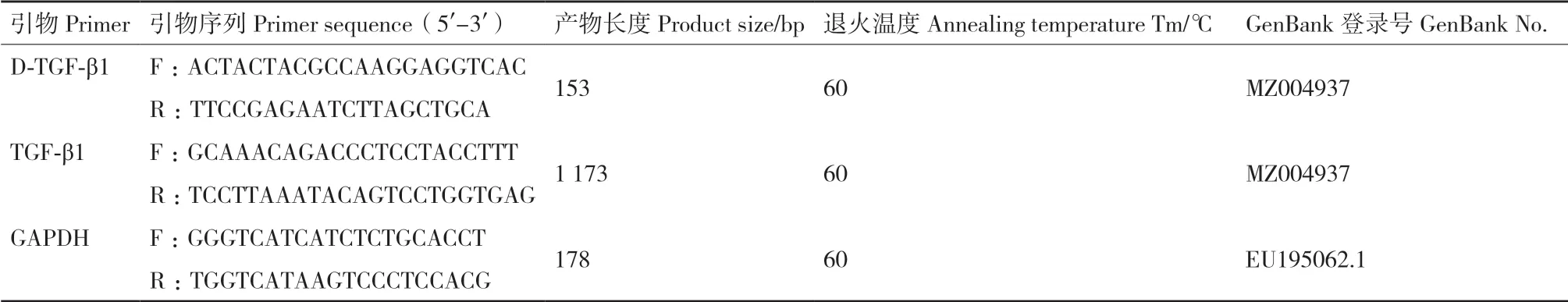
表1 引物序列及长度Table 1 Primer sequences and length
1.2.2.2 总RNA、蛋白提取及目的基因的扩增 从-80℃超低温冰箱中取出发情期和妊娠期不同部位的雌性牦牛组织,参照TransZol试剂盒说明书提取总RNA,利用分光光度计测定RNA浓度和OD260/OD280值,将RNA浓度调成一致,参照两步法反转录试剂盒说明书(Go ScriptTM Reverse Transcription Syatem,Promega)合 成cDNA,-20℃保存备用。参照RIPA组织蛋白提取试剂盒说明书,提取组织总蛋白,-80℃保存备用。
1.2.2.3 牦牛TGF-β1基因的克隆 以牦牛cDNA为模板,TGF-β1为引物,扩增牦牛TGF-β1基因全序列。PCR总反应体系为20 μL:Taq PCR Master Mix 10 μL,ddH2O 8 μL,模板1 μL,上下游引物各0.5 μL。琼脂凝胶电泳验证。PCR反应条件为预变性(95℃ 4 min);变性(95℃ 30 s);退火(60℃ 30 s);延伸(72℃ 15 s);循环40次;72℃保存5 min;最后保存于4℃,琼脂凝胶电泳验证扩增结果。用胶回收试剂盒回收纯化目的条带。将纯化的胶回收产物与pMDTM19-T Vector进行连接,将连接产物(10 μL)转化至100 μL JM109感受态细胞后,于含有X-Gal、IPTG、AMP的LB固体培养基中37℃过夜培养,挑取单颗菌进行菌落PCR验证,将验证正确的阳性克隆菌落扩大培养,所得菌液送至上海生工进行测序。
1.2.2.4 生物信息学分析 NCBI-ORF在线软件(https://www.ncbi.nlm.nih.gov/orffinder/)进行开放阅读 框 分 析,NCBI-BLAST(https://blast.ncbi.nlm.nih.gov/Blast.cgi)对比分析牦牛TGF-β1基因相似性,利用软件MEGA7.0构建系统发育树,利用ExPASy-Protparam(https://web.expasy.org/protparam/)在线软件分析牦牛TGF-β1基因编码蛋白质的理化性质,利用在线软件TMHMM ServerV.2.0(http://www.cbs.dtu.dk/services/TMHMM-2.0/)预测牦牛TGF-β1基因编码蛋白跨膜区域,利用IBCP在线软件(http://npsa-pbil.ibcp.fr/cgi-bin/npsa_automat.pl?page=npsa_gor4.html)预测其蛋白质的二级结构,利用软件SWISS-MODEL(https://swissmodel.expasy.org)预测其蛋白质的三级结构,利用在线软件Protscale(https://web.expasy.org/protscale/)分析其蛋白亲疏水性,利用在线软件Netphos(http://www.cbs.dtu.dk/services/NetPhos/) 预测其磷酸化位点。
1.2.3 qRT-PCR检测TGF-β1基因的表达 利用qRT-PCR检测牦牛TGF-β1基因在牦牛发情期和妊娠期主要生殖器官的表达情况,以牦牛cDNA为模板,D-TGF-β1为引物进行扩增反应体系为20 μL:cDNA为2 μL,上下游引物为0.8 μL,无菌去离子水6.4 μL,SYBR®Premix Ex TapTMEraserTM10 μL,3 Step Amplification:(95℃,5 s)、(60℃,30 s)、(72℃,12 s)、40个循环(n=4)。根据cq值以2-ΔΔCt计算[19]TGF-β1基因在发情期和妊娠期卵巢,输卵管和子宫中的相对表达量。
1.2.4 Western blot检测TGF-β1蛋白的表达
1.2.4.1 蛋白样品的制备 将牦牛发情期和妊娠期卵巢、输卵管和子宫的蛋白样品与4X蛋白上样缓冲液按照3∶1比例配置蛋白工作液,金属浴变性(100℃,10 min),冰上静置10 min后,-20℃保存备用。
1.2.4.2 Western blot SDS PAGE凝胶电泳,分别配置12%分离胶和5%的浓缩胶进行电泳,电泳结束后按照目的蛋白大小切胶将其转至PVDF膜上,转膜结束后5%脱脂奶粉封闭,TGF beta1 Antibody(1∶1 500稀释)4℃孵育过夜,PBST清洗一抗,10 min/次,共1 h,Goat Anti-Rabbit IgG/HRP antibody室温孵育1 h,PBST清洗,10 min/次,共1 h。使用GEAI600化学发光仪成像系统扫描目的条带,利用成像结果计算灰度值分析TGF-β1蛋白相对表达量(目的灰度数值/内参灰度数值)。
1.2.5 免疫组化法对TGF-β1蛋白表达进行定位 选取固定于4%多聚甲醛溶液中的卵巢、输卵管和子宫组织块自来水冲洗24 h,上行酒精脱水,酒苯透明浸蜡,进行石蜡包埋,切成4 μm的组织切片,烘片机上烘片6 h,下行酒精脱蜡,抗原修复(柠檬酸盐缓冲液-微波热修复法),阻断(滴加3%H2O2溶液37℃作用10 min),封闭(擦干组织后滴加SPA试剂盒A液作用15 min),一抗反应((Rabbit Anti-TGF-β1 antibody)1∶150稀释后4℃孵育过夜),添加对照组(PBS代替一抗),二抗反应(滴加二抗SPA试剂盒B液37℃湿盒孵育15min),三抗反应(滴加三抗SPA试剂盒C液37℃湿盒孵育15 min),DAB显色,苏木精复染后盐酸酒精分化、自来水返蓝脱水、透明、树脂封片,待晾干至于显微镜(DP71,Olympus,日本)进行拍照。
1.2.6 数据分析 采用ImageJ软件根据灰度值分析蛋白表达量(目的灰度数值/内参灰度数值)。运用SPSS21.0对TGF-β1基因和蛋白的相对表达量差异显著性进行单因素方差(ANOVA)分析(均值两两比较),极显著(P<0.01),显著(P<0.05),结果以±SE(平均值±标准误)表示,用GraphPad Prism8绘制数据图。
2 结果
2.1 牦牛TGF-β1基因的扩增与克隆
以内参引物GAPDH、引物D-TGF-β1检测牦牛cDNA模板,结果显示(图1),条带单一,在178 bp、153 bp处有清晰目的条带,cDNA可用于后续实验。以TGF-β1为引物,扩增牦牛TGF-β1全CDS区,结果显示(图2),在1 173 bp处出现单一条带,与预期大小一致,经克隆测序结果比对后,其与参考序列高度一致,将其提交至GenBank,登陆号为MZ004937。
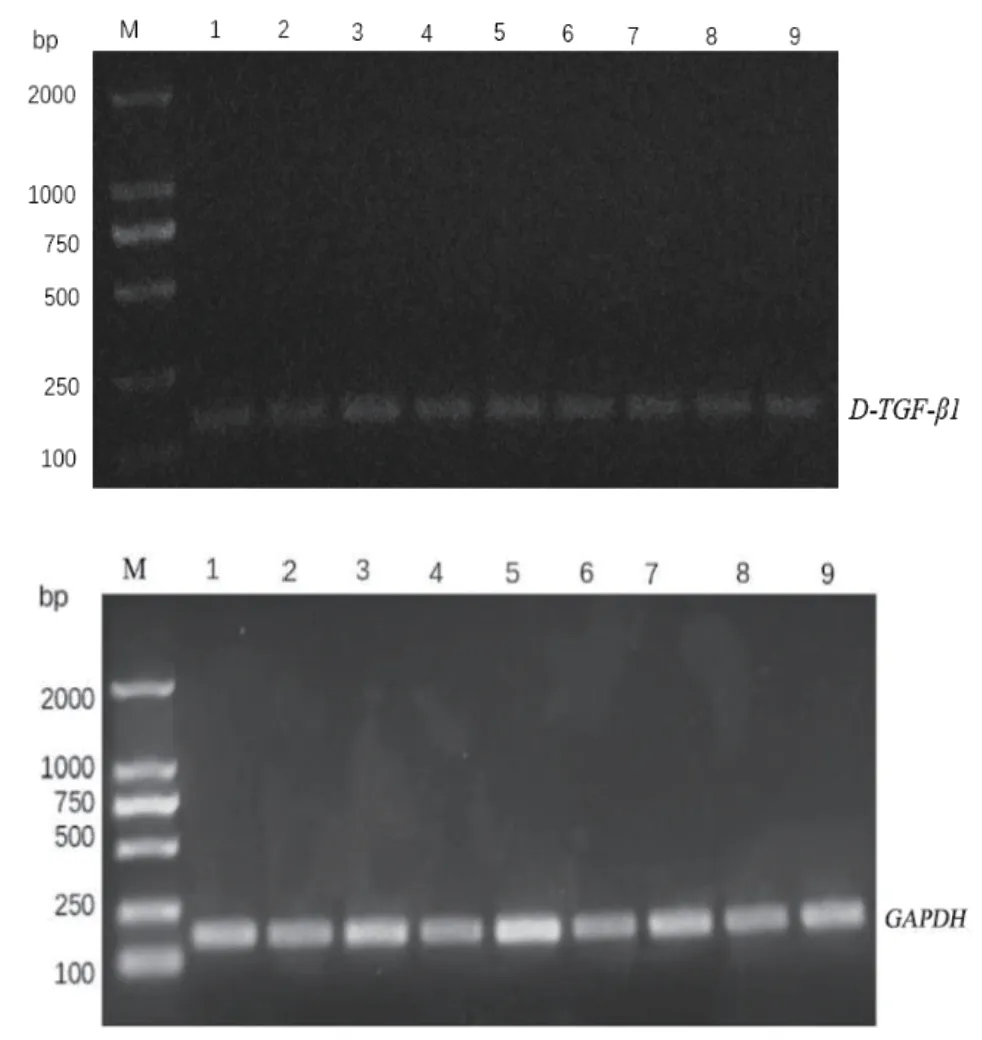
图1 D-TGF-β1、GAPDH基因 PCR扩增电泳Fig. 1 D-TGF-β1 and GAPDH PCR amplification electrophoresis
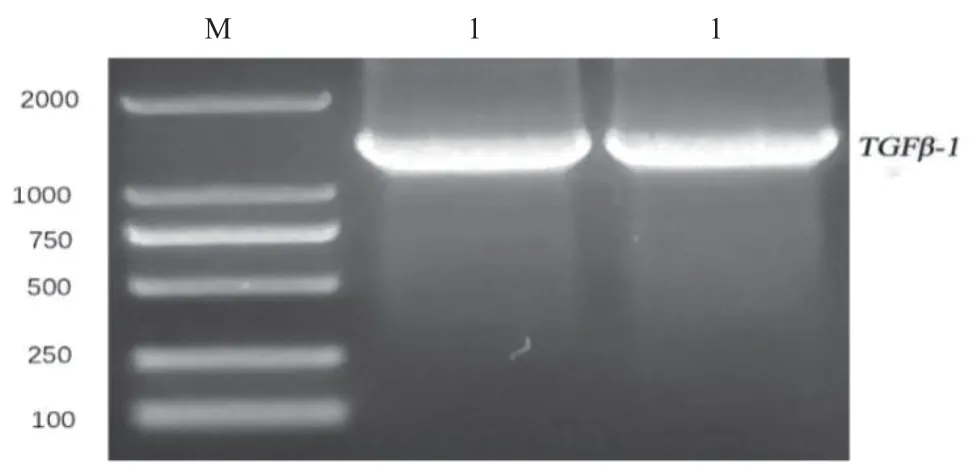
图2 TGF-β1 PCR扩增电泳Fig. 2 TGF-β1 PCR amplification electrophoresis
2.2 生物信息学分析
2.2.1 TGF-β1基因开放阅读框分析及系统进化树构建 牦牛TGF-β1基因开放阅读框分析结果显示,牦牛TGF-β1基因全长1 173 bp,编码390个氨基酸。NCBI-BLAST比对核苷酸相似性结果显示,牦牛TGF-β1基因与瘤牛×普通牛(Bos indicus×Bos taurus)相似性最高为99%以上,与山羊(Capra hircus)、绵羊(Ovis aries)相似性为98%,与家猫(Felis catus)、犬(Canine)相似性最低为91%左右,与瘤牛×普通牛相比,其核苷酸序列在第1 168位出现差异,所编码氨基酸由丙氨酸突变为甘氨酸(图3)。构建系统进化树结果显示(图4),牦牛TGF-β1基因与普通牛的亲缘关系最近,与瘤牛×普通牛次之,与犬、大熊猫的亲缘性最远。

图3 不同物种间TGF-β1基因序列比对Fig. 3 Sequence alignment of TGF-β1 gene among different species
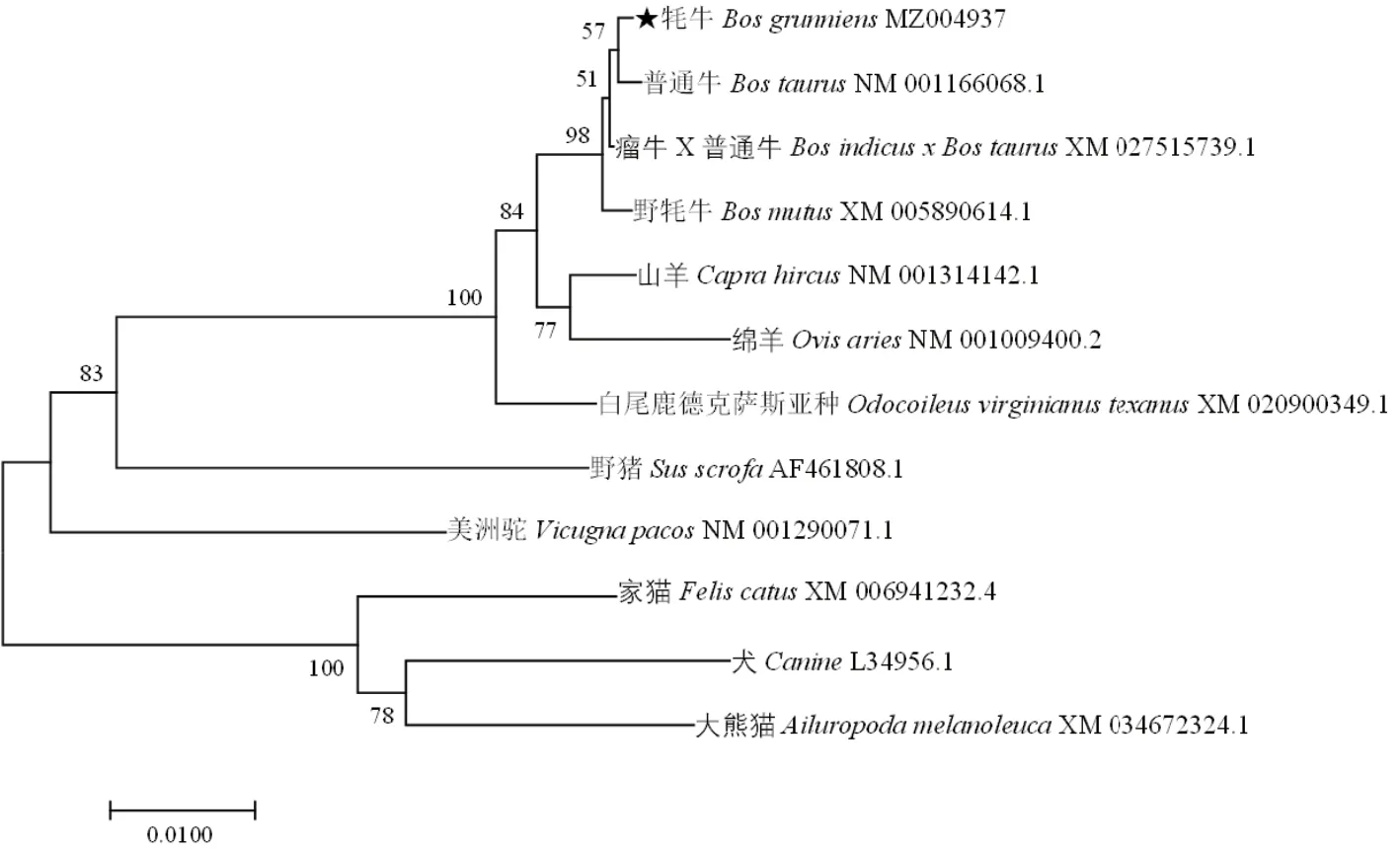
图4 TGF-β1基因的系统进化树Fig.4 Phylogenetic tree of TGF-β1gene
2.2.2 牦牛TGF-β1基因编码蛋白的理化性质分析 牦牛TGF-β1基因编码蛋白质的理化性质分析结果显示,TGF-β1蛋白分子量大小44.4 kD,理论等电点(pI)8.97,原子总数6 256,不稳定指数(Ⅱ)52.97,为不稳定蛋白。共编码氨基酸390个,其中含量最高的氨基酸是亮氨酸(Leu)13.3%,含量最低的氨基酸是色氨酸(Trp)1.8%,带负电荷的氨基酸(Asp+Glu)40个,占氨基酸总数的7.6%;带正电荷的氨基酸(Arg+Lys)50个,占氨基酸总数的12.8%。
2.2.3 牦牛TGF-β1基因编码蛋白质二级结构和三级结构预测 二级结构预测结果表明(图5-A),该蛋白由3种折叠方式构成:α-螺旋90个氨基酸占23.07%;延伸链为97个氨基酸,占24.87%;无规则卷曲为203个氨基酸,占52.05%。牦牛TGF-β1蛋白质的三级结构预测结果(图5-B)与二级结构相符。
2.2.4 牦牛TGF-β1基因编码蛋白亲疏水性、跨膜结构域和磷酸化位点分析 牦牛TGF-β1蛋白亲疏水性分析结果(图5-C)表明,疏水性最强为第15位亮氨酸(Leu),分值最高为2.678,亲水性最强为第176位天冬酰胺(Asn),分值最低为-2.522,亲水性平均系数(GRAVY)-0.382,为亲水性蛋白。TGF-β1蛋白跨膜结构域分析结果(图5-D)表明,TGF-β1蛋白含跨膜区域,为跨膜蛋白。磷酸化位点分析结果(图5-E)显示,有27个丝氨酸(Ser),6个苏氨酸(Thr),4个酪氨酸(Tyr阈值大于0.5),可能成为蛋白质激酶磷酸化位点。
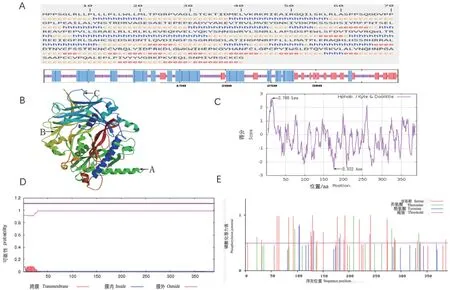
图5 牦牛TGF-β1蛋白生物信息学分析结果Fig. 5 Results of yak TGF-β1 protein via bioinformatics analysis
2.3 牦牛TGF-β1基因表达检测结果
采用qRT-PCR检测牦牛发情期和妊娠期卵巢、输卵管和子宫中TGF-β1基因的表达量结果(图6)显示,TGF-β1基因在牦牛发情期和妊娠期卵巢、输卵管和子宫中均有表达。其中,在卵巢和输卵管中妊娠期表达量均显著高于卵泡期和黄体期(P<0.05),黄体期次之,卵泡期表达量最低;在子宫中,妊娠期表达量最高,卵泡期次之,黄体期表达量最低(P<0.05)。
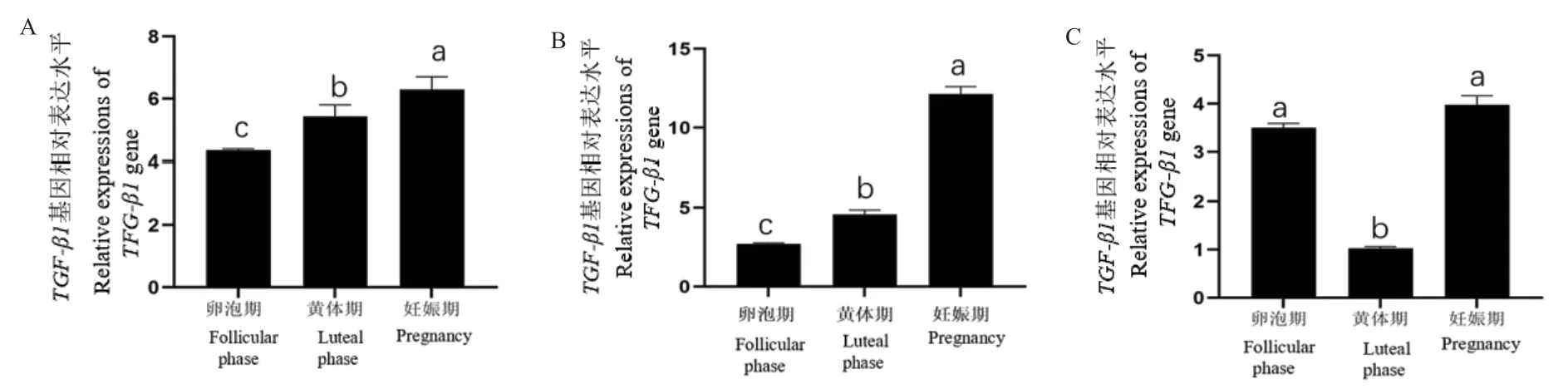
图6 TGF-β1 mRNA在不同组织中的相对表达量Fig. 6 Relative expressions of TGF-β1 mRNA in different tissues
2.4 牦牛TGF-β1蛋白表达检测结果
Western blot结果(图7)显示,TGF-β1蛋白普遍表达于牦牛发情期和妊娠期卵巢、输卵管和子宫中。结果(图8)显示,卵泡期卵巢表达量显著高于妊娠期和黄体期(P<0.05),黄体期次之,妊娠期表达量最低;妊娠期输卵管TGF-β1蛋白表达量显著高于黄体期、卵泡期。妊娠期子宫中TGF-β1蛋白表达量显著高于黄体期和卵泡期,卵泡期次之,黄体期最低。
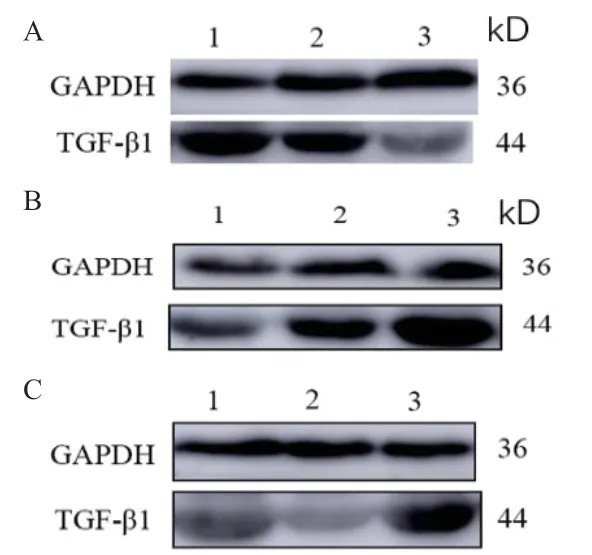
图7 TGF-β1和GAPDH蛋白在不同组织中的检测结果Fig. 7 Detection results of TGF-β1 and GAPDH protein in different tissues

图8 TGF-β1蛋白在不同组织中的相对表达量Fig. 8 Relative expressions of TGF-β1 protein in different tissues
2.5 牦牛TGF-β1蛋白定位结果
免疫组化结果(图9)显示(棕褐色为TGF-β1蛋白阳性表达,与之对应的为阴性表达)。TGF-β1蛋白在牦牛发情期和妊娠期卵巢,输卵管和子宫中均有阳性表达,在发情期和妊娠期的同一组织中蛋白表达部位无明显差异。在卵巢中主要表达于卵巢生殖上皮(GE)、卵泡膜细胞(TF)、卵泡颗粒层(SG)(图9-A1、图9-A2)和黄体细胞(CL)(图9-B1);在输卵管中主要表达于浆液腺(sg)和黏膜上皮细胞(EM)(图9-C1、图9-C2);在子宫中主要表达部位为子宫腺(UG)和子宫内膜细胞(EP)(图 9-D1、图9)。
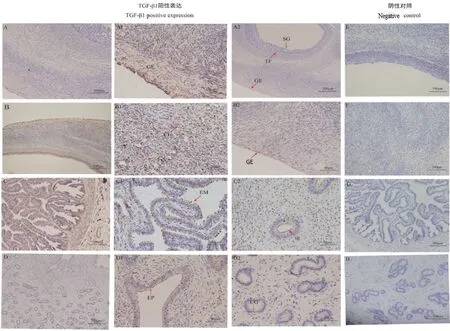
图9 TGF-β1蛋白在在不同组织中的分布Fig. 9 Distribution of TGF-β1 proteins in different tissues
3 讨论
本实验成功克隆出了牦牛TGF-β1基因(GenBank登录号:MZ004937),并发现TGF-β1在雌性牦牛发情期和妊娠期的卵巢,输卵管和子宫中均有表达。研究结果显示,牦牛TGF-β1基因ORF全长为1 173 bp。编码390个氨基酸,人和小鼠编码氨基酸数也为390个。TGF-β1蛋白存在37个磷酸化位点,含跨膜区域,为跨膜蛋白。据报道,TGF-β通过与跨膜I型(TβRI)2和II型(TβRII)受体结合来启动下游信号通路并发挥其功能[20]。可能与其含跨膜区相关。有学者发现,成熟型TGF-β1基因在进化中高度保守,且人、猴、猪和鸡TGF-β1的成熟单体有完全相同的氨基酸序列[21]。本实验结果显示,牦牛TGFβ1基因核苷酸序列与普通牛一致性较高,仅在第1 168位出现差异,所编码氨基酸由丙氨酸突变为甘氨酸,且系统进化树结果显示,牦牛TGFβ1基因与犏牛、普通牛和野牦牛的亲缘关系较近,进一步说明其高度保守型。
在雌性哺乳动物中,原始卵泡池的形成对维持繁殖力至关重要。有研究阐明了TGF-β1参与原始卵泡发育过程[22]。有研究表明,TGF-β1在调控卵巢体细胞间的卵母细胞与颗粒细胞间缝隙连接中扮演了重要的角色[23]。在卵泡发育、闭锁、成熟、排卵及黄体的形成等生理过程中都发挥了重要的作用,这些作用与卵巢功能密切相关。TGF-β1作为多细胞来源的细胞因子[24],有文献报道[25-28]称TGF-β1具有多条信号通路,在翻译过程中受多个转录因子(IL-26、HMGBI、NF-κB、15-LOX-1、CBX7)调控。因此蛋白和基因在相对表达水平上存在差异。文献报道[29]TGF-β1参与胚泡着床过程,TGF-β1可促使卵泡颗粒细胞分化但阻滞其增殖,与体内FSH浓度呈负相关[30],本研究发现TGF-β1蛋白在卵泡期卵巢中的相对表达量显著高于黄体期和妊娠期。TGF-β1蛋白在卵泡期卵巢中的高表达及黄体期的下降,可能与其参与卵泡发育及成熟,受体内FSH浓度影响有关。卵泡连续的发育需要卵母细胞,黄体细胞以及颗粒细胞之间的双向交流[31],而TGF-β1可以自分泌或旁分泌的方式通过Smad蛋白家族广泛地表达于不同时期卵泡的卵泡膜细胞、卵母细胞及颗粒细胞中[32-33]。本研究结果显示,TGF-β1蛋白在卵巢中主要分布于颗粒细胞、卵巢生殖上皮、卵泡膜细胞和黄体细胞,与前人研究一致。进一步证明其在卵泡发育成熟过程中发挥了重要作用。
输卵管具有输送精子、卵子及受精卵的功能,且是精子贮藏、精子获能、顶体反应和受精的场所[34]。有研究发现输卵管细胞可以调节合成TGF-β1,TGF-β1在调节与早期胚胎发育相关的输卵管生殖生理学功能中起重要作用[35]。本研究发现TGF-β1在妊娠期相对表达量最高。免疫组化结果显示TGF-β1主要表达于牦牛的输卵管黏膜上皮,输卵管粘膜上皮细胞具有分泌功能,分泌的活性物质为胚胎早期发育提供了营养物质[36]。TGF-β1在妊娠期的高表达,可能提示其参与了早期胚胎发育并诱导输卵管黏膜上皮细胞的快速增殖,为早期胚胎发育提供营养物质维持妊娠环境。有证据表明TGF-β1在人类输卵管、胎盘、子宫内膜和胚胎组织中都有表达[37-39],本研究发现TGF-β1定位于牦牛的输卵管黏膜上皮,与学者研究一致。
子宫是胚胎附植的器官,为胎儿的发育提供稳定的环境和必须的营养物质。有研究发现,TGF-β1在调节子宫内膜容受性中起关键作用,附植失败的子宫内膜中TGF-β1的表达量会显著降低[40]。且有研究结果表明,TGF-β/Smad3信号传导参与了胚胎植入过程,TGF-β1及其最特异性的信号转导因子Smad3在植入窗口期间在子宫内膜中表达[41]。本研究发现TGF-β1在妊娠期子宫的表达量最高,其在妊娠期的高表达,可能与其参与胚胎附植及胚胎发育过程有关。学者研究发现,子宫腺可分泌TGF-β1,TGF-β1参与胚胎附植和胚胎发育过程[29],且TGF-β1还参与调节母体-胚胎免疫反应[42-43]。本研究结果显示TGF-β1在子宫中主要表达子宫内膜和子宫腺,与学者研究结果一致。子宫腺分泌的子宫乳中含糖原等营养物质,可供给着床前附植阶段胚胎早期所需营养[44]。TGF-β1在子宫内膜和子宫腺的表达,可能提示其参与分泌胚胎发育所需的营养物质,并参与附植时胎儿及母体间的免疫反应。
4 结论
本实验成功克隆出了牦牛TGF-β1基因(GenBank登录号:MZ004937),牦牛TGF-β1基因ORF全长为1 173 bp,编码390个氨基酸,为跨膜的不稳定蛋白。牦牛TGF-β1基因与普通牛的进化水平最近,与犬、大熊猫的最远。TGF-β1在牦牛发情期和妊娠期的卵巢、输卵管和子宫均有表达,表达有差异。TGF-β1蛋白在不同时期同一组织定位无明显变化。结果提示TGF-β1在牦牛发情期和妊娠期的卵巢、输卵管和子宫中具有重要的生物学作用,可能参与调节牦牛卵泡发育、成熟及排卵过程,且在早期胚胎发育、胚胎附植和维持妊娠过程中发挥重要作用。TGF-β1在发情期和妊娠期的卵巢、输卵管和子宫中的表达,有助于进一步探讨高原哺乳动物对高寒环境的适应性提供理论依据。

