基于网络药理学研究苦参治疗COVID-19的作用机制
叶先文,张金莲,邓亚羚,刘敏敏,刘 颖,夏澜婷,任洪民,李安全,叶嘉丽
(江西中医药大学药学院,江西 南昌 330004)
冠状病毒 (CoVs) 由单股正链RNA病毒构成,属于冠状病毒科,具有外套膜,感染的动物和人有可能发展为呼吸道、肠道和神经系统等疾病[1]。2019年爆发的新型冠状病毒由国际病毒分类委员会分类为严重急性呼吸综合征冠状病毒2 (SARS-CoV-2),世界卫生组织把这种病毒造成的疾病命名为COVID-19[2]。
COVID-19与严重急性呼吸综合征 (SARS) 的病理机制类似,SARS-COV-2感染细支气管上皮诱导细支气管炎,侵入邻近深部肺间质,造成肺泡壁上皮细胞的损伤,进而导致间质和肺泡水肿、出血,同时肺泡内形成透明膜[3]。石正丽团队报道了SARS-CoV-2与一种蝙蝠中的CoVs序列一致性高达96%,推测其宿主来源于蝙蝠[4]。肖永红团队依据深度学习算法模拟得出SARS-CoV-2与严重急性呼吸综合征冠状病毒 (SARS-CoV)、蝙蝠SARS-CoV和中东呼吸综合征冠状病毒 (MERS-CoV) 具有相近的感染力,并推测出蝙蝠和水貂可能是SARS-CoV-2的源头[5]。穿山甲CoVs的S蛋白与SARS-CoV-2两者的受体结合域仅存在一个氨基酸差异,这说明穿山甲也可能是SARS-CoV-2的起源或中间宿主[6]。钟南山团队在文献报道中表明,63.4%的COVID-19患者的临床症状是发烧,胸腔CT扫描出现肺异常,实验研究表明COVID-19患者有淋巴细胞减少症,反应蛋白 (CRP) 水平增加[7]。
苦参是豆科植物苦参SophoraeflavescentisAit的干燥根,气微,味极苦[8]。苦参碱类生物碱具有抗乙型肝炎病毒 (HBV) 的作用[9],能诱导HepG 2.2.15细胞凋亡,将细胞增殖阻滞于S期[10]。对乙型肝炎病毒e抗原 (HBeAg),乙型肝炎病毒s抗原 (HBsAg)的分泌也有抑制作用,高浓度的苦参碱能长期高效抑制HepG2.2.15细胞中HBV复制,该作用与病毒核酸复制和基因表达的抑制有关[11]。苦参碱类生物碱除抗HBV外,还能抗流感病毒、呼吸道合胞体病毒、牛乳头状瘤病毒和巨细胞病毒等[12]。COVID-19以“湿”邪为主,其病机为湿、毒、瘀、虚,中医辨证为湿邪偏盛,而苦参味苦,性寒,是常用的燥湿药,可退热泄降,荡涤湿火等,这为苦参可能治疗COVID-19提供中医药理论基础[2]。
近期网络药理学大量运用于中药及中药处方抗SARS-CoV-2研究,如藿香正气口服液[13]、达原饮[14]、清肺排毒汤[15]等,本文基于TCMSP数据库,运用网络药理学探寻苦参抗SARS-CoV-2的可能机制。
1 方法
1.1 化学成分搜索 SymMap[16]通过内部分子机制和外部症状定位,将中医和现代医学结合,集TCM-ID、TCMID、TCMSP数据库于一体。它收录499种草药、19 595种成分、1 717种相应的中医症状。以“苦参”为关键词对其化学成分进行搜索。
1.2 活性成分筛选 基于TCMSP[17]数据库,以符合口服生物利用度(OB)>30%、类药性(DL)>0.18为标准筛选化学成分,得到相应的靶标蛋白,即为活性成分。
1.3 靶标网络构建及分析 通过UniProt[18]将靶标蛋白转为相应的基因名,String[19]构建靶标蛋白的相互作用网络 (PPI网络),同时将核心靶点与COVID-19相关的靶点进行共表达分析,利用Cytoscape 3.7.2[20]软件平台构建化合物-靶点PPI网络。
1.4 靶点GO功能及KEGG通路富集分析 将靶点上传至Metascape[21],物种限定为人,阈值P<0.05,进行GO生物功能富集分析,同时通过DAVID[22]进行KEGG信号通路富集分析。
1.5 成分-靶点分子对接 从PDB[23]下载SARS-CoV-2 3CL 水解酶 (3CLpro) 和Uniprot新冠肺炎专题“View SARS-CoV-2 Proteins and Receptors”下的9个人体靶蛋白,见表1,TMPRSS2无晶体结构,利用Swiss-Model进行同源建模,见图1。将10个目标大分子通过Discovery Studio 2016 Client软件对其进行加氢,删除水分子,移除配体等操作。将目标成分及大分子上传CB-Dock[24]进行分子对接,以结合能≤-5.0 kJ/mol为分子-靶点有相互作用的依据[13-15]。
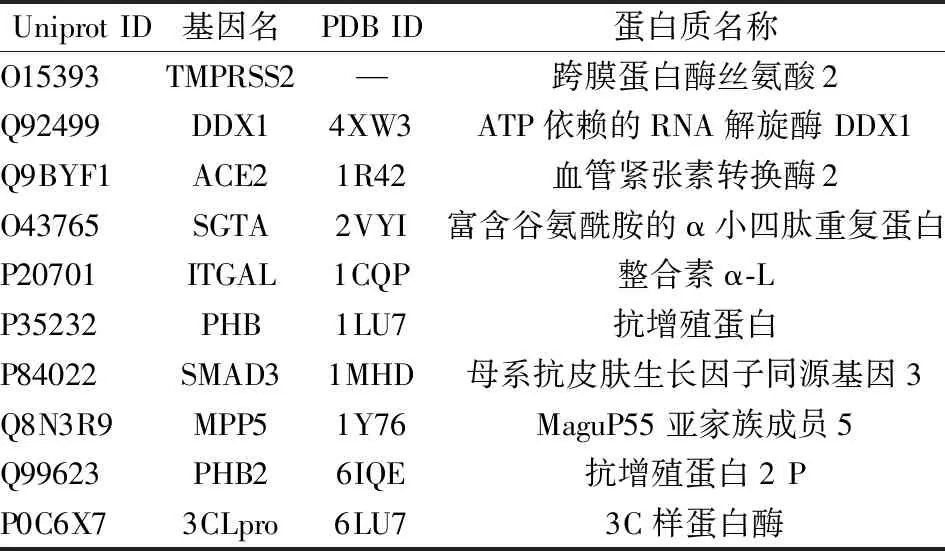
表1 3CLPro与9个人体靶蛋白信息

图1 TMPRSS2预测模型
2 结果
2.1 化学成分筛选 基于SymMap获得苦参化学成分114种,以OB>30%、和DL>0.18进行筛选后得到45种。在TCMSP中,23种成分已通过PreDC (Predict Drug Combination) 预测靶标蛋白,即为活性成分,见表2。

表2 苦参活性成分信息
2.2 化合物-靶点网络分析 将TCMSP获取的靶标蛋白以Uniprot进行标准化,利用Cytoscape 3.7.2构建化合物-靶点PPI网络,见图2,含223个节点、3 907条边,其中23个节点为活性成分,剩余200个为相互作用靶点;平均度值Degree为35.04,倒三角形为成分,圆形为靶点,度值小于平均度值的底色为白色,度值越大越接近红色,形状也越大,以度值大于2倍Degree获取核心网络;成分K23 (Degree 145.0)、K13 (Degree 56.0)、K8 (Degree 36.0)可能为主要药效物质;靶点AKT1 (Degree 128.0)、IL6和TP53 (Degree 117.0)、PTGS2 (Degree 111.0) 等28个靶点均大于2倍的平均度值,可能为苦参主要作用的靶标蛋白,见图2,再对其进行共表达分析,见图3,在该共表达网络图中,含34个节点、388条边,平均度值22.8,其中27个节点为预测靶点 (除PTGS2),剩余7个 (除MPP5、SGTA) 为与COVID-19相关的靶蛋白,提示核心靶点与新冠肺炎的发生发展具有紧密的相关性。

图2 苦参成分-靶点PPI网络
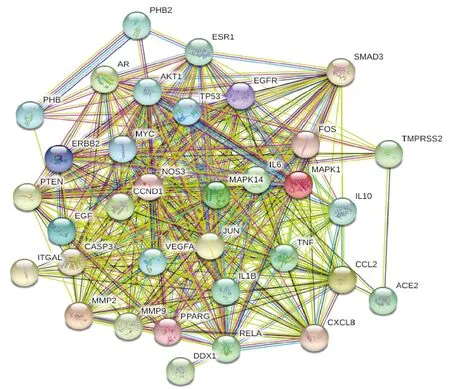
图3 核心靶点与新冠肺炎相关靶点共表达分析
2.3 GO、KEGG信号通路富集分析 由Metascape获得GO功能1 999项,其靶点按属性可聚类成7项 (图4A),最显著的一项以靶点淀粉样β前体蛋白 (APP) 为中心,具有重要的突触功能,充当细胞表面受体,并在神经元表面执行与神经突生长,神经元粘附和轴突发生有关的生理功能[25],将前20项保留,见图4B,推测细胞对有机环化合物的反应、对有毒物质的反应、细胞因子介导的信号传导途径等可能是苦参抗SARS-CoV-2重要生物过程。由DAVID富集到132条结果,其中92条对应多种疾病,如乙型肝炎、膀胱癌、前列腺癌等;通路有40条,较显著的前3条为TNF信号通路、HIF-1信号通路、PI3K-Akt信号通路,大多与免疫和炎症通路有关,提示苦参可能通过炎症和免疫途径抗SARS-CoV-2,见图5。
2.4 分子对接 选择表2中的生物碱 (苦参碱、槐果碱、槐定碱)及度值前三的化合物 (槲皮素、木犀草素、刺芒柄花素),与表1中的靶蛋白进行分子对接,结果见图6~7。由此可知,目标成分与10个目标大分子的结合能均小于-5.0 kJ/mol,提示这些成分可能具有抗SARS-CoV-2的作用。

图4 苦参作用靶点GO富集分析
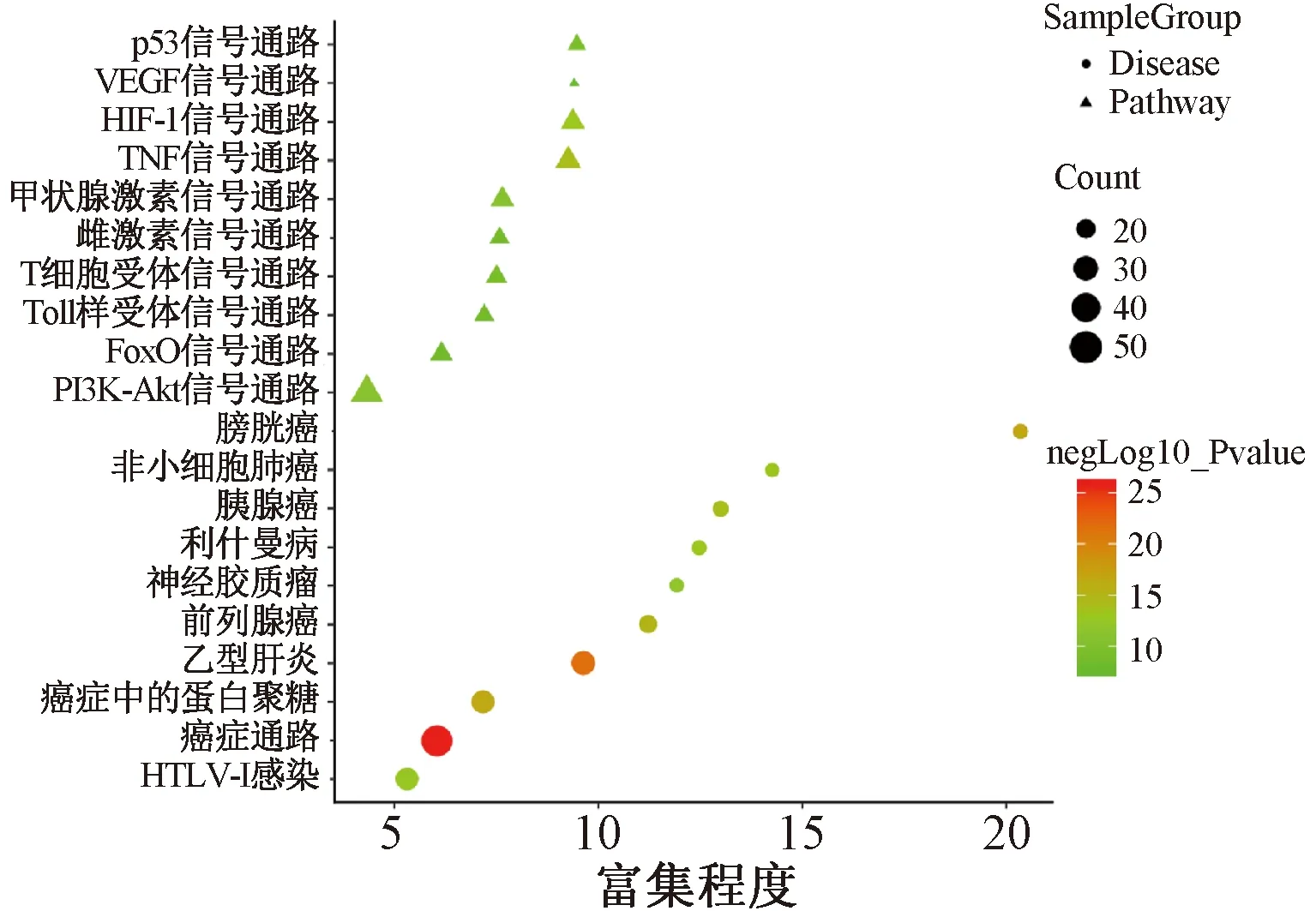
图5 苦参作用靶点KEGG信号通路富集(前20条通路)
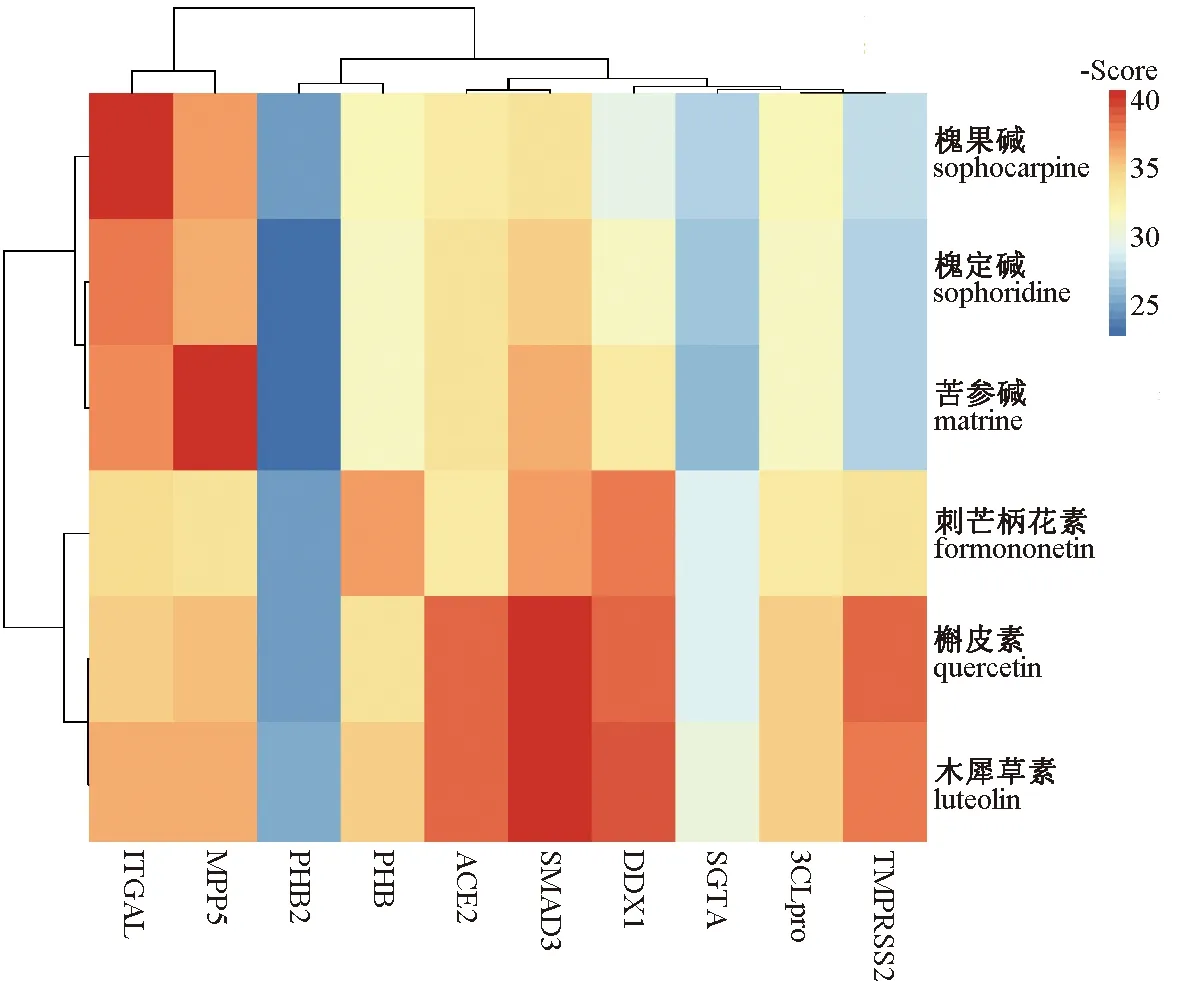
图6 苦参活性成分与目标蛋白的结合能热图
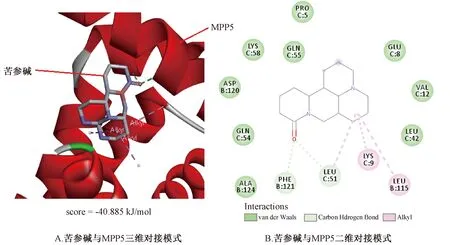
图7 苦参碱与MPP5的分子对接模式
3 讨论
气溶胶传播、粪-口传播有可能是SARS-CoV-2的传播途径。Vincent Munster团队报道了SARS-CoV-2和SARS-CoV在物体表面和气溶胶中有相似的稳定性和半衰期,表明SARS-CoV-2存在气溶胶和其他途径传播[26],有效的消毒对于减少SARS-CoV-2的气溶胶传播至关重要[27]。中山大学第五医院在53.42%的COVID-19患者粪便中检测出病毒RNA呈阳性,在胃肠道组织中也可检测病毒RNA呈阳性,提示粪-口传播可能为SARS-CoV-2的传播途径[28]。
吴玉章团队在咽拭子样本和尿液中发现SARS-CoV-2的N蛋白的结果与核酸检测100%匹配,在73.6%的被诊断为COVID-19的患者尿液中检测到病毒N蛋白,这表明N蛋白可能作为COVID-19的诊断方法[29]。高水平的利钠肽患者死亡风险较大[30],COVID-19患者可能发展为心肌炎和心力衰竭等严重心脏并发症[31]。ACE2为SARS-COV-2入侵人体的主要受体蛋白,是抑制病毒与细胞结合、减少肺部和心脏损伤、抑制炎症风暴的潜在治疗靶点[32]。3CLpro作为冠状病毒的主要蛋白酶之一,具有高度保守性,在SARS-CoV-2的复制过程中起重要作用,可在药物设计中作为关键靶标[33]。NIH团队研究表明,ACE2主要在精原细胞、睾丸间质细胞、以及支持细胞中表达,暗示睾丸可能也是SARS-CoV-2感染人体的靶点之一[34]。通过ePlant[35]对其进行定位表达分析,发现ACE2在肾脏中高表达,在心脏、肺部、支气管等也有表达,提示在COVID-19治疗中,应进行多个器官观察,见图8。在COVID-19老年及重症患者中,T细胞、CD4+和CD8+T细胞总数显著减少,T细胞数与血清炎症因子浓度呈负相关,而在恢复期这些因子却下降,且T细胞计数逐渐恢复。不仅如此,T细胞的耗竭标志物PD-1和Tim-3表达增高,进一步提示T细胞功能耗竭和减少为COVID-19患者的重要临床特征[36]。在感染SARS-CoV-2后,CD4+T细胞转变为致病性的Th1细胞,并产生GM-CSF等。细胞因子诱导单核细胞 (CD14+,CD16+) 的IL-6的高表达,过多的炎症反应可能进入肺循环,破坏了免疫环境,从而导致肺功能损伤和快速死亡[37]。
苦参碱类生物碱双向调节机体免疫功能,即高剂量免疫抑制,低剂量免疫促进[38]。在CoVs肺炎寒湿疫毒袭肺病证结合小鼠模型中,苦参碱氯化钠注射液对模型组小鼠肺指数抑制率高达86.86%,其机制与抑制病毒复制、调节免疫功能 (升高外周血CD4+T细胞、CD8+T细胞及B细胞的百分比) 和抑制炎症因子 (IL-6、IL-10、TNF-α和IFN-γ) 释放有关[39]。苦参碱类生物碱有可能通过阻滞病毒吸附,减少病毒进入细胞并且抑制病毒在细胞内的复制,从而产生抗病毒作用;对磷脂酰肌醇-3激酶/蛋白激酶B信号通路有上调作用,对把关受体-4/髓样分化因子-88/TNF-α 受体相关信号通路有下调作用;通过上调或下调相关通路,不仅增加了干扰素的表达,还阻滞了炎性因子表达,减少病毒对细胞的损伤[12,40]。氧化苦参碱联合恩替卡韦可抑制p38蛋白磷酸化,同时下调钠离子-牛磺胆酸共转运蛋白 (NTCP) 的表达,这可能是其抗病毒的机制[41]。
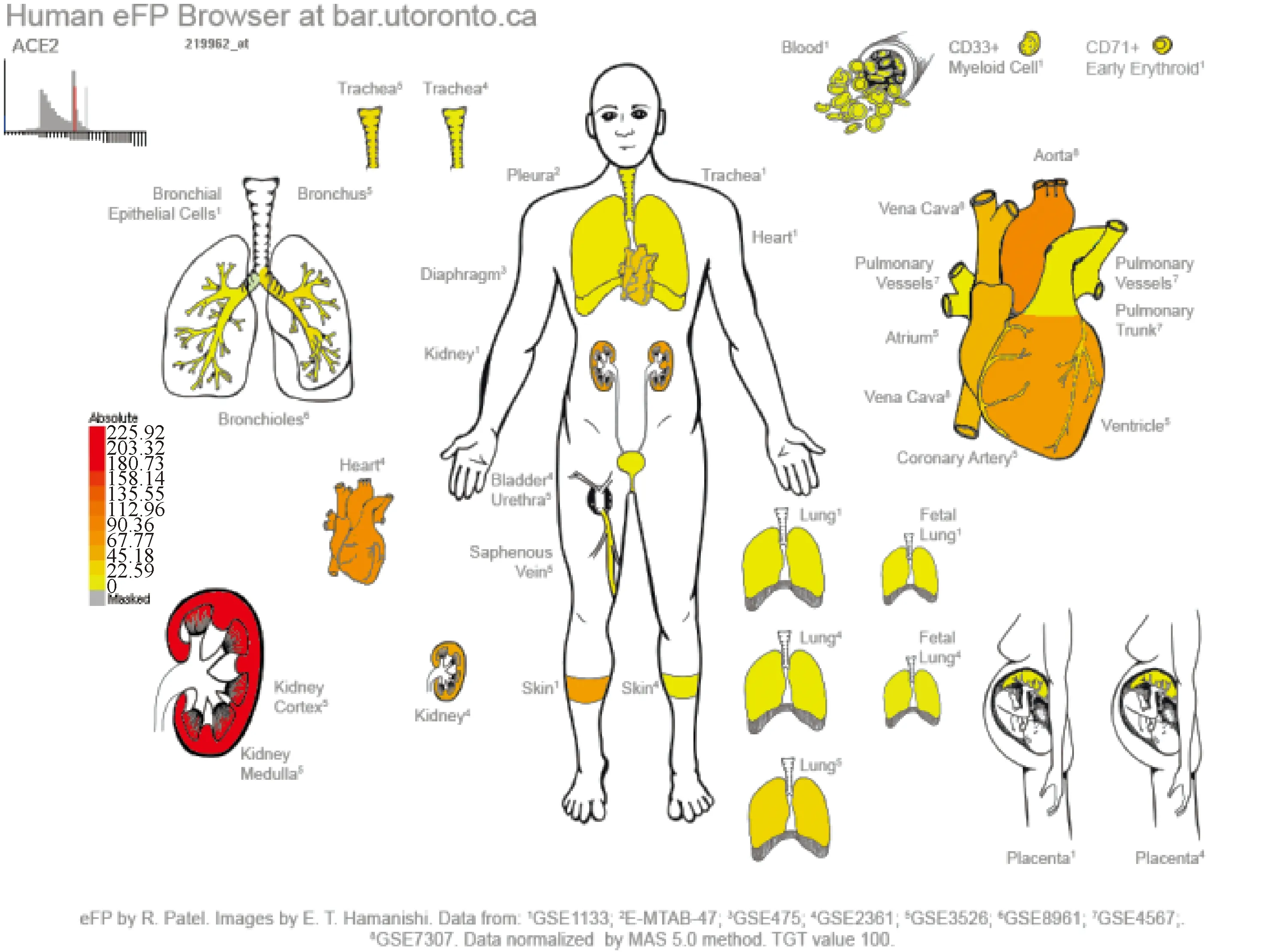
图8 ACE2在人体呼吸循环系统中的表达
通过网络药理学方法,获得苦参潜在活性成分23种,可能靶点200个,对其成分-靶点进行PPI网络分析,发现苦参碱、槐果碱、槐定碱、槲皮素、木犀草素、刺芒柄花素等可能是苦参抗SARS-CoV-2的关键成分,淀粉样β前体蛋白 (APP)、丝氨酸/苏氨酸蛋白激酶 (AKT1)、白细胞介素6 (IL6)、细胞肿瘤抗原p53 (TP53)、前列腺素内过氧化物合酶2 (PTGS2) 等28个靶标度值大于2倍平均度值,且27个靶标与7个COVID-19相关靶点有紧密的共表达关系,提示这些核心靶点可能为苦参治疗COVID-19的关键靶点。通过GO生物功能和KEGG信号通路富集分析,得到1 999个GO功能和132条KEGG信号通路。在GO功能中,多为细胞的应激反应,如细胞对有机环化合物、有毒物质、内毒素、激素、氧化等应激反应;也有生物调节功能,如正向调节细胞因子、胰岛素及活性氧代谢等。在KEGG信号通路富集分析中,TNF信号通路、HIF-1信号通路、PI3K-Akt信号通路、甲状腺激素信号通路、p53信号通路、T细胞受体信号通路等40条通路可能为苦参抗SARS-CoV-2的途径;乙型肝炎、膀胱癌、前列腺癌、非小细胞肺癌、HTLV-Ⅰ 感染、小细胞肺癌等92条疾病途径也可能与苦参抗SARS-CoV-2有关。在与COVID-19相关靶点的分子对接中,苦参碱、槐果碱、槐定碱、槲皮素、木犀草素、刺芒柄花素与其结合能等均小于-5 kJ/mol,提示这些成分可能与新冠肺炎的相关靶点有良好的相互作用。
通过网络药理学方法系统的在多成分、多靶点、多途径层面阐明苦参抗SARS-CoV-2的可能机制,后续将通过动物体内外试验进一步探索苦参抗SARS-CoV-2的药效作用及机制,为COVID-19的治疗提供更多依据。

