四氢姜黄素对MCF-7细胞增殖、凋亡及转移的作用
张 敏,华 桦,曾安琪,刘 俐,刘 芳,赵军宁,
(1.成都中医药大学,四川 成都 610075;2.四川省中医药科学院转化药理与临床应用研究所,四川省中医药转化医学中心,四川省道地药材系统开发工程技术研究中心,四川省道地药材形成原理与品质评价工程研究中心,中医药转化医学四川省重点实验室,国家中医药管理局中药质量生物评价重点研究室,四川 成都 610041;3.四川大学,四川 成都 610041)
乳腺癌是一种发生于乳腺上皮组织的恶性肿瘤,其发病率逐年上升并愈发年轻化[1-4]。乳房并非维持生命的重要器官,但乳腺癌细胞易失去细胞间的黏附能力,极易增殖扩散,短时间内迅速转移、生长到其他器官如骨髓、淋巴等,最后危及患者生命[5-8]。姜黄素类为中药姜黄的主要有效成分,目前已有研究证实姜黄素能抑制膀胱癌、乳腺癌、肺癌等肿瘤细胞的生长[9-10]。四氢姜黄素 (tetrahydrocurcumin)为姜黄素在体内的主要代谢产物,具有抗肿瘤作用[11-14],但其作用机制尚不清楚。本研究探索了四氢姜黄素对MCF-7乳腺癌细胞增殖、凋亡、转移的作用及其机制,为四氢姜黄素后续开发奠定实验基础。
1 材料
1.1 细胞 人乳腺癌细胞(MCF-7)由上海中国科学院干细胞库提供,目录号TCHu74。
1.2 试剂与药物 四氢姜黄素由四川省中医药科学院药学研究所提供,批号2018090,纯度≥98%。二甲基亚砜(DMSO)(批号EZ6688D182)购自美国Sigma-Aldrich公司;磷酸缓冲盐溶液(PBS)(批号8119244)购自美国Gibco公司;胎牛血清(批号1909505)购自杭州四季青生物工程材料有限公司;胰酶(批号14J22C67)购自美国HyClone公司;细胞增殖毒性检测试剂盒(Cell Counting Kit-8,CCK8,批号14I07A60)、HRP-羊抗兔IgG(批号BST14KBL54)、HRP-羊抗小鼠IgG(批号BST14J0A50)均购自武汉博士德生物工程有限公司;结晶紫染色液(批号C0121)购自上海碧云天生物技术有限公司;Annexin V-FITC/PI 细胞凋亡检测试剂盒(批号20200624)购自江苏凯基生物技术股份有限公司;β-肌动蛋白(β-Actin)(批号HL0305)购自杭州华安生物技术有限公司;基质金属蛋白酶9(MMP-9)(批号GR3204084-11)、基质金属蛋白酶2(MMP-2)(批号GR3244972-1)、B淋巴细胞瘤-2(Bcl-2)(批号GR3219584-4)、BCL-2-Associated X的蛋白质(Bax)(批号GR380247-20)均购自英国Abcam公司。
1.3 仪器 BSC-1304ⅡA2细胞生物安全柜(苏州安泰空气技术有限公司);美国311水套式二氧化碳培养箱(美国Thermo公司);1820型酶标仪(赛默飞世尔科技有限公司);ME204/02电子天平[梅特勒-托利多仪器(上海)有限公司];YM100 A灭菌锅(上海三申医疗器械有限公司);DHG-9070A型电热恒温鼓风干燥箱(上海精宏实验设备有限公司);C2500低温离心机(湖南湘仪实验仪器厂);090-135008倒置显微镜(德国徕卡公司)。
2 方法
2.1 四氢姜黄素对MCF-7细胞增殖的影响
2.1.1 CCK8实验 将对数生长期的MCF-7细胞用完全培养液配成细胞悬液,以每孔8 000、6 000、4 000个细胞接种于3块96孔板中,放置于5% CO2、37 ℃培养箱中培养24 h,待细胞贴壁至80%~90%时,加入不同浓度(0、0.78、1.56、3.12、6.25、12.5、25、50、100、200 μmol/L)四氢姜黄素药液进行干预,每孔100 μL。分别培养24、48、72 h,弃去旧培养基,每孔加入新鲜培养基100 μL后,再避光加入10 μL CCK8溶液,37 ℃ 孵育1 h,酶标仪检测450 nm波长处吸光度(A)值。根据公式计算细胞增殖抑制率,Graphpad计算半数抑制浓度(IC50)。细胞增殖存活率=[(A实验-A空白)/(A对照-A空白)]×100%。
2.1.2 克隆形成实验 取对数生长期细胞,完全培养基重悬后计数,细胞以500/mL密度分别加入6孔板中,放置于5% CO2、37 ℃培养箱培养24 h后,加入浓度为0、6.25、12.5、25、50、100 μmol/L四氢姜黄素药液,每3天换1次药液至第10天。实验结束时弃去旧培养基,加入1 mL甲醇固定15 min后弃去甲醇,再加入2 mL结晶紫避光固定30 min,结晶紫回收后PBS清洗孔板2次后晾干拍照。
2.2 四氢姜黄素对MCF-7细胞凋亡的影响
2.2.1 MCF-7细胞形态变化 取对数生长期细胞计数后,按1×105/mL密度接种于6孔板,放置于5% CO2、37 ℃培养箱培养24 h后,弃去培养基,加入浓度为0、25、50、100 μmol/L四氢姜黄素药液,分别于0、48 h在200倍显微镜下观察细胞形态并拍照。
2.2.2 流式细胞术检测MCF-7细胞凋亡情况 用不含EDTA胰酶消化收集细胞,PBS洗涤细胞2次,500 μL预冷Binding Buffer悬浮细胞,加入5 μL Annexin V-FITC混匀后,再加入5 μL Propidium lodide混匀,室温避光反应15 min,检测细胞凋亡情况。
2.3 四氢姜黄素对MCF-7细胞转移的影响
2.3.1 划痕实验 取对数生长期细胞,将细胞悬液密度调为5×105/mL后接种于6孔板,放置于5% CO2、37 ℃培养箱培养24 h后进行划痕;将0、25、50、100 μmol/L四氢姜黄素药液(含2%血清的培养基配制)依次加入孔板中,每孔2 mL,放入放置于5% CO2、37 ℃培养箱孵育48 h后弃去旧液,用PBS清洗2次,再加入600 μL PBS,40倍显微镜下观察拍照。Image J 软件分析细胞迁移距离。
2.3.2 Transwell实验 在对数生长期细胞中加入无血清培养基计数后调整密度为4×104/μL;用无血清培养基分别配置0、25、50、100 μmol/L四氢姜黄素药液,每孔加入50 μL药液和50 μL细胞悬液;将5个Transwell小室放入6孔板中,小室下加入600 μL含血清培养基,小室中加入50 μL无血清药液和50 μL无血清细胞培养基,放置于5% CO2、37 ℃培养箱孵育48 h后,弃小室下方培养基,用棉签轻轻旋转擦拭小室,1 mL甲醇固定后,每孔加入1 mL结晶紫染液染色,用PBS清洗3次后用棉签轻轻旋转擦拭小室中液体,于通风橱中晾干,将小室底部圆片取出放在滴有中性树胶(滴载玻片中心)的载玻片上,盖上盖玻片,于100倍显微镜下拍照。
2.4 蛋白质印迹(Western blot)实验 将细胞接种于培养皿中,待贴壁后加入相应浓度的四氢姜黄素药液(0、25、50、100 μmol/L),48 h后用刮刀将各组细胞收集于离心管中,加入RIPA细胞裂解液,冰浴30 min后,加入等量4×SDS Loading buffer,进行凝胶电泳后,置于转膜仪转膜后,加封闭液封闭1 h,用一抗(Bcl-2、Bax、MMP2、MMP9)孵育(4 ℃)过夜,放置于摇床用TBST清洗4次,15 min更换1次TBST,二抗孵育(37 ℃)1 h,发光液曝光10 min,显影,进行Bcl-2、Bax、MMP-2、MMP-9蛋白表达分析。

3 结果
3.1 四氢姜黄素对MCF-7细胞增殖的影响
3.1.1 CCK8实验 如图1所示,实验各时间点四氢姜黄素 6.25、12.5、25、50、100、200 μmol/L剂量组细胞存活率,与空白对照组(0 μmol/L)比较均降低(P<0.05,P<0.01)。根据其IC50值提示后续试验药物作用浓度为0、6.25、12.5、25、50、100 μmol/L,实验时间为48 h。

注:与空白对照组(0 μmol/L)组比较,*P<0.05,**P<0.01。图1 四氢姜黄素对MCF-7细胞增殖的影响
3.1.2 克隆形成实验 如图2所示,与空白对照组比较,四氢姜黄素25、50、100 μmol/L剂量组MCF-7细胞克隆形成数减少(P<0.01),四氢姜黄素对MCF-7细胞具有抑制作用。
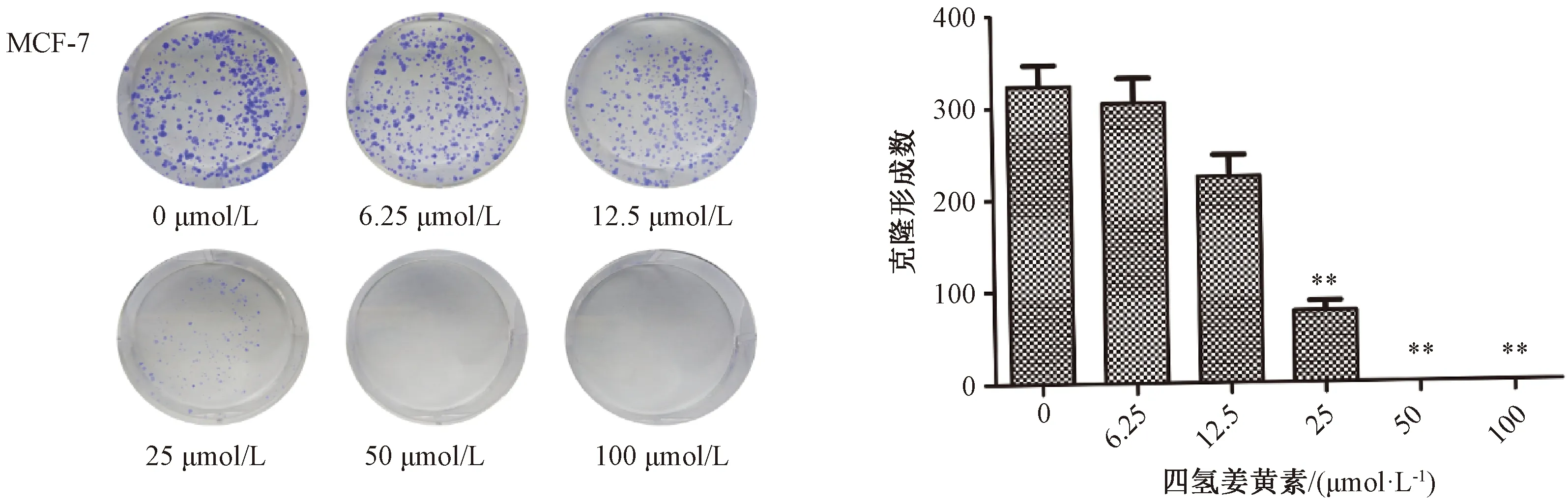
注:与空白对照组(0 μmol/L)组比较,**P<0.01。图2 四氢姜黄素对MCF-7克隆形成的影响
3.2 四氢姜黄素对MCF-7细胞凋亡的影响
3.2.1 细胞形态 如图3所示,与空白对照组比较,四氢姜黄素作用48 h后细胞生长缓慢,细胞数量减少,细胞形态发生改变,胞内出现空泡,大量细胞碎片漂浮于培养液表面。

图3 四氢姜黄素对MCF-7细胞形态的影响(×200)
3.2.2 流式细胞术实验 如图4所示,与空白对照组比较,四氢姜黄素50、100 μmol/L剂量组MCF-7细胞凋亡率升高(P<0.05,P<0.01),四氢姜黄素能促进MCF-7细胞凋亡。
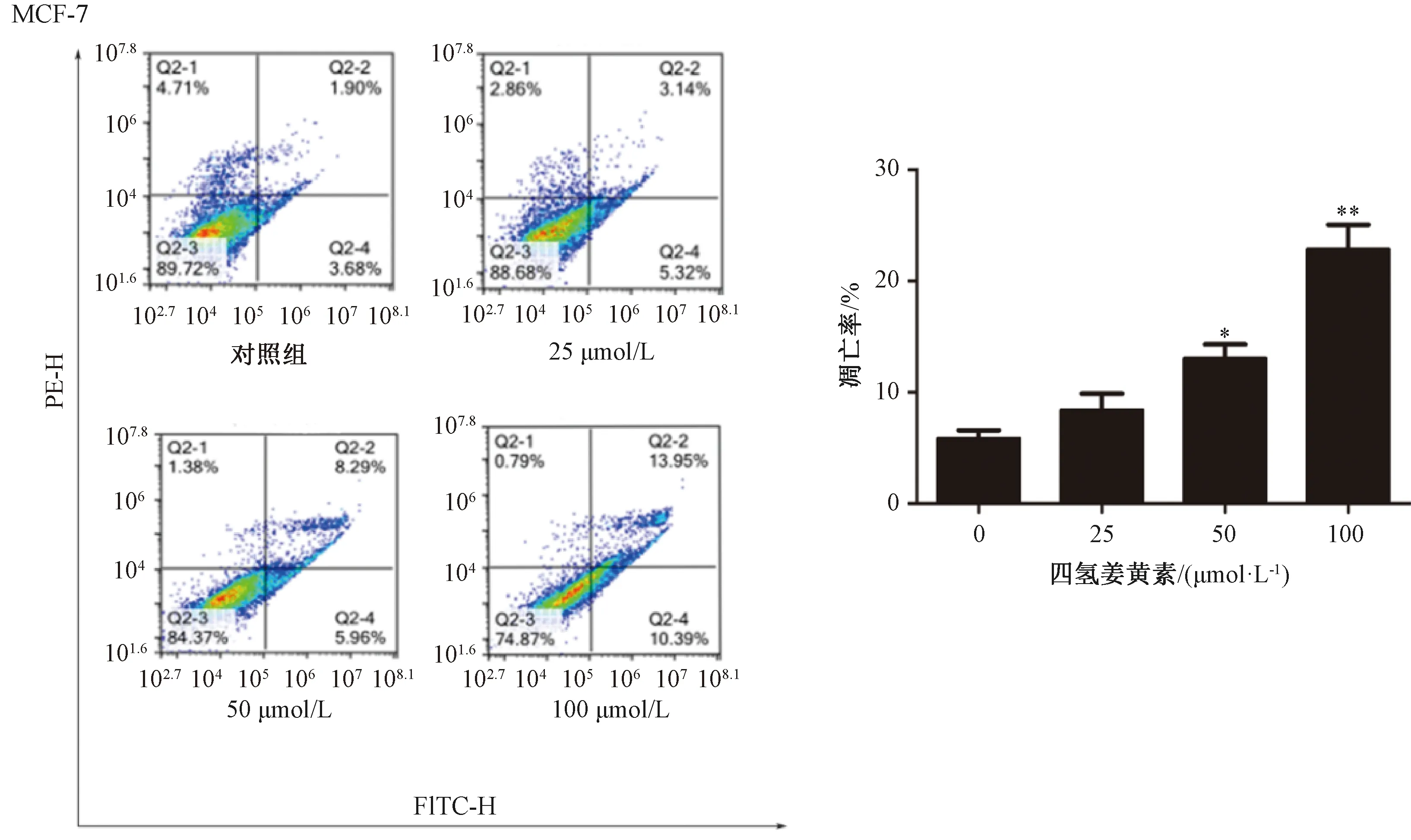
注:与空白对照组(0 μmol/L)组比较,*P<0.05,**P<0.01。图4 四氢姜黄素对MCF-7细胞凋亡的影响
3.3 四氢姜黄素对MCF-7细胞转移的影响
3.3.1 划痕实验 如图5所示,与空白对照组比较,四氢姜黄素25、50、100 μmol/L剂量组细胞迁移率降低(P<0.01)。
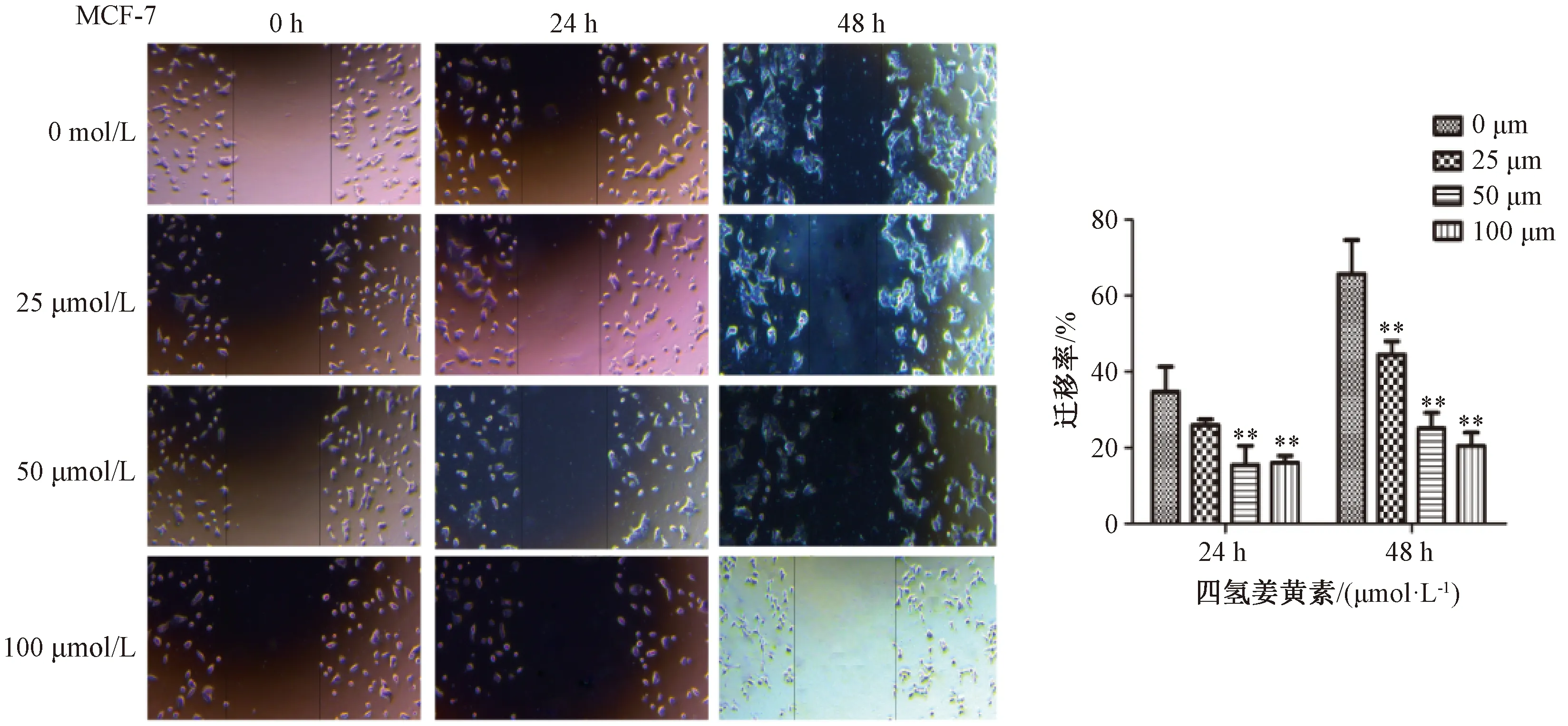
注:与空白对照组(0 μmol/L)组比较,**P<0.01。图5 四氢姜黄素对MCF-7细胞迁移的影响
3.3.2 Transwell实验 如图6所示,与空白对照组比较,四氢姜黄素25、50、100 μmol/L剂量组穿透小室隔膜到达上层小室的底面的细胞数减少(P<0.01)。
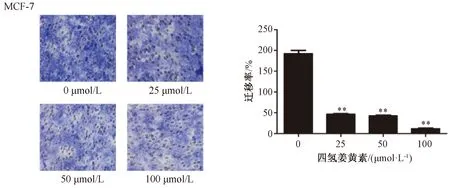
注:与空白对照组(0 μmol/L)组比较,**P<0.01。图6 四氢姜黄素对MCF-7细胞迁移的影响

注:与空白对照组(0 μmol/L)组比较,*P<0.05。图7 四氢姜黄素对MCF-7细胞Bax、Bcl-2蛋白表达的影响
3.4 Western blot实验 如图7所示,与空白对照组比较,四氢姜黄素100 μmol/L剂量组MCF-7细胞中Bcl-2蛋白表达降低(P<0.05),Bax蛋白表达升高(P<0.05),提示四氢姜黄素能促进MCF-7的凋亡。如图8所示,四氢姜黄素100 μmol/L剂量组MCF-7细胞MMP2、MMP-9蛋白表达均降低(P<0.05),表示四氢姜黄素能抑制MCF-7细胞的转移。

注:与空白对照组(0 μmol/L)组比较,*P<0.05。图8 四氢姜黄素对MCF-7细胞MMP2、MMP9蛋白表达的影响
4 讨论
乳腺癌是女性中常见的恶性肿瘤之一,发病率和致死率高,具有起病隐匿、发展快、早期诊断率低等特征,严重危害女性健康。肿瘤的转移依靠癌细胞的迁移和侵袭两大关键途径,阻断这些途径是抗肿瘤治疗的重要方法,因此,抑制细胞转移及增殖是预防和治疗恶性肿瘤的重要研究方向[11]。近年来,中医药在肿瘤的治疗中通过稳定癌灶、减轻放化疗副作用及改善患者预后等多种方式起到良好抗肿瘤效果[15]。肿瘤的迁移与侵袭是肿瘤向远端转移和增殖的第一步,肿瘤细胞必须要穿透细胞外基质、基底膜组成的组织屏障才能完成转移[16-17]。MMP-9以酶原的形式分泌,被激活后形成Ⅳ型胶原酶,通过降解、破坏靠近肿瘤表面的细胞外基质中的Ⅳ型、Ⅴ型胶原和明胶,然后肿瘤细胞沿着缺失的基底膜向周围组织浸润,最终导致肿瘤的侵袭和转移[18-20]。MMP-2是金属蛋白酶家族中与肿瘤关系最为密切的因子之一。MMP-2是一种锌离子依赖的蛋白水解酶,由肿瘤细胞和间质细胞以酶原形式分泌,经水解后激活,能特异性地降解基底膜的主要成分—Ⅳ型胶原,还可降解Ⅴ、Ⅵ、Ⅹ型胶原、FN和明胶,同时通过对细胞外基质的改建,促进肿瘤新生血管的形成,促进肿瘤的侵袭和转移,从而影响预后[18-23]。
本研究中,CCK8与克隆实验结果显示四氢姜黄素对MCF-7细胞的增殖具有抑制作用;流式细胞术实验及Western blot实验结果显示,四氢姜黄素能诱导细胞凋亡;划痕实验、Transwell实验及Western blot实验结果表明四氢姜黄素能抑制细胞的迁移。综上所述,四氢姜黄素对MCF-7乳腺癌细胞的增殖、转移具有一定的抑制作用,可促进MCF-7乳腺癌细胞的凋亡,其作用机制可能是通过抑制细胞MMP2、MMP9的表达从而抑制MCF-7细胞迁移。本研究为四氢姜黄素在预防和/或治疗乳腺癌转移提供了实验依据,具有进一步研究的价值。

