痛泻要方对肝郁脾虚型溃疡性结肠炎大鼠脂质代谢及自噬的影响
张旭飞,罗运凤,高 洁,陈云志*,蒋志滨
(1.贵州中医药大学研究生院,贵州 贵阳 550025;2.贵州中医药大学基础医学院,贵州 贵阳 550025;3.贵州中医药大学药学院,贵州 贵阳 550025)
溃疡性结肠炎是一种局限于结肠黏膜和黏膜下层的特发性炎症[1],中医学按症状统归为“久痢”范畴[2]。祖国医学认为“肝与大肠相通”,这与现代医学“肝肠轴”学说有异曲同工之处,肝与大肠在生理病理上互为因果[3]。肝脏硬脂酰辅酶A去饱和酶1(SCD1)、肠道5-羟色胺(5-HT)均与溃疡性结肠炎发生发展密切相关[4],课题组前期通过实验研究,发现肝郁脾虚型溃疡性结肠炎大鼠既有结肠病理改变,也存在肝脏脂质代谢异常;痛泻要方干预后可上调结肠5-HT转运体(SERT)的蛋白表达,减少结肠5-HT分泌,抑制炎性因子表达,发挥抗炎作用[5-6]。
肝脏SCD1参与脂质代谢过程,是调节饱和脂肪酸转化为不饱和脂肪酸的关键酶。细胞自噬与中医“气”的功能密切关联,自噬功能失调会使内生实邪积聚,健脾补气药物可调节“气”的功能影响细胞自噬水平,以维持内环境代谢稳态[7]。外周5-HT作用于肝脏受体调节脂质代谢,而肝细胞自噬与肝脏脂质代谢相互作用[8]。因此,本实验将通过观察痛泻要方对肝郁脾虚型溃疡性结肠炎大鼠血清5-HT及肝脏5-HT2A受体(5-HT2AR)、SCD1、固醇调节元件结合蛋白-1(SREBP-1)、微管相关蛋白1轻链3(LC3)、酵母Atg6同系物(Beclin1)蛋白表达的影响,聚焦肝脏脂质代谢稳态,进一步探讨痛泻要方对缓解期肝郁脾虚型溃疡性结肠炎的作用机制。
1 材料
1.1 动物 SPF级雄性SD大鼠,60只,体质量(200±10)g,购自长沙市天勤生物技术有限公司,动物生产许可证号SCXK(湘)2014-0011。实验方案经贵州中医药大学动物实验伦理审查委员会认证。
1.2 药物 从北京同仁堂贵阳药店有限责任公司购买中药饮片,经贵州中医药大学药学院严福林讲师鉴定合格。按痛泻要方经典配伍比例(6∶4∶3∶2)称取炒白术、炒芍药、炒陈皮、防风,在锅中用蒸馏水浸泡半小时后,武火煮沸,文火煎煮30 min,将水煎液浓缩至100 mL,高、中、低剂量分别含生药量为1、0.5、0.25 g/mL,置于4 ℃冰箱备用。
1.3 试剂 2,4,6-三硝基苯磺酸(TNBS)(美国Sigma公司,货号SLCG2384);柳氮磺胺吡啶(上海阿拉丁生化科技股份有限公司,货号E1525058);5-HT ELISA试剂盒(武汉伊莱瑞特生物科技股份有限公司,货号E-EL-0033c);苏木素染液、伊红染液(武汉赛维尔生物技术有限公司,货号G1005-1、G1001);油红O(合肥博美生物科技有限责任公司,货号YO7512);兔多抗GAPDH(杭州贤至生物科技有限公司,货号AB-P-R001);兔多抗5HT2AR[爱必信(上海)生物科技有限公司,货号Abs138420];鼠单抗SCD1[艾博抗(上海)贸易有限公司,货号Ab19862];兔多抗SREBP-1、Beclin1(江苏亲科生物研究中心有限公司,货号Af6283、Af5128);兔单抗LC3(美国Cell Signaling Technology公司,货号2775)。
1.4 仪器 微型高速离心机(美国Labnet公司);离心机(湖南湘仪实验室仪器开发有限公司);电热恒温培养箱(日本ASONE公司);全自动酶标仪(美国Thermo Fisher Scientific公司);水平摇床(海门市其林贝尔仪器制造有限公司);电子天平(北京赛多利斯仪器系统有限公司);磁力搅拌器(江苏省金坛市中大仪器厂);转轮式切片机(德国徕卡公司);TSJ-Ⅱ型全自动封闭式组织脱水机、BMJ-Ⅲ型包埋机、PHY-Ⅲ型病理组织漂烘仪(常州市中威电子仪器有限公司)。
2 方法
2.1 模型建立 60只SD大鼠适应性喂养1周,分别称体质量并标记,随机分为正常组(8只)和造模组(52只)。参照经典的肝郁脾虚型溃疡性结肠炎造模法,采取TNBS/乙醇溶液灌肠联合束缚应激+饮食失节,建立动物疾病模型[9-10]。将造模组大鼠禁锢于鼠笼中,并将其双前肢反捆至背部以限制其活动,每天捆绑束缚2次,每次进行45 min,并隔日足量或半量喂养饲料,模拟饮食失节,连续造模2周。将造模大鼠禁食1天后,使用10%水合氯醛(3 mL/kg)腹腔注射进行麻醉,利用灌肠管将100 mg/kg TNBS与0.25 mL 50%乙醇混合溶液缓慢注入距离大鼠肛门约8 cm处深的结肠部位,固定大鼠尾部片刻,短暂夹闭肛门,使大鼠保持平躺姿势,苏醒后送回动物房继续饲养,灌肠1次;正常组大鼠则以上述操作注入相同体积的0.9%氯化钠生理盐水。
2.2 分组及给药 60只大鼠随机分为正常组8只,造模组52只,其中造模组在进行捆绑束缚及灌肠后,由于骨折、感染、相互撕咬等情况死亡10只,另外抽取2只进行病理观察评价。确定造模成功后,把40只造模组大鼠随机分为模型组、柳氮磺胺吡啶组及痛泻要方高、中、低剂量组,每组8只,给予药物灌胃。痛泻要方高、中、低剂量组分别按每天10、5、2.5 g/kg剂量灌胃(按人与大鼠体表面积折算[11],相当于60 kg成人每日剂量的12、6、3倍)痛泻要方;柳氮磺胺吡啶组按每天0.3 g/kg灌胃柳氮磺胺吡啶;正常组、模型组均以等量0.9% 氯化钠水溶液进行灌胃,各给药组大鼠连续给药3周,每天1次。
2.3 肝郁脾虚型溃疡性结肠炎动物模型评价指标
2.3.1 宏观表征 主要从大鼠精神状态、摄食改变、活动规律、皮毛色泽、体质量变化、粪便形态等方面进行观察,是评价动物模型的基本要素以及评定动物证候属性的方法,同时是探讨病证结合动物模型的关键环节[12]。宏观表征是动物四诊信息的直接体现,肝郁脾虚证动物会出现皮毛干枯无光泽、静卧少动、乏力、食少便溏等宏观表征,可作为评估肝郁脾虚证的四诊指标[13]。
2.3.2 疾病活动指数(DAI)评分 溃疡性结肠炎的临床表征主要为体质量减轻、稀便、便血,通过对模型动物这3项指标的评分,可以初步了解动物病症发展的严重程度,是评价动物溃疡性结肠炎模型的重要方法[14]。
2.3.3 行为学实验 旷场实验,利用动物在空旷场地中对新异环境的恐惧,与对新异事物的探究本性所产生的冲突行为,来评价模型的情绪状态[15];高架十字迷宫实验,利用动物对新异环境的探究本性和对高悬敞开臂的恐惧形成矛盾冲突行为来考察动物的焦虑状态,是动物焦虑行为学研究中较为经典的测试[16]。不同疾病肝郁脾虚证在临床中常出现情志类症状,因此在动物模型中常选用旷场实验和高架十字迷宫实验等行为学指标评价肝郁脾虚证[17]。
2.3.4 结肠组织病理学 结肠病理显示炎性细胞浸润、杯状细胞减少、腺体破坏及溃疡形成等一系列变化,可确定溃疡性结肠炎动物模型成立[18]。
2.4 宏观表征观察和DAI评分 在造模前、给药前、给药3周后,观察大鼠精神状态、毛发色泽、行为体态;记录大鼠体质量、大便性状,采用邻联甲苯胺法检测粪便隐血,作DAI评分。DAI评分参照文献[19]标准,DAI=(体质量下降分数+大便性状分数+便血分数)/ 3,见表1。
2.5 旷场实验和高架十字迷宫实验观察大鼠行为状态 旷场实验,将大鼠放置于旷场中央区域,记录其5 min内总运动距离和中央区域停留时间。高架十字迷宫实验,记录大鼠5 min内开臂停留时间、进入开臂次数、闭臂停留时间、进入闭臂次数并计算开臂停留时间、进入开臂次数百分比。

表1 大鼠DAI评分标准Tab.1 DAI scoring criteria for rats
2.6 大鼠组织标本采集 给药、DAI评分及行为学实验结束后,注射2%戊巴比妥钠(2.5 mL/kg)进行麻醉,随后腹主动脉取血,静置30 min后,3 000 r/min低温离心15 min,分离收集血清,置于-80 ℃冰箱存放备用。摘取大鼠结肠、肝脏组织,分别4%多聚甲醛储存及-80 ℃保存。
2.7 HE、油红O染色法分别观察大鼠结肠与肝脏组织病理学变化 大鼠结肠组织、肝脏组织经4%多聚甲醛固定、脱水、包埋、切片,分别进行HE染色和油红O染色,光学显微镜下观察结肠组织形态结构和肝脏组织脂质沉积,并对结肠组织进行评分,评分标准参照文献[20],见表2。

表2 溃疡性结肠炎炎症分级评分标准Tab.2 Grading and scoring standards for ulcerative colon
2.8 ELISA法检测大鼠血清5-HT水平 按照ELISA试剂盒说明书进行检测,在96孔酶标板内进行操作,经过显色后在酶标仪内以450 nm波长依序检测各孔OD值并根据标准曲线获得样品检测目标的浓度。
2.9 Western blot检测大鼠肝脏5-HT2AR、SCD1、SREBP-1、LC3、Beclin1蛋白表达 按照试剂盒说明提取肝脏蛋白后,取上清液分装并置于-20 ℃保存,根据蛋白样品OD值,用BCA试剂盒检测蛋白浓度。配置10% SDS-PAGE凝胶,上样后进行电泳、转膜,用TBST封闭2 h,加入内参GAPDH一抗(1∶1 000),5-HT2AR、SCD1、SREBP1、LC3Ⅰ/Ⅱ、Beclin1一抗(1∶1 000),4 ℃孵育过夜,TBST洗膜,加入相应的二抗(1∶50 000),37 ℃摇床孵育2 h。最后显色曝光,扫描胶片,用IPP分析胶片灰度值。

3 结果
3.1 宏观表征观察和DAI评分 正常组大鼠精神活跃,毛发整齐光泽,活动性强,灌胃时抵抗强烈,粪便呈褐色颗粒状且干稀适中;模型组大鼠时而易怒狂躁,时而萎靡不振,出现拖尾,毛发凌乱且色泽干枯晦暗,扎堆少动且蜷伏角落,灌胃时抵抗减弱,粪便稀溏伴有脓血;给药组大鼠精神状态良好但偶有易怒表现,毛发虽凌乱但逐渐恢复光泽,活动增加,时喜扎堆,粪便虽时有稀溏但逐渐成形,质地变干。
各组大鼠DAI评分结果显示,给药前,各造模组之间无显著性差异(P>0.05),与正常组比较,各造模组大鼠DAI评分均升高(P<0.01);给药3周后,各给药组大鼠DAI评分均降低(P<0.01),以痛泻要方中剂量组及柳氮磺胺吡啶组评分降低最为明显,而痛泻要方高剂量组次之。见表3。
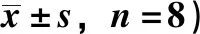
表3 各组大鼠DAI评分(分,Tab.3 DAI scores of rats in each
3.2 旷场实验和高架十字迷宫实验 旷场实验结果显示,与正常组比较,模型组大鼠总运动距离减少,中央区域停留时间降低(P<0.01);与模型组比较,各给药组大鼠总运动距离增加,中央区域停留时间增加(P<0.05,P<0.01),以痛泻要方中剂量组和柳氮磺胺吡啶组最为明显。高架十字迷宫实验结果显示,与正常组比较,模型组大鼠开臂停留时间和进入开臂次数百分比均降低(P<0.01);与模型组比较,各给药组大鼠开臂停留时间和进入开臂次数百分比均升高(P<0.05,P<0.01),以痛泻要方中剂量组和柳氮磺胺吡啶组最为明显。见表4。

表4 各组大鼠旷场实验和高架十字迷宫实验结果Tab.4 Results of open field test and elevated plus maze test of rats in each
3.3 大鼠结肠组织病理学变化 正常组大鼠结肠组织黏膜层、黏膜下层、肌层及浆膜层形态结构完整且界限明晰,固有层内大肠腺排列较为密集,未见坏死和炎症细胞浸润;模型组大鼠大量肠段形成溃疡灶,累及结肠全层,正常细胞结构消失,由大量渗出纤维素、黏液、坏死组织和大量中性粒细胞替代,炎症细胞浸润累及肌层;给药组大鼠结肠组织黏膜层、黏膜下层、肌层及浆膜层结构较完整,固有层内富含管状肠腺。其中痛泻要方高、中剂量组和柳氮磺胺吡啶组黏膜固有层内少量中性粒细胞或淋巴细胞浸润;痛泻要方中剂量组部分固有层和黏膜下层内见毛细淋巴管;痛泻要方低剂量组部分肠腺变性、坏死及扩张,部分区域出现溃疡灶,累及结肠全层,可见大量中性粒细胞浸润。见图1。
图1 各组大鼠结肠组织HE染色(×100)Fig.1 HE staining of rat colon tissue in each group(×100)
溃疡性结肠炎炎症评分结果显示,与正常组比较,模型组大鼠炎症评分升高(P<0.01);与模型组比较,痛泻要方高、中剂量组和柳氮磺胺吡啶组大鼠炎症评分降低(P<0.01)。见表5。
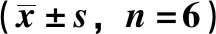
表5 各组大鼠炎症评分结果Tab.5 Results of inflammatory score of rats in each
3.4 大鼠肝脏组织脂质沉积变化 正常组大鼠肝脏组织中细胞核浅染,未见明显橘红色脂滴;与正常组比较,模型组大鼠肝脏组织中脂滴形成增多,细胞浆可见大量大泡样橘红色脂滴,形态较大,形状不规则且排列紧密,脂肪变性明显;与模型组比较,痛泻要方高、中剂量组及柳氮磺胺吡啶组肝脏组织脂滴水平减少,脂肪变性程度减轻。见图2。
图2 各组大鼠肝脏组织油红O脂类染色(×400)Fig.2 Oil red O lipid staining of rats in each group(×400)
3.5 大鼠血清5-HT水平 如表6所示,模型组大鼠血清5-HT水平高于正常组(P<0.01);与模型组比较,各给药组大鼠血清5-HT水平均降低(P<0.01),痛泻要方中剂量组和柳氮磺胺吡啶组降低趋势最为明显,痛泻要方高剂量组次之。
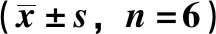
表6 各组大鼠血清5-HT水平Tab.6 Serum 5-HT level of rats in each
3.6 大鼠肝脏5-HT2AR、SCD1、SREBP-1、LC3、Beclin1蛋白表达 与正常组比较,模型组大鼠肝脏SCD1蛋白表达降低(P<0.01),5-HT2AR、SREBP-1、LC3Ⅱ、Beclin1蛋白表达升高(P<0.01);与模型组比较,痛泻要方中剂量组和柳氮磺胺吡啶组大鼠肝脏5-HT2AR蛋白表达降低(P<0.01),痛泻要方高、中剂量组和柳氮磺胺吡啶组肝脏SCD1蛋白表达升高(P<0.05,P<0.01),SREBP-1、LC3Ⅱ、Beclin1蛋白表达降低(P<0.05,P<0.01)。见图3、表7。
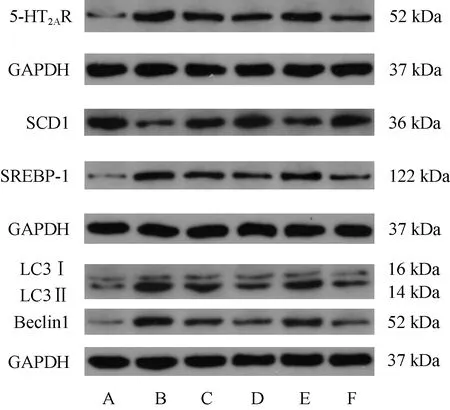
注:A为正常组,B为模型组,C为痛泻要方高剂量组,D为痛泻要方中剂量组,E为痛泻要方低剂量组,F为柳氮磺胺吡啶组。图3 各组大鼠肝脏5-HT2AR、SCD1、SREBP-1、LC3、Beclin1蛋白电泳图Fig.3 Electrophoresis images for 5-HT2AR,SCD1,SREBP-1,LC3 and Beclin1 proteins in the liver of rats in each group
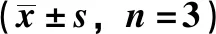
表7 各组大鼠肝脏5-HT2AR、SCD1、SREBP-1、LC3、Beclin1蛋白表达Tab.7 Protein expressions of 5-HT2AR,SCD1,SREBP-1,LC3 and Beclin1 in the liver of rats in each
4 讨论
本实验中模型大鼠与正常大鼠比较,宏观表征改变,DAI评分较高;探究特性和好奇心行为减少;结肠组织全层形成溃疡灶,炎症评分升高,提示肝郁脾虚型溃疡性结肠炎大鼠模型造模成功。经痛泻要方给药后能改善大鼠肝郁脾虚症状,修复结肠病理损伤,抑制炎症反应,对结肠具有保护作用。
外周5-HT及肝脏5-HT2AR介导着肝脏脂肪变性,调节脂质代谢稳态[21-22]。本实验模型大鼠肝脏5-HT2AR表达升高,与血清5-HT变化趋势一致,肝脏脂质沉积;痛泻要方通过调控外周5-HT作用于肝脏5-HT2AR表达,减轻脂质沉积,从而影响肝郁脾虚型溃疡性结肠炎大鼠肝脏脂质代谢。
肝脏SCD1参与脂质代谢过程,是将饱和脂肪酸转化为不饱和脂肪酸的关键酶,当二者平衡失调时会造成肝细胞应激损伤,加重肠道炎症反应[23]。SREBP-1与肝脏脂肪变性密切关联,是评价脂质代谢的关键指标[24]。SREBP-1可以激活SCD1参与脂质合成,二者间的表达具有相关性[25],抑制肝脏SCD1表达会导致肝脏脂质代谢改变,影响脂肪生成转录因子SREBP-1表达[26]。本实验模型大鼠肝脏脂质沉积,SCD1表达降低,而SREBP-1表达升高,结肠黏膜损伤和炎症反应加重;痛泻要方通过调节肝脏SCD1和SREBP-1表达,使饱和脂肪酸转化为不饱和脂肪酸,平衡肝脏脂质代谢稳态,进而减轻肝细胞应激损伤,缓解溃疡性结肠炎结肠黏膜损伤和炎症反应。
Beclin1是自噬启动的调节因子[27],而LC3是反映自噬激活与否的重要标志物,包括LC3Ⅰ和激活的LC3Ⅱ。生理状态下细胞内LC3Ⅰ呈常规表达,当各种应激反应激活自噬时,LC3Ⅰ转化为自噬膜形式的LC3Ⅱ[28],其蛋白表达已成为判断自噬水平的主要标准[29]。脂滴是主要的脂质储存形式[30],自噬参与脂滴的分解代谢[31],改善肝脏脂质代谢紊乱[32]。本实验模型大鼠肝脏脂质沉积,LC3Ⅱ、Beclin1表达升高,提示肝脏脂质代谢紊乱会激活细胞自噬功能;痛泻要方通过平衡肝脏脂质代谢稳态以及改变细胞自噬水平,影响肠道病理损伤。
综上所述,溃疡性结肠炎肝郁脾虚证的证候实质,一方面可能在于外周5-HT作用于肝脏5-HT2AR,抑制SCD1表达,升高SREBP-1表达,使饱和脂肪酸无法转化为不饱和脂肪酸,影响二者动态平衡,导致肝脏脂质沉积增加,出现脂质代谢紊乱,造成肝细胞应激损伤,加重肠道病理损伤和炎症反应;另一方面可能在于脾失健运,肝失疏泄致使膏脂蕴结于肝,出现肝细胞脂质代谢紊乱,激活肝细胞自噬功能。综合各项检测数据,痛泻要方中剂量组给药效果接近柳氮磺胺吡啶组,且优于高、低剂量组。由此可知痛泻要方中剂量相对药效活性最佳,其补脾柔肝的机制可能是通过调控外周5-HT作用于肝脏5-HT2AR表达,维持肝脏脂质代谢稳态以及改变肝细胞自噬水平,从而改善结肠组织病理变化,影响缓解期肝郁脾虚型溃疡性结肠炎。

