HIV-1感染者病毒学指标与血浆中白细胞介素表达水平的相关性研究①
毕铭辕 李建辉 康 文 孙永涛 (中国人民解放军空医军医大学第二附属医院传染病科,西安 710038)
白细胞介素(interleukin,IL)是由多种细胞产生,参与体内免疫调节、免疫应答、免疫激活、信息传递等多种过程的一类细胞因子[1]。由于IL作用广泛,IL 家族根据其主要性质分为IL-1、IL-2、趋化因子、IL-10、IL-12及IL-17等。IL家族中与HIV-1感染及感染后患者免疫炎症激活状态相关的因子较多,包括主要为促炎症因子的IL-1 家族中的IL-1β、IL-6和IL-18[2-4];具有趋化作用的IL-8[5];主要发挥免疫调节作用的IL-10家族中的IL-10、IL-16等[6-7]。尽管已有研究表明HIV-1 感染后,患者体内这些IL 表达会有一定改变,但其在血浆中的表达与未治疗HIV-1感染者的病毒学水平,尤其是与HIV-1 DNA 水平是否相关鲜有报道。本研究根据HIV-1 RNA 或HIV-1 DNA 水平对HIV-1 感染者进行分组,观察不同组间IL-1β、IL-6、IL-8、IL-10、IL-16 和IL-18 表达差异,并分析其与HIV-1 RNA及HIV-1 DNA的相关性。
1 资料与方法
1.1 资料
1.1.1 研究对象 选取空军军医大学第二附属医院就诊的HIV-1 感染者75 例,所有HIV-1 感染者均经初筛和HIV-1抗体确认试验,无HBV/HCV 合并感染或肿瘤,一般状况良好,采血前均未接受过任何抗病毒治疗。本研究经空军军医大学第二附属医院伦理委员会批准(201911-04),患者血液样本仅用于科研,75例患者一般资料及部分检测结果见表1。
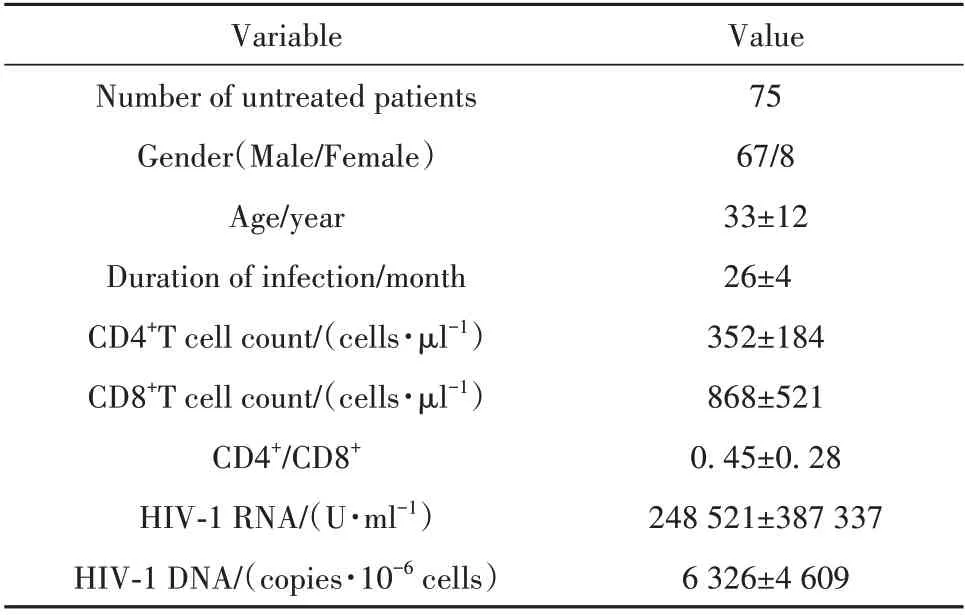
表1 未治疗HIV患者基本信息Tab.1 Basic information of untreated patients with HIV
1.1.2 主要试剂与仪器 QIAamp DNA Blood Mini Kit(QIAGEN);HIV-1 核酸检测试剂盒、DNA 定量检测试剂盒(广州海力特);CD4-FITC/CD8-PE/CD3-PerCP 荧光单克隆抗体试剂盒(同生时代);Luminex Assay Human Premixed Multi-Analyte 试剂盒(R&D公司);FACSAria Ⅱ流式细胞仪(BD公司);
1.2 方法
1.2.1 PBMC 中DNA 提取 抽取受试者EDTA 抗凝的外周血10 ml用于PBMC 分离、流式细胞检测和病毒核酸定量检测。采用密度梯度离心法分离得到PBMC,用于后续检测。采用QIAamp DNA Blood Mini Kit提取PBMC样本总DNA,严格按照试剂盒说明书进行,采用50 μl buffer AE 洗脱DNA 并保存于灭菌的200 μl EP 管。采用ScanDrop 仪检测提取的DNA 核浓度,直接进行HIV-1 DNA 定量检测或-20 ℃冻存。
1.2.2 HIV-1 RNA 定量检测 采用HIV-1 核酸检测试剂盒,在ABI 7500 荧光PCR 仪上对血浆样本中HIV-1 RNA 进行定量检测,严格按照试剂盒说明操作,结果以U/ml表示,最低检测限为20 U/ml。
1.2.3 HIV-1 DNA 定量检测 采用HIV-1 DNA 定量检测试剂盒,在ABI 7500 荧光PCR 仪上对PBMC样本中提取的HIV-1 DNA 进行定量检测,严格按照试剂盒说明操作,结果以copies/106cells 表示,最低检测限为20 copies/106cells。
1.2.4 外周血CD4+T 细胞、CD8+T 细胞计数 采用CD4-FITC/CD8-PE/CD3-PerCP 荧光单克隆抗体试剂盒和BD FACSAria Ⅱ流式细胞仪检测外周血CD4+T细胞、CD8+T 细胞数,取50 μl 全血,采用20 μl 单克隆混合抗体混合物孵育20 min,红细胞裂解液裂解红细胞,上机检测,结果采用Flowjo软件进行分析。
1.2.5 Luminex 液相芯片检测趋化因子 选取IL-1β、IL-6、IL-8、IL-10、IL-16和IL-18并订制对应的Luminex Assay Human Premixed Multi-Analyte Kit 试剂盒。取50 μl 血浆样本并严格按照说明书操作,Luminex 200仪检测。
1.3 统计学处理 采用SPSS23.0 软件和Graph Pad Prism 8 软件进行统计学处理、分析及绘图。一般资料采用描述性分析,计量资料以±s表示。组间比较采用Mann-WhitneyU检验,两两比较采用q检验。由于HIV-1 DNA 及HIV-1 RNA 分布差异较大,取对数后进行相关性分析。相关性分析采用散点图及Pearson 相关分析。P<0.05 为差异具有统计学意义。
2 结果
2.1 各组病毒学水平及外周血CD4+T 细胞、CD8+T细胞计数比较 根据患者HIV-1 DNA是否<103copies/106cells 或HIV-1 RNA 是 否<106 U/ml 分 为4 组:DNA 高水平组(DHG)、DNA 低水平组(DLG)、RNA高水平组(RHG)和RNA 低水平组(RLG),各组患者一般资料、CD4+T 细胞、CD8+T 细胞计数和CD4+/CD8+差异均无统计学意义(P>0.05,表2、表3)。
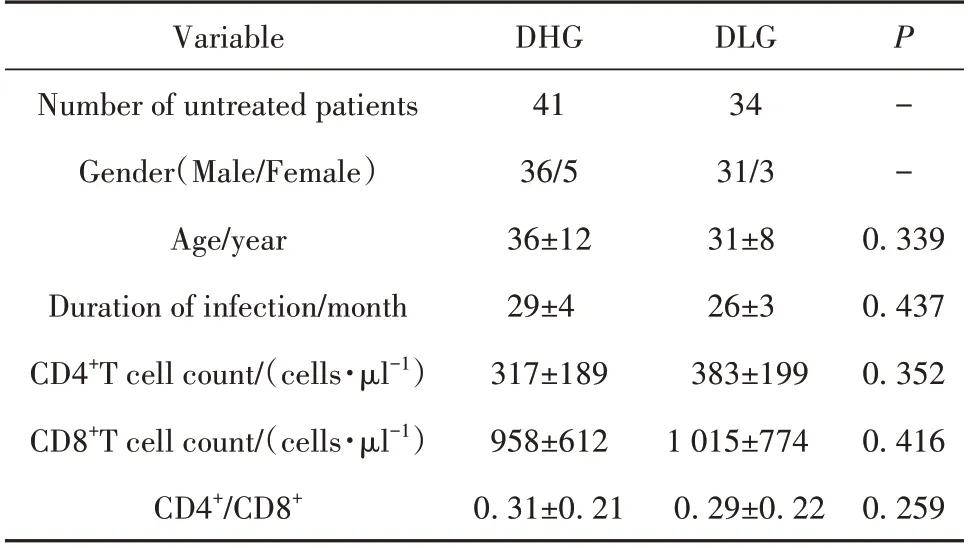
表2 HIV-1 DNA高、低组间差异Tab.2 Differences between high and low HIV-1 DNA groups
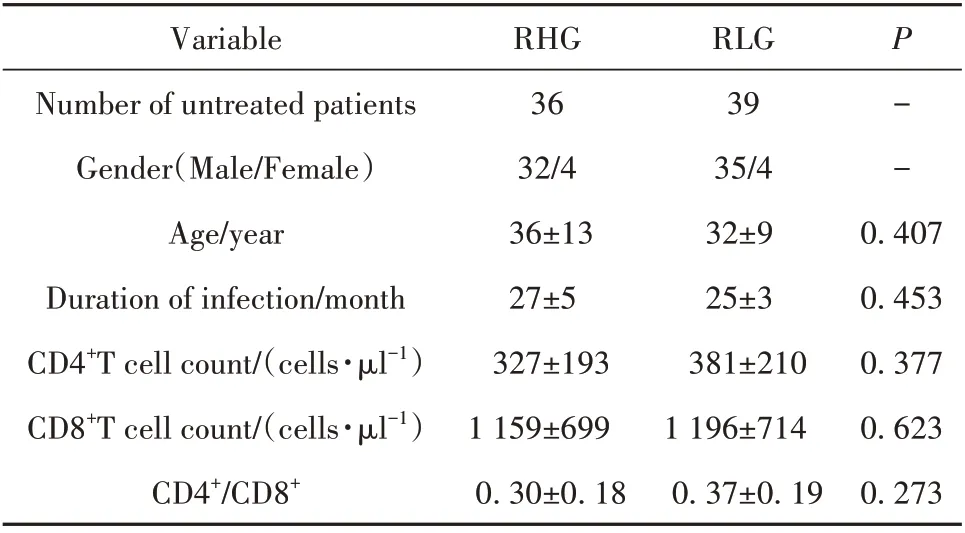
表3 HIV-1 RNA高、低组间差异Tab.3 Differences between high and low HIV-1 RNA groups
2.2 各组IL-1β、IL-6、IL-8、IL-10、IL-16 和IL-18 表达比较 根据以上分组方法,对DLG 与DHG、RLG与RHG 组患者IL-1β、IL-6、IL-8、IL-10、IL-16 和IL-18表达进行比较,结果表明IL-8 表达在两种分组方法下差异均无统计学意义(P>0.05),DHG 组与DLG组IL-1β 水平差异无统计学意义(P>0.05),而IL-6、IL-10、IL-16 和IL-18 表达差异均有统计学意义(P<0.05,图1)。
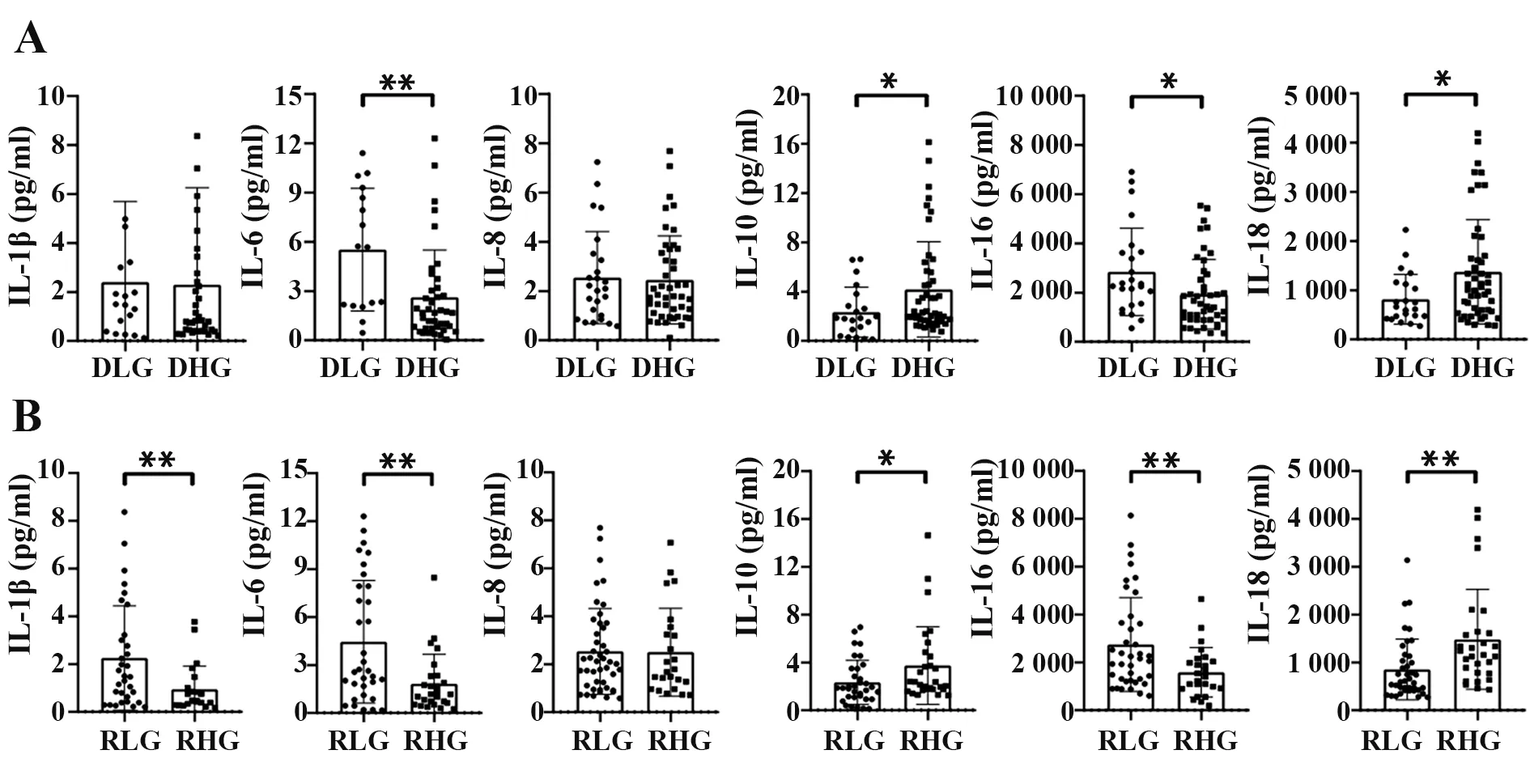
图1 各组IL-1β、IL-6、IL-8、IL-10、IL-16和IL-18表达Fig.1 Expressions of IL-1β,IL-6,IL-8,IL-10,IL-16 and IL-18 in each group
2.3 IL-1β、IL-6、IL-8、IL-10、IL-16 和IL-18 与病毒学指标相关性分析 上述结果表明不同HIV-1 RNA或HIV-1 DNA 水平组间趋化因子IL-1β、IL-6、IL-10、IL-16和IL-18表达存在差异。进一步相关性分析表明,IL-6、IL-10、IL-16 和IL-18 表达与lgDNA 相关(r=-0.420、0.271、-0.332 和0.294,P<0.05),IL-1β和IL-8表达则与lgDNA 无关(r=-0.121和0.123,P>0.05)。同时,IL-1β、IL-6、IL-10、IL-16 和IL-18 表达与lgRNA 相关(r=-0.298、-0.462、0.299、-0.229 和0.269,P<0.05),而IL-8 表 达 与lgRNA 无 关(r=0.123,P>0.05,图2)。
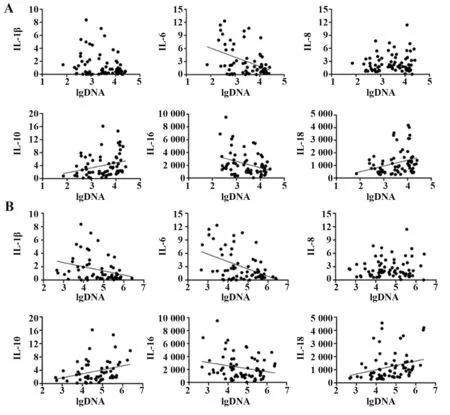
图2 IL-1β、IL-6、IL-8、IL-10、IL-16和IL-18表达与病毒学指标相关性Fig.2 Correlation between expressions of IL-1β,IL-6,IL-8,IL-10,IL-16 and IL-18 and virological indicators
3 讨论
IL-1β 是一种重要的炎症细胞因子,主要由外周血单核细胞和巨噬细胞分泌产生,与细胞凋亡密切相关[8]。炎症、感染等刺激往往会诱导IL-1β水平升高,如HIV-1感染者肠道相关淋巴组织中IL-1β基因表达较健康人明显增高[2]。但也有研究表明,IL-1β在体外可抑制淋巴细胞系、Jurkat 细胞和分离的PBMC 中HIV-1 复制,且可能通过阻断caspase-3 表达和激活进而抑制病毒复制[4,9]。
IL-6 为促炎细胞因子,参与调节多种生理学过程,尤其是在急性炎症反应和从急性炎症向慢性炎症转变中起关键作用[10]。长期以来,HIV-1 感染已被证明可诱导单核细胞和巨噬细胞表达和分泌IL-6,即使在病毒学抑制情况下,接受治疗的HIV 感染者血浆IL-6 水平也明显高于匹配良好的未感染对照组[11-12]。最近研究表明,HIV-1感染者血浆IL-6水平升高与贫血、心血管疾病、癌症等不良临床结果相关[13-15]。IL-6 水平持续升高证明活动性炎症可能对HIV-1 感染者预后具有重要临床意义,但其是否参与并影响病毒复制过程尚无定论[3]。
IL-10 被认为是可由多种类型免疫细胞产生的Th2 型细胞因子,具有间接抑制Th1 反应的功能。研究表明,HIV-1、HBV、HCV 等多种病毒导致的慢性感染状态下,IL-10 表现出对T 细胞的持续抑制作用,进而促进病毒感染活性[16]。IL-10可直接作用于抗原提呈细胞,减少刺激分子表达,阻止初始T细胞成熟,或直接作用于T 细胞以限制其增殖、功能分化[6]。HIV 感染者PBMC 产生的IL-10 可抑制CD4+和CD8+T细胞增殖及细胞因子产生,而阻断IL-10可有效地在体外恢复这些细胞的功能[17]。
IL-16是一种淋巴细胞趋化因子,作为CD4的天然可溶性配体,具有促炎和免疫调节特性,对CD4+T细胞、单核细胞和嗜酸性粒细胞也具有趋化作用[7]。IL-16 的抗病毒活性最初是在分离培养的CD8+T 细胞中发现的,可抑制HIV-1和SIV复制[18]。尽管IL-16和HIV-1 均以CD4 为受体,但研究表明其并不共享共同结合位点[19]。因此,IL-16作为一种内源性抗病毒因子,在抑制HIV-1复制过程中发挥重要作用。
IL-18是一种促炎症、促凋亡和致动脉粥样硬化的细胞因子,属于IL-1 细胞因子家族,关于其对HIV-1复制的影响一直颇有争议。有研究认为IL-18通过诱导嗜碱性粒细胞和肥大细胞产生IL-4、IL-5等Th2 型细胞因子,促进初始CD4+T 细胞发育和分化为Th2 效应细胞,从而抑制抗HIV-1 的免疫作用,间接促进HIV-1 复制[20]。也有研究认为IL-18 通过介导IFN-γ 产生及上调SAMHD1 表达限制HIV-1 在初始巨噬细胞中的复制,或通过抑制caspase-3 激活和表达抑制HIV-1复制[4,21]。
本研究通过对75例未治疗HIV患者血浆IL-1β、IL-6、IL-8、IL-10、IL-16 和IL-18 水平进行检测,并根据患者HIV-1 RNA 或HIV-1 DNA 水平进行分组,比较组间各IL 水平,结果表明除病毒学指标有差异外,组间患者一般情况及免疫学指标,如CD4+T 细胞、CD8+T 细胞计数和CD4+/CD8+差异均无统计学意义(P均>0.05),患者免疫学背景相似。相对于低病毒载量患者,高病毒载量患者血浆IL-10 和IL-18 表达升高,IL-1β、IL-6和IL-16表达降低,而两组间IL-8表达差异无统计学意义。相关性分析也表明IL-1β、IL-6、IL-10、IL-16 和IL-18 表达与病毒载量相关,与既往研究提出的IL与HIV-1感染程度相关的结论一致[2-7]。此外,高HIV-1 DNA 患者血浆IL-10 和IL-18表达高于低HIV-1 DNA患者,IL-6和IL-16表达则低于低HIV-1 DNA 患者,而IL-1β 和IL-8 水平差异无统计学意义。相关性分析结果也表明IL-6、IL-10、IL-16 和IL-18 表达与HIV-1 DNA 相关。由 于HIV-1 DNA 被认为是衡量患者病毒储存库大小的重要指标,因此本研究认为IL-6、IL-10、IL-16 和IL-18 表达不仅与病毒载量有关,还可能与病毒储存库规模有关。由此可知,IL在HIV-1感染中扮演重要角色,是否有其他IL亚族因子也与HIV-1病毒储存库规模相关,以及这些趋化因子可能影响病毒储存库的具体机制有待进一步探索。