定量检测破伤风类毒素酶联免疫吸附法的建立及初步应用
祝传顺 周振发 洪 禹 薛 莹 姚 雷 朱卫华
(北京智飞绿竹生物制药有限公司,北京市细菌性疫苗工程技术研究中心,北京 100176)
无细胞百白破联合疫苗作为计划免疫品种,在我国得到了广泛应用,可有效预防百日咳、白喉、破伤风,其中破伤风疫苗的主要成分为破伤风类毒素(tetanus toxoid,TT)[1]。2020 版《中国药典》三部采用絮状单位测定法检测TT抗原含量,结果判定为肉眼观察,较为主观,存在一定误差[2]。建立和完善TT 抗原的ELISA 方法是非常必要的。目前欧美国家吸附无细胞百白破(组分)联合疫苗(DTaP)生产工艺过程中均采用ELISA 法进行质量控制,而国内许多厂家主要侧重于构建百日咳类毒素(pertussis toxoid,PT)、百日咳丝状血凝素(filamentous hemag⁃glutinin,FHA)与百日咳黏附素(pertactin,PRN)抗原的ELISA检测方法[3-5]。本文采用TT为包被抗体,建立双抗体夹心ELISA 法精确定量TT抗原含量,以期为破伤风疫苗质量控制提供依据。
1 材料与方法
1.1 材料 TT 抗毒素絮状反应标准品(0022,950 Lf/支)购自中国食品药品检定研究院;大鼠抗TT抗体由本实验室制备;羊抗大鼠IgG-HRP 购自Sigma-Aldrich;TT 抗原标准品(04/150,690 Lf/支)购自英国国家生物制品研究所,稀释至2 Lf/ml 备用;TT 抗原(批 号:20190505T-1、20190505T-2、20190505T-3、20190505T-4、20190505T-5、20190505T-6)、DTaP 实验 样 品(批 号:20180101、20180102、20180103、20200101、202004002、202005003、202005004)和氢氧化铝佐剂均由本实验室提供;DTaP市售品(批号:R3L38、U3D57、ROC941M)购自赛诺菲-巴斯德公司;405LSR 型洗板机购自美国伯腾仪器有限公司;Spectra Max 190 型酶标仪购自美国美谷分子仪器有限公司;Legend Micro17 型台式离心机购自Thermo Fisher;DPX-9272132 型恒温培养箱购自上海福玛设备有限公司。
1.2 方法
1.2.1 包被抗体和检测抗体工作浓度确定 将TT抗毒素(100 Lf/ml)分别稀释为2、1、0.5、0.25 Lf/ml包被酶标板,大鼠抗TT 检测抗体分别稀释2 000、5 000、10 000、20 000 倍进行棋盘滴定,羊抗大鼠IgG-HRP 抗体10 000 倍稀释,检测0.125、0.062 5、0.031 25、0.015 625、0.007 813、0.003 906、0.001 953、0.000 976 7、0.000 488 35 Lf/ml 系列稀释TT 抗原标准品,根据0.125 Lf/ml标准品450 nm处吸光度A450>1.0、0~0.062 5 Lf/ml TT 抗原浓度区间标准曲线相关系数(r)>0.99、阴性对照(NC)A450<0.1 这3 条标准筛选最佳包被浓度和检测抗体浓度[6-7]。
1.2.2 双抗体夹心ELISA 法构建 采用碳酸盐缓冲液(pH=9.6)将TT(100 Lf/ml)稀释至0.25 Lf/ml,包被酶标板,37 ℃孵育1 h,按照常规ELISA 操作步骤进行,加入TMB底物液显色,2 mol/L H2SO4终止反应,酶标仪测定A450[6-7]。
1.2.3 双抗夹心ELISA法验证
1.2.3.1 线性关系的重复性 建立絮状单位(Lf/ml)对应A450的log-log 直线回归方程,确定最佳线性关系,实验重复8 次,计算8 次检测的r值,r2均应>0.99,考察线性关系的重复性。
1.2.3.2 特异性 将高浓度TT 抗原和DT 抗原及100 ng/ml PT 抗原、FHA 抗原、PRN 抗原作为待检品,磷酸盐缓冲液作为阴性对照,进行双抗体夹心ELISA法特异性评价。以阴性对照(NC)A450的2.1倍作为判定阴性与阳性的标准[8-9]。
1.2.3.3 准确度、精密度验及定量限确定 定量限:检测准确稀释的0.002 5、0.0012 5、0.000 625、0.000 312 5 Lf/ml 的TT 抗原标准品,各浓度同批次检测8 次,批间检测3 次,计算实验内和实验间检测的回收率、均值xˉ、标准偏差(s)及变异系数(CV);准确度及精密度:在磷酸盐缓冲液中分别添加已知的TT抗原标准品至絮状浓度为0.04、0.01、0.002 5 Lf/ml,再进行双抗体夹心ELISA 法检测,各浓度批内重复测 定8 次,批 间 测 定3 次,计 算 检 测 回 收 率、xˉ、s及CV[10]。
1.2.4 氢氧化铝佐剂对TT 抗原的吸附能力测定向TT 抗原中加入氢氧化铝佐剂和0.85%氯化钠溶液,使铝离子终浓度达到0.5 mg/ml,絮状单位分别达到7、21、70、140、350、700、1 400 Lf/ml,搅拌吸附18~24 h,8 000 g 离心5 min,取上清,测定上清TT 抗原含量,结合TT 抗原理论量计算吸附率(%)=(TT 抗原理论量-上清TT 抗原量)/TT 抗原理论量×100%。
1.2.5 抗原吸附率测定 取6 批TT 抗原经氢氧化铝佐剂吸附,使铝离子终浓度达到0.5 mg/ml,TT抗原吸附后浓度分别达到200 Lf/ml,10 mg/ml 加入柠檬酸钠混匀,37 ℃孵育24 h 进行解吸附,解吸附后的供试品和未经解吸附供试品同时8 000 g 离心5 min,分别取上清检测TT 抗原含量,计算抗原吸附率(%)=(解吸附抗原量-未解吸附上清抗原量)/解吸附抗原量×100%,解吸附回收率(%)=解吸附抗原量/理论量×100%。
1.2.6 TT 抗原含量测定 采用已建立的双抗体夹心ELISA 法对6 批TT 抗原含量进行测定,同时与类毒素絮状单位测定法检测结果进行相关性分析。
1.2.7 DTaP 中TT 抗原含量及吸附率测定 采用双 抗 体 夹 心ELISA 法 对7 批DTaP 实 验 样 品、3 批DTaP 市售品的TT 抗原含量及TT 抗原吸附率进行测定。
1.3 统计学分析 采用SPSS23.0软件进行统计学分析,双抗体夹心ELISA 法与絮状单位测定法相关性分析采用Pearson 相关性分析,判定标准:相关系数r的绝对值在0.5~0.8呈显著相关(或中等程度相关),>0.8 呈高度相关[8,10]。组间比较采用配对t检验,P<0.05为差异有统计学意义。
2 结果
2.1 双抗体夹心ELISA 法建立 检测抗体浓度10 000 倍稀释,包被抗体浓度为0.25 Lf/ml 时,建立的双抗体夹心ELISA 法在TT 抗原标准品浓度为0~0.062 5 Lf/ml内呈良好线性关系(r2>0.99,图1)。

图1 TT双抗体夹心ELISA法标准曲线建立Fig.1 Establishment of TT double antibody sandwich ELISA standard curve
2.2 双抗体夹心ELISA法验证结果
2.2.1 线性关系的重复性验证 重复试验8 次,r和r2均>0.99,说明建立的线性关系可重复性较好(表1)。
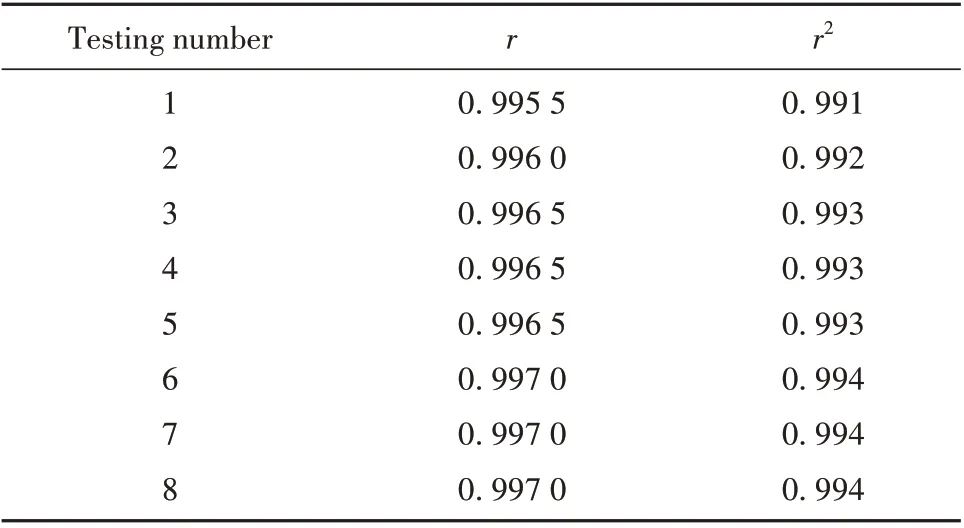
表1 双抗体夹心ELISA法线性重复性验证Tab.1 Verification for linearity repetitive of double anti⁃body sandwich ELISA method
2.2.2 特异性验证 建立的双抗体夹心ELISA 法对高浓度DT 抗原、PT 抗原、FHA 抗原、PRN 抗原的检测结果均为阴性,而对0.2 Lf/ml TT 抗原检测结果为强阳性(表2),表明该方法特异性较好。
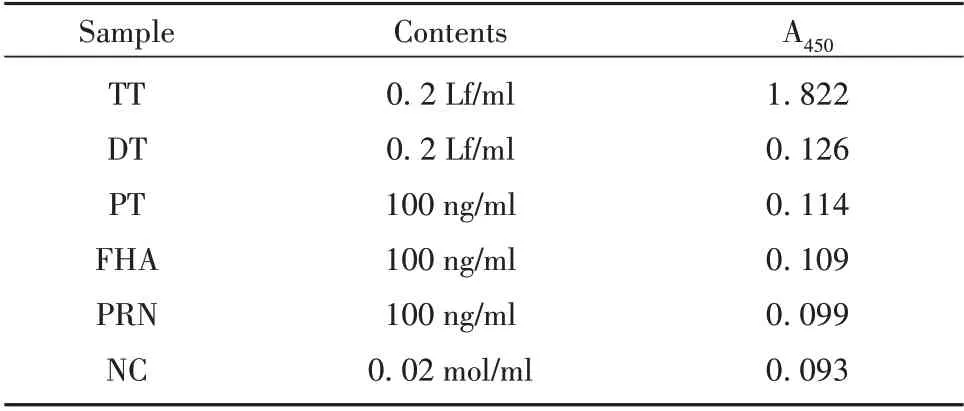
表2 特异性验证Tab.2 Specificity verification
2.2.3 准确度、精密度及定量限验证
2.2.3.1 定量限 不同浓度TT 抗原检测结果见表3。TT 抗原标准品稀释至0.000 625 Lf/ml 时,批内和批间回收率分别为102.40%和99.09%,CV分别为4.089%和5.092%,准确度和精密度较好;TT抗原标准品稀释至0.000 312 5 Lf/ml 时,批内和批间回收率分别为77.59% 和72.00%,CV分别为14.44%和15.56%,准确度和精密度较差。因此确定该方法准确检测的最低浓度为0.000 625 Lf/ml。
2.2.3.2 准确度和中间精密度 双抗体夹心ELISA法检测0.0400 0、0.0100 0、0.002 5 Lf/ml 3 个浓度TT 抗原批内回收率分别为89.90%、106.60%、105.20%,批间回收率分别为90.65%、102.87%、103.96%,均在85%~115%范围内,同时3 个浓度批内和批间检测CV均<10%(表3)。表明该检测方法准确度和精密度较好。

表3 精密度及准确度验证Tab.3 Precision and accuracy verification
2.3 双抗体夹心ELISA法检测TT抗原的实际应用
2.3.1 氢氧化铝佐剂对TT 抗原吸附能力的测定铝离子浓度为0.5 mg/ml 时,7~700 Lf/ml 范围内TT抗原吸附率均>90%。随着样品含量增加,吸附率略有下降,TT 抗原含量为1 400 Lf/ml 时,吸附率下降为81.4%(表4)。

表4 佐剂对TT抗原的吸附能力Tab.4 Adsorption capacity of adjuvant to TT antigen
2.3.2 TT 抗原吸附率测定 6 批TT 抗原佐剂吸附后解吸附,絮状单位回收率为97.6%~112.1%,表明该解吸附方法可将TT 抗原从氢氧化铝佐剂上解吸附,解吸附回收率>95%,同时不对双抗体夹心ELISA法测定TT 抗原造成干扰。连续6 批TT 抗原原液吸附率均>98%(表5)。
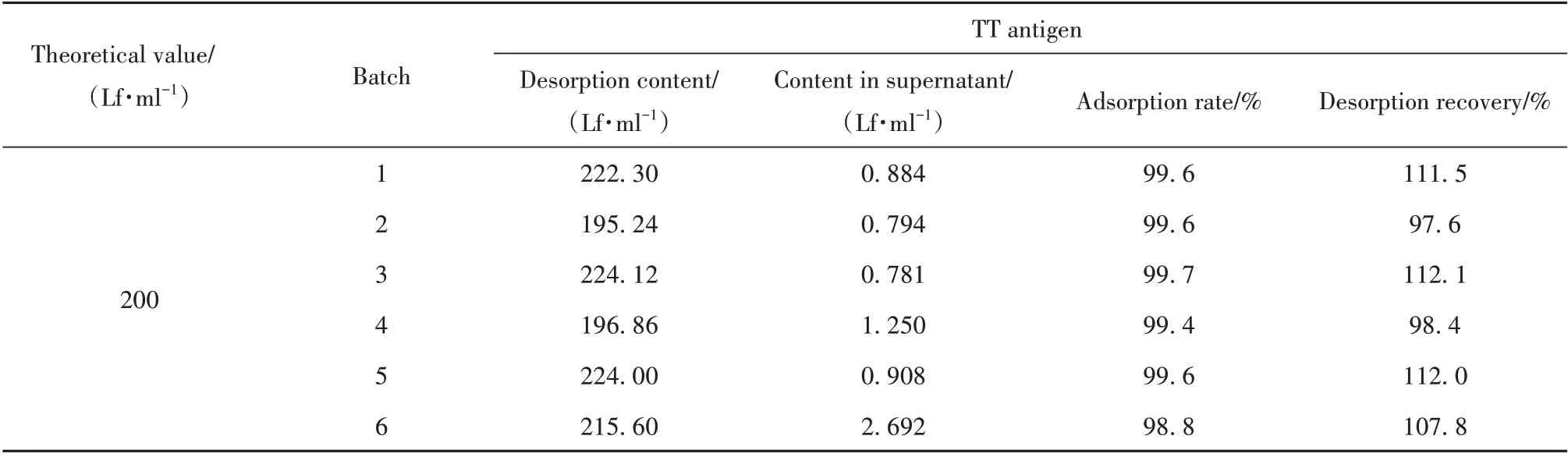
表5 TT抗原吸附率Tab.5 TT antigen adsorption rate
2.3.3 两种不同方法检测TT 抗原含量结果比较双抗体夹心ELISA法和絮状单位测定法检测结果间变异系数<15%,两种方法检测结果比值为0.93~1.15。采用Pearson 相关性分析发现2 种方法测定结果高度相关(r=0.94)。配对t检验结果显示,2 种方法检测结果差异无统计学意义(t=0.13,P>0.05,表6)。
2.3.4 联合疫苗中TT抗原加入量及吸附率 采用双抗体夹心ELISA 法对7 批DTaP 实验室联合疫苗样品、3 批市售DTaP 联合疫苗成品经解吸附处理测定TT 抗原含量,已知理论加入量为7 Lf/ml,10 批样品均值为7.93 Lf/ml,CV为9.82%。同时测定联合疫苗的TT 抗原吸附率均>99%,说明TT 抗原与DT抗原、PT抗原、FHA抗原、PRN抗原混合,TT抗原未发生解离(表7)。
3 讨论
DTaP联合疫苗已在国内外推广应用,而抗原定量控制已成为质量控制的工作重点。为制备合格的无细胞百白破联合疫苗,建立和完善各种抗原的检测方法是必需的[8]。TT 抗毒素有效抗原含量测定是破伤风疫苗质量控制的重要指标。本文采用TT 和相应酶标抗体建立的双抗体夹心ELISA 法在0~0.062 5 Lf/ml 范围能够建立较理想的线性关系(r2>0.99),方法学验证表明该方法可重复性、特异性和稳定性良好,可靠测量范围为0.000 625~0.040 000 Lf/ml,定量限为0.000 625 Lf/ml。分别采用双抗体夹心ELISA 法和絮状单位测定法测定6 批TT 抗原,配对t检验显示结果间差异无统计学意义(P>0.05),Pearson相关性分析也显示两种检测方法高度相关。
本研究探索了双抗体夹心ELISA 法在TT 抗原质量控制过程中的应用,通过检测氢氧化铝佐剂对TT抗原的吸附能力发现,1 mg铝离子可吸附1 400 Lf TT 抗原,而成品中对应的TT 含量为7 Lf/ml,铝离子含量为0.5 mg/ml,这一结果对于制备高吸附率的多联多价疫苗意义重大。同时探索了双抗体夹心ELISA 法在TT 吸附原液和百白破联合疫苗中的应用。
《中国药典》2020 版中的絮状单位测定法是检测人员以肉眼观察的半定量方法,较为主观,敏感度低,不适用于TT 抗原吸附后的含量测定,难以完成对原液和成品的检测要求[2];而双抗体夹心ELISA 法能够对抗原吸附工艺前后进行精确定量,可适用于原液和成品检测工作。
综上,本研究建立的双抗体夹心ELISA 法更有利于联合疫苗制备过程中TT抗原的质量控制,对提高我国破伤风疫苗品质具有重要意义。