细粒棘球蚴通过STAT6促进巨噬细胞向M2型极化①
冯叶叶 许军英 逯君霞 侯 隽 王良海 吴向未 陈雪玲 (石河子大学医学院,石河子 832002)
棘球蚴病是一种由棘球绦虫属绦虫的幼虫引起的人畜共患疾病,细粒棘球蚴(Echinococcus granu⁃losus)幼虫引起的囊性棘球蚴病较为常见。中国西部是全球流行病最严重的地区之一,包括内蒙古、四川、云南、西藏、陕西、甘肃、青海、宁夏、新疆和新疆生产建设兵团等9 个省级行政区划的370 个县[1-2]。细粒棘球蚴的生命周期中主要包括中间宿主和终宿主,人类可以作为中间宿主,其临床症状与靶器官的损伤或功能障碍有关。细粒棘球蚴的幼虫阶段主要居住在中间宿主的肝脏(70%)和肺部(20%),其余部分包括脑、脾、肾和心脏[3]。细粒棘球蚴幼虫侵入实质脏器后,发生免疫逃逸,形成囊肿[4]。囊肿破裂后会引起全身或局部过敏反应,甚至死亡,治疗复杂,对患者的生活质量产生了严重的影响[5]。尽管人们已经对其进行了广泛地研究,然而,其相关分子机制仍不完全清楚。
巨噬细胞在不同条件下,根据其释放的细胞因子、细胞表面标志物等不同,分为两种活化状态:M1型经典活化型和M2型替代活化型。M1型巨噬细胞相关因子主要有CD86、TNF-α、IL-1β、IL-6 等,发挥清除细菌病毒、促进炎症等效应。M2型巨噬细胞相关因子主要包括CD206、IL-10、精氨酸酶1(argi⁃nase,ARG1)、IL-4、TGF-β等,从而发挥抑制炎症、参与组织修复等效应[6]。
信号转导和转录激活因子STAT 家族包括STAT1、STAT2、STAT3、STAT4、STAT5a、STAT5b 和STAT6[7]。信号转导和转录激活因子6(signal trans⁃ducer and activator of transcription 6,STAT6)在机体的各种生理病理过程中发挥重要作用,包括参与机体的免疫应答,参与肿瘤细胞的增殖、凋亡、转移等[8]。STAT6 的激活是巨噬细胞发挥功能的关键信号通路,是M2 型巨噬细胞激活所必需的,IL-4 和IL-13 是M2 型巨噬细胞的关键因子,通过STAT6 发挥作用,诱导其磷酸化并促进STAT6 参与基因的转录[9]。棘球蚴病作为一种感染性疾病,对于STAT6的表达研究尚未见报道。因此,本研究探讨细粒棘球蚴感染是否可影响巨噬细胞向M2 型极化,进一步采用STAT6 抑制剂探讨STAT6 在细粒棘球蚴诱导巨噬细胞M2 型极化中的作用,为进一步研究治疗囊性棘球蚴病的潜在分子靶标提供理论依据。
1 材料与方法
1.1 材料
1.1.1 细粒棘球蚴囊液来源 细粒棘球蚴囊液(Echinococcus granulosuscyst fluid,EgCF)采集于新疆维吾尔自治区石河子市屠宰场病羊肝脏。
1.1.2 细胞来源 巨噬细胞系Raw264.7 购自上海生命科学研究院细胞库。
1.1.3 主要仪器与试剂 DMEM 高糖培养基(货号:C11995500BT)、特级胎牛血清FBS(货号:04-001-A)、青链霉素(货号:SV30010)、ACK 红细胞裂解液(货号:A1049201)、磷酸盐缓冲液PBS(货号:c20012500bt)购自美国Life-Gibco 公司;二甲基亚砜DMSO(货号:#D8370)购自北京索莱宝生物公司;总RNA 提取试剂盒(货号:R6834-01)购自美国Omega 生物技术公司;Nanodrop2000 购自Thermo Fisher Scientific,USA;逆 转 录 试 剂 盒(货 号:K1622)购自赛默飞世尔科技有限公司;荧光染料SYBR Green Ⅱ(货号:RR820A)购自TaKaRa;PE anti-mouse CD206(货号:85-12-2061-80)、PE antimouse TNF-α(货号:12-7321-81)、Intracellular Fixa⁃tion/Permeabilization Buffer(货 号:88-8824-00)、Foxp3/Transcription Factor Staining Buffer Set(货号:00-5523-00)、Cell Stimulation Cocktail(plus protein transport inh)(货号:00-4975-93)购自eBioscience 公司;重组Anti-STAT6 抗体(货号:ab32520)购自Abcam 公司;STAT6 抑制剂AS1517499(货号:HY-100614)购自美国MCE 生物科技公司;FITC 标记山羊抗兔(货号:ZF-0311)购自北京中杉金桥公司;Mouse IL-6 ELISA Kit(货号:70-EK2062/2)购自联科集团有限公司。
逆转录仪器(TaKaRa,11007136);荧光定量PCR仪(美国Bio-Rad 公司,785BR11656);流式细胞仪(安捷伦科技有限公司,45-2-2005-3352-1);酶标仪(赛默飞世尔科技有限公司,3001-2140)。
1.1.4 引物 根据Genebank 中小鼠β-actin、STAT6、CD206、IL-4、ARG1、TGF-β、TNF-α、IL-1β、IL-6 的基因序列,应用Blast 进行分析和比较,选取合适的区域合成引物,所有引物由上海生工生物工程公司合成(表1)。

表1 qRT-PCR引物Tab.1 qRT-PCR primers
1.2 方法
1.2.1 EgCF 的采集及制备 采用清水冲洗、乙醇消毒感染细粒棘球蚴病的新鲜羊肝脏,50 ml洁净注射器抽取包囊中清澈无污染的单囊型包囊囊液,注入无菌容器,移入无菌操作台,用0.22 μm滤菌器过滤囊液,分装备用。
1.2.2 巨噬细胞系Raw264.7的培养 配制DMEM完全培养基(50 ml 离心管中加入1 ml 青链霉素、5 ml 特级胎牛血清FBS、44 ml DMEM 高糖培养基)。细胞以1×106个/孔铺于6 孔板,并加入适量DMEM完全培养基培养。
1.2.3 STAT6 抑制剂使用浓度的配制 取20 μl STAT6 抑制剂原液(10 mmol/L),加入180 μl DMEM高糖培养基中充分溶解混匀,吸出20 μl再加入180 μl DMEM高糖培养基中充分溶解混匀,吸出20 μl再加入180 μl DMEM 高糖培养基中充分溶解混匀,即倍比稀释1 000 倍,再分别取4.2 μl、20 μl 稀释液加入DMEM 完全培养基与EgCF 混合液中,共2 ml,其最终浓度为21 nmol/L、100 nmol/L[10]。
1.2.4 EgCF 处理巨噬细胞 各孔加入1.75 ml DMEM 完全培养基。0 h 组:加入0.25 ml DMEM 完全培养基;24 h 组:加入0.25 ml EgCF。在37 ℃、5%CO2培养箱内培养,在24 h收集细胞(各设3个复孔)及细胞培养上清液备用[检测细胞因子前6 h加入Cell Stimulation Cocktail(plus protein transport inh)]。
1.2.5 EgCF 与STAT6 抑制剂处理巨噬细胞0 nmol/L组:加入1.75 ml DMEM完全培养基、0.25 ml EgCF;21 nmol/L 和100 nmol/L 组:加 入0.25 ml EgCF,STAT6抑制剂AS1517499分别以21 nmol/L 和100 nmol/L 浓度加入,补充加入DMEM 完全培养基至2 ml;溶剂组:加入DMSO。在37 ℃、5%CO2培养箱内培养24 h,收集细胞备用。
1.2.6 定量逆转录聚合酶链反应(qRT-PCR)检测STAT6、CD206、IL-4、ARG1、TGF-β、IL-6、TNF-α、IL-1β 的表达 使用总RNA 提取试剂盒提取巨噬细胞中的RNA,Nanodrop2000 检测各组样品浓度。逆转录试剂盒在逆转录仪器中进行反转录(70 ℃5 min,4 ℃2 min)、扩增(42 ℃60 min,70 ℃5 min,4 ℃∞)得到cDNA。使用荧光定量PCR 仪检测,反应体系总体积20 μl:cDNA 1.6 μl,正向引物0.8 μl,反向引物0.8 μl,荧光染料SYBR Green Ⅱ10 μl,ddH2O 6.8 μl;反应条件:95 ℃30 s 预变性;95 ℃5 s 变性,60 ℃30 s退火/延伸,共39个循环。引物序列见表1。结果用Bio-Rad CFX96 Manager进行分析。
1.2.7 流式细胞术检测STAT6、CD206、TNF-α 的表达 弃培养上清液,PBS 洗1遍,加入适量PBS,采用细胞刮轻柔刮掉细胞,将细胞转移至1.5 ml 离心管,2 000 r/min离心5 min,弃PBS,进行如下处理。
细胞胞浆内CD206、TNF-α 染色组处理:使用Intracellular Fixation/Permeabilization Buffer,每管加入100 μl PBS、200 μl IC Fixation Buffer 固定液固定细胞,室温孵育30 min,2 000 r/min 离心5 min,弃上清;每 管 加 入1 ml 1×Permeabilization,室 温 孵 育15 min,2 000 r/min 离心5 min,弃上清;逐管加入1×Permeabilization 配好的抗体PE anti-mouse CD206(1∶200)、PE anti-mouse TNF-α(1∶20),悬浮振荡细胞,室温避光孵育30 min;每管加入1 ml 1×Permea⁃bilization,2 000 r/min离心5 min,弃上清,加入300 μl PBS悬浮振荡细胞,在1 h内使用流式细胞仪检测。
细胞核内STAT6 染色组处理:使用Foxp3/Transcription Factor Staining Buffer Set,每 管 加 入100 μl PBS、200 μl Fixation/Permeabilization 固定液固定细胞,室温避光孵育30 min,2 000 r/min 离心5 min,弃上清;每管加入1ml 1×Permeabilization,室温孵育15 min,2 000 r/min 离心5 min,弃上清;逐管加入1×Permeabilization 配制好的抗体Anti-STAT6(1∶30),悬浮振荡细胞,室温避光孵育1 h;每管加入1 ml 1×Permeabilization,2 000 r/min 离心5 min,弃上清;逐管加入1×Permeabilization 配好的抗体FITClabeled goat anti-rabbit(1∶100),悬浮振荡细胞,室温避光孵育1 h;每管加入1 ml 1×Permeabilization,2 000 r/min 离心5 min,弃上清,加入300 μl PBS 悬浮振荡细胞,在1 h内使用流式细胞仪检测。
1.2.8 ELISA 检测上清液中IL-6 的量 收集细胞培养上清液,4 ℃、300 g 离心10 min 去除沉淀物,离心后的上清液直接用来检测。参照Mouse IL-6 ELISA Kit 说明书,倍比稀释标准品,第一排每孔按照稀释后的浓度梯度依次加入100 μl;每个样本孔加入100 μl细胞培养上清液,再向所有孔中加入50 μl稀释的检测抗体(1∶100),300 r/min 振荡并于室温孵育1.5 h。弃液体洗板6 次并甩干。每孔加100 μl稀释的辣根过氧化物酶标记的链霉亲和素(1∶100),300 r/min 振荡并于室温孵育30 min。弃液体洗板6 次并甩干。每孔加入100 μl 显色底物TMB,室温避光孵育15 min左右(肉眼观察第5孔有淡蓝色,空白孔无蓝色)。加入终止液终止反应,30 min内使用酶标仪测定吸光度(A450和A570),绘制标准曲线并计算各样品浓度。
1.3 统计学方法 使用GraphPad Prism 7.0 软件进行统计学分析,3 组及以上组间的差异采用One-Way ANOVA 检验,两组间的差异采用t检验,P<0.05 代表差异具有统计学意义,ns 代表差异无统计学意义。
2 结果
2.1 EgCF 抑制M1 型巨噬细胞相关因子的表达为了研究细粒棘球蚴对巨噬细胞的影响,采用EgCF和巨噬细胞系Raw264.7 进行体外研究,EgCF 的最终浓度为0.5 mg/ml。EgCF 处理巨噬细胞24 h,通过qRT-PCR 检测M1 型巨噬细胞分泌的促炎因子IL-6、IL-1β、TNF-α 的mRNA 表达水平(图1A~C),ELISA 检测IL-6 蛋白表达水平(图1D),流式细胞术检测TNF-α蛋白表达水平(图1E)。结果显示:与0 h相比,EgCF 处理巨噬细 胞24 h 后,M1 型标志物IL-6、IL-1β、TNF-α 的mRNA 和蛋白表达均下降(P<0.01)。
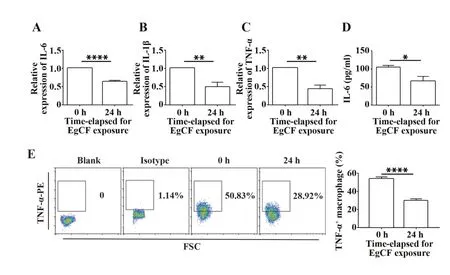
图1 EgCF对M1型巨噬细胞相关分子表达的影响Fig.1 Effect of EgCF on expressions of M1 polarization related molecules
2.2 EgCF 促进M2 型巨噬细胞相关因子的表达qRT-PCR 检测M2 型巨噬细胞表面标志物CD206 以及分泌的抑炎因子IL-4、ARG1、TGF-β 的mRNA 表达水平(图2A~D),流式细胞术检测CD206 蛋白表达水平(图2E)。结果显示:与0 h 相比,EgCF 处理巨噬细胞24 h 后,M2 型巨噬细胞相关因子CD206、IL-4、ARG1、TGF-β 的表达均上升(P<0.05)。提示EgCF可促进巨噬细胞表型向M2型极化。
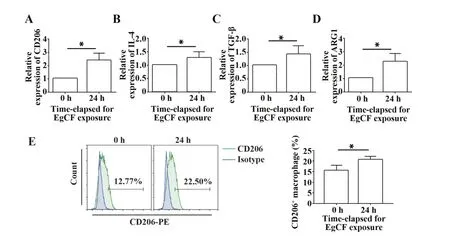
图2 EgCF对M2型巨噬细胞相关分子表达的影响Fig.2 Effect of EgCF on expressions of M2 polarization related molecules
2.3 EgCF 促进Raw264.7 细胞中STAT6 的表达qRT-PCR 检测巨噬细胞中STAT6 的mRNA 表达水平发现,STAT6表达呈升高趋势(图3A,P<0.01);流式细胞术检测巨噬细胞中STAT6 的蛋白表达水平,发现其与mRNA 表达水平一致(图3B,P<0.001)。提示EgCF可促进巨噬细胞中STAT6表达。但EgCF是否通过促进STAT6 的表达促使巨噬细胞向M2 型极化需进一步研究。
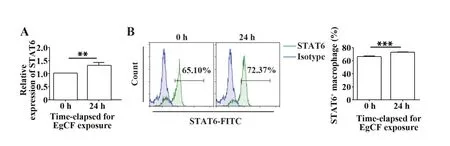
图3 EgCF对Raw264.7细胞中STAT6表达的影响Fig.3 Effect of EgCF on STAT6 expression in Raw264.7 cells
2.4 STAT6 抑制剂AS1517499 可有效抑制STAT6的表达 进一步探讨EgCF 是否通过STAT6 影响巨噬细胞的极化类型。流式细胞术结果显示,STAT6抑制剂与EgCF处理巨噬细胞24 h后,加入21 nmol/L STAT6抑制剂组与DMSO 组相比STAT6的表达差异无统计学意义(图4A,P>0.05),而加入100 nmol/L STAT6抑制剂组与DMSO 组相比STAT6表达差异有统计学意义(图4B,P<0.01)。qRT-PCR 结果显示,100 nmol/L STAT6 抑制剂抑制了STAT6 的表达,差异有统计学意义(图4C,P<0.05)。提示100 nmol/L STAT6抑制剂可有效抑制STAT6表达。
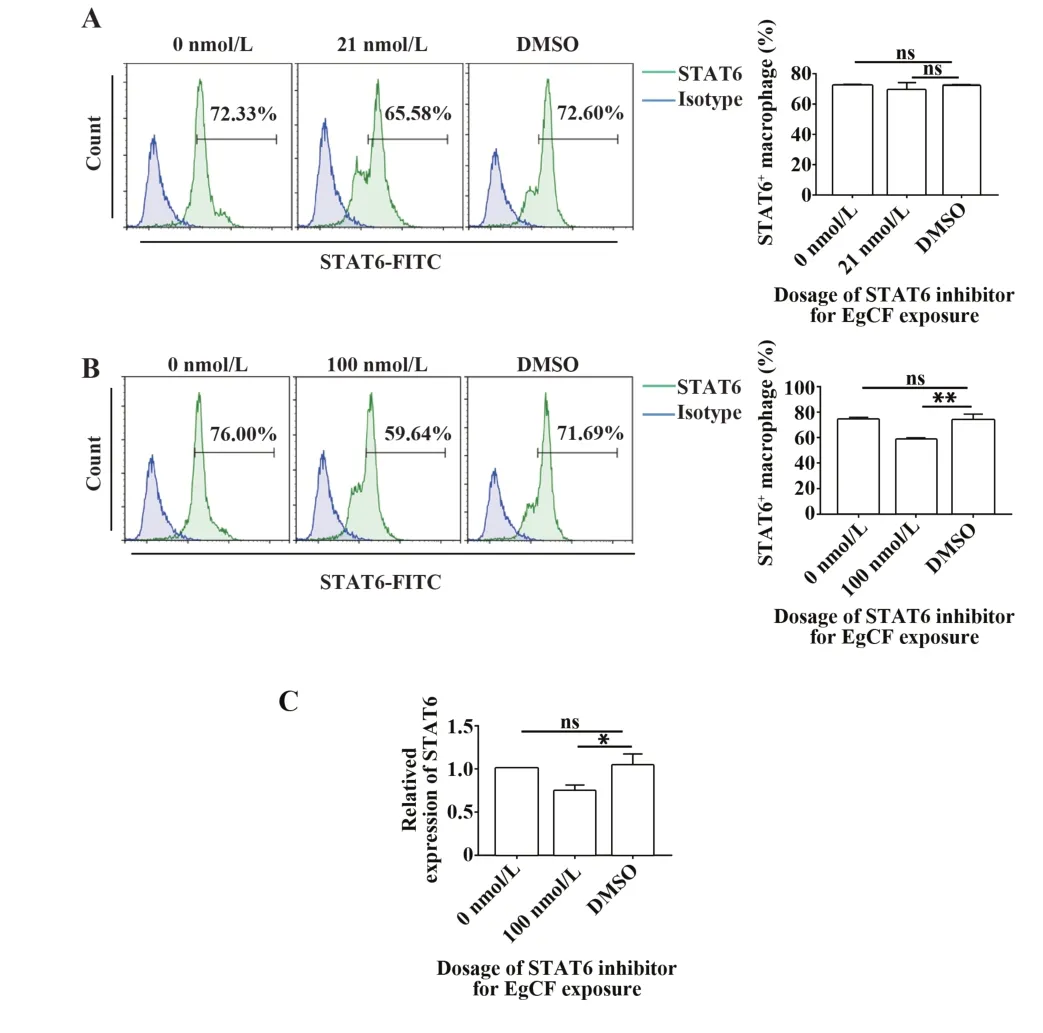
图4 STAT6 抑制剂对Raw264.7 细胞中STAT6 表达的抑制作用Fig.4 Inhibitory effect of STAT6 inhibitor on expression of STAT6 in Raw264.7 cells
2.5 STAT6抑制剂抑制M2型巨噬细胞相关因子的表达 进一步使用100 nmol/L STAT6 抑制剂与EgCF 处理巨噬细胞24 h,qRT-PCR 检测M1 型和M2型巨噬细胞相关因子的表达水平。结果显示:M2型巨噬细胞相关因子CD206、TGF-β、IL-4 的表达被抑制(图5A~C,P>0.05),而M1 型巨噬细胞相关因子IL-6的表达被促进(图5D,P>0.05)。提示100 nmol/L STAT6 抑制剂可逆转EgCF 诱导的巨噬细胞极化类型转变,促进巨噬细胞向M1 型极化、抑制其向M2型极化。

图5 STAT6抑制剂对EgCF诱导的巨噬细胞极化的作用Fig.5 Effect of STAT6 inhibitor on EgCF induced macro⁃phage polarization
3 讨论
棘球蚴病的常见受累器官为肝脏。在炎症的发生发展过程中,固有免疫是防御的第一道防线,是肝脏受到损伤刺激后首先发生的,巨噬细胞在固有免疫反应中发挥重要的作用[11]。巨噬细胞极化是调节炎症反应的重要机制[12]。有文献报道,肝脏浸润的M2 型巨噬细胞具有免疫抑制作用[13]。已有研究发现,细粒棘球蚴能够促进巨噬细胞向M2 型极化[14]。课题组猜测其可能与细粒棘球蚴发生免疫逃逸有关。
有研究发现核转录因子对巨噬细胞的极化起重要作用。CD11b+细胞中的STAT6 信号通过促进IL-4 分泌,并增加M2 型巨噬细胞促进肺癌进展[15]。敲除STAT6 能够阻止M2 型巨噬细胞的极化和叶酸肾病中单核细胞向成纤维细胞的转变,从而减缓肾纤维化进程[16]。STAT6 能够促进巨噬细胞向M2 型极化以抑制动脉粥样硬化[17]。但在细粒棘球蚴上未见相关研究。因此,课题组在体外研究了感染细粒棘球蚴时STAT6 诱导的巨噬细胞极化。研究证实STAT6抑制剂可促进巨噬细胞向M1型极化。
本实验中EgCF处理巨噬细胞24 h后,STAT6和M2 型巨噬细胞相关因子IL-4、ARG1、TGF-β 表达水平升高,同时M1 型巨噬细胞相关因子IL-6、IL-1β、TNF-α 表达水平降低。使用STAT6抑制剂后,M1型相关因子的表达水平均被提升,M2型相关因子的表达水平均被抑制。提示在细粒棘球蚴感染中STAT6可促进巨噬细胞表型向M2型极化。
综上所述,课题组猜测细粒棘球蚴促进STAT6表达,使巨噬细胞向抑炎的M2 型极化,因此课题组采用STAT6 抑制剂抑制了STAT6 的表达,发现其可减少EgCF 诱导的M2 极化,可能对逆转EgCF 的免疫逃逸具有重要作用。本研究也揭示了STAT6 可能作为治疗细粒棘球蚴感染的一个新靶点。

