长链非编码RNA LINC01105调控肝癌对胸腺素α1耐药①
黄凤霞 李海燕 李正堃 黄君华 雷 燕 (西安医学院医学技术学院,西安 710021)
长链非编码RNA(long-chain non-coding RNA,lncRNA)一般是指无蛋白产物且长度大于200 nt 的RNA 转录本,是转录和转录后过程调控网络中的一部分,在哺乳动物基因组中广泛表达,参与DNA 甲基化、染色质重塑、转录和翻译等多种生物学过程调控[1-2]。lncRNA 通常由RNA 聚合酶Ⅱ转录形成,与mRNA 一样含5'端帽子结构,常用于拼接和多聚腺苷酸化[3]。与mRNA 相比,lncRNA 表现出一定序列保守性,因此lncRNA 序列似乎不如其高级结构重要,lncRNA 的二级和三级结构在其功能上起重要作用[4]。YE 等[5]研究报道,LINC01105 在神经母细胞瘤中可通过其miR-6769b-5p 信号轴促进靶基因VEGFA 表达,在神经母细胞瘤发生发展过程中起重要作用。
世界卫生组织数据显示,肝癌是全球第六大常见癌症,在癌症引起的死亡中位列第四,与肝癌耐药性密切相关[6]。胸腺素广泛分布于多种组织中,尤其是胸腺肽α1和胸腺肽β4在医学上具有重要用途,其中胸腺肽α1的生物活性包括促进淋巴细胞生成、恢复免疫能力和增强T细胞特征和功能等,在原发性或继发性免疫缺陷疾病、癌症或衰老相关疾病患者中具有治疗潜力[7-9]。研究显示,采用胸腺肽α1治疗肝癌具有明显优势,可显著延长患者无复发生存 期(recurrence-free survival,RFS)和 总 生 存 期(overall survival,OS),但 仍 存 在 胸 腺 肽α1 耐 药性[10-11]。本研究拟探究LINC01105 能否调控肝癌对胸腺素α1的耐药性及可能机制。
1 材料与方法
1.1 材料
1.1.1 组织 本研究共收集26例肝癌患者资料及手术/活检的肝组织样本以及26 例肝良性增生患者资料及活检的肝组织样本。26 例肝癌患者中,甲胎蛋白(alpha-fetoprotein,AFP)<25.0 μg/ml 者5 例,25.0~200.0 μg/ml 者15 例,>200.0 μg/ml 者6 例;26 例肝良性增生患者中,AFP<25.0 μg/ml 者11 例,25.0~200.0 μg/ml 者11 例,>200.0 μg/ml 者4 例。两组受试者性别、年龄、体重指数及AFP 水平均具有可比性(P>0.05)。本研究经川北医学院附属医院伦理委员会批准同意,患者知情同意。
1.1.2 实验动物 BALB/c 小鼠购自国家啮齿类实验动物种子中心上海分中心,合格证号:0020627-SCXK(SH)2007-0005。
1.1.3 主要试剂与仪器 HEK-293T 细胞、L-02 细胞、Huh7 细胞、Hep-3B 细胞和HepG2 细胞均购自中国科学院上海生命科学研究所细胞库;MEM 培养基、胎牛血清购自Gibco;DMEM 培养基、无RNase 水购 自Hyclone;Lipofectamine2000 购 自Invitrogen;TRIzol 试剂购自Life Technology 公司;酚氯仿异戊醇、异丙醇等化学试剂购自国药集团;逆转录试剂购自日本TaKaRa公司;SYBR Green荧光定量试剂盒购自Bio-Rad;海肾荧光素酶报告基因检测试剂盒购自Promega 公司;流式细胞术实验相关试剂均购自GE Healthcare 公司;戊巴比妥钠购自Sigma 公司;Nanodrop 2000 超微量分光光度计购自Thermofisher公司。
1.2 方法
1.2.1 细胞培养与转染 HEK-293T 细胞、L-02 细胞、Hep-3B 细胞和HepG2 细胞采用MEM 培养基培养,Huh7 细胞采用DMEM 培养培养,培养基中均加入10%胎牛血清,培养条件:37 ℃、5%CO2。采用脂质体Lipofectamine2000 进行细胞瞬时转染,操作方法参照Invitrogen产品说明。消化细胞并按5×104个/孔铺至12 孔板,待细胞完全贴壁且达到60%融合时,采 用Lipofectamine2000 进 行sh-NC、sh-LINC01105、oe-miR-6769b-5p 和sh-LINC01105+oe-miR-6769b-5p慢病毒转染,37 ℃、1%O2、5%CO2和94%N2条件下培养48 h备用。
1.2.2 qRT-PCR 采用TRIzol 试剂提取总RNA,Nanodrop 2000 仪器检测,测量RNA 浓度。根据浓度计算逆转录使用RNA 的体积,采用逆转录试剂盒将1 μg RNA 逆转录为cDNA。采用无RNase 水将cDNA 稀释10 倍,并作为模板采用SYBR Green 荧光定量试剂盒进行qRT-PCR 检测,引物序列见表1。所有实验重复3次。
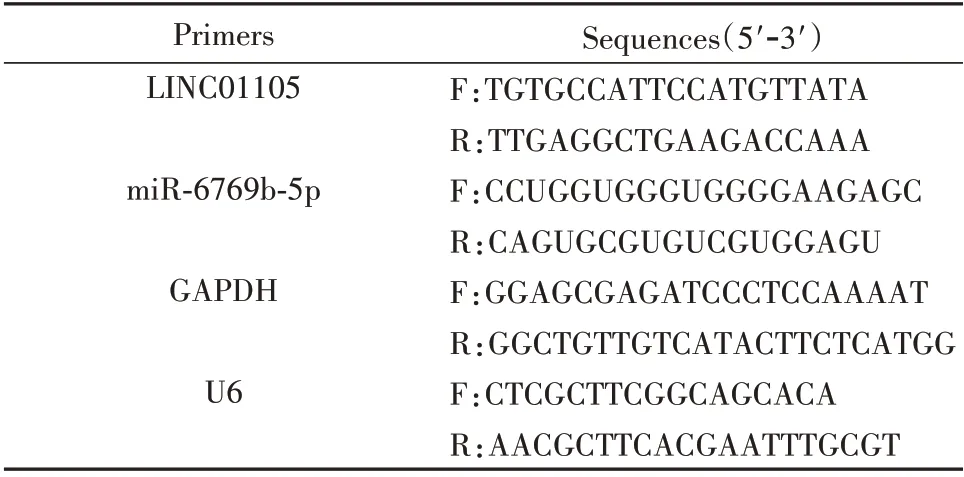
表1 引物序列Fig.1 Primer sequence
1.2.3 荧光素酶报告实验 将HEK293T细胞接种于24 孔板,培养24 h。人工构建miR-6769b-5p 野生型启动子双荧光素酶报告基因载体pGL4.10-hRluc,将miR-6769b-5p 预测结合位点突变的突变体MutmiR-6769b-5p和LINC01105双荧光素酶报告基因载体共转染HEK293T 细胞,转染48 h 后吸出培养基,PBS 洗2 遍,收集并裂解细胞,将生长培养基吸尽,PBS漂洗,加入1×PLB 裂解液室温摇床充分裂解,采用Promega 海肾荧光素酶报告基因检测试剂盒及荧光素酶底物发光检测仪进行检测,根据产品和仪器说明操作。所有实验重复3次。
1.2.4 小鼠肝癌异种移植模型构建 将获得稳定转染的细胞系体外培养7 d后制备50 μl单细胞悬液(1×106个/ml),合 并50 μl Matrigel 溶 液 注 射 于BALB/c 小鼠腹股沟区域,每组8 只。移植当日记为第0天,移植第7天开始每隔1周采用游标卡尺测量肿瘤大小,记录并计算肿瘤体积(V)=0.8×2/3×D12×D2(D1、D2 分别为相互垂直的最长直径与最短直径)。手术移除原位移植瘤并统计瘤体重量。静脉注射3倍浓度的3%戊巴比妥钠处死小鼠,本研究经西安医学院动物伦理会批准。
1.2.5 流式细胞术 收集不同处理的Huh7 细胞,0.25%胰蛋白酶消化,计数并调整细胞浓度至1×106个/ml,取1 ml 细胞1 500 r/min 离心10 min,弃上清,每毫升细胞加2 ml PBS,离心,弃上清,加入预冷70%乙醇固定细胞,4 ℃过夜。第2天用PBS洗涤细胞2次,取100 μl细胞悬液,加入至0.5 ml含50 μg/ml RNAase PI 溶液中避光反应30 min,100 目尼龙网过滤,流式细胞仪检测G1期、S期和G2期细胞比例。
1.2.6 LINC01105 通 过miR-6769b-5p 对 肝 癌 细 胞胸腺素α1 耐药性的影响 分别敲低LINC01105 和miR-6769b-5 表达,并设置4 组转染Huh7 细胞:sh-NC+NC inhibitor;sh-LINC01105+NC inhibitor;sh-NC+miR-6769b-5p inhibitor 和 sh-LINC01105+miR-6769b-5p inhibitor,qRT-PCR 验 证4 组 细 胞LINC01105和miR-6769b-5p表达。采用不同浓度胸腺素α1 处理4 组细胞48 h,每组设5 个复孔,CCK-8实验检测细胞存活率。
1.3 统计学分析 采用SPSS21.0软件进行统计学处理,计量资料采用±s表示,两组间比较采用t检验,多组间比较采用单因素方差分析。P<0.05表示差异具有统计学意义。
2 结果
2.1 LINC01105 和miR-6769b-5p 与肝癌的关系qRT-PCR 结果表明,肝癌组织中LINC01105 呈显著高表达(图1A),miR-6769b-5p 呈显著低表达(图1B)。与人正常肝细胞L-02相比,肝癌细胞系中LINC01105 呈高表达,miR-6769b-5p 呈低表达,其中Huh7 细胞中LINC01105 表达最高(图1C),因此采用Huh7 细胞进行后续实验。提示LINC01105 和miR-6769b-5p与肝癌发生密切相关。
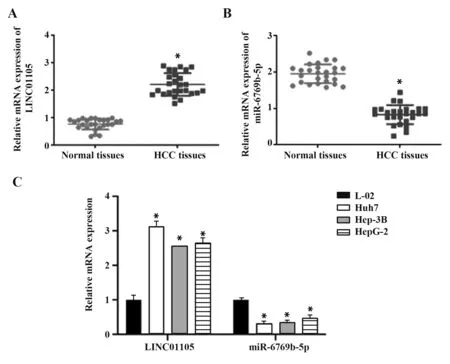
图1 肝癌组织及细胞LINC01105和miR-6769b-5p表达Fig.1 LINC01105 and miR-6769b-5p expressions in liver cancer tissues and cells
2.2 LINC01105 靶向抑制miR-6769b-5p 表达 采用Targetscan 预测LINC01105 和miR-6769b-5p 的靶向抑制关系,LINC01105 和miR-6769b-5p 靶向作用位点如图2A 所示。课题组在Huh7 细胞中敲低LINC01105 表达,并采用qRT-PCR 检测LINC01105的敲低效率(图2B)。在Huh7 细胞中成功敲低LINC01105 后,采用荧光素酶报告实验确定LINC01105 对miR-6769b-5p 的靶向抑制关系(图2C),发现敲低LINC01105后,miR-6769b-5p表达显著上调(图2D)。表明LINC01105 可靶向结合miR-6769b-5p,并抑制miR-6769b-5p表达。
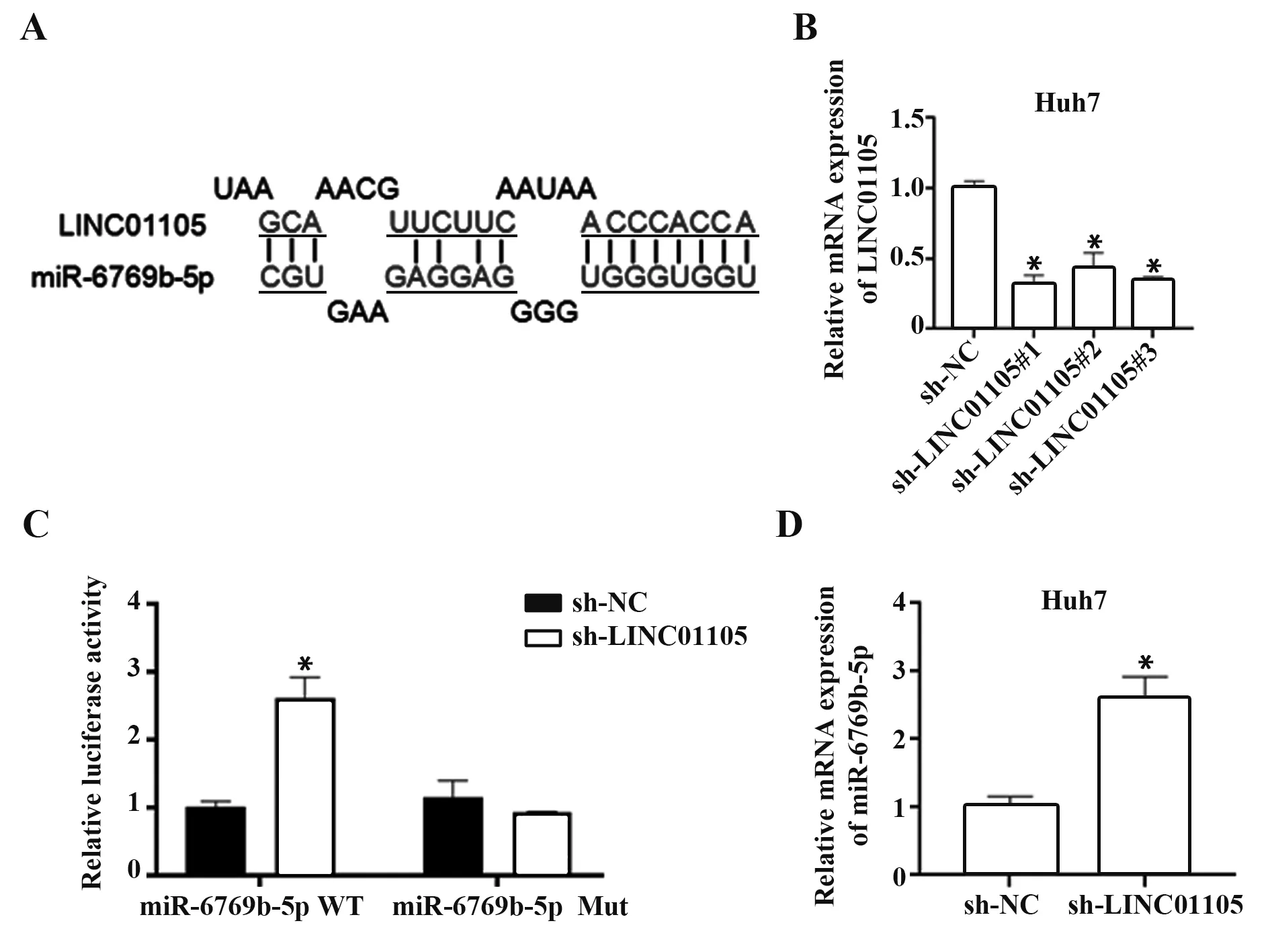
图2 LINC01105靶向抑制miR-6769b-5p表达Fig.2 LINC01105 targeting inhibiting miR-6769b-5p expression
2.3 LINC01105 通过miR-6769b-5p 促进肝癌细胞对胸腺素α1 的耐药性 敲低LINC01105 表达可显著增强Huh7 细胞对胸腺素α1 的敏感性,过表达miR-6769b-5p 可显著增强Huh7 细胞对胸腺素α1的敏感性,敲低LINC01105 联合过表达miR-6769b-5p进一步增强Huh7细胞对胸腺素α1的敏感性。进一步采用0.5 μmol/L 胸腺素α1 处理各组细胞48 h,流式细胞术检测细胞周期分布,结果表明,敲低LINC01105和过表达miR-6769b-5p均可抑制细胞进入G1期,使细胞停滞于S期(图3)。
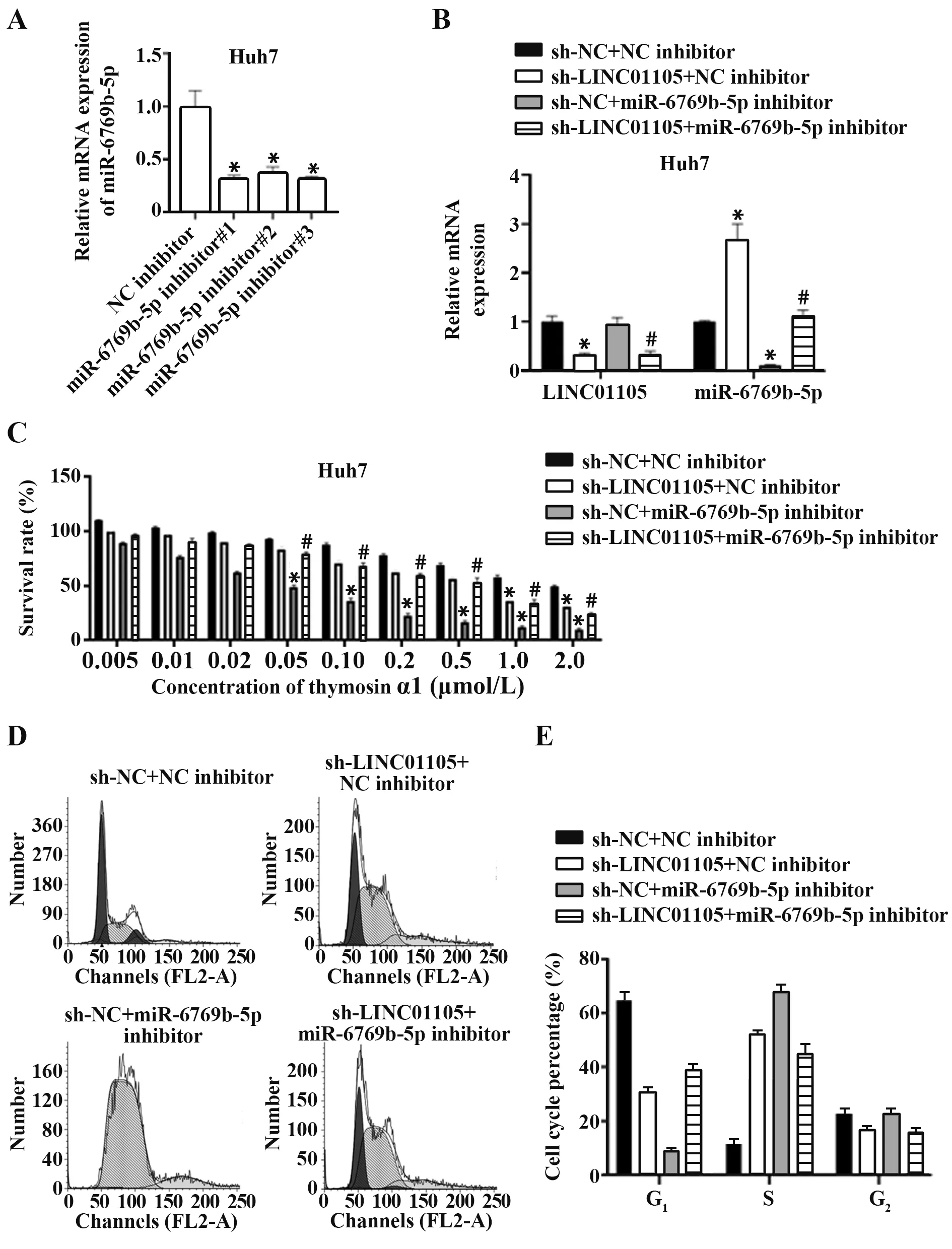
图3 LINC01105通过miR-6769b-5p促进肝癌细胞对胸腺素α1的耐药性Fig.3 LINC01105 promoted resistance of HCC cells to thymosin α1 through miR-6769b-5p
2.4 LINC01105通过miR-6769b-5促进肝癌在小鼠体内对胸腺素α1 的耐药性 将4 组转染的Huh7 细胞皮下接种至小鼠腹股沟成瘤,持续21 d,每天灌胃给予0.5 mg/10 g胸腺素α1,qRT-PCR检测小鼠皮下肿瘤中LINC01105 和miR-6769b-5p 表达,结果表明各组小鼠皮下肿瘤中,敲低LINC01105 表达,miR-6769b-5p表达显著上调(图4A)。抑制miR-6769b-5p表达也可显著下调miR-6769b-5p 表达,小鼠6 周内存活率显示,敲低LINC01105 表达可降低皮下肿瘤质量和体积,提高小鼠存活率,敲低LINC01105同时过表达miR-6769b-5p,可进一步降低小鼠皮下肿瘤质量和体积,提高小鼠存活率(图4B~D)。
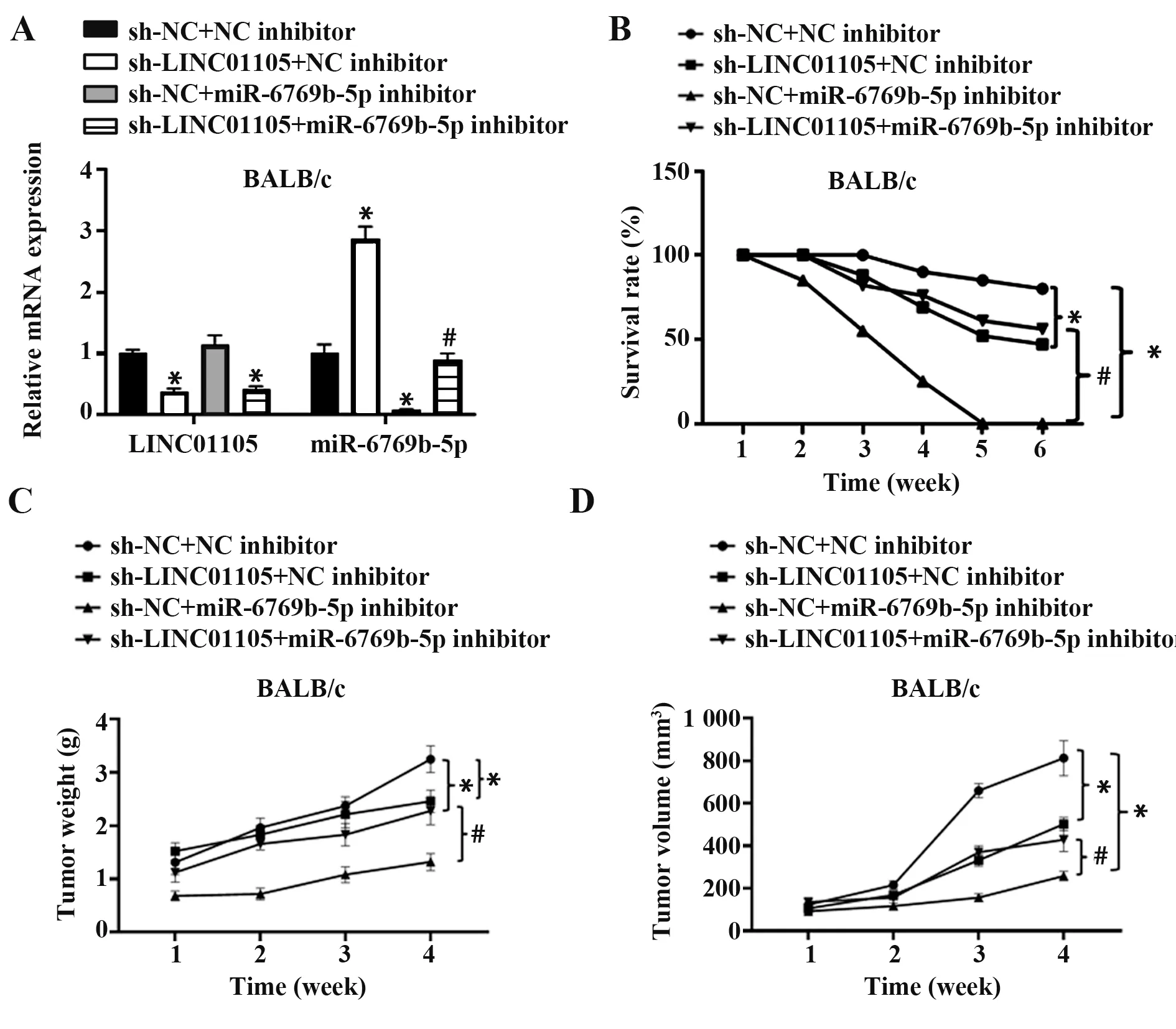
图4 LINC01105通过miR-6769b-5p促进肝癌细胞对胸腺素α1的耐药性Fig.4 LINC01105 promoted resistance of HCC cells to thymosin α1 through miR-6769b-5p
3 讨论
肝细胞癌是原发性肝癌的主要类型,也是全球致死率最高的癌症之一。因此革新肝癌治疗手段,提高患者生存率及生活质量,是目前所亟须解决的问题。作为一种新发现的lncRNA,近年报道中LINC00511在包括肺癌、乳腺癌、胰腺癌、宫颈癌、肝癌、卵巢癌和胶质瘤在内的多种癌症中表达上调并与癌症发生密切相关,其潜在作用机制包括促进肿瘤的增殖、细胞周期进程、侵袭、迁移、转移和化疗耐药及抑制细胞凋亡等[5]。此外,LINC00511 上调往往预示不良预后,也代表临床上LINC00511 可被用作癌症患者预后的生物标志物。本研究结果显示,与正常肝组织比,肝癌组织显著增高(P<0.05),与人正常肝细胞L-02相比,肝癌细胞系Huh7、Hep-3B和HepG2 LINC01105 表达显著增高(P<0.05),与上述文献结论一致。
本研究证实了胸腺素α1对肝癌的抗癌活性,胸腺素α1可促进淋巴细胞生成、增强T细胞功能等,可通过增强人体免疫功能从而恢复潜在的杀伤癌细胞能力[12]。进一步研究显示,肝癌细胞模型中LINC00511 呈高表达,miR-6769b-5p 呈低表达,且LINC00511 可 负 向 调 控miR-6769b-5p 表 达,敲 低LINC01105 表达可显著增强Huh7 细胞对胸腺素α1的敏感性,过表达miR-6769b-5p 可显著增强Huh7细胞对胸腺素α1的敏感性,敲低LINC01105联合过表达miR-6769b-5p 可进一步增强Huh7 细胞对胸腺素α1 的敏感性,与既往文献结论一致[5]。同时本研究结果也为后续研究提供了方向,即调节LINC00511或miR-6769b-5p表达的新药联合胸腺素α1或可成为肝癌治疗的新方案。
综上所述,LINC01105可通过靶向miR-6769b-5p调节肝癌对胸腺素α1的耐药性。