基于多壁碳纳米管和聚十六烷基三甲基溴化铵修饰玻碳电极的电化学法快速测定水和土壤中双酚A的含量
李丹莹 ,黄象金 ,韦寿莲
(1.广东省城市技师学院 环保与检测学院,广州 510520;2.肇庆市食品检验所,肇庆 526060;3.肇庆学院 广东省环境健康与资源利用重点实验室,肇庆 526061)
双酚A(BPA)是生产聚碳酸酯和环氧树脂的重要单体,广泛存在于塑料器皿、食品包装材料和医疗器械中。BPA 与天然雌激素结构相似,可干扰人体内分泌系统,降低免疫力,损害生殖功能,增加癌症发病率[1],被认为是环境中典型的内分泌干扰物。使用含有聚碳酸酯和环氧树脂的产品会不可避免地导致BPA 的释放,对人类健康和环境构成潜在威胁,因此检测环境中的BPA 十分必要。
目前测定BPA 含量的方法有高效液相色谱法(HPLC)[2]、液相色谱-串联质谱法(LC-MS/MS)[3]、气相色谱-质谱法(GC-MS)[4]、酶联免疫吸附法[5]、荧光光谱法[6]及电化学法[7-8]等。这些方法中,电化学法具有灵敏度高、分析快速、设备简单、操作方便、成本低等优点,特别适合于常规分析。然而,BPA 的氧化产物不稳定,容易形成二聚体使电极表面污染钝化,从而降低电化学信号[9],因此需要在电极表面修饰合适的材料,以提高其检测灵敏度和抗污染能力。
多壁碳纳米管(MWCNTs)具有优异的导电性、大的比表面积、良好的催化活性和化学稳定性等特点[10],是研究较多的修饰电极材料之一。因其独特的结构和性质,以MWCNTs修饰的电极用于分析传感,可降低过电势,提高检测灵敏度[11-12]。十六烷基三甲基溴化铵(CTAB)是一种阳离子表面活性剂,具有两亲性,在水溶液中可形成胶束聚集体,稳定自由基,增强和改变电极/溶液的界面特性,有研究表明在电解质中加入CTAB 可起到表面防污的作用[13]。而表面活性剂聚合物修饰电极的导电性更好,分析物还原或氧化的过电势更低,电极表面与分析物之间的电子转移速率更快,检测灵敏度和选择性更高[14]。目前聚CTAB(p-CTAB)修饰电极已应用于多巴胺、尿酸、色氨酸、茶碱和氨基三唑等的分析研究[15-16]中,对BPA 的检测研究却未见报道。
本工作通过循环伏安法(CV)在玻碳电极(GCE)上电聚合CTAB膜,进一步采用滴涂法修饰MWCNTs,制备了MWCNTs、p-CTAB修饰的GCE(MWCNTs/p-CTAB/GCE),基于该电极,建立了一种灵敏、简单、快速的BPA 电化学分析方法,用于测定土壤和水中BPA 的含量。
1 试验部分
1.1 仪器与试剂
CHI 600E型电化学工作站;三电极体系,修饰电极(直径3 mm)为工作电极,钛棒为对电极,饱和甘汞电极为参比电极;SUPRA 55 SAPPHIRE型扫描电子显微镜(SEM)。
BPA 标准储备溶液:0.5 mmol·L-1,称取0.011 4 g BPA,加入25 mL 乙醇,溶解后将溶液转移至100 mL容量瓶中,再用乙醇定容,于4 ℃冰箱储存,备用。
BPA标准溶液:1 μmol·L-1,移取适量的BPA 标准储备溶液,用0.3 mol·L-1磷酸盐缓冲液(PBS,pH 7.0)逐级稀释,配制成1μmol·L-1BPA标准溶液。
MWCNTs标准溶液:98 g·L-1,使用时,用水将其稀释至1.96 g·L-1。
CTAB溶液:0.5 g·L-1,称取0.250 g CTAB,用水溶解并定容至500 mL容量瓶中。
所用试剂均为分析纯;试验用水为超纯水。
1.2 仪器工作条件
1.2.1 CV
扫描范围-0.8~1.2 V;扫描速率0.10 V·s-1;扫描圈数20圈。
1.2.2 差分脉冲伏安法(DPV)
电解质为0.3 mol·L-1PBS(pH 7.0);初始电位0.3 V,终止电位0.7 V,电位增量10 mV;脉冲周期0.2 s;富集电位0.2 V,富集时间150 s;搅拌速率800 r·min-1。
1.2.3 电化学阻抗谱法(EIS)
电解质为含0.1 mol·L-1KCl的5 mmol·L-1K3[Fe(CN)6]溶液;频率范围0.01~100 k Hz;振幅5 mV。
1.3 试验方法
1.3.1 修饰电极的制备
在湿润的抛光绒布上用0.5μm 氧化铝粉末将GCE打磨抛光,再用水冲洗干净,晾干。将GCE 置于0.5 g·L-1CTAB 溶液中,以钛棒为对电极,饱和甘汞电极为参比电极,按照1.2.1节CV 条件进行试验,得到p-CTAB修饰的GCE(p-CTAB/GCE),用水小心清洗,晾干。吸取1.96 g·L-1MWCNTs标准溶液5μL,滴涂在p-CTAB/GCE表面,在红外灯下干燥后得到MWCNTs/p-CTAB/GCE。同法制备MWCNTs 修饰的GCE 电极(MWCNTs/GCE)。
1.3.2 样品测定
收集的水样经0.22μm滤膜过滤,取水样2 mL,与0.3 mol·L-1PBS(pH 7.0)8 mL 混 匀后,按照1.2.2节DPV 条件进行测试。
将土壤样品自然风干,去除砂石,研磨,过孔径0.18 mm(80目)的筛网。称取25 g土壤样品,置于带塞三角烧瓶中,加入50 mL乙醇,涡旋30 s,超声提取30 min,过滤并收集滤液。再用50 mL乙醇重复提取一次,合并两次滤液,于50 ℃旋转蒸发浓缩至约1 mL 后,转移至10 mL 容量瓶中,用乙醇定容。取土壤样液2 mL,与0.3 mol·L-1PBS(pH 7.0)8 mL混匀后,按照1.2.2节DPV 条件进行测试。
2 结果与讨论
2.1 修饰电极的形貌表征
GCE、p-CTAB/GCE、MWCNTs/p-CTAB/GCE的SEM 图见图1。

图1 不同修饰电极的SEM 图Fig.1 SEM images of different modified electrodes
由图1可见:GCE表面平整光滑;在GCE 表面电聚合CTAB后,可观察到p-CTAB/GCE 表面呈现许多细短棒和花蕊状形貌,二者紧密地交错排列,形成多孔空隙;进一步修饰 MWCNTs 后,MWCNTs/p-CTAB/GCE表面呈现许多随机缠结的网状结构形貌,其多孔空隙和多孔网状结构不仅有利于电解质的浸润,促进离子传输,而且还为BPA 的电化学氧化提供了大量的活性位点。
2.2 修饰电极的电化学性能
采用DPV,考察了GCE、MWCNTs/GCE、p-CTAB/GCE、MWCNTs/p-CTAB/GCE在1μmol·L-1BPA 标准溶液中的电化学行为,结果见图2。
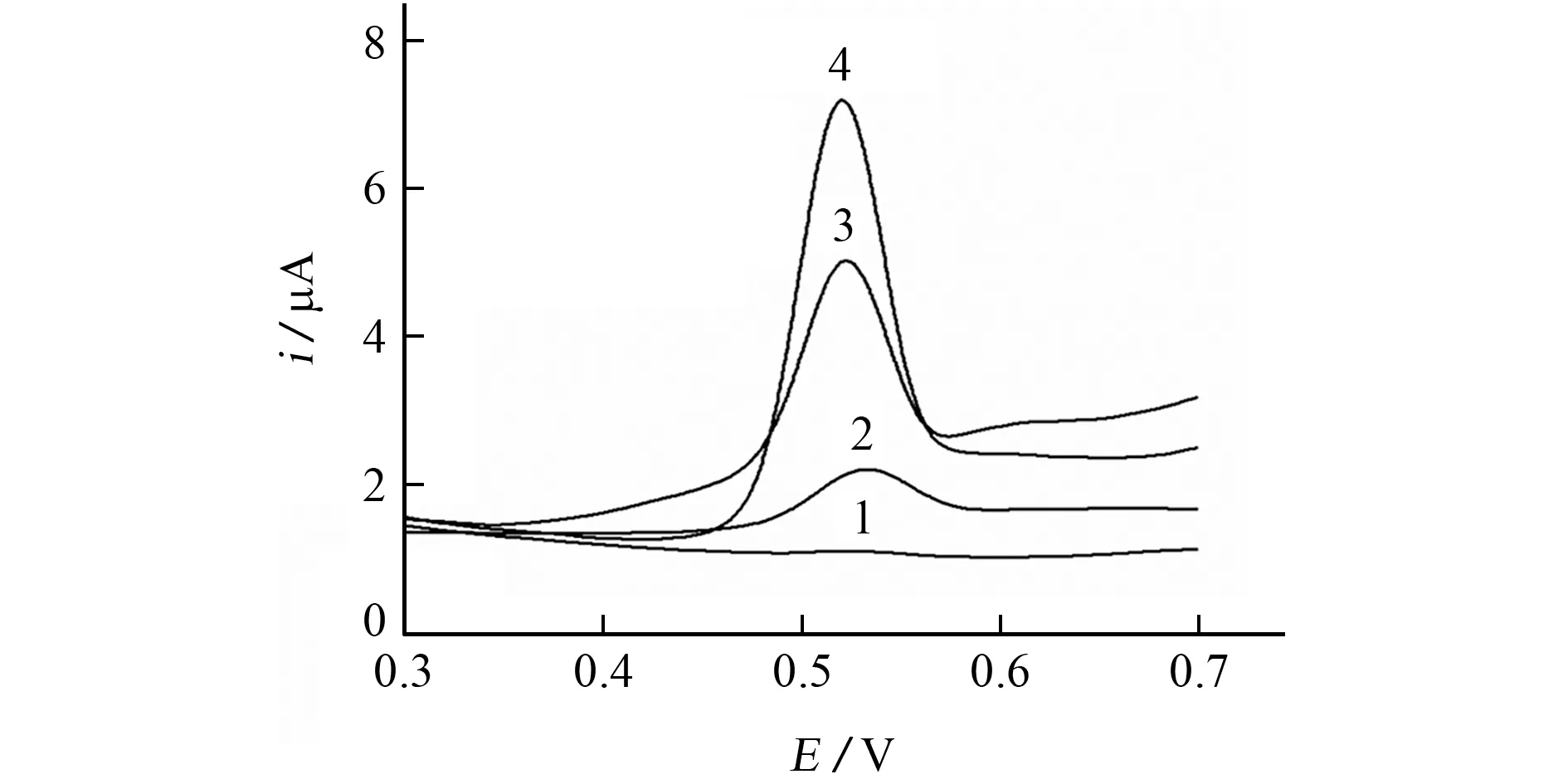
图2 不同电极对BPA 的DPV 响应Fig.2 DPV response of different electrodes to BPA
结果表明:GCE 对BPA 表现出很弱的电化学响应,峰电位为0.530 V,峰电流为0.051μA(扣除基线电流后,下同);修饰MWCNTs后,BPA 的峰电位明显增强,峰电流为0.780μA,这是由于MWCNTs优异的导电性能增大了电子转移速率,同时其大的比表面积和强的吸附能力提高了MWCNTs/GCE对BPA 的富集效率,从而促进了BPA 的催化氧化;在p-CTAB/GCE 上,BPA 的 氧化峰电流显著增至3.470 μA,峰电位负移至0.523 V,说明p-CTAB能提高导电性、生物相容性和比表面积,降低BPA 的氧化过电势,从而增加电极表面的BPA 浓度,提高氧化峰电流;在MWCNTs/p-CTAB/GCE 上,BPA 的氧化峰电流更大,达到5.950μA,峰电位负移至0.520 V,背景电流低,峰形窄,说明p-CTAB 和MWCNTs之间具有协同作用,能进一步提高MWCNTs/p-CTAB/GCE的电化学活性。
采用EIS,考察了GCE、MWCNTs/GCE、p-CTAB/GCE、MWCNTs/p-CTAB/GCE 在含有0.1 mol·L-1KCl的5 mmol·L-1K3[Fe(CN)6]溶液中的电化学行为,结果见图3。
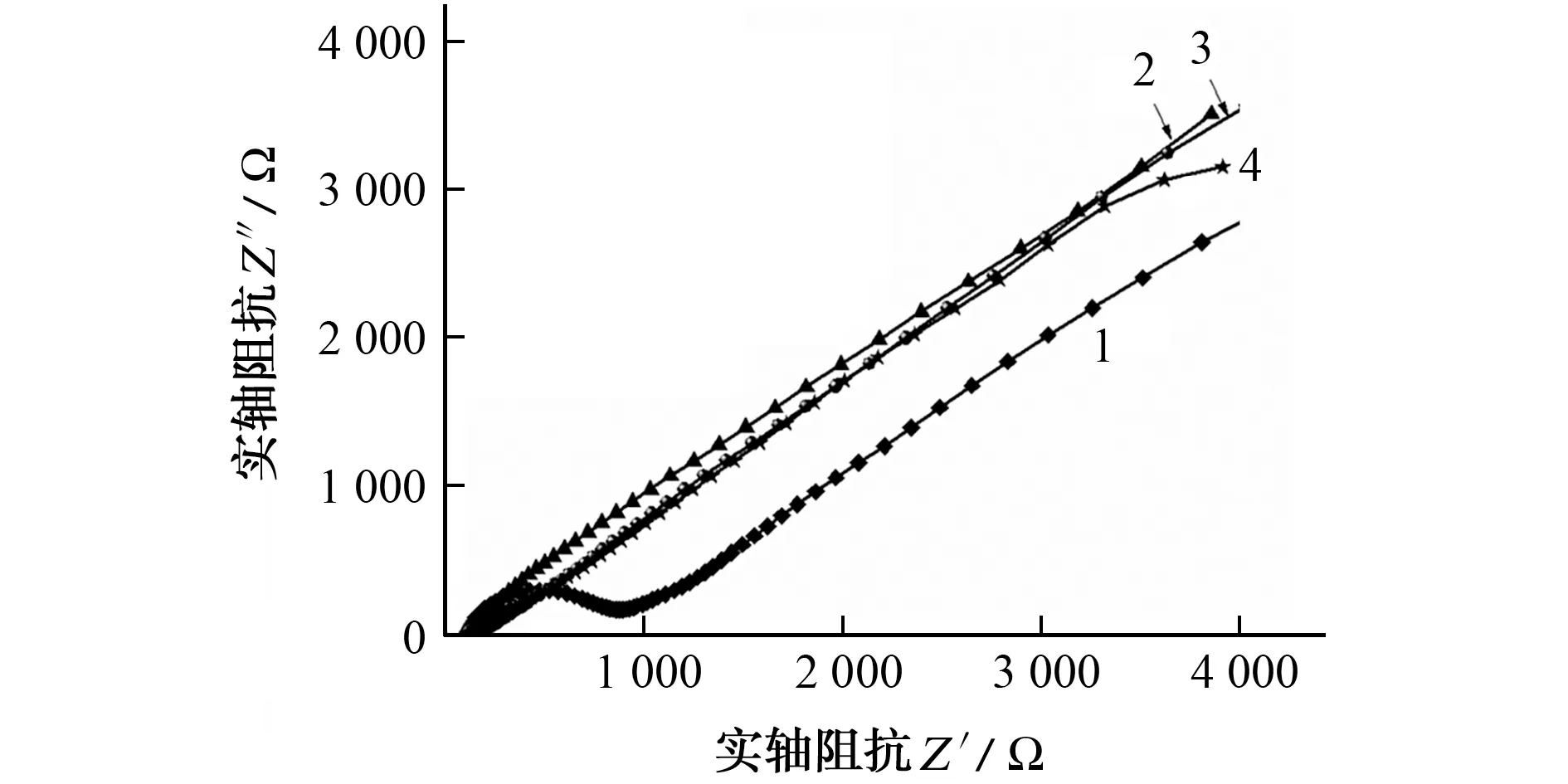
图3 不同电极的EIS响应Fig.3 EIS response of different electrodes
结果表明:GCE 的电子转移阻抗较大;MWCNTs/GCE 的EIS 曲线近似于直线,说明MWCNTs/GCE 的电子转移阻抗很小,这是由于MWCNTs的修饰提高了电极的导电性和比表面积;与GCE 相比,p-CTAB/GCE 的电子转移阻抗显著变小,可能归因于p-CTAB/GCE 表面带正电,对[Fe(CN)6]3-/4-产生静电吸附,从而促进电极界面的电子转移,另外,修饰p-CTAB后,电极比表面积增大,进一步提高了电极的催化活性;当MWCNTs修饰到p-CTAB/GCE 表面时,电子转移阻抗相对减小。上述结果与DPV 的表征结果相符,表明MWCNTs/p-CTAB/GCE 具有良好的电子转移能力,能加快电极表面的氧化还原反应速率,增强电化学响应。
采用CV,考察了扫描速率分别为0.05,0.10,0.15,0.20,0.25 V·s-1时,MWCNTs/p-CTAB/GCE在1μmol·L-1BPA 标准溶液中的电化学行为。
由图4可知,BPA 在0.52 V 处出现一个氧化峰,没有相应的还原峰,表明BPA 在MWCNTs/p-CTAB/GCE上的电化学反应不可逆。并且,BPA的氧化峰电流随扫描速率的增加而增大,在0.05~0.25 V·s-1内,扫描速率与其对应的BPA 氧化峰电流呈线性关系,线性回归方程为ip=55.86v+0.765 4,相关系数为0.998 0,表 明BPA 在MWCNTs/p-CTAB/GCE 上的氧化过程受吸附控制。
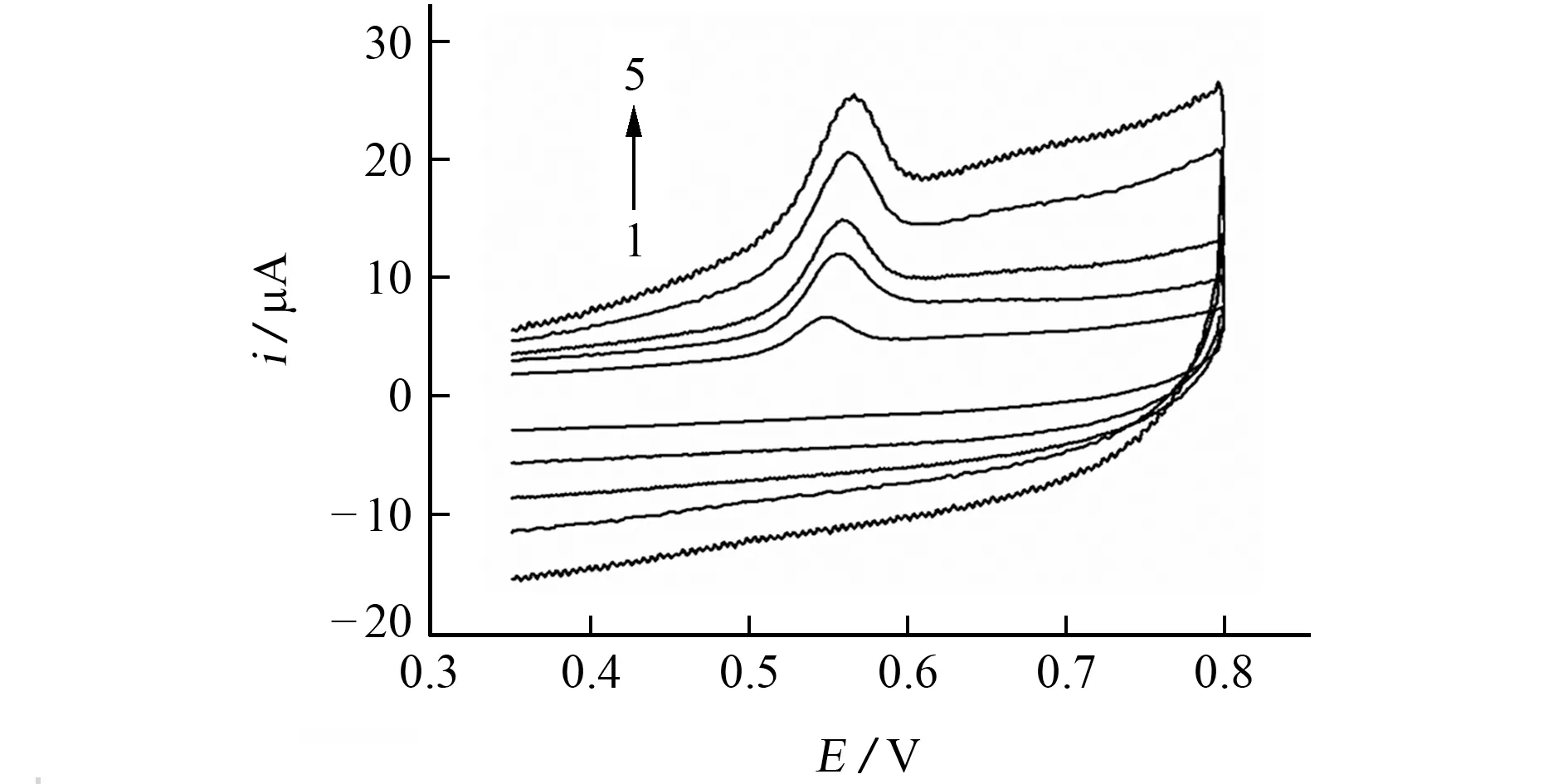
图4 不同扫描速率下BPA 的CV 响应Fig.4 CV response of BPA at different scanning rates
2.3 修饰电极制备条件的优化
2.3.1 CTAB聚合量
电极表面CTAB 的聚合量显著影响电极的电化学性能。试验考察了电聚合CTAB 的扫描圈数(4,8,12,16,20,24圈)对BPA 氧化峰电流的影响。
结果显示:随着电聚合CTAB的扫描圈数的增加,电极表面p-CTAB 膜的厚度增加,BPA 在电极上产生的氧化峰电流增大;当扫描圈数为20圈时,峰电流较大;超过20圈后,峰电流下降,原因可能是扫描圈数过多导致形成较厚的p-CTAB膜,阻碍了BPA 与电极表面之间的电子转移。因此,选择电聚合CTAB的扫描圈数为20圈。
2.3.2 MWCNTs修饰量
修饰量的增加可为电极表面提供更多的活性位点,从而增大电流响应。通过加入1.96 g·L-1MWCNTs溶液对p-CTAB/GCE进行修饰,考察了MWCNTs修饰量(1,3,5,7,9μL)对BPA 氧化峰电流的影响。
结果显示:当修饰量为5μL时,峰电流较大;进一步增大修饰量,峰电流减小,可能是由于过厚的MWCNTs 膜增大了传质阻力。因此,选择的MWCNTs修饰量为5μL。
2.4 电化学检测条件的优化
2.4.1 电解质酸度
以PBS 为电解质,考察了 MWCNTs/p-CTAB/GCE在不同酸度(pH 4.0,5.0,6.0,7.0,8.0,9.0)PBS中对BPA 的DPV 响应,结果见图5。
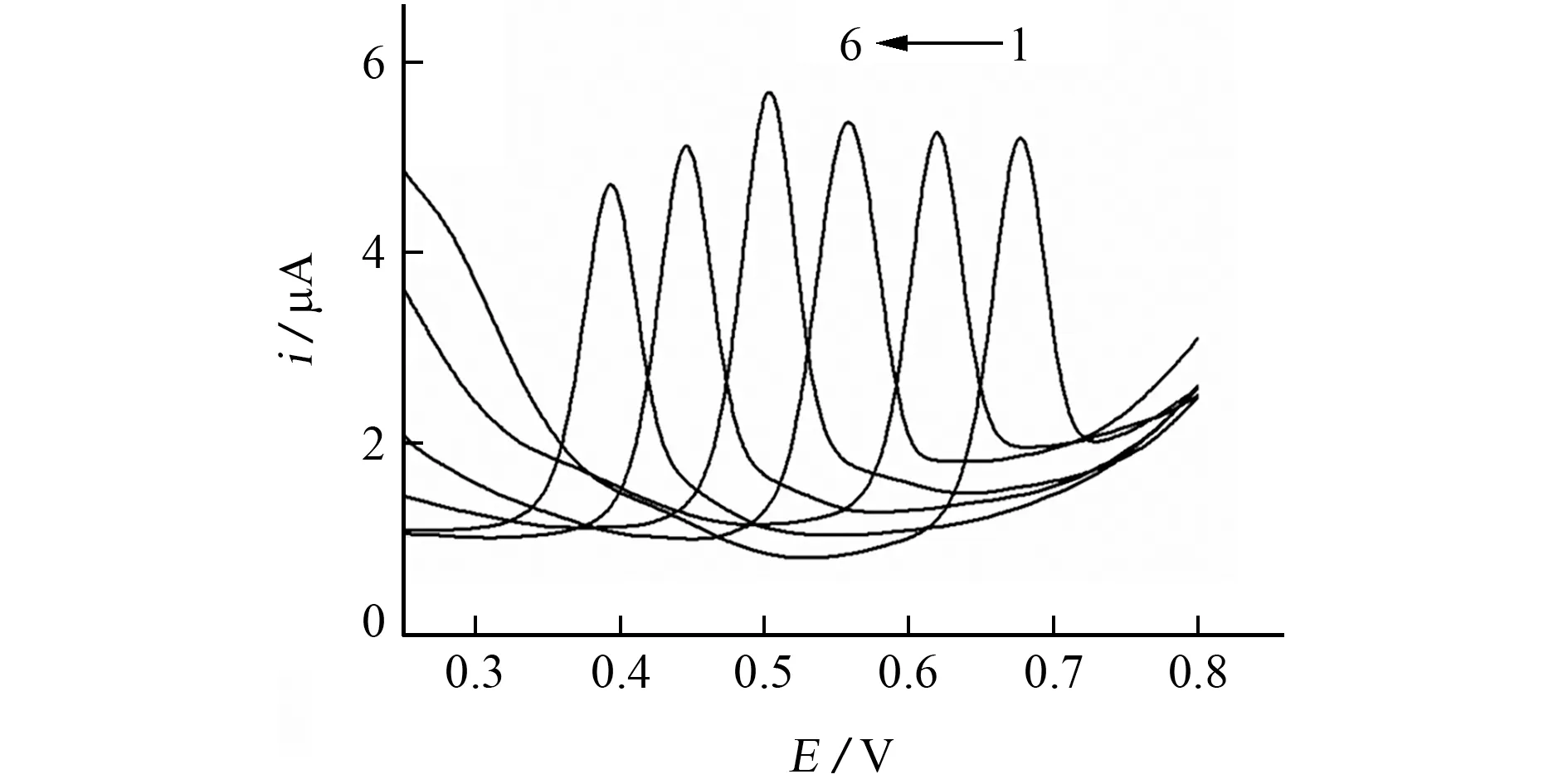
图5 不同酸度电解质中BPA 的DPV 响应Fig.5 DPV response of BPA in different acidities of electrolyte
由图5可见,BPA 的氧化峰电位随pH 的增大逐渐负移,表明有质子参与电极反应。以pH对峰电位进行线性回归,结果显示在pH 4.0~9.0 内,pH 与其对应的峰电位呈线性关系,线性回归方程为Ep=-0.057 71pH +0.908 5,相关系数为0.999 0,斜率绝对值接近于理论值59 mV·p H-1[17],说 明BPA 在MWCNTs/p-CTAB/GCE上的反应为等质子、电子转移过程。另一方面,在pH 4.0~9.0内,BPA 的氧化峰电流呈先增大后减小的趋势。当电解质酸度为pH 7.0时,BPA 的峰电流较 大,此时pH 小于BPA 的pKa(9.73),BPA主要以分子的形式存在,容易在电极表面吸附[18]。因此,试验选择的电解质酸度为pH 7.0。
2.4.2 富集电位
试验考察了富集电位分别为-0.1,0,0.1,0.2,0.3,0.4,0.5 V 时MWCNTs/p-CTAB/GCE 对BPA 氧化峰电流的影响。结果表明:随着富集电位的增加,峰电流逐渐增大;当富集电位为0.2 V 时,峰电流较大;继续增加富集电位,峰电流减小,可能是富集电位过大导致测定前BPA 已在电极表面氧化,从而降低响应电流。因此,试验选择的富集电位为0.2 V。
2.4.3 富集时间
试验考察了富集时间分别为30,60,90,120,150,180 s时MWCNTs/p-CTAB/GCE 对BPA 氧化峰电流的影响。结果表明:随着富集时间的延长,BPA 在电极上的富集量增多,峰电流逐渐增大;当富集时间大于150 s时,峰电流增幅很小,说明BPA在电极表面的吸附已趋于饱和。因此,试验选择的富集时间为150 s。
2.4.4 搅拌速率
搅拌速率影响BPA 的扩散速率,从而影响BPA 的富集效果。试验考察了搅拌速率分别为0,200,400,600,800,1 000,1 200,1 400 r·min-1时MWCNTs/p-CTAB/GCE对BPA 氧化峰电流的影响。结果表明:峰电流随搅拌速率的增大显著增大;当搅拌速率为800 r·min-1时,峰电流较大;继续增大搅拌速率,峰电流略有下降,原因可能是搅拌速率过大导致电极表面吸附的BPA 部分脱附,富集量减少。因此,试验选择的搅拌速率为800 r·min-1。
2.5 标准曲线和检出限
移取适量的BPA 标准储备溶液,用0.3 mol·L-1PBS(pH 7.0)逐级稀释,配制成0.08,0.5,1,5,10,15,20μmol·L-1BPA 标准溶液系列,按照1.2.2节DPV条件,测定了MWCNTs/p-CTAB/GCE在上述BPA 标准溶液系列中的DPV 响应。以BPA 浓度为横坐标,其对应的氧化峰电流为纵坐标绘制标准曲线。结果显示:BPA 峰电流与BPA浓度在0.08~20μmol·L-1内呈线性关系,线性回归方程为ip=3.427c+2.552,相关系数为0.997 5。
以信噪比为3时对应的BPA 浓度为检出限,所得结果为0.02μmol·L-1。
2.6 干扰试验
采用DPV,考察了水和土壤中常见的无机离子(Cl-、Na+、SO42-、Mg2+、K+、Ca2+、CO32-和NO3-)、有机物(腐殖质富里酸、胱氨酸、苯、苯胺、葡萄糖和尿素)及与BPA 结构相似的酚类化合物(邻苯二酚、对苯二酚和苯酚)对1μmol·L-1BPA标准溶液测定结果的影响。结果表明:100 倍的Cl-、Na+、SO42-、Mg2+、K+、Ca2+、CO32-和NO3-,20倍的腐殖质富里酸、胱氨酸、苯、苯胺、葡萄糖和尿素,5倍的邻苯二酚、对苯二酚和苯酚均对BPA 的响应电流干扰较小,所得相对误差在容限范围±5%以内,说明MWCNTs/p-CTAB/GCE 对BPA 的选择性高,抗干扰能力好。
2.7 重现性和稳定性试验
使用同一支 MWCNTs/p-CTAB/GCE 对1μmol·L-1BPA 标准溶液重复测定10 次,测得峰电流的相对标准偏差(RSD)为5.0%。在相同条件下制备了6支MWCNTs/p-CTAB/GCE,分别对1μmol·L-1BPA 标准溶液进行测定,结果得峰电流的RSD 为2.8%。将其中的3 支MWCNTs/p-CTAB/GCE在室温下放置7d后,对上述溶液重新测定,峰电流平均值仍达到初始值的93.1%。以上结果表明MWCNTs/p-CTAB/GCE 具有良好的重现性和稳定性。
2.8 方法比对
与文献报道的其他电化学传感器进行比对,结果见表1。其中,Fe2O3-r GO/GCE 为Fe2O3-还原氧化石墨烯复合物修饰的GCE,N-CNTs/GCE 为氮掺杂碳纳米管修饰的GCE,CNCs/CNT-COOH/GCE 为碳纳米笼/碳纳米管复合物修饰的GCE,CuS-MWCNT/GCE为CuS-多壁碳纳米管复合物修饰的GCE。
由表1 可知,与其他电化学传感器相比,MWCNTs/p-CTAB/GCE检测BPA 的线性范围较宽,检出限较低,能够实现对BPA 的灵敏检测。
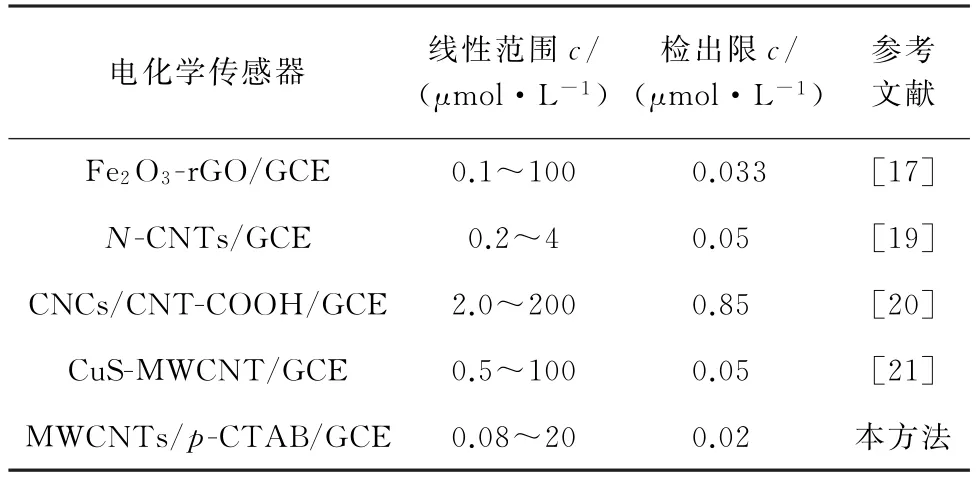
表1 不同电化学传感器比对结果Tab.1 Comparison results of different electrochemical sensors
2.9 精密度和回收试验
分别按照本方法和高效液相色谱法(HPLC)[22]测定土壤和水中BPA 的含量,结果均未检出BPA。为了验证本方法的准确度,对样品进行3个浓度水平的加标回收试验,计算回收率和测定值的RSD,结果见表2。
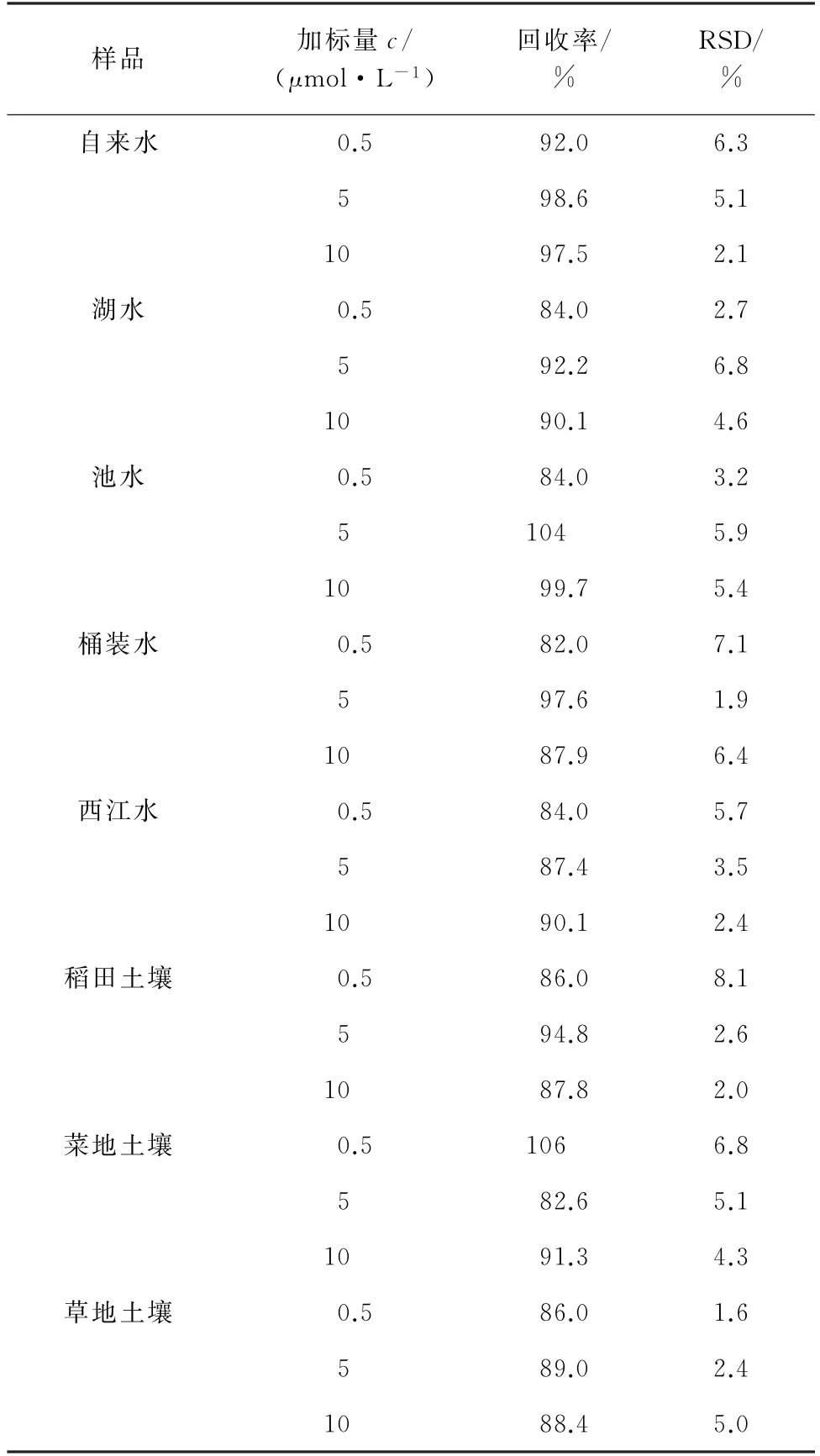
表2 精密度和回收试验结果(n=5)Tab.2 Results of tests for precision and recovery(n=5)
结果显示:回收率为82.0%~106%,测定值的RSD 为1.6%~8.1%,表明该方法适用于实际水样和土壤中BPA 的检测。
本工作以MWCNTs和p-CTAB 为增敏材料,构建了一种对BPA 有高灵敏度和高选择性响应的电化学传感器MWCNTs/p-CTAB/GCE,实现了对BPA 的快速检测。该传感器对BPA 表现出较高的氧化活性,且具有制备简单、线性范围较宽、检出限低、抗干扰能力强、重现性和稳定性好等优点,将其应用于多种土壤和水中BPA 的分析,结果令人满意。

