基于免疫磁分离和酶催化放大的化学发光免疫传感器测定人血清中癌胚抗原的含量
字琴江 ,吴 凡 ,卢朝粉 ,李佳昕 ,刘梦婷 ,周川华∗
(1.云南大学 化学科学与工程学院 国家级化学化工实验教学中心,昆明 650091;2.洱源县检验检测院,洱源 671200)
癌胚抗原(CEA)是目前临床上最有价值的肿瘤标志物之一[1],健康成年人血清中CEA 质量浓度低于2.5μg·L-1[2],而肿瘤疾病患者由于恶性肿瘤细胞调控受损后会重新启动蛋白的合成,导致血清中CEA 浓度水平升高[3]。因此,测定肿瘤患者血清中CEA 的含量,对监控肿瘤性疾病的转移、复发具有一定的参考价值。
近年来,为了准确测定肿瘤标志物的含量,科研工作者开发了很多定量分析方法,其中免疫分析法由于具有抗干扰能力强、灵敏度高的优点,引起了人们广泛的关注。常见的免疫分析法有电化学免疫传感器[4]、酶联免疫传感器[5]、放射性免疫传感器[6]和化学发光免疫传感器[7]等。化学发光免疫传感器是将免疫反应与化学发光检测手段相结合构建的一种生物传感器[8]。该方法一般采用酶或化学发光物质对抗体或抗原进行标记,然后利用抗体和抗原之间的特异性反应形成免疫复合物,最后根据信号标记物的化学发光强度来实现目标物的定性、定量检测。该分析方法在核酸[9]、细胞[10]、蛋白质[11]、肿瘤标志物[12]的检测方面已有广泛应用。如何提高方法的检测灵敏度,实现复杂样品中目标物的高灵敏检测是科研工作者努力的方向。
在免疫传感器的构建过程中,固相载体会极大地影响传感器的性能。以纳米材料作为生物分子的固相载体受到人们广泛的青睐,其中磁性纳米粒子由于比表面积大、表面易于修饰、生物相容性好、易于分离富集和催化性能好等优点,被人们广泛地用于生物分子的富集、纯化和分离[13]。
本工作基于免疫磁分离和酶催化放大策略,构建了一种高灵敏的化学发光免疫传感器,并将其应用于肿瘤标志物的检测。以磁球(MB)作为免疫反应的固相载体,辣根过氧化物酶(HRP)作为信号标记物,首先通过抗原-抗体特异性识别反应在MB表面形成磁性免疫夹心复合物,然后利用其表面的HRP催化鲁米诺-过氧化氢体系产生化学发光,根据化学发光强度来实现CEA 的检测,为测定人血清中CEA 的含量提供了一种新的手段。
1 试验部分
1.1 仪器与试剂
THMR-0594型磁力架;UV-2550 型紫外可见分光光度计;Malvern Zetasizer Nano ZS90型动态光散射粒径仪;MPI-E型电致化学发光检测仪。
磷酸盐缓冲溶液(PBS):0.1 mol·L-1,称取1.56 g二水合磷酸二氢钠,3.58 g十二水合磷酸氢二钠,用水定容至100 mL,再用0.1 mol·L-1磷酸溶液和0.1 mol·L-1氢氧化钠溶液调节溶液酸度分别为pH 6.0,7.2,8.0,于4 ℃保存。
羧基功能化的超顺磁性MB 标准溶液:50 g·L-1,MB粒径为500 nm,批号为02130。
CEA 标准溶液:2.1 g·L-1,使用时,用PBS(pH 7.2)稀释至所需质量浓度。
CEA 单克隆抗体Ab1和Ab2的单标准溶液:Ab1质量浓度为6.4 g·L-1,Ab2质量浓度为4.2 g·L-1,使用时,用PBS(pH 7.2)稀释至所需质量浓度。
脱脂奶粉的纯度为99.9%;生物素化试剂(sulfo-NHS-LC-biotin)、1-(3-二甲氨基丙基)-3-乙基-碳二亚胺盐酸盐(EDC)标准品、N-羟基琥珀酰亚胺(NHS)标准品、鲁米诺标准品的纯度均为98%;链霉亲和素标记的辣根过氧化物酶(SA-HRP)标准品的纯度为90%;其他试剂均为分析纯;试验用水为超纯水(电阻率为18.25 MΩ·cm)。
1.2 仪器工作条件
光电倍增管电压600 V;测量时间1 000 s;采样速率10 T·s-1;放大级数3;进样方式为手动注射。
1.3 试验方法
1.3.1 MB-Ab1与Ab2-biotion的制备[14]
取5μL羧基功能化的超顺磁性MB 标准溶液(50 g·L-1),用PBS(pH 6.0)洗涤3次,然后将其分散到200 μL含有0.1 mol·L-1NHS 和0.1 mol·L-1EDC 的PBS(pH 6.0)中,以转速130 r·min-1于37 ℃恒温摇床中活化40 min。用PBS(pH 7.2)洗 涤3 次,然后分散到600μL 含0.21 g·L-1CEA 单克隆抗体Ab1的PBS(pH 7.2)中,于37 ℃恒温摇床中反应12 h。再用PBS(pH 7.2)洗涤3次,除去多余的Ab1,然后分散到600μL含1%(质量分数,下同)牛血清白蛋白(BSA)的PBS(pH 7.2)中封闭30 min。用PBS(pH 7.2)洗涤3次,然后分散到600μL 含1%BSA 和0.05%(质量分数,下同)Na N3的PBS(pH 7.2)中,得到复合物MB-Ab1,于4 ℃冷藏保存,备用。
取20μL CEA 单克隆抗体Ab2标准溶液(0.64 g·L-1),用PBS(pH 7.2)稀释至200μL,然后加入10μL 新配制的1 g·L-1sulfo-NHS-LCbiotin溶液,以转速130 r·min-1于37 ℃恒温摇床中孵育3 h,采用NAP-5脱盐柱除去多余的sulfo-NHS-LC-biotin,利用紫外可见分光光度计测定生物素化抗体Ab2-biotion在280 nm 处的吸光度值并对其进行定量。然后加入20μL 含1% BSA 和0.05%(质量分数,下同)NaN3的PBS(pH 7.2),得到复合物Ab2-biotion,于4 ℃冷藏保存,备用。
1.3.2 MB-Ab1-CEA-Ab2-biotion-SA-HRP的制备
取20μL MB-Ab1,分散在100μL CEA 标准溶液或10μL 新鲜人血清样品中,以转速130 r·min-1于37 ℃恒温摇床中反应30 min,采用磁力架分离,以含0.05%(质量分数)吐温和0.4%(质量分数)脱脂奶粉的PBS(pH 7.2)为洗液,洗涤2次,除去未反应的CEA 和其他杂质,再用PBS(pH 7.2)除去吸附的洗液,得到复合物MB-Ab1-CEA。将上述MB-Ab1-CEA 分散到100μL 含10 mg·L-1Ab2-biotion的PBS(pH 7.2)中,以转速130 r·min-1于37 ℃恒温摇床中孵育30 min,用磁力架分离,洗液洗涤2次,再用PBS(pH 7.2)清洗,除去未反应的Ab2-biotion,得到复合物 MB-Ab1-CEA-Ab2-biotion。将上述MB-Ab1-CEA-Ab2-biotion 分散到100μL含10 mg·L-1的SA-HRP的PBS(pH 7.2)中,以转速130 r·min-1于37 ℃恒温摇床中孵育35 min,采用磁力架吸附MB,分别用洗液和PBS(pH 7.2)各洗涤2次,除去多余的SA-HRP,得到标记HRP 的磁性免疫夹心复合物MB-Ab1-CEAAb2-biotion-SA-HRP。制备过程如图1(a)所示。
1.3.3 CEA的测定
参照文献[14],将MB-Ab1-CEA-Ab2-biotion-SA-HRP分散到2 mL 含1 mmol·L-1鲁米诺和10 mmol·L-1过氧化氢的PBS(pH 8.0)中,采用电致化学发光检测仪测定体系的化学发光强度。
MB-Ab1-CEA-Ab2-biotion-SA-HRP 表面的HRP 能催化过氧化氢分解形成羟基自由基(·OH),·OH 与鲁米诺反应产生激发态鲁米诺中间体,鲁米诺中间体从激发态回到稳定的基态时会产生光学辐射[15],通过检测鲁米诺的发光强度,进而对CEA 进行定量,原理示意图如图1(b)所示。
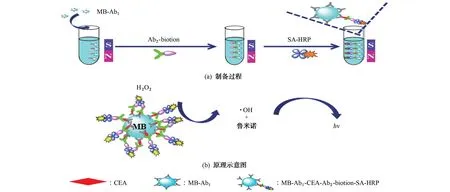
图1 制备过程和原理示意图Fig.1 Schematic diagrams of preparation process and principle
2 结果与讨论
2.1 方法可行性
试验考察了不同反应体系的化学发光强度,结果如图2所示。
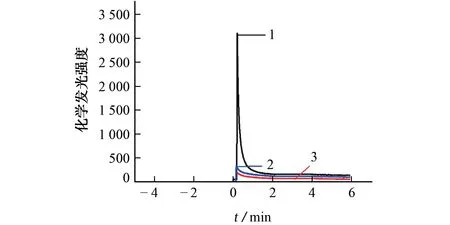
图2 不同反应体系的化学发光强度Fig.2 Chemiluminescence intensity of different reaction systems
由图2可知:当鲁米诺反应液中只有过氧化氢(曲线2)或只有 MB-Ab1-CEA-Ab2-biotion-SAHRP(曲线3)时,体系的化学发光强度很弱;当鲁米诺反应液中同时含有MB-Ab1-CEA-Ab2-biotion-SA-HRP和过氧化氢时,体系产生较强的化学发光信号,这是由于标记物HRP 可以催化过氧化氢产生大量的·OH,从而氧化鲁米诺[16]。
利用动态光散射粒径仪对一系列免疫复合物进行表征,结果如表1所示。
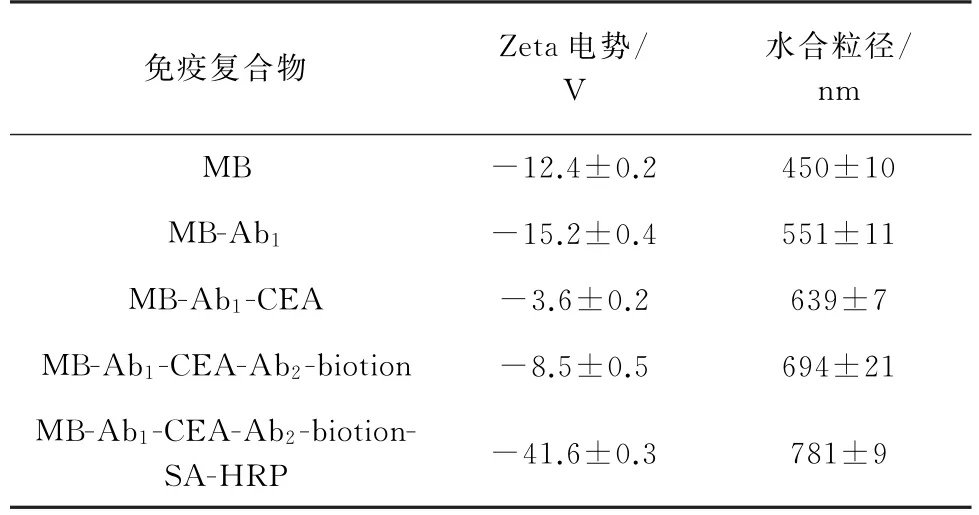
表1 免疫复合物的Zeta电势和水合粒径Tab.1 Zeta potential and hydrated particle size of the immune complex
由表1可见,随着对MB的逐步修饰,免疫复合物的Zeta电势和水合粒径发生了明显变化,表明目标物MB-Ab1-CEA-Ab2-biotion-SA-HRP 的顺利合成。
2.2 反应时间的优化
试验考察了 MB-Ab1-CEA-Ab2-biotion-SAHRP制备过程中各阶段反应时间对体系化学发光强度的影响,结果见图3。
由图3(a)可知,体系化学发光强度在MB-Ab1捕获CEA 30 min时达到峰值;由图3(b)可知,体系化学发光强度随着MB-Ab1-CEA 与Ab2-biotion反应时间的延长先增加后趋于稳定,反应时间过短时,免疫反应不完全,化学发光强度较小,当反应时间为30 min时,化学发光强度较大;由图3(c)可知,化学发光强度随着MB-Ab1-CEA-Ab2-biotion与SA-HRP反应时间的延长先增大后减小,当反应时间为35 min时,化学发光强度较大。因此,试验选择MB-Ab1与CEA 的反应时间为30 min,MB-Ab1-CEA 与Ab2-biotion的反应时间为30 min,MB-Ab1-CEAAb2-biotion与SA-HRP的反应时间为35 min。
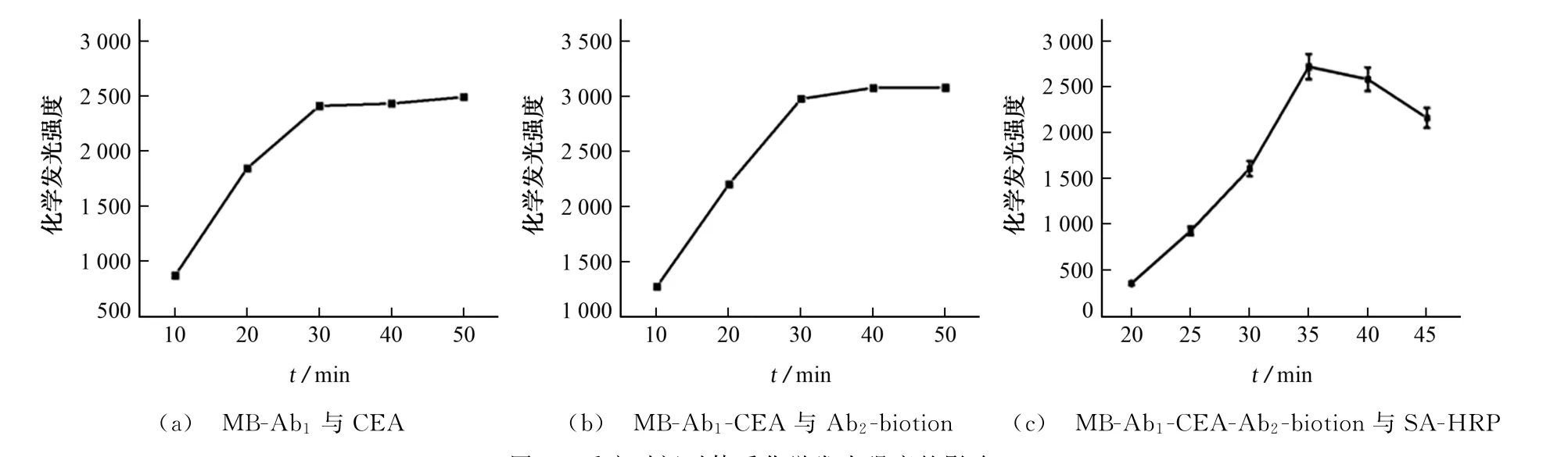
图3 反应时间对体系化学发光强度的影响Fig.3 Effect of reaction time on the chemiluminescence intensity of system
2.3 测定条件的优化
试验考察了过氧化氢浓度、鲁米诺浓度以及体系酸度对体系化学发光强度的影响,结果如图4所示。
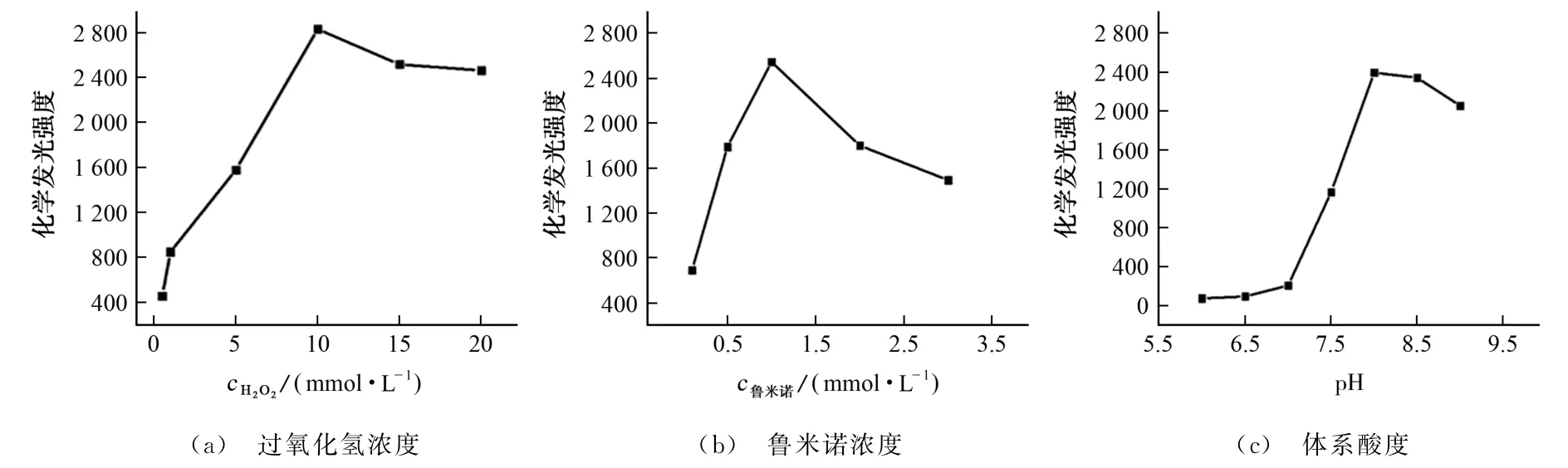
图4 过氧化氢浓度、鲁米诺浓度、体系酸度对体系化学发光强度的影响Fig.4 Effects of H2 O2 concentration,luminol concentration and system acidity on the chemiluminescence intensity of system
由图4(a)可知,随着过氧化氢浓度的增加,体系的化学发光强度先增大后减小,当过氧化氢浓度为10 mmol·L-1时,体系化学发光强度较大,可能是由于过氧化氢浓度过高时,HRP 的活性会下降[17],同时共氧化作用导致化学发光强度下降[18]。由图4(b)可知,体系化学发光强度在鲁米诺浓度为1 mmol·L-1时达到顶点,之后随着鲁米诺浓度的增加,体系化学发光强度逐渐降低。由图4(c)可知,体系化学发光强度在pH 8.0时达到顶点,之后随着pH 的增大,体系化学发光强度逐渐下降,可能是由于pH 较高时,HRP 的催化活性降低。因此,试验选择的过氧化氢浓度为10 mmol·L-1,鲁米诺浓度为1 mmol·L-1,体系酸度为pH 8.0。
2.4 干扰试验
为了评估该化学发光免疫传感器的特异性,选择人血清中可能存在的葡萄糖氧化酶(GOD)、人血清白蛋白(HSA)、免疫球蛋白(IgG)和甲胎蛋白(AFP)作为干扰物,考察了上述干扰物对检测CEA的干扰情况,结果见图5。
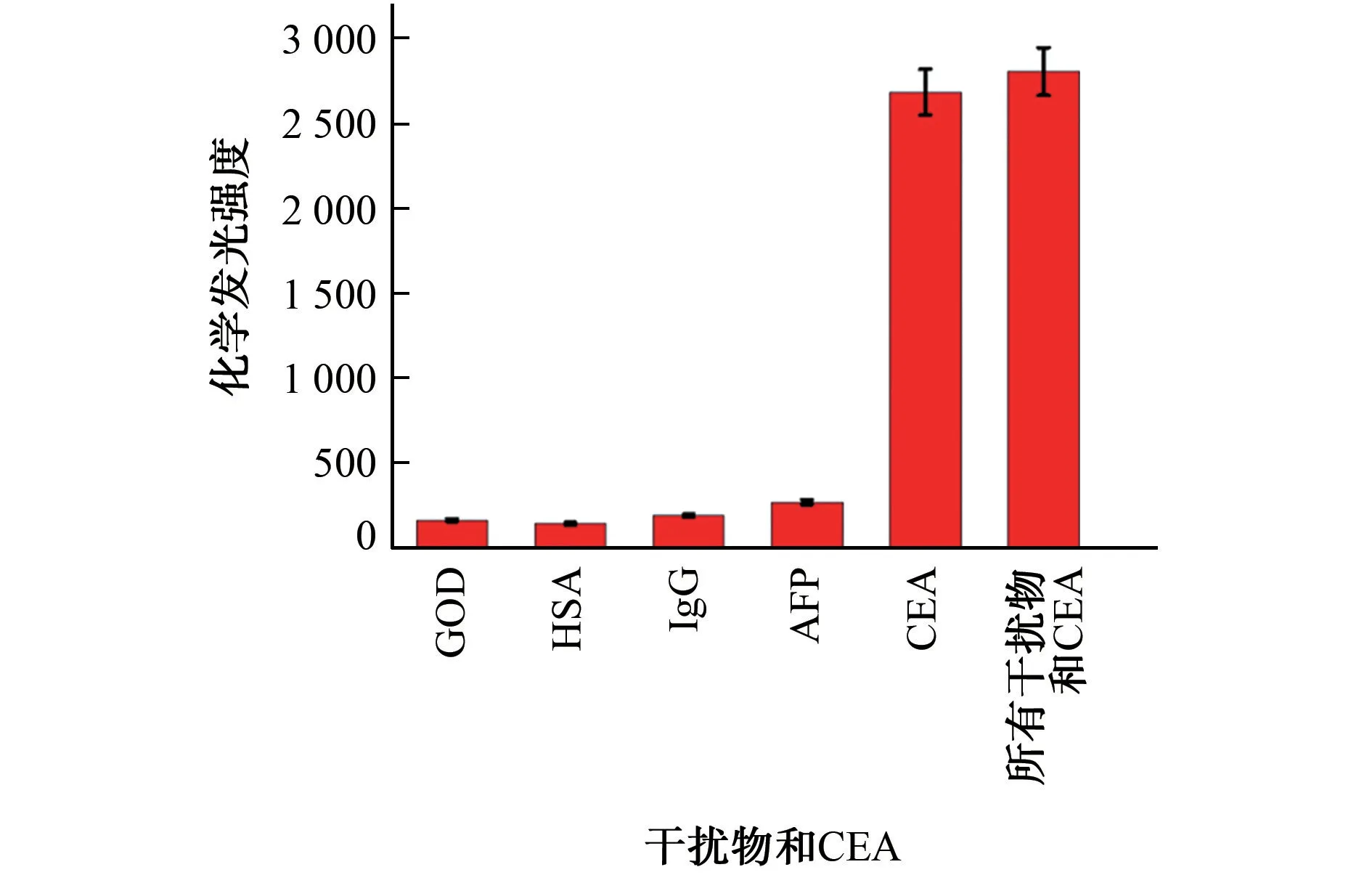
图5 干扰试验结果Fig.5 Results of test for interference
由图5可知,只有CEA 存在时,体系产生明显的化学发光信号,并且GOD、HSA、IgG 和AFP 的加入基本不影响化学发光强度,表明该传感器具有良好的特异性和抗干扰能力,这是由抗原-抗体的特异性结合所致。
2.5 标准曲线和检出限
移取适量的CEA 标准溶液,用PBS(pH 7.2)逐级稀释,配制成质量浓度为0.05,0.50,1.00,10.00,30.00,50.00,80.00μg·L-1的CEA 标准溶液系列,按照试验方法进行测定。以CEA 的质量浓度为横坐标,其对应的化学发光强度为纵坐标绘制标准曲线。结果显示,CEA 标准曲线的线性范围为0.05~80.00μg·L-1,线性回归方程为y=108.4x+528.6,相关系数为0.991 7。以信噪比为3时所对应的质量浓度为检出限,结果为4.5 ng·L-1。
2.6 回收试验
按照试验方法,对实际人血清样品进行加标回收试验,结果见表2。
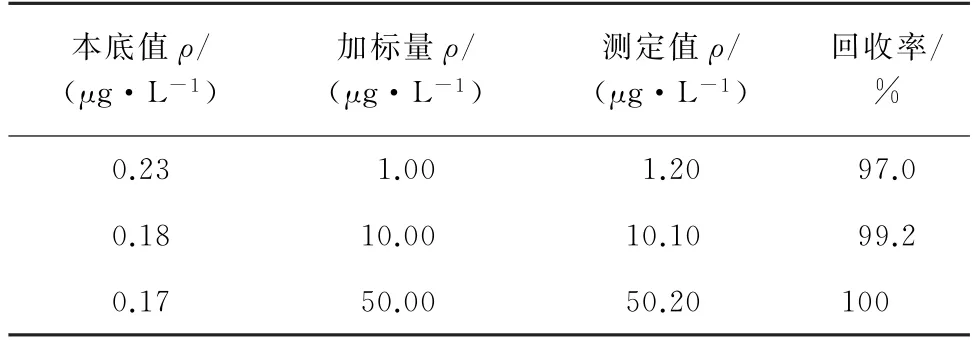
表2 回收试验结果Tab.2 Results of test for recovery
2.7 方法比对
将本方法中所用的MB 与玻片[14]、96 孔板[19]分别作为固相载体进行比较,结果如图6所示。
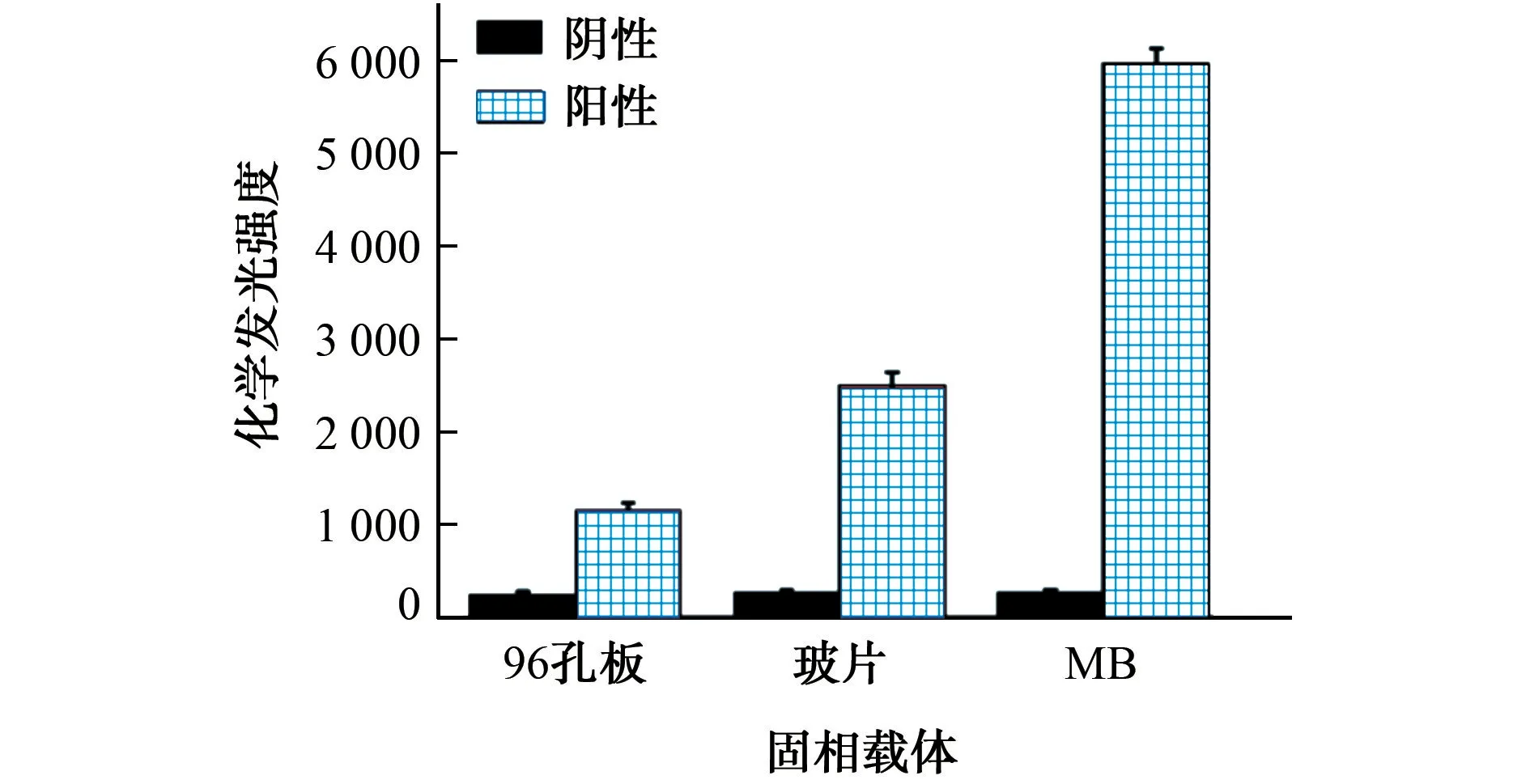
图6 不同固相载体检测CEA 的比较Fig.6 Comparison of different solid-phase carriers for the determination of CEA
在同一检测条件下,本方法得到的化学发光强度分别是玻片和96孔板作为固相载体得到化学发光强度的2.4倍和5.2倍。可能是由于MB 具有较大的比表面积,并且在水中分散良好,作为免疫反应的固相载体空间位阻较小,可以捕获到更多的CEA。同时,CEA 抗体与MB 是通过共价键结合,而96孔板与抗体是通过物理吸附结合,作用力相对较弱。将本方法与文献报道的其他化学发光免疫传感器相比较,结果见表3。
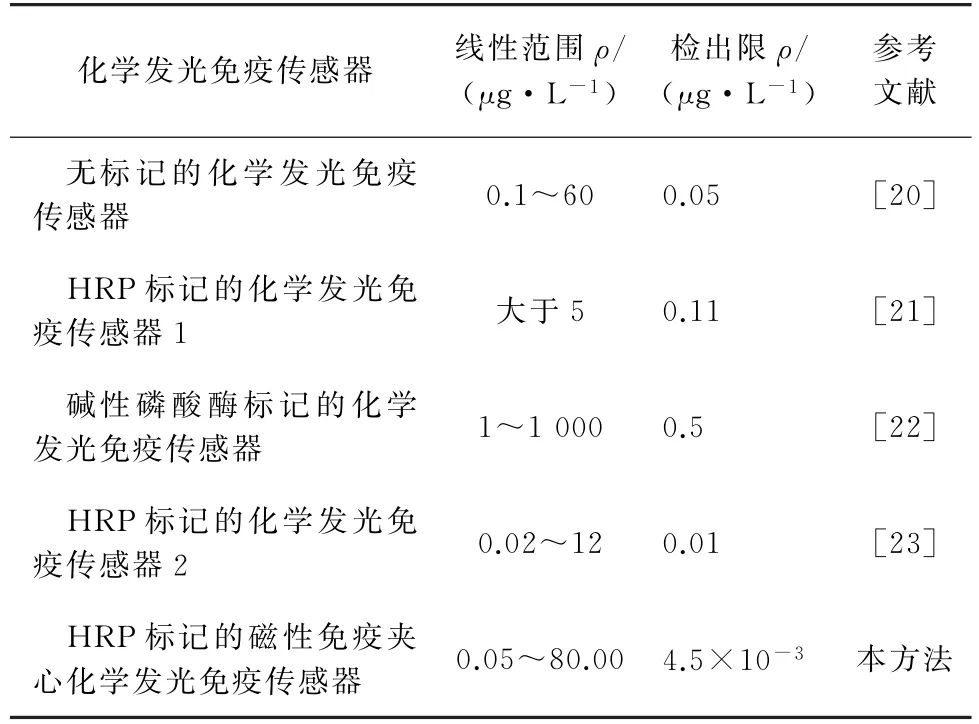
表3 不同化学发光免疫传感器检测CEA的比较Tab.3 Comparison of different chemiluminescence immunosensors for the determination of CEA
结果显示,与其他化学发光免疫传感器相比,本方法所构建的传感器具有更宽的线性范围和更低的检出限。
本工作将MB 作为固相载体,HRP 作为标记物,结合免疫磁分离技术和酶催化作用,构建了一种灵敏度高、选择性好、特异性和抗干扰性强的CEA化学发光免疫传感器,该传感器具有较宽的线性范围和较低的检出限,在疾病的早期诊断方面具有良好的应用前景。

