甘蔗线条花叶病毒RNA沉默抑制子的寄主互作蛋白鉴定
冯小艳 王俊刚 王文治 沈林波 赵婷婷 冯翠莲 张树珍



摘 要:甘蔗线条花叶病毒(, SCSMV)是引起甘蔗花叶病的一种主要病原。SCSMV编码的P1蛋白是RNA沉默抑制子,在SCSMV抑制寄主的RNA沉默防御中发挥关键作用,但其作用机制尚未清楚。与寄主蛋白互作是RNA沉默抑制子发挥其抑制作用的主要途径之一,因此鉴定与病毒RNA沉默抑制子互作的寄主蛋白是研究抑制子作用机制的一个重要方法。为探究SCSMV P1抑制寄主RNA沉默的机制,本研究首先将SCSMV 基因连接到质粒pGBKT7上构建诱饵质粒pGBKT7-P1,然后对pGBKT7-P1进行毒性和自激活检测,最后以pGBKT7-P1为诱饵,采用酵母双杂交技术从甘蔗cDNA文库中筛选与P1互作的寄主蛋白。结果显示,成功构建pGBKT7-P1诱饵质粒。将pGBKT7-P1诱饵质粒转入Y2H Gold酵母菌株后,酵母菌株在SD/-Trp平板及液体培养基中生长良好,表明pGBKT7-P1诱饵质粒对Y2H Gold酵母菌株无毒性。含pGBKT7-P1诱饵质粒的酵母菌株在SD/-Trp/X-α-Gal平板上长出白色菌落未变蓝,在SD/-Trp/X-α-Gal/AbA和SD/-Trp/-Leu/X-α-Gal/AbA平板上无菌落生长,表明pGBKT7-P1诱饵质粒无自激活活性。用pGBKT7-P1诱饵质粒对甘蔗cDNA文库进行筛选,经SD/-Trp/-Leu/X-α-Gal/AbA平板筛选1次及SD/-Trp/-Leu/-His/-Ade/X-α-Gal/AbA平板筛选3次后,获得42个阳性酵母克隆,提取阳性酵母质粒并导入大肠杆菌中擴大培养,经测序及blastx比对分析,获得13个可能与SCSMV P1互作的寄主甘蔗蛋白,分别是生长素应答蛋白IAA1、IAA15,转录因子NAC、GATA4、OFP4,真核翻译起始因子eIF5A,分子伴侣DnaJ,辅分子伴侣SBA1,重金属相关异戊二烯化植物蛋白HIPP35,mec-8和unc-52蛋白同系物抑制子SMU2,外膜孔蛋白OEP24,及2个未表征蛋白。基于这些蛋白的功能,推测P1可能通过与寄主蛋白互作来调控寄主防御反应相关基因的表达,和/或通过与寄主蛋白互作来影响寄主RNA沉默相关蛋白的合成、加工或转运,从而发挥其RNA沉默抑制子的功能。研究结果为后续深入解析P1抑制RNA沉默的作用机制奠定了重要基础。
关键词:甘蔗线条花叶病毒;RNA沉默抑制子;P1蛋白;互作蛋白中图分类号:S435.661 文献标识码:A
Identification of Host Proteins Interacting with RNA Silencing Suppressor of
FENG Xiaoyan, WANG Jungang, WANG Wenzhi, SHEN Linbo, ZHAO Tingting, FENG Cuilian,ZHANG Shuzhen
Institute of Tropical Bioscience and Biotechnology, Chinese Academy of Tropical Agricultural Sciences, Haikou, Hainan 571101, China
(SCSMV) is a major pathogen of sugarcane mosaic disease. P1 protein encoded by SCSMV is an RNA silencing suppressor, which plays a key role in suppressing the host’s RNA silencing defense. However, its mechanism is not yet clear. Interaction with host proteins is one of the main pathways for RNA silencing suppressors to exert the suppression functions. Therefore, identifying host proteins that interact with viral RNA silencing suppressors is an important method to study the mechanism of suppressors. In order to explore the mechanism of SCSMV P1 suppressing the host RNA silencing, in this study, SCSMV was ligated to the plasmid pGBKT7 to construct the bait plasmid pGBKT7-P1, then pGBKT7-P1 was tested for toxicity and self-activation, and finally pGBKT7- P1 was used as a bait to screen the host proteins that interact with P1 from the sugarcane cDNA library by yeast two-hybrid technology. The results showed that the bait plasmid pGBKT7-P1 was successfully constructed. After the pGBKT7-P1 bait plasmid was transferred into the Y2H Gold yeast strain, the yeast strain grew well in the SD/-Trp plate and liquid medium, indicating that the pGBKT7-P1 bait plasmid was non-toxic to the Y2H Gold yeast strain. The yeast strain containing the pGBKT7-P1 bait plasmid grew white rather than blue colonies on the SD/-Trp/X-α-Gal plate, and did not grow on the SD/-Trp/X-α-Gal/AbA and SD/-Trp/-Leu/X-α-Gal/AbA plates, indicating that the pGBKT7-P1 bait plasmid had no self-activation activity. The sugarcane cDNA library was screened with pGBKT7-P1 bait plasmid. After screening on SD/-Trp/-Leu/X-α-Gal/AbA plate once and SD/-Trp/-Leu/-His/-Ade/X-α-Gal/AbA plate three times, 42 positive yeast clones were obtained. The positive yeast plasmids were extracted and introduced into for amplification. After sequencing and blastx comparison analysis, a total of 13 host sugarcane proteins that may interact with SCSMV P1 were obtained, namely auxin-responsive proteins IAA1, IAA15, transcription factors NAC, GATA4, OFP4, eukaryotic translation initiation factor eIF5A, chaperone DnaJ, co-chaperone SBA1, heavy metal-associated isoprenylated plant protein HIPP35, suppressor of mec-8 and unc-52 protein homolog SMU2, outer envelope pore protein OEP24, and two uncharacterized proteins. Based on the functions of the proteins, it was speculated that P1 may interact with host proteins to regulate the expression of host defense response-related genes, and/or interact with host proteins to affect the synthesis, processing, or transport of host RNA silencing-related proteins, thereby exerting the RNA silencing suppressor function of P1. The research results would lay an important foundation for the subsequent in-depth analysis of the RNA silencing suppression mechanism of P1.
; RNA silencing suppressor; P1 protein; interacting protein
10.3969/j.issn.1000-2561.2022.06.016
甘蔗线条花叶病毒(, SCSMV)隶属马铃薯Y病毒科(Potyviridae)禾本科病毒属(),是引起甘蔗花叶病的主要病原之一。SCSMV侵染甘蔗除能引起典型的花叶症状外,还会导致甘蔗植株矮化,分蘖减少,汁液变少,口感变差,产量和品质严重下降。据统计,当SCSMV发生率超过50%时,可导致蔗茎和蔗糖产量分别显著下降16%~17%和19%~21%。自1978年首次报道以来,SCSMV在全球范围迅速传播,目前已在中国、印度尼西亚、泰国、印度等主要甘蔗种植国家广泛发生,严重制约甘蔗产业发展。目前缺乏行之有效的针对SCSMV的科学防控方法。
RNA沉默是植物用以抵抗病毒侵染的重要天然防御机制[6-。病毒为了对抗这一机制,在与植物长期共进化过程中,通过自身编码RNA沉默抑制子来干扰植物的RNA沉默通路从而建立有效侵染。RNA沉默抑制子通常是病毒成功侵染植物的必需因子,因此,阐明其作用机制可为病毒的科学防控提供理论指导。SCSMV编码的P1蛋白是RNA沉默抑制子,其在SCSMV抑制寄主的RNA沉默防御从而建立有效侵染中发挥关键作用,但目前尚未清楚其抑制RNA沉默的作用机制。解析SCSMV P1的作用机制对该病毒的科学防控具有重要意义。
RNA沉默抑制子不仅可以通过结合siRNA和dsRNA来发挥其抑制作用,还可通过与寄主蛋白互作来实现其抑制功能。因此,鉴定与病毒RNA沉默抑制子互作的寄主蛋白是研究抑制子作用机制的一个重要途径。目前,已有多个病毒RNA沉默抑制子的寄主互作蛋白被鉴定,这些互作蛋白种类多样、功能不一,按作用通路大致可归纳为2类,一类是RNA沉默通路蛋白,另一类是非RNA沉默通路蛋白。RNA沉默通路蛋白:AGO、Dicer、DRB4、RDR6和SGS3是RNA沉默通路中的重要蛋白,有些病毒编码的抑制子与这些蛋白中的一个或几个互作,通过干扰它们的正常功能来抑制RNA沉默。非RNA沉默通路蛋白:马铃薯Y病毒属()病毒编码的HC-Pro抑制子与寄主转录因子RAV2互作,可能通过RAV2调控寄主防御反应相关基因的表达来抑制寄主的RNA沉默机制。黄瓜花叶病毒(,CMV)编码的2b抑制子与寄主核糖体蛋白亚基RPS11互作,下调寄主中RPS11的mRNA水平导致2b抑制子活性降低、病毒复制和积累减少,表明2b可能通过作用于寄主蛋白RPS11来发揮其抑制子功能。甜菜严重曲顶病毒(, BSCTV)、甜菜曲顶病毒(, BCTV)和番茄金色花叶病毒(, TGMV)编码的抑制子与寄主甲基化循环相关蛋白SAMDC1或ADK互作,通过抑制SAMDC1降解或者促使ADK失活,从而抑制寄主DNA甲基化介导的基因沉默。
鉴定与病毒RNA沉默抑制子互作的寄主蛋白是研究抑制子作用机制的重要途径,目前已被应用于多个病毒RNA沉默抑制子作用机制的解析,但未见SCSMV编码的RNA沉默抑制子P1与寄主蛋白互作研究的报道。本研究利用酵母双杂交技术筛选与SCSMV P1蛋白互作的寄主(甘蔗)蛋白,以期为阐明SCSMV P1抑制RNA沉默的作用机制奠定基础,为SCSMV的科学防控提供理论依据。
材料与方法
材料
酵母双杂交所用质粒pGBKT7购自美国Clontech公司。Y2H Gold菌株和DH5α感受态细胞购自上海唯地生物技术有限公司。高保真酶Phanta HS Super-Fidelity DNA Polymerase购自南京诺唯赞生物科技股份有限公司;快速限制性内切酶购自美国Thermo Scientific公司;T DNA连接酶购自美国Promega公司;X-α-gal和AbA溶液购自北京酷来搏科技有限公司。琼脂糖凝胶回收试剂盒购自北京艾德莱生物科技有限公司;质粒小量提取试剂盒购自爱思进生物技术(杭州)有限公司;酵母质粒提取试剂盒购自北京索莱宝科技有限公司。引物合成由生工生物工程(上海)股份有限公司完成。
方法
1.2.1 SCSMV 基因的克隆 根据NCBI数据库中SCSMV的基因组序列(GenBank:GQ246 187.1)及本实验室获得的SCSMV 基因序列(待发表)设计基因扩增引物,并在正向引物引入酶切位点R I,反向引物引入酶切位点H I,引物序列具体如下:P1-R I-F:TCCGA ATTCATGGCTACTATCACTAAG,P1-H I-R:TCCGGATCCTCAGTAAAATACTAAATCTTC。以实验室保存的含有基因的pMD-18T载体为模板,使用高保真酶Phanta HS Super-Fidelity DNA Polymerase PCR扩增基因。扩增程序:95℃ 30 s;95℃ 10 s,54℃ 10 s,72℃ 17 s(30个循环);72℃ 10 min。PCR产物经琼脂糖凝胶电泳检测,然后使用琼脂糖凝胶回收试剂盒进行回收。
1.2.2 pGBKT7-P1诱饵质粒的构建 将基因胶回收产物用快速限制性内切酶R I和H I进行双酶切,然后使用T DNA连接酶将酶切后的基因与经相同酶切处理的pGBKT7质粒进行连接,连接产物转化DH5α感受态细胞,采用PCR法鉴定阳性克隆。提取阳性克隆质粒并进行酶切验证,将酶切验证正确的质粒送至生工生物工程(上海)股份有限公司进行测序,测序结果正确的质粒即为pGBKT7-P1诱饵质粒。
1.2.3 诱饵质粒毒性及自激活检测 按照Clontech公司的Yeastmaker Yeast Transformation System 2手册说明进行Y2H Gold酵母感受态细胞的制备和质粒转化。毒性检测:将100 ng的pGBKT7-P1诱饵质粒和pGBKT7空质粒分别转化Y2H Gold酵母感受态细胞,然后取100 μL稀释10倍的转化产物涂布于SD/-Trp平板,30℃倒置培养3 d左右,挑取平板上生长良好的单菌落接种于50 mL SD/-Trp(含50 μg/mL卡那霉素)液体培养基中,30℃ 260 r/min培养20~24 h后测量值。自激活检测:将转化了pGBKT7-P1诱饵质粒、pGBKT7空质粒、阳性对照质粒(pGBKT7-53和pGADT7-T)和阴性对照质粒(pGBKT7-Lam和pGADT7-T)的Y2H Gold酵母菌分别划线于分区的SD/-Trp、SD/-Trp/X-α- Gal、SD/-Trp/X-α-Gal/AbA和SD/-Trp/-Leu/X-α- Gal/AbA平板上,30℃倒置培养2~3 d,观察并记录结果。
1.2.4 酵母双杂交文库筛选 甘蔗cDNA文库的构建委托上海欧易生物医学科技有限公司完成。采用共转法对甘蔗cDNA文库进行筛选,将5 μg的pGBKT7-P1诱饵质粒和15 μg的文库质粒共同转化Y2H Gold酵母感受态细胞,具体操作参照Clontech公司的Yeastmaker Yeast Transformation System 2手册进行。将转化产物涂布于SD/ -Trp/-Leu/X-α-Gal/AbA平板上,30℃倒置培养3~5 d后,将平板上的蓝色克隆转移到SD/-Trp/- Leu/-His/-Ade/X-α-Gal/AbA平板上,重复3次。对3次转板后仍正常生长的蓝色阳性克隆进行质粒提取。利用pGADT7载体通用引物T7:TAATACGACTCACTATAGGGC和3¢ AD:AGAT GGTGCACGATGCACAG对提取的酵母质粒进行PCR鉴定。PCR程序:95℃ 5 min;95℃ 30 s,55℃ 30 s,72℃ 2 min(35个循环);72℃ 10 min。将经PCR鉴定后的酵母质粒转化DH5α感受态细胞,转化产物涂布于LB平板上(含100 μg/mL氨芐青霉素),37℃过夜培养后挑取PCR阳性克隆送至生工生物工程(上海)股份有限公司测序。使用NCBI的blastx功能对测序结果进行分析,以获得候选互作蛋白的相关信息。
结果与分析
2.1 SCSMV 基因扩增
利用特异性引物P1-R I-F和P1-H I-R对SCSMV 基因的编码框进行PCR扩增,扩增产物经琼脂糖凝胶电泳检测,获得1074 bp左右的片段,片段大小与预测的目的基因大小一致(图1),表明基因扩增成功。
诱饵质粒构建
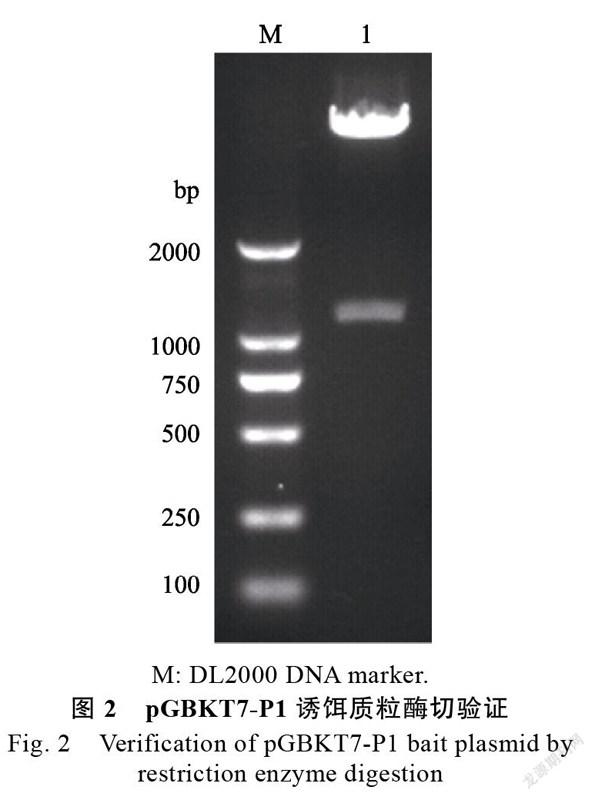
利用R I和H I对SCSMV 基因扩增产物进行双酶切,然后用T DNA连接酶将酶切的基因连接至pGBKT7载体,构建pGBKT7-P1诱饵质粒。对构建的诱饵质粒进行双酶切验证,结果显示酶切得到与预期大小一致的基因片段(图2)。诱饵质粒测序结果也显示插入的序列方向及编码框完全正确,表明pGBKT7-P1诱饵质粒构建成功。
诱饵质粒毒性及自激活检测
将分别转化了pGBKT7-P1诱饵质粒和pGBKT7空质粒的Y2H Gold酵母感受态细胞涂布于SD/-Trp平板,结果显示含有诱饵质粒和空质粒的酵母均可在平板上生长正常,且菌落数量大体相同,菌落大小均为2~3 mm。挑取平板上生长良好的单菌落接种于SD/-Trp液体培养基中,培养20~24 h后含有诱饵质粒和空质粒的菌液值分别达到2.168和2.308,均超过0.8的判定标准。以上结果表明,pGBKT7-P1诱饵质粒对Y2H Gold酵母菌株无毒性。
将含有pGBKT7-P1诱饵质粒的Y2H Gold酵母菌株划线于不同的营养缺陷型培养基上,结果如图3所示。含有诱饵质粒的菌株与含有空质粒及阴性对照质粒的菌株一样,在SD/-Trp平板上正常生长,在SD/-Trp/X-α-Gal平板上长出白色菌落,在SD/-Trp/X-α-Gal/AbA和SD/-Trp/-Leu/X-α- Gal/AbA平板上无菌落生长,而阳性对照在SD/ -Trp/X-α-Gal、SD/-Trp/X-α-Gal/AbA和SD/-Trp/ -Leu/X-α-Gal/AbA平板上均长出蓝色菌落。以上结果表明,pGBKT7-P1诱饵质粒无自激活活性,可用于酵母双杂交筛选。
的寄主互作蛋白筛选
用pGBKT7-P1诱饵质粒对甘蔗cDNA文库进行筛选,经SD/-Trp/-Leu/X-α-Gal/AbA平板筛选1次及SD/-Trp/-Leu/-His/-Ade/X-α-Gal/AbA平板筛选3次后,成功获得42个阳性酵母克隆。提取阳性酵母质粒,使用pGADT7载体通用引物对T7/3' AD进行PCR扩增,结果显示,有3个酵母质粒(15、34、41)未扩增出片段,2个酵母质粒扩增出双片段(37、40),其余酵母质粒扩增出单一片段,扩增获得的片段大小均在750 bp以上(图4)。
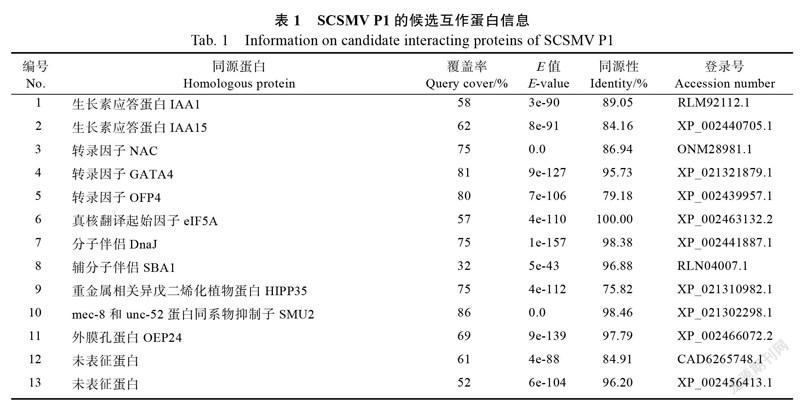
将扩增出片段的酵母质粒导入DH5α进行扩大培养,分离插入片段,并挑取阳性克隆进行测序分析。对于扩增出双片段的酵母质粒,每条扩增片段所对应的阳性克隆均送去测序。测序结果在NCBI数据库中进行blastx比对分析,去除重复序列后,获得13个候选互作蛋白,它们分别是:生长素应答蛋白IAA1、IAA15,转录因子NAC、GATA4、OFP4,真核翻译起始因子eIF5A,分子伴侣DnaJ,辅分子伴侣SBA1,重金属相关异戊二烯化植物蛋白HIPP35,mec-8和unc-52蛋白同系物抑制子SMU2,外膜孔蛋白OEP24,及2个未表征蛋白(表1)。
讨论
SCSMV引起甘蔗花叶病导致甘蔗产量减少和品质下降,目前在多个甘蔗种植国家广泛发生,对甘蔗产业发展构成严重威胁。SCSMV编码的P1蛋白是RNA沉默抑制子,在SCSMV抵抗寄主的RNA沉默防御中发挥关键作用,阐明其作用机制可为该病毒的科学防控提供理论依据。鉴定与病毒RNA沉默抑制子互作的寄主蛋白是研究抑制子作用机制的重要途径。因此,为初步解析SCSMV P1抑制RNA沉默的作用机制,本研究采用酵母双杂交技术筛选与SCSMV P1蛋白互作的寄主(甘蔗)蛋白,结果共获得13个候选互作蛋白,包括IAA1、IAA15、NAC、GATA4、OFP4、eIF5A、DnaJ、SBA1、HIPP35、SMU2、OEP24、和2个未表征蛋白。
AUX/IAA(auxin/indole-3-acetic acid)是生长素早期应答基因家族,是生长素信号传导途径的核心因子,生长素通过调节AUX/IAA蛋白水平进而调控一系列响应生长素的基因表达。AUX/IAA蛋白不仅参与植物生长发育过程,还在植物与病毒相互作用过程中发挥作用。水稻矮缩病毒(,RDV)编码的P2蛋白与水稻AUX/IAA蛋白IAA10互作,通过抑制26S蛋白酶体介导的IAA10降解来干扰生长素信号传导途径,影响生长素应答基因的表达,进而增强病毒侵染力、促进病情发展。在转基因水稻中的研究发现,过表达使水稻更容易受到RDV感染,而敲低则增强了水稻对RDV的抗性。烟草花叶病毒(, TMV)编码的复制酶蛋白与拟南芥AUX/IAA蛋白IAA26互作,通过改变IAA26的亚细胞定位及生长素应答基因的表达水平,来诱导植物产生特定病征。本研究利用酵母双杂交技术筛选获得2个与SCSMV P1蛋白互作的AUX/IAA蛋白,即IAA1和IAA15,这2个蛋白在筛库得到的酵母质粒中多次出现——在筛库获得的42个酵母质粒中,有8个质粒经测序及blastx比对分析得到IAA1,有11个质粒经测序及blastx比对分析得到IAA15。推测SCSMV编码的P1蛋白与甘蔗IAA1和IAA15互作,可能通过抑制IAA1和IAA15的降解和/或改变其亚细胞定位,继而干扰生长素信号传导途径,影响生长素应答基因的表达,从而抑制寄主的RNA沉默防御,增强病毒侵染力。
NAC转录因子是植物特有的一类转录因子,其可激活植物体内病程相关基因的表达从而调节植物的防御反应。研究表明,病毒可通过靶向寄主的NAC转录因子来增强侵染性。TMV编码的复制酶蛋白与寄主转录因子NAC互作,通过诱导NAC降解来抑制寄主病程相关基因的表达,从而帮助病毒建立系统侵染。番茄卷叶病毒(, TLCV)编码的复制辅助蛋白REn与寄主转录因子NAC互作,并诱导NAC在感染细胞中特异性表达,从而增强病毒DNA的复制。水稻突变体由于 插入破坏了其转录因子NAC的结构,从而导致RDV在突变体中的积累量显著下降,表明NAC对RDV在水稻体内的增殖是必需的。本研究利用酵母雙杂交技术筛选获得1个与SCSMV P1蛋白互作的甘蔗NAC转录因子,该转录因子在筛库得到的酵母质粒中屡次出现——筛库获得的42个酵母质粒中有4个质粒经测序及blastx比对分析得到NAC。表明SCSMV P1可能通过与寄主转录因子NAC互作,通过NAC来影响寄主病程相关基因的表达从而抑制寄主的RNA沉默防御,增强病毒侵染力。除了NAC外,本研究还筛选到2个与SCSMV P1互作的寄主转录因子(GATA4和OFP4),暗示P1可能通过与多个寄主转录因子互作,通过转录因子来影响寄主防御反应相关基因的表达从而实现其RNA沉默抑制子的功能。
eIF5A是普遍存在于植物、动物、真菌等真核生物体内的翻译因子,在蛋白质翻译过程的延伸阶段和终止阶段具有普遍的促进作用。本研究显示,SCSMV编码的P1蛋白与甘蔗eIF5A互作,推测其可能通过eIF5A调控RNA沉默相关蛋白的翻译进而抑制寄主的RNA沉默。分子伴侣是一类普遍存在于生物体内的保守蛋白质家族,能协助蛋白质的正确折叠、组装、转运乃至降解,对蛋白功能的发挥具有重要意义。辅分子伴侣是一类与分子伴侣结合并调节其功能的蛋白。本研究利用酵母双杂交技术筛选到1个与SCSMV P1蛋白互作的甘蔗分子伴侣(DnaJ)及1个辅分子伴侣(SBA1),暗示P1可能通过作用于寄主的分子伴侣和辅分子伴侣来干扰RNA沉默相关蛋白的正确折叠、组装、转运或降解,进而抑制寄主的RNA沉默。金属离子在生物体内扮演着非常重要的角色,生物体内将近一半的蛋白质需要金属离子,金属离子是这些蛋白质分子的结构成分或催化因子。HIPP是植物中负责金属离子转运的关键蛋白之一,对植物体内金属相关蛋白功能的发挥具有重要意义。本研究利用酵母双杂交技术筛选到1个与SCSMV P1蛋白互作的甘蔗HIPP蛋白(HIPP35),推测P1可能通过结合寄主HIPP35来影响寄主金属相关蛋白的功能,从而抑制寄主的RNA沉默。此外,本研究利用酵母双杂交技术还筛选到与SCSMV P1蛋白互作的甘蔗蛋白SMU2、OEP24,及2个未表征蛋白,P1亦可能通过与这些蛋白互作来发挥其RNA沉默抑制子的功能。
本研究利用酵母双杂交技术筛选到13个可能与SCSMV P1蛋白互作的寄主甘蔗蛋白,基于这些蛋白的功能,推测P1可能通过与寄主蛋白IAA1、IAA15、NAC、GATA4和/或OFP4互作来调控寄主防御反应相关基因的表达,和/或通过与寄主蛋白eIF5A、DnaJ、SBA1和/或HIPP35互作来影响寄主RNA沉默相关蛋白的合成、加工或转运,从而发挥其RNA沉默抑制子的功能。研究结果为后续深入解析P1抑制RNA沉默的作用机制奠定了重要基础。但本研究仅通过酵母双杂交技术研究蛋白互作关系,由于酵母结构简单,其蛋白质的加工和修饰与甘蔗可能存在差异,因此酵母双杂交的结果仅是提示蛋白质相互作用的可能性,后续还需要进行双分子荧光互补、免疫共沉淀、GST pull-down等试验验证蛋白的互作关系。SCSMV编码的P1蛋白与寄主蛋白如何互作?P1如何通过与寄主蛋白互作来发挥其抑制RNA沉默的功能?这些问题有待进一步研究。
参考文献
- 冯小艳, 王文治, 沈林波, 冯翠莲, 张树珍. 甘蔗线条花叶病毒研究进展[J]. 生物技术通报, 2017, 33(7): 22-28.FENG X Y, WANG W Z, SHEN L B, FENG C L, ZHANG S Z. Research advances on [J]. Biotechnology Bulletin, 2017, 33(7): 22-28. (in Chinese)
- PUTRA L K, KRISTINI A, ACHADIAN E M, DAMAYANTI T A. in Indonesia: distribution, characterisation, yield losses and management approaches[J]. Sugar Tech, 2014, 16(4): 392-399.
- 贺 振. 甘蔗线条花叶病毒和高粱花叶病毒的分子进化研究[D]. 北京: 中国农业科学院, 2014.HE Z. Molecular evolution of and [D]. Beijing: Chinese Academy of Agricultural Sciences, 2014. (in Chinese)
- KASEMSIN P, CHIEMSOMBAT P, HONGPRAYOON R. Characterization and genetic variation of , a infecting sugarcane in Thailand[J]. Modern Applied Science, 2016, 10(4): 137-149.
- CHANDRAN V, GAJJERAMAN P. Molecular diversity analysis of pretty interesting potyviridae ORF (PIPO) coding region in Indian isolates of [J]. Sugar Tech, 2016, 18(2): 214-221.
- WANG F, ZHAO X, DONG Q, ZHOU B G, GAO Z L. Characterization of an RNA silencing suppressor encoded by -RMV2[J]. Virus Genes, 2018, 54(4): 570-577.
- TATINENI S, QU F, LI R H, MORRIS T J, FRENCH R Triticum mosaic poacevirus enlists P1 rather than HC-Pro to suppress RNA silencing-mediated host defense[J]. Virology, 2012, 433(1): 104-115.
- GUPTA A K, HEIN G L, TATINENI S. P7 and P8 proteins of high plains , a negative-strand RNA virus, employ distinct mechanisms of RNA silencing suppression[J]. Virology, 2019, 535(6): 20-31.
- SALAVERT F, NAVARRO J A, OWEN C A, KHECHMAR S, PALLÁS V, LIVIERATOS I C. p22 suppressor of RNA silencing binds single-, double-stranded long and short interfering RNA molecules [J]. Virus Research, 2020, 279: e197887.
- QI N, ZHANG L, QIU Y, WANG Z W, SI J, LIU Y X, XIANG X, XIE J Z, QIN C F, ZHOU X, HU Y Y. Targeting of Dicer-2 and RNA by a viral RNA silencing suppressor in cells[J]. Journal of Virology, 2012, 86(10): 5763-5773.
- RAJAMÄKI M L, STRENG J, VALKONEN J P T. Silencing suppressor protein VPg of a interacts with the plant silencing-related protein SGS3[J]. Molecular Plant- Microbe Interactions, 2014, 27(11): 1199-1210.
- WANG R L, DU Z Y, BAI Z Q, LIANG Z S. The interaction between endogenous 30S ribosomal subunit protein S11 and LS2b protein affects viral replication, infection and gene silencing suppressor activity[J]. PLoS One, 2017, 12(8): e0182459.
- BUCHMANN R C, ASAD S, WOLF J N, MOHANNATH G, BISARO D M. AL2 and L2 proteins suppress transcriptional gene silencing and cause genome-wide reductions in cytosine methylation[J]. Journal of Virology, 2009, 83(10): 5005-5013.
- ZHANG Z H, CHEN H, HUANG X H, XIA R, ZHAO Q Z, LAI J B, TENG K L, LI Y, LIANG L M, DU Q S, ZHOU X P, GUO H S, XIE Q. BSCTV C2 attenuates the degradation of SAMDC1 to suppress DNA methylation-mediated gene silencing in[J]. The Plant Cell, 2011, 23(1): 273-288.
- JIN L, QIN Q Q, WANG Y, PU Y Y, LIU L F, WEN X, JI S Y, WU J G, WEI C H, DING B, LI Y. P2 protein hijacks auxin signaling by directly targeting the rice OsIAA10 protein, enhancing viral infection and disease development[J]. PLoS Pathogens, 2016, 12(9): e1005847.
- PADMANABHAN M S, GOREGAOKER S P, GOLEM S, SHIFERAW H, CULVER J N. Interaction of the replicase protein with the Aux/IAA protein PAP1/1AA26 is associated with disease development[J]. Journal of Virology, 2005, 79(4): 2549–2558.
- 趙才美, 黄兴奇, 殷富有, 李定琴, 陈 越, 陈 玲, 程在全. 水稻NAC转录因子家族的研究进展[J]. 植物科学学报, 2020, 38(2): 278-287.ZHAO C M, HUANG X Q, YIN F Y, LI D Q, CHEN Y, CHEN L, CHENG Z Q. Research progress on NAC transcription factor family in L[J]. Plant Science Journal, 2020, 38(2): 278-287. (in Chinese)
- SEO P J, KIM M J, PARK J Y, KIM S Y, JEON J, LEE Y H, KIM J, PARK C M. Cold activation of a plasma membrane-tethered NAC transcription factor induces a pathogen resistance response in [J]. The Plant Journal, 2010, 61(4): 661-671.
- WANG X, GOREGAOKER S P, CULVER J N. Interaction of the replicase protein with a NAC domain transcription factor is associated with the suppression of systemic host defenses[J]. Journal of Virology, 2009, 83(19): 9720-9730.
- SELTH L A, DOGRA S C, RASHEED M S, HEALY H, RANDLES J W, REZAIAN M A. A NAC domain protein interacts with replication accessory protein and enhances viral replication[J]. The Plant Cell, 2005, 17(1): 311-325.
- YOSHII M, SHIMIZU T, YAMAZAKI M, HIGASHI T, MIYAO A, HIROCHIKA H, OMURA T. Disruption of a novel gene for a NAC-domain protein in rice confers resistance to [J]. Plant Journal, 2009, 57(4): 615-625.
- 王 琪, 许志茹, 陈瑾元, 张 双, 黄佳欢, 刘关君. 杨树重金属相关异戊二烯化植物蛋白(HIPPs)基因的鉴定及表达分析[J]. 植物研究, 2019, 39(6): 935-946.WANG Q, XU Z R, CHEN J Y, ZHANG S, HUANG J H, LIU G J. Identification and expression analysis of heavy metal-associated isoprenylated plant proteins (HIPPs) genes in [J]. Bulletin of Botanical Research, 2019, 39(6): 935-946. (in Chinese)
- 方思齐, 李泽栋, 王记圆, 何其光, 李 潇, 刘文波, 张 宇, 林春花, 缪卫国. 利用酵母双杂交技术筛选炭疽菌中与CsSSK1相互作用的蛋白质[J]. 热带作物学报, 2021, 42(1): 198-204.FANG S Q, LI Z D, WANG J Y, HE Q G, LI X, LIU W B, ZHANG Y, LIN C H, MIAO W G. Screening of proteins interacting with CsSSK1 in by yeast two-hybrid technique[J]. Chinese Journal of Tropical Crops, 2021, 42(1): 198-204. (in Chinese)
——一道江苏高考题的奥秘解读和拓展

