养殖对虾白斑综合征防控技术研究进展
谢 玺,王庆志
(辽宁省海洋水产科学研究院,大连市海产贝类种质资源创新利用重点实验室,辽宁 大连 116023)
对虾养殖是水产养殖业的重要组成部分,中国已成为对虾出口大国。近30年来,随着养殖业规模的不断扩大,生态环境不断恶化,对虾的集约化养殖和管理不善导致了一些病毒性疾病普遍流行,主要病原包括:黄头杆状病毒(YHV)、桃拉综合征病毒(TSV)、传染性皮下及造血组织坏死病毒(IHHNV)、白斑综合征病毒(WSSV)等,其中由白斑综合征病毒引起的白斑综合征对对虾养殖业的危害最为严重[1-2]。
对虾白斑综合征是由白斑综合征病毒引起的暴发性流行病,白斑综合征病毒可通过水平和垂直传播感染中国明对虾(Fenneropenaeuschinensis)、日本囊对虾(Marsupenaeusjaponicus)、凡纳滨对虾(Litopenaeusvannamei)等几乎所有对虾类甲壳动物,对虾生命周期各阶段全部易感,发病病程短,致死率极高[3]。感染白斑综合征病毒后,对虾甲壳内表面初现点状白斑,继而逐渐扩大至头胸部和全身,最后甲壳呈白色;发病前期虾须、尾扇发红,身体消瘦,漫游于水面,发病后期病虾残胃或空胃,甲壳易脱离真皮,游动缓慢无力,致死率高达100%[4]。
自20世纪90年代初,白斑综合征病毒在中国台北首次发现以来,先后在亚洲、北美洲、欧洲等国家和地区暴发,引起全球性对虾流行病,造成养殖对虾大规模死亡和巨大经济损失,成为全球对虾养殖业危害最大的一种病毒[5-7]。世界动物卫生组织(OIE)、联合国粮食及农业组织(FAO)以及亚太水产养殖网络中心(NACA)将白斑综合征列为需要上报的严重水生动物病毒性疫病,我国农业农村部也于2009年将其列入《一、二、三类动物疫病病种名录》中水生生物一类动物疫病。多年来,为了预防和控制该病害流行暴发,各国学者对白斑综合征的病原学与流行病学、免疫与致病机理、生态防控与抗病育种等技术进行了广泛而深入的研究与应用,取得了显著成效,其中“中国明对虾‘黄海1号’新品种及其健康养殖技术”与“对虾白斑症病毒单克隆抗体库的构建及应用”两项成果分别荣获2007年度和2010年度国家技术发明奖二等奖,为我国对虾养殖业持续健康发展提供了技术支撑。目前,在对虾养殖生产上多采用培育抗病力强的虾种和切断白斑综合征病毒传播途径综合防控白斑综合征发生[8]。笔者以白斑综合征防控技术的发展现状作为典型案例分析,展望相关技术的应用前景,为有效防控对虾白斑综合征及其他病害提供参考。
1 白斑综合征防控技术水平分析
白斑综合征病毒是具有双层囊膜的环状双链DNA病毒,基因组大小约为300 kb,不形成包涵体,病毒粒子形态为卵圆形或椭球形至短杆状,呈规则对称,长度为250~380 nm,直径为80~130 nm,囊膜厚为6~7 nm,一端具有鞭毛状的延伸结构(图1[9])。病原体功能基因的研究已成为疫苗研制的一个方向。目前GenBank公布了白斑综合征病毒中国株WSSV-CN、泰国株WSSV-TH、韩国株WSSV-KR、澳大利亚株WSSV-AU等10株的基因组序列[10-14],各基因组序列间的差异主要表现在大序列缺失、单核苷酸突变、重复序列变化等方面。国际病毒学分类委员会(ICTV)将中国株系白斑综合征病毒(Whitespotsyndromevirus)WSSV-CN列为线头病毒科白斑病毒属(Whispovirus)的代表种[15-16]。
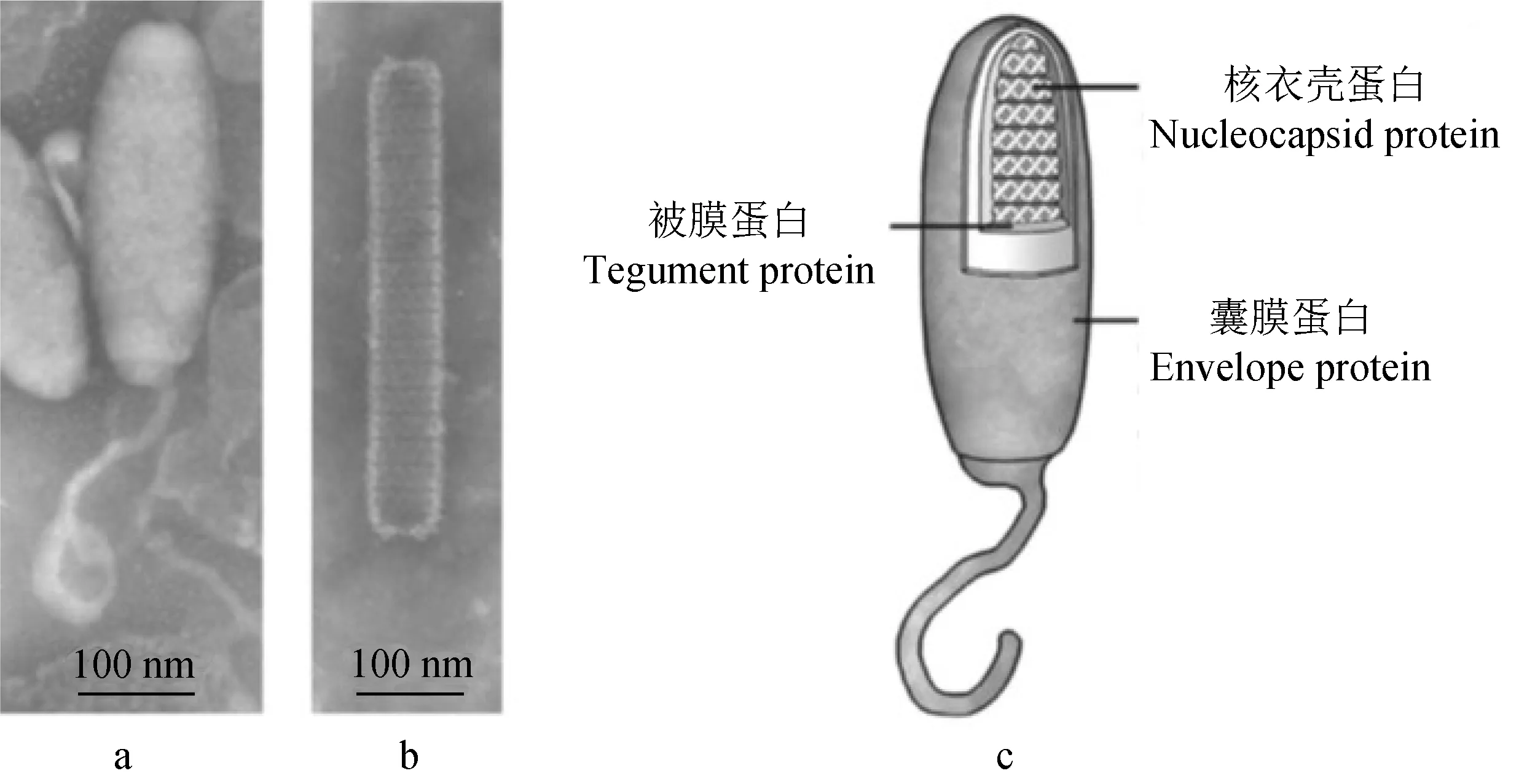
图1 白斑综合征病毒病毒粒子的形态学Fig.1 Morphology of the WSSV virion
对白斑综合征病毒的蛋白质鉴定有助于认知白斑综合征病毒的装配形式和入侵机理,为开发白斑综合征病毒的快速诊断技术和疫苗提供理论依据。白斑综合征病毒基因组中编码的蛋白包括能组装成病毒粒子的结构蛋白和参与病毒复制及相关的调控蛋白。其中结构蛋白可维持病毒基本构象、保护病毒核酸,在病毒识别、吸附和侵入细胞过程中起重要作用[17],主要为核衣壳蛋白(如VP15)、囊膜蛋白(如VP19与VP28)[18]和被膜蛋白(如VP26)(图2[19])。
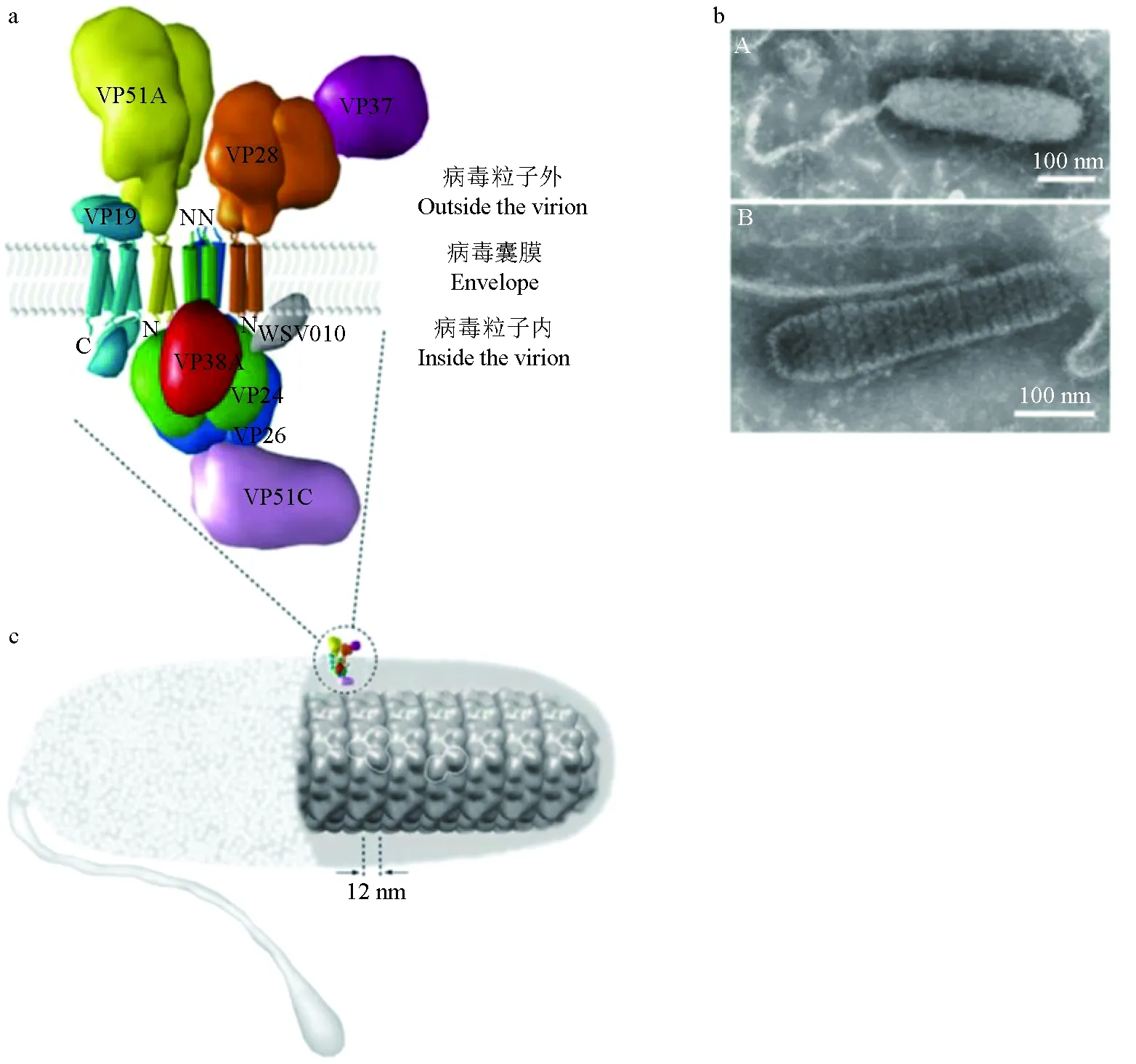
图2 膜蛋白复合物和核衣壳的三维模型Fig.2 3D models of the membrane protein complex and the nucleocapsid
1.1 检测与诊断技术
对虾养殖实践表明,任何病害一旦暴发就很难控制,易造成对虾严重减产或绝产。在白斑综合征病毒感染早期,快捷准确的病毒诊断技术是生产上实现病毒预警与防控、减少经济损失的重要前提。目前,世界动物卫生组织(https:∥www.oie.int/index.php?id=2439&L=0&htmfile=chapitre_wsd.htm#chapitre_wsd.biblio-48)推荐的白斑综合征病毒标准检测方法主要包括宏观病理学检测法、显微病理学检测法[20-21]、抗体抗原检测法[22-23]、分子生物学检测法[24]等,一些方法的适用性和定向性诊断评级见表1。
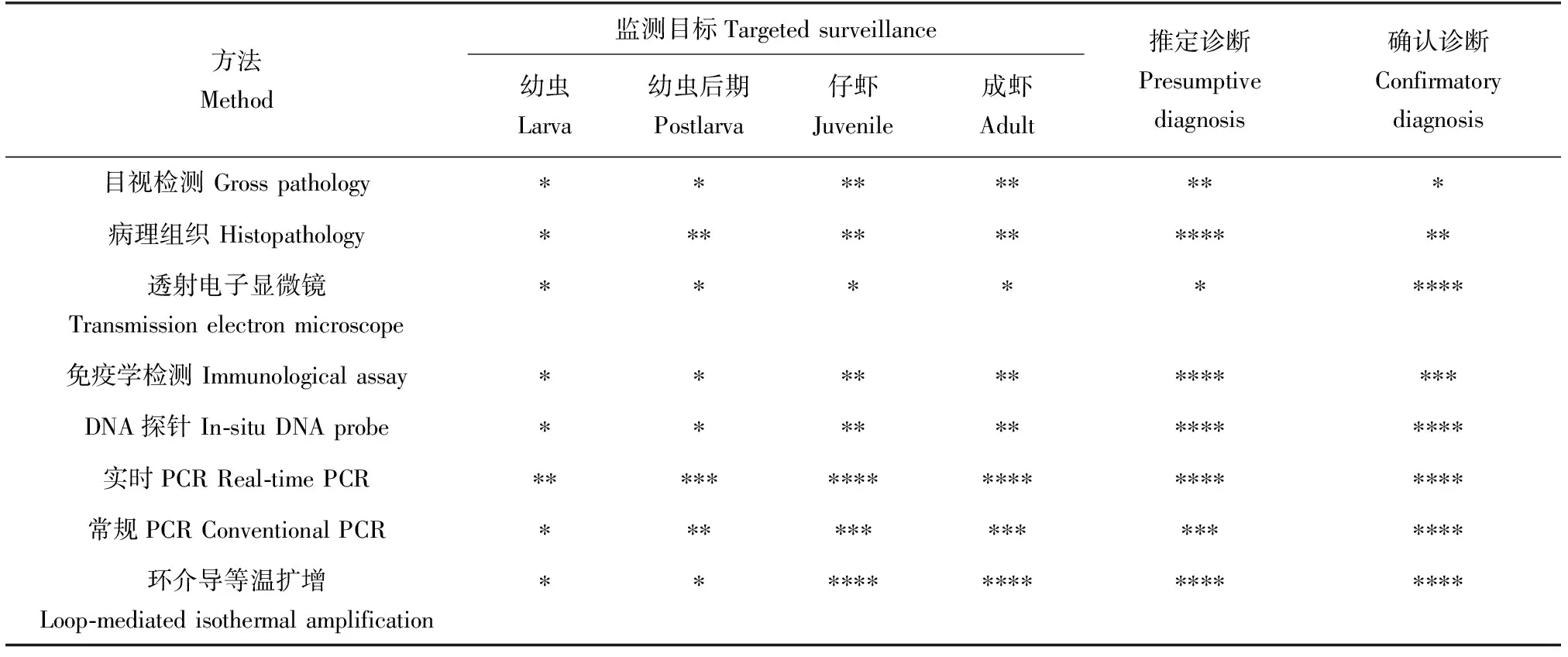
表1 养殖对虾不同阶段定向监测和诊断白斑综合征病毒感染的方法评级
1.1.1 目视检测法
目视检测法主要依据宏观病理学原理于养殖现场直接观察判断。一旦发现对虾食量下降,静卧水底,出现离群独游、缓游、侧游或游到水面附近等不正常的游泳行为,且甲壳上嵌有明显的白色斑点,头胸甲出现易剥离等症状[3,25],建议及时采取应急措施,控制病情蔓延。需要注意的是,出现白斑并非感染白斑综合征病毒的可靠诊断标志,也难以全面掌握白斑综合征病毒的感染率,需结合组织病理学等方法获得准确病情。
1.1.2 显微病理学检测法
显微病理学诊断法是通过光学或电子显微镜观察患病对虾的组织学变化,包括细胞核肥大、染色质边缘化等。黄倢等[26]首创了一种适用于现场快速检测白斑综合征病毒的简便方法,即新鲜病变组织(如鳃上皮或表皮上皮组织)的T-E染色法,全程用时仅需10 min,通常在400~1000倍光学显微镜下可以看到细胞核肥大和核内嗜酸性或空泡样包涵体,不过该方法检测到的病毒不能直接用于断定对虾发病。电子显微技术可以直接观察到白斑综合征病毒粒子的形态和大小,是公认最为直观的检测病毒性病原方法,但是操作复杂、样品处理时间长,试验条件比较严格[27-28]。
1.1.3 免疫学检测方法
针对病毒或重组病毒结构蛋白的多克隆和单克隆抗体已被用于各种免疫分析,包括免疫印迹分析[29]、酶联免疫吸附法、液相芯片技术[30]等。其中酶联免疫吸附法是根据免疫测定原理发展的一种固相免疫酶技术,包括单克隆抗体酶联免疫吸附法[31]、间接酶联免疫吸附法[32]、双抗夹心直接或间接酶联免疫吸附法[33]等,典型应用代表是以胶体金免疫层析法为基础建立的快速检测试纸条,适用于对虾养殖现场[34]。需要注意的是,白斑综合征病毒的主要靶组织是外胚层和中胚层的胚胎起源,特别是角质层上皮和皮下结缔组织,但是不同组织对白斑综合征病毒的免疫应答有明显差异,建议应用该类方法时选择虾体相同部位检测[35]。相较前述两种方法,基于抗原抗体的方法更为快速方便,因此推荐该类方法用于确诊急性白斑综合征病毒感染。
1.1.4 分子生物学检测法
分子生物学检测法主要包括环介导等温扩增技术、随即扩增多态性DNA技术、核酸探针技术、聚合酶链式反应(PCR)技术等。其中,PCR技术是以对虾的基因组为模板,根据预测病毒设计引物,进行体外扩增检测,灵敏度高、特异性强,广泛应用于对虾病毒的检测、早期诊断、防控与品种选育等,目前国内外均已开发出白斑综合征病毒的商品化PCR检测试剂盒[36-37]。一些研究人员还根据实际需要对常规PCR技术进行了改进,使检测结果更为快速准确[38],如套式PCR、实时定量PCR、反转录PCR、多重引物PCR等[39-41]。核酸探针是被放射性同位素、生物素或荧光染料标记了的能够被探测到的核酸片段,具有特异性好、敏感性高和快速检测等特点,白斑综合征病毒核酸探针试剂盒目前已经面世;通过结合原位杂交和组织切片技术,不但可以确定白斑综合征病毒感染细胞的类型,而且能观察到组织病理变化,相比染色更具优越性,有助于研究发病机理和流行病学[42]。随即扩增多态性DNA技术的扩增产物能够形成病毒核酸指纹图谱,在检测时可以比较不同来源毒株DNA序列的同源性,有助于筛选出与抗病性状相关的分子遗传标记[43]。环介导等温扩增技术依赖于循环置换扩增实现对靶序列的放大,在等温条件下,1 h即可扩增出109拷贝靶序列,可以检出对虾发病早期或隐性感染阶段体内携带的较低量白斑综合征病毒,兼具特异、灵敏和现场快速检测与推广应用等特点[44-45]。此外,近年来有国内学者基于重组酶聚合酶扩增(RPA)技术初步构建了对虾白斑综合征病毒快速检测方法,在灵敏度(10个病毒粒子以下)和检测时间(10 min以内)上体现出明显优势,有望实现实时荧光重组酶聚合酶扩增技术的应用与推广[46]。
1.2 免疫防控技术
对虾类水生动物疾病的预防与控制是产业持续健康发展的关键和基本保障。对虾养殖水环境复杂多变,病原变异频繁,特别是大面积暴发的病毒性疾病很难得到有效的控制。免疫防治是对虾大规模养殖中病害防控最有潜力的一种手段[18]。Venegas等[47]于2000年首次报道,在自然和试验白斑综合征病毒感染中存活下来的日本囊对虾对随后的白斑综合征病毒感染表现出了抗病性。经典的免疫学理论认为对虾类无脊椎动物的先天性免疫缺乏特异性和免疫记忆,尽管潜在的机制仍然未知,越来越多试验已经表明,“接种”的对虾在白斑综合征病毒攻击后有更好的存活率,说明在抵抗病原感染的过程中,对虾的先天免疫系统同样具有某种形式的免疫记忆,即所谓的“免疫启动”或“训练免疫”[48-49]。这种训练免疫记忆主要表现为:经过病原微生物或疫苗的初次处理,多数对虾[凡纳滨对虾、斑节对虾(Penaeusmonodon)、日本囊对虾等]可以对再次感染的同种或异种病原微生物诱发出更强的免疫防御反应和清除病原的能力[19]。这种免疫反应为通过接种疫苗制定对虾类无脊椎动物的疾病控制策略提供了理论基础。目前,核酸疫苗(DNA疫苗和双链RNA疫苗)被认为是有效对抗白斑综合征病毒的潜在新方法,国内外学者已研制出对虾抗白斑综合征病毒的核酸药物或植物提取物等有效成分,可以诱发虾体产生针对白斑综合征病毒免疫应答的保护效应,提高对虾成活率,相关产品已获得国际专利授权[50-51]。
1.2.1 DNA疫苗
DNA疫苗一般由抗原蛋白基因和表达载体质粒构成,通过在宿主体内翻译、合成、识别过程激活免疫系统,当病毒与宿主细胞表面分子相互作用时引发免疫应答。研究发现,向对虾体内导入利用编码白斑综合征病毒结构蛋白VP15、VP28、VP35和VP281的基因构建重组DNA质粒,能明显提高对虾的抗病力、存活率及酚氧化酶原和超氧化物歧化酶水平,抵御白斑综合征病毒的侵害[52-53]。相比于传统的蛋白质疫苗:DNA疫苗制备简洁,成本低廉,易于规模化生产;抗原基因在体内可以长期表达;具有弱毒疫苗的免疫原性,能激发体液免疫和细胞免疫反应,不存在毒力回升等[54],但存在一定程度的转基因争议和风险。
1.2.2 RNA疫苗
RNA干扰是由双链RNA(dsRNA)诱导的与dsRNA同源的mRNA高效特异性降解现象,能够抑制相关基因表达,在水生动物的生长发育和抗病毒入侵方面发挥重要作用[55-56]。白斑综合征病毒是具有囊膜的双链DNA病毒,利用RNA干扰技术可定向沉默编码关键囊膜蛋白的mRNA来抑制白斑综合征病毒的复制扩增。研究发现,从脊椎动物体内获得的免疫球蛋白基因dsRNA导入对虾可以诱导其表现出白斑综合征病毒抗性[57]。由于对虾体内不存在上述脊椎动物的免疫球蛋白,所以脊椎动物的dsRNA分子不会参与到对虾的抗病毒免疫体系。这种抗病毒状态的诱发是独立于dsRNA序列的,引起染病对虾死亡率降低的原因是注射到对虾体内的脊椎动物免疫球蛋白基因dsRNA作为外源性物质激活了对虾先天性的免疫反应[58]。白斑综合征病毒的膜蛋白VP28或VP26的dsRNA注射免疫对虾10 d后,对虾累积死亡率均较低,其表现出较好的抗病毒保护效应[59]。在中国明对虾幼体中注射与白斑综合征病毒蛋白激酶基因、VP28和VP281基因相关的长链dsRNA能有效提高对虾的存活率[60]。将VP28相关的短链dsRNA注射到对虾体内也具有类似效果,若干靶向病毒复制相关酶的小干扰RNA和短发夹RNA诱导的特异RNA干扰均不同程度地抑制了白斑综合征病毒的增殖,降低了对虾的死亡率[61]。
作为对抗病毒入侵的一种新技术,RNA干扰技术具有安全、高效、无毒等特点,在对虾白斑综合征病毒防治过程中将发挥积极作用。首先在技术层面上,可通过筛选不同靶点和不同剂量的dsRNA解决RNA干扰脱靶和剂量效应问题;其次缘于RNA干扰的内生性调控机制,导入对虾体内的dsRNA可以持续发挥作用。相比脊椎动物,对虾的dsRNA注射用量较少,生产成本更低。
2 白斑综合征防控技术发展趋势
白斑综合征的成功防控主要取决于流行病学的研究突破,查明传染源、传播途径及暴发流行与环境的关系。早期是通过环境调控病原[62-63],目前则是无特异性病原苗种生产技术和生物防控技术的融合,未来白斑综合征等病害防控除了需要先进的检测技术,还可能依赖于疫苗技术、生态防控技术、无特异性病原苗种、生物絮团环境调控技术的综合应用与发展。
2.1 免疫防控技术
疫苗是水产动物疾病防控的最有效的手段,在对虾类水产动物病毒病防治上的不可替代性展现了它的应用前景[64]。对虾疫苗研制应该符合疫苗学的发展方向,如研制能控制多种疾病的联合疫苗、开发出治疗性疫苗、通过转基因技术制备饵料食物疫苗等。饲料中添加免疫活性物质,使对虾在摄取食物的同时,调动或激活自身的免疫系统,进而增强抗病力。一些研究显示,β-葡聚糖、维生素C、海藻提取物(褐藻多糖)和其他免疫增强剂可能提高对白斑综合征病毒感染的抵抗力[65-66],如:饲料中添加适宜的卵黄抗体能有效提高对虾抗白斑综合征病毒免疫因子的活性[67];饲料中添加适量的家蝇抗菌肽能够减少白斑综合征病毒引发的对虾血细胞和造血组织的程序性凋亡,提高对虾的免疫力[68];饲料中添加毕赤酵母(Pichiapastoris)表达的Fortilin蛋白,能提高对虾的免疫力和感染白斑综合征病毒后的存活率[69];饲料中添加壳聚糖衍生物壳聚糖硫酸酯可以明显提高对虾抵御白斑综合征病毒感染的能力[70];在对虾饵料中包裹可表达VP26融合蛋白的枯草芽孢杆菌(Bacillussubtilis)也能够有效降低对虾免受白斑综合征病毒感染的概率[71]。
2.2 生态防控技术
生态防控是通过生态学手段调控养殖水体的理化因子和生物因子,如生态调控溶解氧、盐度、温度、密度、pH、氨氮、硝态氮等因子,阻断病原体传播途径,达到预防疾病的目的。水体生物因子的控制主要是利用养殖生物间的互利或偏利作用实现的。我国现在流行将对虾与大型海藻、滤食性贝类、肉食性鱼类等进行多营养层次综合养殖,通过改善水质、提高对虾抗病力、清除染病对虾等途径实现更高的养殖效益[72]。生产实践表明,对虾与河鲀混养的防病效果十分明显,河鲀可以摄食感染白斑综合征病毒游泳缓慢的对虾,防止健康对虾残食病虾而感染,客观上起到防白斑综合征病毒扩散的效果[72]。同时应注重调控浮游生物群落结构,压制蓝藻的生态优势,避免蓝藻等与白斑综合征病毒的双重胁迫,降低养殖风险。
此外,高密度对虾养殖系统中菌群结构和多样性对水质和对虾的生物安全都有很大影响。生物絮团是在成熟的集约化养殖系统中,水体悬浮的细菌、残饵、粪团等颗粒有机物絮凝在一起自然形成的团状聚合物[73]。典型的生物絮团以菌胶团或丝状细菌作为基架,通过附着细菌分泌胞外聚合物或静电引力作用而结合。生物絮团中含有多种有益微生物菌群及其分泌产物,如聚-β-羟基丁酸、多糖类等活性物质,对养殖对虾具有促进生长发育和免疫增强作用[74]。基于生物絮团技术构建的零换水、高密度对虾养殖模式,无需过滤、生物基反应、消毒等复杂处理环节,即可直接分解转化养殖动物的代谢物及水体中的氨氮等有害物质。生物絮团中的微生物与病原菌发生空间与营养竞争,可以扰乱病原菌的密度感应系统,从而抑制水体中病原菌生长和繁殖[74]。因此,生物絮团在对虾病害防控中的关键是构建封闭式生物絮团养殖系统,避免引入外源性病原,提高养殖生物安全。
2.3 无特异性病原苗种生产及抗病种群选育技术
自白斑综合征病毒暴发以来,对虾育苗和养成率均较低,严重阻碍其养殖业的健康快速发展,因此在积极研制各种抗白斑综合征病毒药物的同时,引进抗病力强的虾种和开发对虾无毒良种幼苗的培育技术尤为重要。无特异性病原虾苗生产技术是通过建立家系选育无病毒亲本,阻断亲本病毒的垂直传播,保持选育亲本优良性状的统一,最终获得无特异性病原的苗种,从而遏制白斑综合征病毒的危害。无特异性病原技术的应用是控制病害发生的有效手段。我国是对虾白斑综合征的重灾区,得益于1999年引进美国无特异性病原对虾种虾和繁育技术,培育出了无特异性病原虾苗,我国对虾产量也已从1994年低谷期的约6.0×104t恢复到2018年的1.409×106t。目前经过系统人工选育的“黄海1号”中国对虾与“中兴1号”凡纳滨对虾已是通过全国水产原种和良种审定委员会审核的抗白斑综合征病毒新品种。
3 应用前景展望
3.1 加强病毒受体及其封闭剂的研究
病毒感染细胞的第一步是病毒与细胞膜表面的受体结合,无论是抗白斑综合征病毒疫苗,还是抗白斑综合征病毒多克隆抗体和噬菌体展示的单链抗体,针对的都是病毒感染相关囊膜蛋白[75]。因此,通过精准定位并分离病毒受体,筛选出封闭病毒受体的高效药物和方法,进而阻断二者结合,加强相关研究有助于预防和控制包括白斑综合征在内的对虾病毒病。
3.2 加大疫苗给予途径的研究
水产动物疫苗可预防疫病发生,已成为病害防控领域研发的主流产品。在抗白斑综合征病毒感染途径的研究中,目前还没有针对白斑综合征病毒感染开发出持续有效的疫苗接种方法,通过注射、口服、浸浴方式或其中两种方式相结合均能达到一定的抗病毒效果。注射方式需对个体逐一进行,可推广应用于亲虾的抗病防治。浸浴和口服是目前对虾疫苗给予途径的重点研究方向。浸浴则较适用于苗期幼体,但是需要确定免疫原量、提高免疫效果和降低疫苗成本;口服是对虾养殖生产上较为理想的疫苗给予方式,如英国水产养殖疫苗有限公司已开发出AquaVac抗弧菌口服疫苗和AquaVac ERM口服疫苗[64],但有机体消化酶易削弱药饵的抗病毒效果,因此需要开发可以封装疫苗抗原而不损失疫苗效价的方法,如可作为虾苗饵料的转基因蓝藻口服剂具有较高的免疫保护效果且食药同源[76-78],有望应用到对虾口服疫苗的规模化生产中。
3.3 完善疫苗的评价系统
对虾疫苗免疫效果的评价不仅关系到疫苗的本身,而且是对虾疫苗能否进入商品流通领域的关键。评价系统应兼顾疫苗的质量和效果,包括疫苗安全性、免疫保护率、免疫学效应、免疫学指标及流行病学评价。
3.4 建设疫苗中试基地
中试基地是商品性对虾疫苗应市的重要桥梁,也是对虾疫苗再研究的一个重要场地。目前,我国商品性对虾疫苗迟迟未能应市的原因之一就是缺乏中试基地。实验室所研究的疫苗能否真正阻止传染性疾病的流行,需要中试基地的进一步验证,从而实现疫苗产业化与规模化使用。
3.5 注重疫苗佐剂研发
疫苗佐剂是非特异性免疫增强剂,与疫苗抗原共同使用能增强机体免疫应答能力,具有增加抗原表面积、延长抗原存留时间、增强细胞免疫活性、提高抗体水平等重要作用[79]。鉴于疫苗佐剂在水产动物疫苗免疫过程中的重要作用,新型疫苗佐剂的开发和应用可能是对虾疫苗研究的重要方向,包括对虾适宜佐剂的筛选、作用机理阐释、产品开发与效果分析、安全性评价等。

