可控性生物吸收镍合金药物洗脱支架对支架内再狭窄的作用与安全性分析研究
张雷,李多禹,徐辉
冠状动脉粥样硬化性心脏病(coronary atherosclerosis heart disease,简称冠心病)是指以冠状动脉狭窄血管的动脉粥样硬化为特征,导致微血管通道阻塞或部分阻塞,导致局部缺血、缺氧窒息或心肌组织坏死的血管疾病[1-2]。近年来高血压的发病人数逐渐呈现年轻化趋势[3]。世界范围内,冠心病已成为人类慢性病的主要死因。亚太地区人群因冠心病死亡的人数为892 万[4]。目前,冠心病已经成为危害人类生命健康的主要疾病之一,但随着现代医学的不断进步,自1986 年金属支架首次置入冠状动脉以来,经皮冠状动脉介入术(PCI)在临床中得到了极大的推广和应用,大幅度提高了冠心病患者的生存率[5-6]。但PCI 术后的并发症成为临床主要关注的问题,特别是术后支架内再狭窄的发生,其发生机制复杂,一旦形成患者将面临手术失败的风险,而且严重加重患者的经济负担,因此,分析PCI 术后发生支架内再狭窄的风险,采取积极有效手段预防其发生,成为目前临床研究的热点。研究发现,PCI 前的血管疾病特征直接影响介入手术预后,并且某些因素与支架内再狭窄(ISR)形成呈正相关:左冠状动脉主要口狭窄病变的再狭窄率高于其他类型和分支病变[7]。介入手术操作、选用支架种类和匹配程度也在ISR 形成中起到关键作用。镍可以通过多种机制抑制细胞增殖、促进细胞凋亡。本研究将镀镍支架置于新西兰大白兔的腹主动脉,以不锈钢金属裸支架为对照组,以术后30 d为观察终点,对比病理切片动脉内膜增殖情况以观察其有效性,检测细胞凋亡及增殖情况,以探讨其作用机制,并对炎症、损伤、内皮化积分进行测定,同时于术前及术后30 d 查全血常规、肝功能、肾功能指标,取重要脏器观察大体及病理情况以评估系统安全性。现报道如下。
1 材料与方法
1.1 实验动物及分组 选取20 只健康的雄性新西兰大白兔,体重2.5~3.0 kg,4~6 个月龄。实验动物由北京协和医院动物实验科提供。随机分到不锈钢裸支架(316L 不锈钢裸支架,哈尔滨工业大学提供)组(BMS 组)和镀镍不锈钢支架(哈尔滨工业大学提供)组(Ni-BMS 组),每组10 只,支架植入术后30 d 为观察终点。兔子适应性喂养3 d,术前3 d 开始喂服,术前动物严格禁食12 h,准确测量体重。将支架预装于球囊上,所有手术器械消毒后备用。本研究对大白兔的处置符合动物伦理学标准。
1.2 模型制备 实验兔子经耳缘静脉进行麻醉,将25% 浓度的乌拉坦(国药集团化学试剂有限公司)以4 ml/kg 的剂量缓慢静脉推注。于右侧大腿部位备皮,以弯剪剪去手术视野的毛,聚维酮碘消毒后铺无菌巾及孔巾,以巾钳固定,在股动脉搏动明显处上方,沿其走行,将皮肤切开,钝性分离皮下组织、肌肉,剥离股动脉鞘,以更好的暴露股动脉,于其下穿3 条线备用,一条线用于结扎远端股动脉,由于剥离时可能导致股动脉痉挛,给予温热盐水纱布热敷,并于股动脉给予1%利多卡因(中国大冢制药有限公司)局部浸润,对局部血管运动神经的阻断可使血管扩张,以利于插管。应用21G 桡动脉穿刺针直视下穿刺股动脉,成功后,拨出针芯,沿穿刺针送入导丝,拔出针鞘,沿导丝送入5F 桡动脉鞘,进入2~3 cm,为防止鞘管脱出,应用备用线将其结扎于鞘管之上股动脉上方固定,将导丝和扩张器拔出,经动脉鞘管的三通管抽血后待化验,之后将肝素以100 μl/kg 的剂量注入,使其肝素化,防止在血管内走行器械时出现血栓形成。经鞘管送入0.036 cm 导引钢丝至腹主动脉,经动脉鞘三通管注入造影剂,造影确认导丝位于血管真腔内,沿导引钢丝送入球囊导管,将预装支架的球囊导管沿引导钢丝送入腹主动脉下段,距髂动脉分叉处约4~5 cm 处,定位后固定导丝、球囊导管,用造影剂充盈压力泵,加压至6.81~1.42 MPa(8~14 ATM),持续20 s,将装置支架的球囊以1.1~1.2 倍于血管内径的直径比进行扩张,待支架完全贴壁后,将球囊抽成负压后撤出,每只兔子均于支架植入15 min 后重复造影,确认管腔通畅,支架贴壁良好,没有明显撕裂、管壁夹层、栓塞、支架移位及动脉痉挛,退出导丝,术后结扎股动脉,逐层缝合皮下及皮肤组织,于兔的腰椎旁侧的肌肉常规注射青霉素480 万U/d,3 d,预防感染。待动物清醒后送回笼中,如于术后2 d 食欲下降,给予胡萝卜喂养,食欲改善后继续全饲料喂养至30 d。
1.3 标本采集 术后30 d,将2 组实验动物以空气栓塞法处死,经耳缘静脉注射空气20~40 ml,迅速剖腹,取出目标血管,包括支架段血管、支架近端25 mm、支架远端10 mm 段,清除脂肪组织,将5F 桡动脉鞘插入支架近端10~15 mm,用线结扎固定,将动脉鞘管芯拔出,三通管连于250 ml 生理盐水输液器上,将血压计袖带绑于生理盐水袋上,加压至100~120 mmHg,连续灌注,冲洗血管,随着袋中液体减少,适当增加袖带压,保持液体流速基本恒定,确认血管通畅、无陈旧性血栓闭塞后,换用装有4%多聚甲醛的固定液继续加压灌注,持续10~15 min。然后于支架近端10 mm处用眼科剪子剪断。将目标血管应用显微外科刀小心剪成2 个部分,于4%多聚甲醛中固定过夜(不超过24 h),固定好后,为更好观察组织与细胞关系,防止由于支架丝抽出后对内膜的影响,可将一部分血管行有机玻璃包埋及硬组织切片,后行苏木精-伊红染色法(HE)染色。另一部分血管标本,为避免金属支架对免疫组化结果分析的影响,先将血管切成前、中、后3 段,再用显微外科镊子小心抽出支架丝,放入塑料包埋盒,行石蜡包埋及切片,切片厚度4 μm,HE 染色,原位末端标记法(TUNEL)检测细胞凋亡,免疫组化链霉亲和素-生物素-过氧化物酶复合物法(SABC)检测细胞增殖指标。
1.4 检测指标 大体病理:肉眼可见管腔通畅,腔内无血栓形成,支架贴壁良好,于支架表面可见呈半透明样的内膜,无明显增厚。于德国LEICA 共览显微镜25 倍镜下,选取有机玻璃包埋后经HE 染色的切片,拍摄数码相片,并于图片上加标尺,选用Image-Pro-Plus 6.0 图像分析软件校正标尺后,可将测量的像素值转换为实际的几何数值。对于校正标尺定标后测量来说,不同放大倍数要分别应用对应设定的标尺,否则会引起测量值错误。确定标尺后测量及计算内、外弹力膜围绕面积,管腔面积,阳性细胞数及全部有参考价值(area of interest)区域内的全部细胞数。管腔各围绕面积狭窄百分比测定:管腔面积、内弹力板(IEL)面积、外弹力板围绕面积(EEL)、新生内膜面积=IEL 围绕面积-管腔面积、面积狭窄百分比(%)=(新生内膜面积/IEL 围绕面积)×100%;损伤积分:0 分=内弹力板完整,1 分=内弹力板断裂,2 分=内弹力板和中膜断裂,3 分=外弹力板断裂。炎症积分[8]:0 分=无炎症细胞,1 分=散在炎症细胞,2 分=25%~50%血管周径内的支架点被炎症细胞包绕50%,3 分=25%~50%血管周径内的支架点被炎症细胞完全包绕。内皮化积分:0 分=无内皮再生,1 分=小于25% 的管腔面可见新生内皮覆盖,2 分=25%~75%的管腔面可见新生内皮覆盖,3 分=大于75%的管腔被内皮覆盖;中膜细胞增殖细胞核抗原(PCNA)免疫组化结果观测指标:采用SABC 法检测血管内膜、PCNA 免疫组织化学表达以确切的细胞核棕黄色或棕褐色定位阳性。随机选择5 个视野,求平均值。增殖细胞阳性指数(PI)=阳性细胞核数/单位面积全部细胞数。应用图形分析软件行半定量分析,校准标尺,测量单位面积内阳性细胞数及全部细胞数,增殖细胞阳性指数(PI)=阳性细胞核数/单位面积全部细胞数。TUNEL细胞凋亡检测结果观测指标:显微镜下观察到细胞核出现棕黄色或棕褐色为凋亡阳性细胞,随机选取5 个视野测定,计数其中阳性细胞核数,求均数。凋亡细胞阳性指数(AI)=阳性细胞核数/单位面积全部细胞数。
1.5 统计学处理 采用SPSS 24.0 统计学软件对数据进行处理。计量资料用±s表示,组间比较采用t检验。计数资料用百分比(%)表示,组间比较采用χ2检验。以P<0.05 为差异有统计学意义。
2 结果
实验动物情况:在实验中有2 只兔子死亡,其中1 只在导丝行进中遇阻力后旋转导丝并向前推送,此时未感阻力,造影提示导丝位于血管真腔,但见造影剂向血管外弥散,提示可能为导丝穿透血管壁。另一只死于麻醉过度、呼吸抑制。补充2 只实验动物,至观察终点时间内20 只实验动物全部存活,全程未发现急性及亚急性血栓形成情况。
2.1 支架血管壁各围绕面积及狭窄百分比比较Ni-BMS 组术后28 d 的管腔面积大于BMS 组(P<0.05),Ni-BMS 组新生内膜面积小于BMS 组(P<0.05),Ni-BMS 组面积狭窄百分比小于BMS 组(P<0.05)。见表1。
表1 Ni-BMS 组与BMS 组实验动物血管壁各围绕面积及狭窄百分比比较(± s)
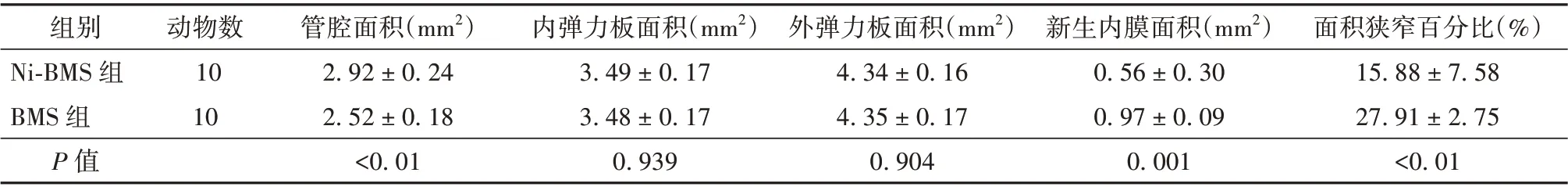
表1 Ni-BMS 组与BMS 组实验动物血管壁各围绕面积及狭窄百分比比较(± s)
注:Ni-BMS 为镀镍不锈钢支架,BMS 为不锈钢裸支架
组别Ni-BMS 组BMS 组P 值面积狭窄百分比(%)15.88±7.58 27.91±2.75<0.01动物数10 10管腔面积(mm2)2.92±0.24 2.52±0.18<0.01内弹力板面积(mm2)3.49±0.17 3.48±0.17 0.939外弹力板面积(mm2)4.34±0.16 4.35±0.17 0.904新生内膜面积(mm2)0.56±0.30 0.97±0.09 0.001
2.2 3 种积分测量比较 Ni-BMS 组与BMS 组的损伤积分、炎症积分及内皮化积分差异均无统计学意义(P>0.05)。见表2。
表2 Ni-BMS 组与BMS 组实验动物3 种积分的比较(分,± s,n=10)

表2 Ni-BMS 组与BMS 组实验动物3 种积分的比较(分,± s,n=10)
注:Ni-BMS 为镀镍不锈钢支架,BMS 为不锈钢裸支架
组别Ni-BMS 组BMS 组P 值内皮化积分2.80±0.42 3.00±0.00>0.05炎症积分1.10±0.32 1.20±0.42>0.05损伤积分1.70±0.67 1.80±0.63>0.05
2.3 细胞增殖、凋亡情况比较 BMS 组的PI(29.25 ± 1.37)大于Ni-BMS 组(18.42 ± 1.46),差异有统计学意义(P<0.05)、Ni-BMS 组的AI(54.38± 10.52)大于BMS 组(25.12 ± 3.45),差异有统计学意义(P<0.05)。
2.4 血液化验指标比较 血常规:红细胞计数、白细胞计数、血小板计数2 组比较未见明显差异(P>0.05),肝功能:谷丙转氨酶、谷草转氨酶2 组比较未见明显差异(P>0.05),肾功能:肌酐值在2 组间比较未见明显差异(P>0.05)。见表3。
表3 Ni-BMS 组与BMS 组实验动物血液指标比较(± s,n=10)
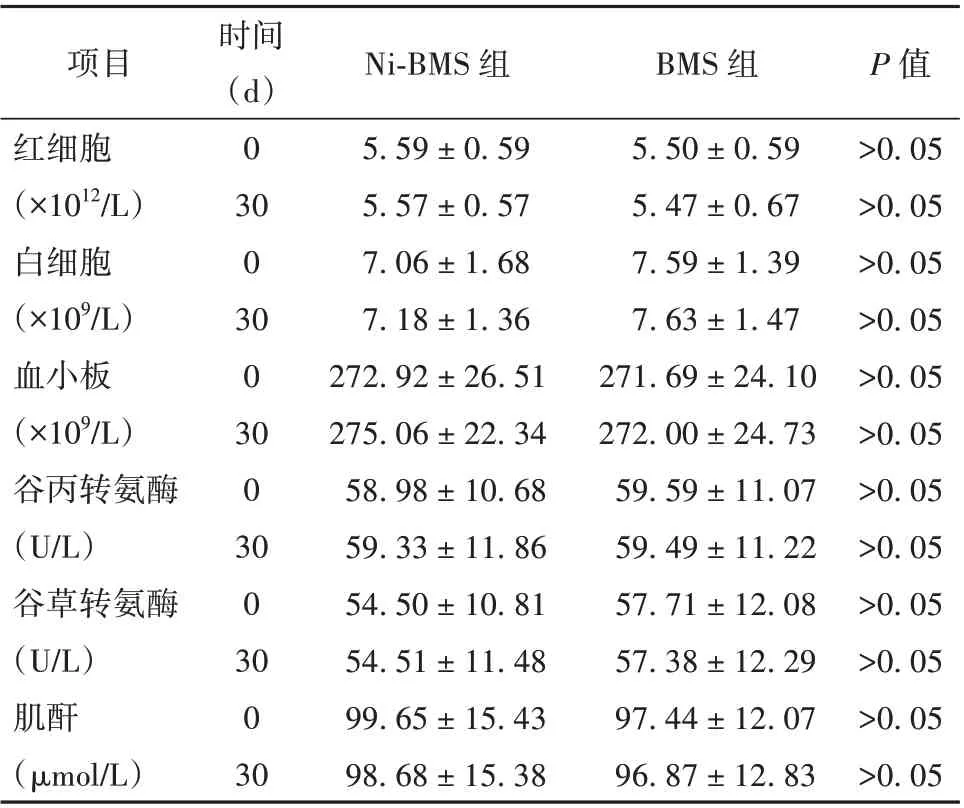
表3 Ni-BMS 组与BMS 组实验动物血液指标比较(± s,n=10)
注:Ni-BMS 镀镍不锈钢支架,BMS 为不锈钢裸支架
项目红细胞(×1012/L)白细胞(×109/L)血小板(×109/L)谷丙转氨酶(U/L)谷草转氨酶(U/L)肌酐(μmol/L)时间(d)0 30 0 30 0 30 0 30 0 30 0 30 P 值>0.05>0.05>0.05>0.05>0.05>0.05>0.05>0.05>0.05>0.05>0.05>0.05 Ni-BMS 组5.59±0.59 5.57±0.57 7.06±1.68 7.18±1.36 272.92±26.51 275.06±22.34 58.98±10.68 59.33±11.86 54.50±10.81 54.51±11.48 99.65±15.43 98.68±15.38 BMS 组5.50±0.59 5.47±0.67 7.59±1.39 7.63±1.47 271.69±24.10 272.00±24.73 59.59±11.07 59.49±11.22 57.71±12.08 57.38±12.29 97.44±12.07 96.87±12.83
2.5 病理观察结果 病理观察2 组支架均未见到亚急性血栓形成、边缘效应、支架表面被覆半透明样内膜,管腔通畅,支架张开良好。所有实验动物处死后迅速取出重要脏器,肉眼见心脏、肺脏、肝脏、肾脏大体形态正常,病理组织学观察各个脏器均未见变性、坏死及炎症反应。
3 讨论
冠状动脉支架是指在管腔内通过球囊扩张形成的支架,放置在冠状动脉病变段,以达到支撑点处血管狭窄和闭塞,减少血管壁良好的弹性肿胀,重塑身体的最终目的,并长期保持更顺畅的流动。一些内支架在预防再狭窄方面也有明显的作用[9].生物医用金属由于其良好的生物功能和加工后的优异性能,成为最早用于支架的材料[10]。裸金属支架是治疗冠状动脉狭窄的有效方法。对于病位位于中、远端和交叉口的其他病理微血管的患者,或易发生血管再狭窄、严重骨化、老年和心功能差的女性患者,药物治疗的安全性较低。然而,裸金属支架往往会引起颈动脉支架处的炎症反应,甚至非常严重的瘢痕增生相关组织炎症,导致动脉再次狭窄,再狭窄率高达30%[11]。
与裸金属支架相比,药物洗脱支架能显著降低支架置入后的再狭窄率,是目前治疗高血压病的技术手段之一[12]。Hong 等[13]的相关研究数据显示,药物洗脱支架不仅可以大大降低血管再狭窄的发生概率,而且不会增加死亡、潜在风险,可以安全有效地应用于急性心肌缺血基底节区的治疗。药物洗脱支架支架对冠状动脉和动脉血管疾病的长期病变也有良好的临床效果。Kaltoft 等[14]的5 年随访研究结果显示,ST 段抬高型心绞痛患者药物洗脱支架相关治疗继发心脏不良事件的并发症发生率显著高于裸金属支架,另一项研究成果对接受口服药物翻转固定器和裸纯金属支架治疗的女性慢性心肌动脉阻塞患者进行了1 年的长期随访,结果表明,口服药物翻转支架应用的技术理想效果明显优于裸金属支架,可显著降低再狭窄率,靶区血液循环修复率提高61%,靶血管内血液循环修复率提高62%,不良事件和心脏并发症的发生率降低了59%,靶动脉疾病发生率降低53%[15]。国外有研究表明,从2000 年到2004 年,药物洗脱固定器的应用比例从0% 上升到54%,再狭窄导致的靶病变血运重建率从9.5%下降到5.5%[16]。
近年来,一些研究表明,在体内镍离子可以引起多种不同的问题,例如癌症、过敏及炎症反应[17-19]。对于植入含镍冠状动脉支架患者来说,镍离子过敏可能和血管内再狭窄存在一定关联[20-21]。同时研究发现金属离子引起的细胞死亡主要方式是凋亡,存在浓度及时间依赖性[22-23]。目前经常使用的支架金属基质包括316L 不锈钢、镍钛合金、钴铬合金以及近年来研究较多的可降解铁、镁合金,在体内的环境中都存在某种程度的金属腐蚀现象。316L 不锈钢支架约含有10%~14% 的镍,镍钛合金含有50% 左右的镍,由于出现某种程度的腐蚀,镍离子会析出。在一些研究中发现镍可以抑制细胞增殖、促进凋亡。Shih 等[24]研究表明采用以镍钛诺丝作为媒介会加速电化学腐蚀,展现出细胞毒性作用,同时改变细胞的形态,镍离子浓度在9×10-6及以上时出现了显著性生长抑制。一些体外研究研究表明增加镍离子浓度当接近29×10-6时可以介导人类气道上皮细胞的凋亡反应[25-26]。Shiao 等[27]首次报告了镍离子在仓鼠卵巢细胞上诱导的细胞凋亡。之后Kim 等[28]研究采用相同浓度的镍离子孵育T 型杂交瘤细胞观察到快速的诱导细胞凋亡。Fuqin Guan 等[29]的研究表明镍离子诱导的细胞凋亡作用呈现时间及浓度依赖性,细胞凋亡率与测得细胞活力数据一致,镍离子的作用大多数是诱导细胞的凋亡。
本研究中,BMS 组炎症积分与Ni-BMS 组差异无统计学意义,提示2 种支架在置入人体后所引起的炎症反应相当。支架置入人体后表面内皮化对血管的愈合十分重要,表面内皮化可以抑制血管平滑肌细胞的增生及迁移。目前,药物支架存在的问题之一为内皮功能障碍,内皮化延迟,部分患者易出现晚期血栓形成。本研究将内皮化积分作为测定指标,发现2 组内皮化积分差异无统计学意义,提示镀镍支架可以完成早期的内皮化。本研究还发现,Ni-BMS 组管腔面积大于BMS 组,新生内膜面积、面积狭窄百分比小于BMS 组,提示镀镍支架在置人后的短期内与金属裸支架相比,具有抑制血管内膜增殖的作用。本研究使用的镀镍支架观察期内未见血栓形成,未见边缘效应、内膜出血及动脉瘤,支架表面愈合良好,提示镀镍支架具有良好的局部安全性及生物相容性。
综上所述,本研究首次采用目前广泛应用的316L 不锈钢作为金属基质,将金属镍电镀于其表面制成新型镀镍不锈钢支架,以316L 不锈钢金属裸支架作为对照组,比较探讨镀镍支架的有效性及安全性,同时以免疫组化PCNA 探讨细胞增殖情况,应用TUNEL 方法比较细胞凋亡情况,以初步探讨镀镍不锈钢支架通过抑制平滑肌细胞增殖,促进其凋亡抑制内膜增生,预防再狭窄的发生机制。镀镍支架表面光滑,全身系统安全性良好,具有较好的生物相容性,同时这种支架无药物失效期,无控制药物释放的聚合物涂层,可以减少再狭窄的发生。

