多房棘球绦虫RNA结合蛋白28的鉴定
寇永杰 ,李 瑞 ,郑亚东 ,夏天奇 ,时恒枝 ,王 璞 ,杨 兴,孙晓林
多房棘球绦虫(Echinococcusmultilocularis)在自然条件下主要寄生在终末宿主狐狸体内,其幼虫多房棘球蚴则寄生在啮齿动物体内。在少数情况下,人因食用了被虫卵污染的食物或水也可以感染,引起多房棘球蚴病,又称泡球蚴病(alveolar echinococcosis,AE)。AE在我国西北牧区是一种比较常见的寄生虫病,传播范围广,致病力强,严重危害牧民的生命健康[1]。在寄生过程中,多房棘球蚴不仅对肝脏造成机械性损伤,也能引起肝脏肿大和脓肿,进而诱发肝癌。由于AE 潜伏期较长,达5~10年之久,且缺乏有效的早期检测方法和有效的治疗手段,使得该病在我国现阶段仍有一定的流行,难以根除[2]。
随着对RNA 分子研究的深入,一类特异结合RNA 分子的蛋白质,即RNA 结合蛋白(RNA binding proteins,RBPs)被发现,它们在多房棘球绦虫的生命活动和寄生虫-宿主互作中发挥重要作用。RBPs是一类与RNA 结合并参与RNA 合成、翻译、剪切和代谢的蛋白质[3]。除了少部分非编码RNA是以核酶的形式存在并发挥作用外,大部分则需要与RBPs结合形成RNA-蛋白质复合物而发挥作用[4]。RBPs的种类有很多,约占细胞总蛋白的6%~8%,但目前只有为数不多的RBPs的生物学功能较为清楚,例如Argonautes蛋白(AGO)、Human antigen R 蛋白(HuR)、RNA 结合 蛋 白Tristetraprolin(TTP)等。这些蛋白主要与RNA 分子发生互作,负责调控甲基化修饰、miRNAs沉默复合体的形成、可变剪切等生物学过程[5-7]。RBPs作为一种多功能调节因子,其修饰及空间构象的改变也可影响与RNA 结合的稳定性,从而引起细胞一系列生物学功能的改变,这些变化往往会导致各种疾病的发生[8-9]。事实证明,RBPs对RNA 的调控作用,还受到一些与RBPs互作的效应蛋白影响。但到目前为止,对多房棘球绦虫RBPs及其互作蛋白质的研究鲜有报道[10]。
本研究通对多房棘球绦虫RNA 结合蛋白编码基因进行分析,发现RNA binding proteins 28(EmuJ_001107900.1,RBP28)是一种在多房棘球绦虫中表达的RBPs。通过制备特异性较高的多克隆抗体,探究了RBP28蛋白在虫体及其细胞内的分布情况。同时利用免疫共沉淀和蛋白质质谱分析技术,初步筛选了潜在与RBP28互作的蛋白质。这有助于进一步解析RBP28与其蛋白质之间的互作关系及其生物学功能。
1 材料与方法
1.1 寄生虫与实验动物 实验所用的多房棘球蚴为实验室保存;新西兰大白兔SCXK(甘)2020-0002购自中国农业科学院兰州兽医研究所。
1.2 主要试剂 原核表达质粒p ET-28a、BL21(DE)感受态细胞均为实验室保存;TRIzol LS Reagent购自美国Ambion公司;IPTG、细胞裂解液和蛋白酶抑制剂购自ThermoFisher公司;HiScript III 1st Strand cDNA Synthesis Kit试剂盒购自南京诺维赞生物科技有限公司;免疫共沉淀试剂购自美国GE公司。
1.3 多房棘球蚴总RNA 和总蛋白的提取 按照RNA 提取试剂的操作步骤,提取多房棘球蚴总RNA,并测定RNA 浓度。虫体总蛋白的提取方法如下:将混有蛋白酶抑制剂的IP 裂解液(1∶100)500μL 与虫体混匀,进行研磨破碎;随后于4 ℃,13 000×g离心20 min,收集上清,测定蛋白浓度。
1.4 RBP28编码基因的扩增、原核表达及重组蛋白的纯化 按照HiScript III 1st Strand cDNA Synthesis Kit试剂盒进行cDNA 合成。根据NCBI数据库中RBP28基因序列设计带有BamH I和SacⅠ酶切位点的引物,上游引物为:5′-GGATCCATGGGGCGGAGGTCAGGG-3′;下游引物为:5′-GAGCTCTTACTTTCCTTTCTTCGG3′-(下标序列为酶切位点序列),PCR 反应体系:96 ℃变性3 min;95℃30 s,57℃40 s,72℃90s,36个循环;72℃10 min。将目的产物连接至p ET-28a质粒,并转入BL21菌株,加入IPTG 进行16 ℃诱导培养。超声破碎后,用Ni-NTA 柱进行蛋白纯化,8% SDSPAGE检测目的蛋白纯度。
1.5 RBP28多克隆抗体的制备及Western blot分析 免疫新西兰大白兔,进行3次免疫接种,每次接种间隔为15 d。45 d后,收集兔血清,用饱和硫酸氨法纯化抗体。利用纯化抗体对多房棘球蚴全虫蛋白和重组蛋白RBP28进行Western blotting检测,将蛋白变性后经10% SDS-PAGE 电泳分离,将制备的抗体作为一抗,以HRP 标记山羊抗兔IgG 作为二抗,进行蛋白鉴定。
1.6 免疫荧光定位 将制备好的多房棘球蚴包囊切片进行脱蜡和抗原修复。PBS清洗后,加0.25%Triton X-100处理15 min,之后加入RBP28多克隆抗体(1∶200)作为一抗,再加AlexaFluor 594标记的山羊抗家兔IgG(1∶2 000),暗盒中37 ℃孵育1 h。滴加DAPI染液,在镜下观察。将多房棘球蚴剪碎后,加入含有胰酶的PBS溶液,37 ℃,消化1 h。将消化后的虫体细胞加入细胞培养皿。细胞贴壁后,弃上清,加入1 mL 4%多聚甲醛,固定30 min,其他步骤同上。同时,设阴性血清作为对照。
1.7 免疫共沉淀与蛋白银染 免疫共沉淀步骤参照PierceTMCo-Immunoprecipitation Kit操作说明书进行。分别设置阴性血清组(G-)和多克隆抗体组(G+)。对免疫共沉淀产物样品在经10%SDSPAGE电泳后,通过银染进行检测。
1.8 质谱分析 将阴性血清组G-和多克隆抗体组G+的产物送至上海生工生物工程股份有限公司。使用Q Exactive Plus液质联用系统进行质谱分析,获得的质谱数据通过ProteinPilot(V4.5)进行检索。对Uniprot(https://www.uniprot.org)和
Worm Base(https://parasite.wormbase.org/index.html)数据库检索时,采用Paragon算法,检索结果以Unused≥1.3为标准进行筛选。
2 结果
2.1 RBP28基因克隆和p ET-28a-RBP28重组质粒的构建、诱导表达及纯化 经RT-PCR 扩增得到与RBP28编码基因大小相同的单一条带,大小为1 245 bp(图1A),且p ET-28a-RBP28质粒成功构建(图1B)。SDS-PAGE 结果显示,重组蛋白在上清中的表达量较高,相对分子质量约为Mr50 000。在纯化过程中,发现以300 mmol/L咪唑进行洗脱时,纯化效果较好(图1C)。
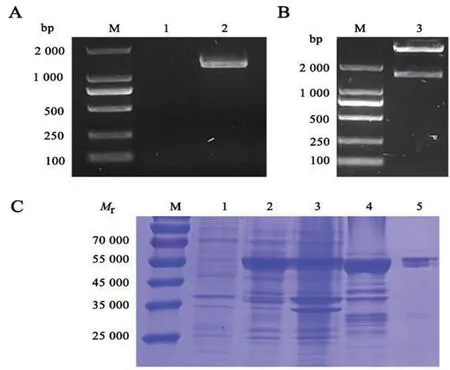
图1 RBP28基因扩增及其诱导表达、纯化Fig.1 Amplification,induced expression and purification of the RBP28 gene
2.2 RBP28多克隆抗体制备及特异性检测 采集血清制备RBP28 多克隆抗体,SDS-PAGE 结果可见重链和轻链(图2A)。Western blot结果显示,无论是纯化的重组蛋白RBP28还是多房棘球蚴全蛋白约在相对分子质量Mr50 000处均出现明显的反应条带,而阴性对照则没有,表明制备的RBP28重组蛋白抗体具有较好的特异性,如图2B 和2C 所示。在细粒棘球绦虫中能够检测到很淡的反应条带,但是条带位置与RBP28不同,然而在猪带绦虫和泡状带绦虫中却没检测到明显的反应条带(图2D),提示RBP28是一种多房棘球绦虫阶段特异表达的RNA 结合蛋白。

图2 RBP28重组蛋白抗体制备及特异性检测Fig.2 Preparation and specificity detection of RBP28 recombinant protein antibodies
2.3 RBP28在多房棘球蚴及其细胞中的分布 对多房棘球蚴组织切片荧光染色发现,RBP28蛋白主要分布在生发层(图3A),而在多房棘球蚴细胞,它则主要分布于细胞质中(图3B),提示它可能在寄生虫生长、发育中发挥作用。

图3 RBP28在多房棘球蚴包囊和细胞中的分布Fig.3 Distribution of RBP28 in E.multilocularis cysts and cells
2.4 免疫共沉淀产物银染及质谱鉴定结果分析 SDS-PAGE 银染显示,RBP28多克隆抗体组(G+)免疫共沉淀产物,与阴性血清组(G-)的相比,条带分布有所不同,特别是在相对分子质量Mr70 000~90 000(图4),可能存在RBP28的互作蛋白。
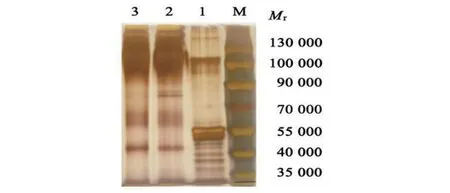
图4 免疫共沉淀产物银染Fig.4 Silver staining of immunoprecipitation products
质谱结果为G-组共获得蛋白215种,而G+组获得蛋白161种。对质谱鉴定结果进行韦恩图分析,发现有24种蛋白是G+组所特有的(图5)。随后通过基因序列及功能比对分析,初步筛选出了7个最有可能与RBP28相互作用的虫体蛋白,包括核糖体产生因子2 同源蛋白(ribosome production factor 2 homolog)、糖蛋白抗原5(glycoprotein antigen 5)、磷酸烯醇丙酮酸羧激酶(phosphoenolpyruvate carboxy kinase)、磷酸甘油醛脱氢酶(glyceraldehyde-3-phosphate dehydrogenase)、14-3-3 蛋白同源物2(14-3-3 protein homolog 2),以及2个未知的保守蛋白,即蛋白Anoctamin 和Expressed conserved protein(表1)。
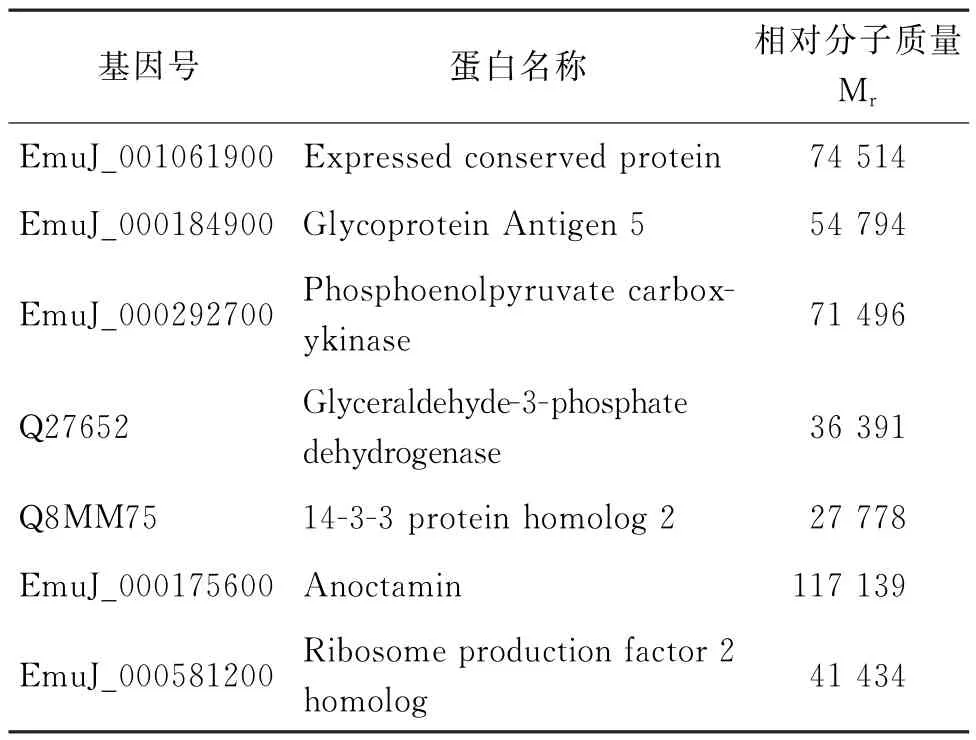
表1 可能与RBP28互作的蛋白质Tab.1 Potential proteins in interaction with RBP28
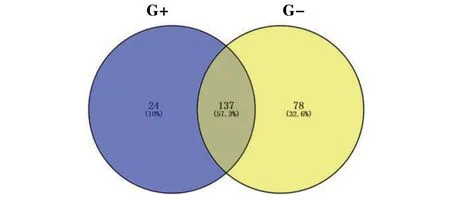
图5 免疫共沉淀产物ESI质谱测试结果韦恩图Fig.5 Venn diagram of ESI mass spectrometry results for immunoprecipitation products
3 讨论
多房棘球绦虫属于圆叶目、带科、棘球属,人和易感动物因误食虫卵污染的食物而感染该寄生虫。虫卵进入到肠胃,激活后突破胃肠道壁进入血液循环,最终定植于寄生部位发育。由于多房棘球蚴特殊的寄生方式,目前对多房棘球蚴的体内发育机制仍不清楚[11]。在生物基因的表达中,RBPs发挥着重要的作用。因此,对于多房棘球绦虫RBPs的研究有助于了解其生长发育。在一些物种和疾病中RBPs已经被发现起到重要的作用,例如研究表明胰岛素样生长因子2 m RNA 结合蛋白家族、Mex-3家族蛋白和Musashi2(MSI2)蛋白家族等一些RBPs与物质代谢、癌症和肿瘤等有着密切的联系[12-14]。此外,RBPs在寄生虫的生长发育中也发挥作用。研究表明,布氏锥虫(Trypanosomabrucei)RBP10(RNA binding protein 10)在促进布氏锥虫的形态分化的过程中起到关键作用[15]。本实验中,我们选择多房棘球绦虫RBP28作为研究对象,通过原核表达、纯化、制备特异性多克隆抗体等证实,制备的RBP28多克隆抗体能够识别多房棘球蚴全虫蛋白中的天然RBP28,与泡状带绦虫和猪带绦虫全虫蛋白不反应,只与细粒棘球绦虫全虫蛋白有着微弱的反应,并且反应条带位置不同,表明RBP28可是一种多房棘球绦虫幼虫阶段特异表达的RNA 结合蛋白。
目前大部分研究集中于分析RBPs与RNA 分子之间的相互关系,以了解RBPs如何调控RNA分子,以及这种调控对于维持细胞正常生理活动的作用。一些研究发现,RBPs对特定RNA 分子调控时,存在一些与RBPs类似作用或辅助作用的效应蛋白,很大程度上参与并影响RNA 分子与RBPs之间的互作[16]。例如,人多聚嘧啶结合蛋白1(PTBP1)与lncRNA SNHG6(small nucleolar RNA host gene 6)的结合,受到PTBP1互作蛋白赖氨酸甲基转移酶(SETD7)的影响,通过竞争性抑制作用来调控PTBP1 与lnc RNA SNHG6 之间的结合,进而影响肝癌的发生[17]。为了发现与RBP28互作的蛋白,本研究以RBP28蛋白作为诱饵,在多房棘球蚴全虫蛋白中筛选互作蛋白。由于多房棘球蚴蛋白质组成复杂,而且本实验所使用的抗体为多克隆抗体,难免会有一些非特异性的吸附。为了确保实验的可靠性,我们采用对兔IgG 有较高结合能力的免疫共沉淀Protein G 磁珠,有效降低非特异性结合的影响。
在质谱的结果中,我们发现有24个蛋白是G+组所特有的。经过蛋白序列对比和功能预测,我们共筛选出7种可能与RBP28存在互作的蛋白。其中,磷酸烯醇丙酮酸羧激酶和磷酸甘油醛脱氢酶是参与细胞内糖代谢的主要蛋白酶,能够为细胞内生理活动提供ATP 和供氢体NADPH。我们推测这2种酶可能为RBP28结合并调控靶标RNA 分子的过程中提供必要的能量[18-19]。糖蛋白抗原5和14-3-3蛋白同源物2 具有信号传导和蛋白质水解功能,可能与RBP28蛋白的生物活性有关[20-21]。核糖体合成因子2 同源蛋白属于核糖体蛋白家族,在RNA 的翻译、转运和多肽的合成方面具有重要的作用。核糖体蛋白也可以作为一种RBPs[22-23],它与RBP28的互作可能对于r RNA 的生物功能具有一定影响。RBP28与这些蛋白的互作及其生物学功能还需进一步研究。上述研究结果为进一步探究多房棘球绦虫RBP28与其互作蛋白的关系和分子机制提供了一定的参考。
利益冲突:无
引用本文格式:寇永杰,李瑞,郑亚东,等.多房棘球绦虫RNA 结合蛋白28的鉴定[J].中国人兽共患病学报,2022,38(6):490-495.DOI:10.3969/j.issn.1002-2694.2022.00.072

