CT肝脏灌注成像对PHC患者TACE术后血流状态的评估
孟明明,董 健,刘福全,刘 红*
1.首都医科大学附属北京世纪坛医院消化内科,北京 100038;2.首都医科大学附属北京世纪坛医院普通放射科CT室,北京 100038;3.首都医科大学附属北京世纪坛医院介入治疗科,北京 100038
原发性肝癌(PHC)属于临床上常见的恶性肿瘤,国内外研究指出,肝癌的发病率位居全球常见肿瘤的第五位,死亡率位居第三位,其发病率仍呈现逐年上升的趋势,目前我国肿瘤疾病中肝癌致死率位居第二位[1-3]。肝动脉化疗栓塞术(TACE)是临床上治疗肝癌的常见介入方式,在PHC的治疗中已广泛应用,术后肿瘤组织的内部及四周血供情况,对于患者后续的治疗情况影响较大[4,5]。肿瘤新生血管的形成在促进恶性肿瘤细胞增殖和侵袭的过程中发挥了重要的介导作用,微血管密度(MVD)是评估肿瘤新生血管形成的重要参考,而血管内皮生长因子(VEGF)可以通过诱导新生血管的形成提高MVD水平,进而促进肿瘤病灶的扩散和侵袭。CT肝脏灌注成像属于功能影像学的检查范畴,可较好地呈现器官组织中的血流动力学变化,其准确性及可重复性均较好[6]。目前,临床上较少CT肝脏灌注成像对PHC血供特点观察及评价TACE血流灌注状况的相关研究,因此,本研究主要探讨CT肝脏灌注成像对PHC血供特点的观察及评价TACE干预后血流灌注状况的价值。
1 资料与方法
1.1 一般资料
本研究纳入2019年6月至2020年6月我院经肝活检证实为PHC的患者70例。纳入标准:患者均符合《原发性肝癌规范化病理诊断指南(2015年版)》[7]中相关标准,具有TACE适应证,同意进行TACE治疗。排除标准:黄疸;腹腔积液;门静脉主干完全闭塞;凝血功能障碍;严重心肺功能不全;精神类疾病;肝脏过大,超过扫描范围;既往有生物、免疫治疗患者;预计生存时间<3个月;碘造影剂过敏者。其中男46例,女24例,年龄38~64岁,平均年龄(49.65±6.95)岁,Child-Pugh分级[8]情况:A级43例,B级27例。本研究获得我院伦理委员会批准,所有患者均签署知情同意书,诊疗中保证患者隐私及安全。
1.2 方法
CT肝脏灌注成像。于TACE干预治疗前、后进行CT肝脏灌注扫描,取仰卧位,指导患者调整情绪及呼吸,进行肝脏平扫,确定肿瘤病灶位置,选择区域作为灌注扫描层面,动态扫描层覆盖病灶及门静脉,设置参数:管电压100 kV,层厚5 mm,电流200 mA,矩阵512×512,4 mL/s速率团注1.0 mL/kg碘对比剂,延迟8 s,动态扫描,数据传入西门子处理站,处理后得到时间-密度曲线(TDC)及相关参数,参数应用斜率法计算,包括肝血流量(HBF)、肝动脉灌注指数(HPI)、达峰时间(TTP)及肝动脉灌注量(HAP)。为减少偏倚,计算时采用不同层面的多次测量,取平均值,为最终结果。
治疗方案。常规消毒后,给予TACE治疗的患者进行局部麻醉,应用Seldinger技术进行经皮穿刺股动脉插管至肝动脉选择性造影明确肿瘤供血动脉、肿瘤大小、形态、数目及供血情况。注入碘油10~30 mL、吡柔比星20~60 mg,注射时间>20 min,在透视监视下缓慢行肝动脉化疗栓塞,然后用明胶海绵碎屑加强栓塞直至血流减慢,栓塞剂量根据肝动脉显示肿瘤大小及血管富乏程度而随之调动。
血供评估。(1)进行数字减影血管造影(DSA)检测,将导管选择性地插管至患者的腹腔肝动脉、膈下动脉、肝动脉进行检查,以微导管插至患者疑似肿瘤滋养动脉进行检查,应用碘帕醇为对比剂,依照DSA的检查结果及染色结果进行判定,病灶血供判定标准为局部肿瘤染色。(2)进行CT肝脏灌注成像检测,活性病灶血供评估标准为高肝动脉血流量表现为红色或黄色,低门静脉灌注值呈现蓝色或紫色,高肝动脉灌注指数呈现红色或黄色。
MVD、VEGF检测。取患者病理标本,应用免疫组法进行检测VEGF水平,结果判定以染色强度及阳性细胞数占比评分之和进行评估。MVD计数方法参照Maeda,在光镜(100×)下选取染色后表现为棕褐色的高血管密度区域,将光镜调至(200×),进行记录MVD的值,选取3个区域,计算平均值为最终的结果。
临床疗效根据实体瘤疗效评定标准[9]进行评估。根据实体瘤大小(满分为30分,2个垂直直径乘积分)、卡氏积分(30分)、生存期(20分,1分为3个月)和临床症状(20分)评分,4项相加得总积分,总分≥50为有效,其余为无效。
1.3 统计学处理
数据采用SPSS 19.0统计软件进行分析处理。计量资料比较分别采用两独立样本t检验和配对t检验;计数资料采用百分率(%)表示,组间比较采用χ2检验;诊断效能分析采用受试者操作特征(ROC)曲线;P<0.05为差异具有统计学意义。
2 结果
2.1 TACE干预前后CT肝脏灌注成像分析
如图1所示,TACE介入术前横断面增强扫描癌灶明显不均匀强化,经TACE介入术后残余活性病灶的CT图像显示碘油沉积良好。
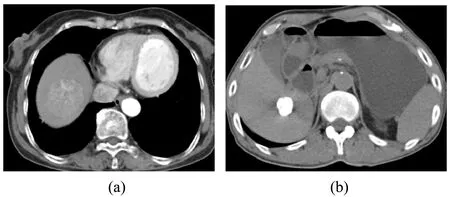
图1 治疗前(a)与治疗后(b)CT肝脏灌注成像
2.2 肿瘤活性灶与非瘤区组织CT肝脏灌注成像参数比较
如表1所示,与非瘤区组织相比,肿瘤活性灶HBF、HPI、HAP较高,TTP较低,差异具有统计学意义(P<0.05)。
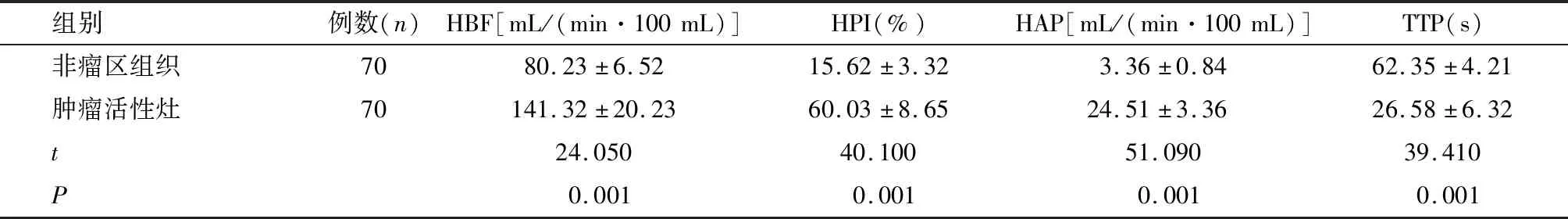
表1 肿瘤活性灶与非瘤区组织CT肝脏灌注成像参数比较
2.3 经TACE干预前后MVD、VEGF结果比较
如表2所示,与无效患者相比,有效患者MVD、VEGF较低,差异具有统计学意义(P<0.05)。

表2 不同临床效果MVD、VEGF结果比较
2.4 经TACE后患者活性病灶血供比较
如表3所示,与DSA相比,CT肝脏灌注成像无血供情况较多,但两者相比差异无统计学意义(P>0.05)。

表3 经TACE后患者活性病灶血供比较
2.5 MVD、VEGF与CT肝脏灌注成像参数相关性
如表4所示,经相关性分析显示,HBF、HPI、HAP与MVD、VEGF均呈正相关,TTP与MVD、VEGF呈负相关,差异具有统计学意义(P<0.05)。
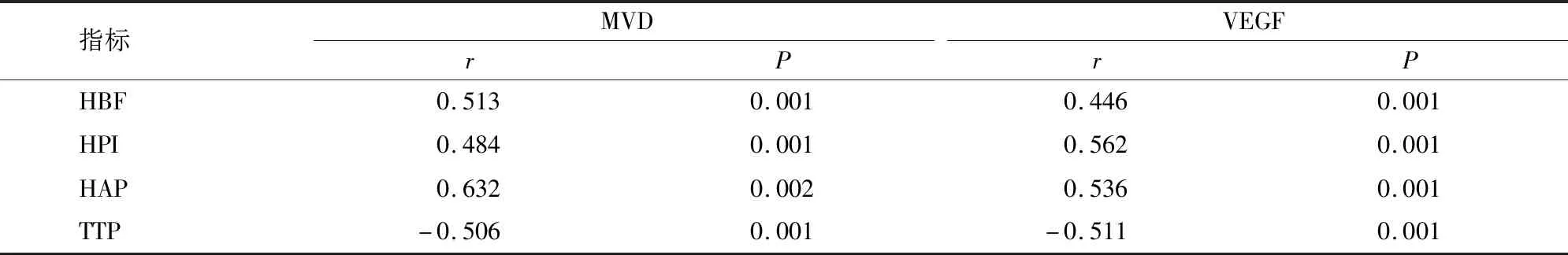
表4 MVD、VEGF与CT肝脏灌注成像参数相关性
2.6 TACE干预前后患者CT肝脏灌注成像参数比较
如表5所示,与干预前相比,干预后HBF、HPI、HAP较低,TTP较高,差异具有统计学意义(P<0.05)。
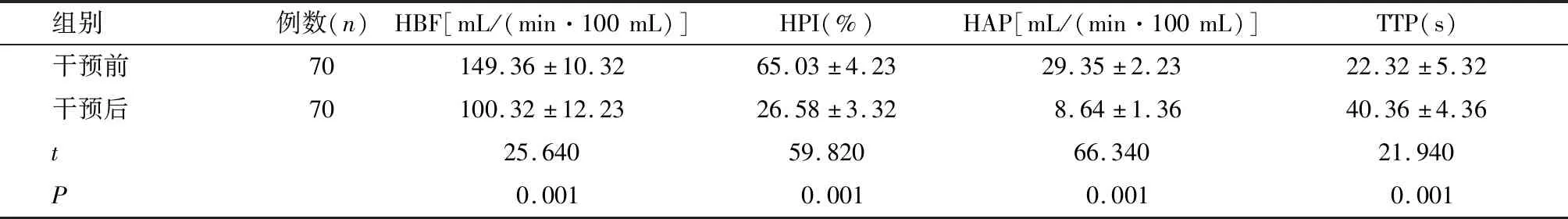
表5 TACE干预前后患者CT肝脏灌注成像参数比较
2.7 CT肝脏灌注成像参数对PHC患者近期疗效的价值
HBF、HPI、HAP和TTP四项联合的ROC曲线下面积(AUC)为0.940,对PHC患者近期疗效的诊断效能较高(P<0.05)。见表6。
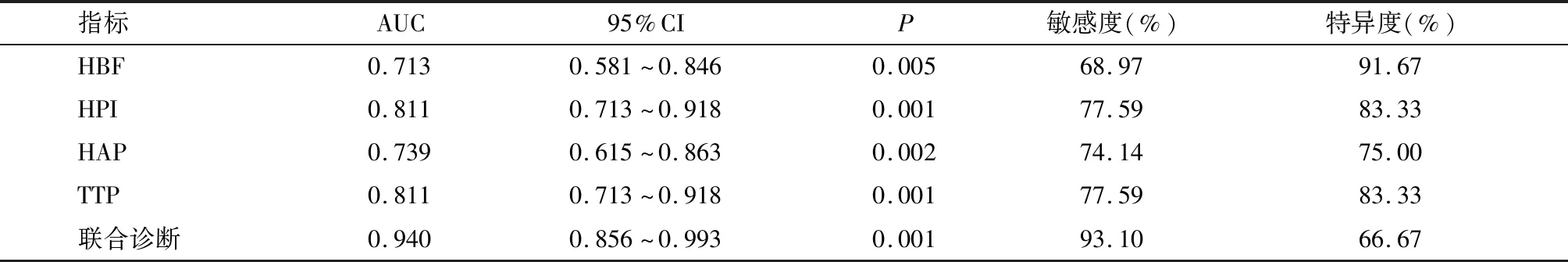
表6 CT肝脏灌注成像参数对PHC患者近期疗效的价值
3 讨论
肝癌的发生与多种因素,常见因素包括病毒感染、环境、遗传等因素,依据其来源分为PHC与继发性肝癌,PHC较为多见,早期起病较为隐匿,临床症状不明显,进展较快易发生早期转移等特点,因此,早期诊断及治疗对于PHC患者较为重要[10-12]。
目前,对于PHC患者的治疗中,TACE已经广泛应用,但其临床疗效及血流灌注情况仍是临床研究的重点。既往研究大多从肿瘤的病灶形态、大小进行评估治疗疗效,对于血供及灌注情况的变化容易被忽视[13]。血管生长是肿瘤进展的关键,肿瘤生长较为活跃时,新生血管及组织的血管建立侧支循环,病早期血流灌注增加,TACE通过栓塞病灶血供,使病灶缺氧,致坏死,进而减少血流量[14]。VEGF属于PHC肿瘤细胞特异性生长因子,可对肿瘤细胞的增殖及血管生长起到促进作用。有研究指出[15],TACE可闭塞肿瘤血管,但血管内皮细胞坏死会导致机体促肿瘤细胞的相关因子VEGF等表达上升,加速癌组织中血管新生。另有学者研究显示[16],TACE治疗后,瘤区肿瘤的新生血管数减少,HPI较治疗前有所降低,HPI与MVD及VEGF关系密切,VEGF表达升高,可上调MVD,增加HPI。本研究结果显示,HBF、HPI、HAP与MVD、VEGF具有相关性,本研究结果与上述学者结果一致。另外本研究结果显示,经TACE治疗后,有效的患者其MVD及VEGF评分均降低。MVD及VEGF评分降低是抑制肿瘤增殖的重要环节。
DSA可较为清晰地反映新生肿瘤血管情况,准确性较好,但其对机体的损伤较大,属于有创检查,婴儿对于短期内评判TACE的临床疗效不甚理想[17]。CT肝脏灌注成像仅需一次扫描就可获得肝脏灌注情况,全面、准确地进行病灶评价[18]。本研究结果显示,以DSA为“金标准”,CT肝脏灌注成像检查PHC患者后活性病灶血供具有一致性,CT肝脏灌注成像可较好地反映PHC患者介入术后活性病灶血供情况。CT肝脏灌注成像属于无创评价组织器官血流灌注的影像学手段,可较好地反映微循环的情况,进而对肿瘤血管生成以及治疗效果进行间接评估。CT灌注通过对静脉团注对比剂,选择层面,进行扫描,计算灌注参数,显示解剖细节[19,20]。肝癌属于富血供的实体肿瘤,其发生、发展及TACE的治疗效果均与新生血管生成及血供的变化关系密切,可较为直观地评估PHC治疗后血流灌注的特征,进而评估治疗效果[21,22]。本研究中,PHC患者肿瘤活性灶HBF、HPI、HAP较高,TTP较低,可能是由于新生血管不规则,进而造成其灌注成像参数出现异常。另外本研究结果显示,TACE治疗后,患者HBF、HPI、HAP较低,TTP较高。血管生长致使肿瘤病灶呈现为高灌注的状态,HBF、HPI上升,TTP提前出现,TTP延长则提示TACE可抑制肿瘤生长。经ROC分析显示,HBF、HPI、HAP、TTP参数均对PHC患者近期疗效具有一定价值,但联合诊断效能较高,说明CT肝脏灌注成像参数联合可较好地评估PHC患者近期疗效,具有较高的临床价值。
综上所述,CT肝脏灌注成像参数对PHC患者近期疗效具有较高的诊断价值,可较好地反映经TACE治疗后PHC患者血流状态,为后续治疗方案的选择提供依据。但是本文研究样本较少,因此仍需后续进一步的研究。

