3,3′-二吲哚甲烷通过PI3K/AKT/NF-κB通路抑制肝星状细胞的活化
黄冰,杨光宇,张岩,李文学,庞雅琴
(1. 广东省广州市疾病预防控制中心毒理与生化检验科,广东 广州 510440;2. 右江民族医学院,广西 百色 533000)
酒精性肝病(alcoholic liver disease,ALD)是由于长期大量的摄入乙醇而导致肝脏损伤。初期表现为酒精性脂肪肝,进一步演变为酒精性肝炎、酒精性肝纤维化、酒精性肝硬化,甚至可以发展为酒精性肝癌[1]。酒精性肝纤维化是ALD进展过程中的关键病理学阶段,肝星状细胞的激活是肝纤维化形成的中心环节[2]。但目前ALD发病过程中,乙醇如何影响肝星状细胞的激活的机制尚未完全明确。而且,目前也尚无有效地针对肝星状细胞激活的特异性治疗药物,因此找到乙醇诱导肝星状细胞激活的机制,并寻找一个能够抑制其激活的药物成为改善酒精性肝纤维化的一个研究方向。
吲哚-3-甲醇(indole-3-carbinol,I3C)是一种确定的肿瘤化学预防物质,可从十字花科蔬菜如萝卜、芹菜、花椰菜等中提取而得[3]。3,3′-二吲哚甲烷(3,3′-diindolylmethane,DIM)是I3C在胃酸等酸性条件下发生低聚而得到的二聚物,其抗癌和抗炎症能力已在多个细胞模型中得到证实[4]。然而对酒精性脂肪肝,DIM是否能够抑制的乙醇诱导的肝星状细胞的激活作用少见报道。因此本研究采用小鼠原代肝星状细胞,观察DIM对乙醇诱导肝星状细胞激活的抑制作用,并初步探讨其作用机制,以期为预防和治疗提供新的理论依据。
1 材料与方法
1.1 动物和试剂 雄性C57BL/6J小鼠共2只,购自广东省医学实验动物中心[许可证号:SXK(粤)2013-0002],6~8周龄,20~22 g,饲养条件室温22~25 ℃,相对湿度55%~60%。抗体购自Cell Signaling Technology公司(美国),培养基、胎牛血清、青霉素/链霉素、蛋白酶和胶原酶购自GIBCO公司(美国),链霉蛋白酶、Nycodenz和DNase I购自Sigma公司(美国),Western blot 预制胶购自Life公司(美国),Tizol购自invitrogen公司(美国),QPCR试剂盒购自Takara公司(日本)。
1.2 肝星状细胞的分离 取2只小鼠,戊巴比妥钠麻醉小鼠,暴露肝脏及下腔静脉,留置针插入下腔静脉,依次灌流乙二醇双(2-氨基乙基醚)四乙酸(EGTA)、链霉蛋白酶、胶原酶溶液,灌流结束后取下肝脏,将切碎的肝脏转移到预温的含有1% DNase I的链霉蛋白酶/胶原酶混合液中,体外消化25 min,将细胞混合液通过100 μm滤网过滤。采用Nycodenz溶液进行梯度离心。离心结束后,用5 mL的吸管收集细胞,转移至新的50 mL离心管。580 g、4 ℃离心10 min,抽吸上清液,DMEM培养基重悬细胞,计数,按(2~4)×105个/毫升,接种在6孔板中。
1.3 肝星状细胞的处理 将肝星状细胞以80%的浓度均匀接种到96孔板中,然后放置培养箱内过夜培养,让细胞完全贴壁,细胞贴壁后,使用不同的浓度乙醇(25 mM、50 mM、100 mM、200 mM、400 mM、800 mM和1600 mM)和DIM(5 μM、10 μM、20 μM、40 μM、80 μM、160 μM和320 μM)及不同时间(24 h、48 h和72 h)分别处理和观察细胞,并将不同浓度的乙醇处理组内的24 h设置为组内对照细胞处理,完成后,分别检测肝星状细胞在不同乙醇计量组内各个时间点上的细胞活性。
1.4 细胞毒性检测 取处于对数生长期的细胞,按0.5×104个/孔接种于96孔培养板中,在含有10% FBS、1% P&S的DMEM完全培养基中,置于37 ℃、5% CO2及饱和湿度的细胞培养箱中过夜。给予受试物处理。处理完毕后先观察细胞的形态和数量上的变化,之后每孔加入100 μL无血清的DMEM完全培养基,再加入10 μL CCK-8试剂,37 ℃孵育1~2 h后,用全自动酶标仪测定各孔的吸光度OD值(实验波长为450 nm)。以对照孔吸光度值(AC)为参照,根据各处理组样本孔的吸光度值(AT),计算细胞活力和抑制率。
1.5 免疫细胞化学和细胞免疫荧光 分离肝星状细胞,按(2~4)×105个/毫升,接种到赖氨酸包被的盖玻片上,细胞处理完毕后,用甲醇固定,Triton X-100透化,用1% BSA封闭,用一抗孵育过夜后,二抗室温孵育1 h,按照DAB显色试剂盒配制DAB染色液,显微镜下对切片进行染色,在镜下看到变色即可停止染色,PBS清洗10 min,苏木精染核5 min,自来水冲洗10 min,脱水透明,中性树胶封片。免疫荧光采用荧光二抗,DAPI染色后封片,荧光显微镜下观察。
1.6 Western blot 将细胞用PBS清洗2次,刮取细胞,2 000 r/min离心10 min,加入细胞裂解液,吹打混匀,将样本放置在冰上裂解,裂解结束后4 ℃ 12 000 r/min离心10 min,取上清-80 ℃保存。将细胞蛋白浓度定量到2 μg/μL数值,加入4×蛋白上样缓冲液(LDS),80 ℃金属浴变性5 min。采用10% Bis-Tris预制胶跑胶。按照“三明治”结构方式组装转膜夹,转膜结束后,用5%脱脂奶粉封闭1 h,一抗4 ℃摇床孵育过夜。加入二抗常温孵育1 h,滴加ECL显影液显影,用Image J分析条带灰度值,用目的条带灰度值进行分析。
1.7 荧光定量 RT-PCR取培养细胞,加入1 mL Trizol,打碎吹匀。加入200 μL氯仿,剧烈震荡30 s,充分混匀后室温静置5 min,出现分层后,4 ℃ 12 000 r/min离心15 min。取上层液体,加入400 μL的异丙醇,12 000 r/min离心15 min。加入1 mL 75%冰乙醇重悬RNA沉淀,4 ℃,12 000 r/min离心10 min。离心后弃上清,加入100 μL RNase-free水充分溶解RNA。利用Takara逆转录试剂盒进行单链cDNA的合成,将样品统一稀释成0.5 g/L的浓度,配置20 μL体系,充分混匀后,37 ℃ 加热15 min,95 ℃,5 s灭活逆转录酶。 配成PCR反应液,总量为5 μL。引物序列见表1:先用排枪加引物混合液1 μL,再加cDNA与SYBR Green的混合液。反应条件:94 ℃预变性2 min,然后按94 ℃ 30 s,65 ℃ 1 min在实时荧光定量PCR仪器V7上进行39个循环,结果采用2-ΔΔCt值进行分析。

表1 试验中采用的引物序列
1.8 统计学方法 采用SPSS 17.0软件进行分析,多组资料间比较采用方差分析,P<0.05为差异有统计学意义。
2 结果
2.1 肝星状细胞分离培养 按照分离步骤成功分离小鼠肝星状细胞,24 h贴壁后观察细胞,胞浆透亮富含脂滴,在培养过程中细胞伸出伪足(见图1A),采用星状细胞特异性的表达蛋白Desmin抗体检测星状细胞的纯度(见图1B),绝大部分细胞呈阳性,纯度达到95%以上。
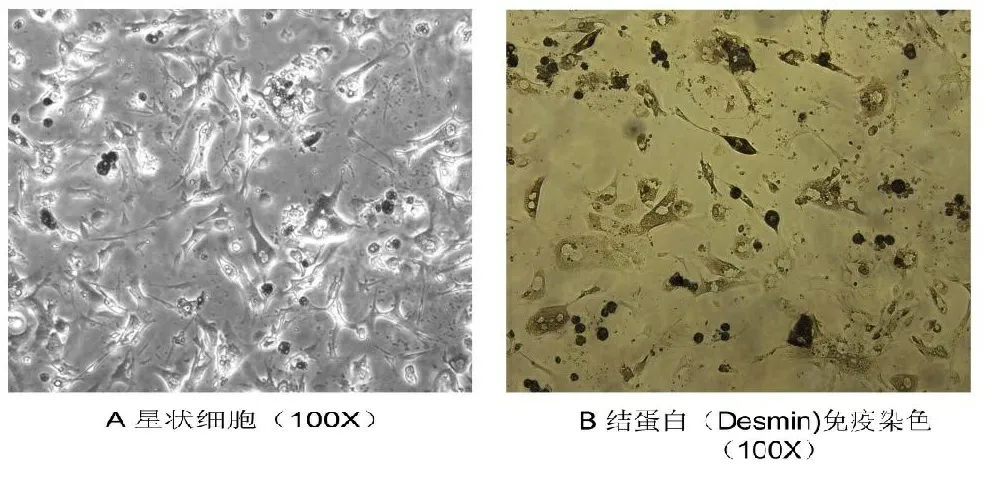
A. 正常培养条件下原代HSC的状态;B. Desmin抗体免疫组化分析纯度。
2.2 乙醇的细胞毒性和DIM的有效工作浓度的确定 原代HSC暴露乙醇24 h后,从200 mM开始,随着乙醇浓度的增高,HSC的存活率逐渐下降;当乙醇浓度在800 mM时,HSC细胞的存活率为对照的70%(P<0.05);暴露48 h后,从200 mM开始,HSC的存活率开始下降到81%(P<0.05),当浓度在800 mM时,HSC的存活率为50%(P<0.05);暴露72 h后,100 mM的浓度也引起细胞活力的下降,到90%(P<0.05);因此在50 mM的浓度下,乙醇对HSC的毒性较小,染毒浓度确定为50 mM,见图2。高剂量的DIM对HSC也有一定的细胞毒性,图2所示,暴露DIM 24 h和48 h后,从20 μM开始出现增殖抑制,暴露72 h后,20 μM出现较为显著的毒性,增殖率为对照的95%(P<0.05),结果表明在<20 μM的浓度范围内,DIM对HSC的毒性较小,细胞存活率在95%以上,所以确定10 μM作为DIM的有效工作浓度。
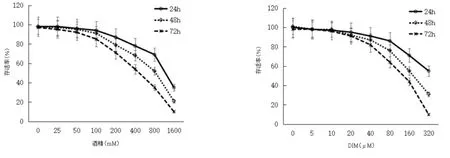
图2 乙醇和DIM对HSC增殖的影响(与对照组相比)
2.3 DIM对乙醇诱导HSC活化后标志物的影响 A-SMA是星状细胞激活的标志蛋白,通过检测乙醇暴露后对星状细胞的a-SMA水平的影响,来观察乙醇对星状细胞的激活作用,结果见图3。通过a-SMA的免疫荧光可以看到50 mM乙醇处理后,明显增加了a-SMA的含量,同样,QPCR的结果也显示,乙醇暴露诱导HSC中a-SMA的水平增加了7倍多(P<0.01)。而单独DIM的暴露对a-SMA的水平无显著的影响。但DIM显著缓解了乙醇诱导的a-SMA的水平如图3所示,QPCR的结果也证实,DIM和乙醇联合处理后,a-SMA的水平比乙醇单独处理组降低了50%。
2.4 DIM抑制乙醇诱导星状细胞活化的机制探讨 PI3K/AKT/NF-κB信号通路在肝纤维化形成过程中起着重要的作用,乙醇单独暴露后,明显增加了PI3K、AKT和NF-κB的磷酸化水平(P<0.05),对总的蛋白水平影响不大,见图4。DIM单独处理对PI3K、AKT和NF-κB的磷酸化水平和总的蛋白水平影响不大。DIM和乙醇联合处理后,与乙醇单独处理组相比明显降低了PI3K、AKT和NF-κB的磷酸化水平(P<0.05),对总的蛋白水平影响不大,见图4。
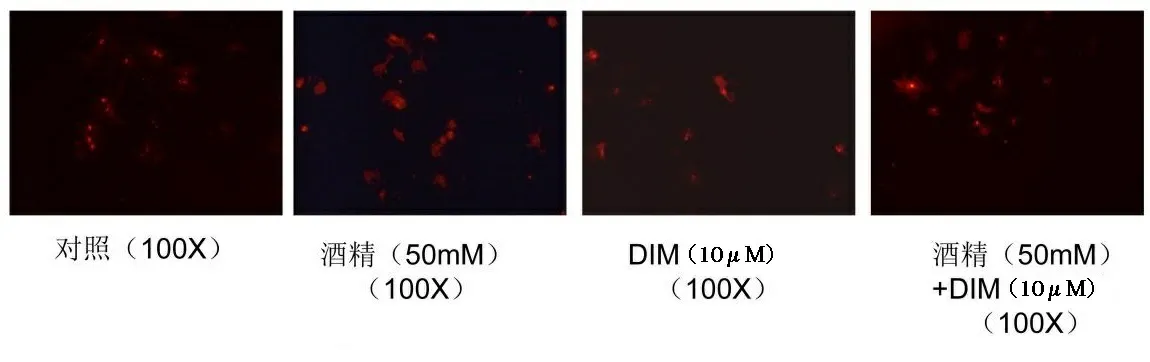

*表示乙醇组与对照组相比,n=3,P<0.05;#表示乙醇+DIM组与单纯乙醇组相比,n=3,P<0.05。
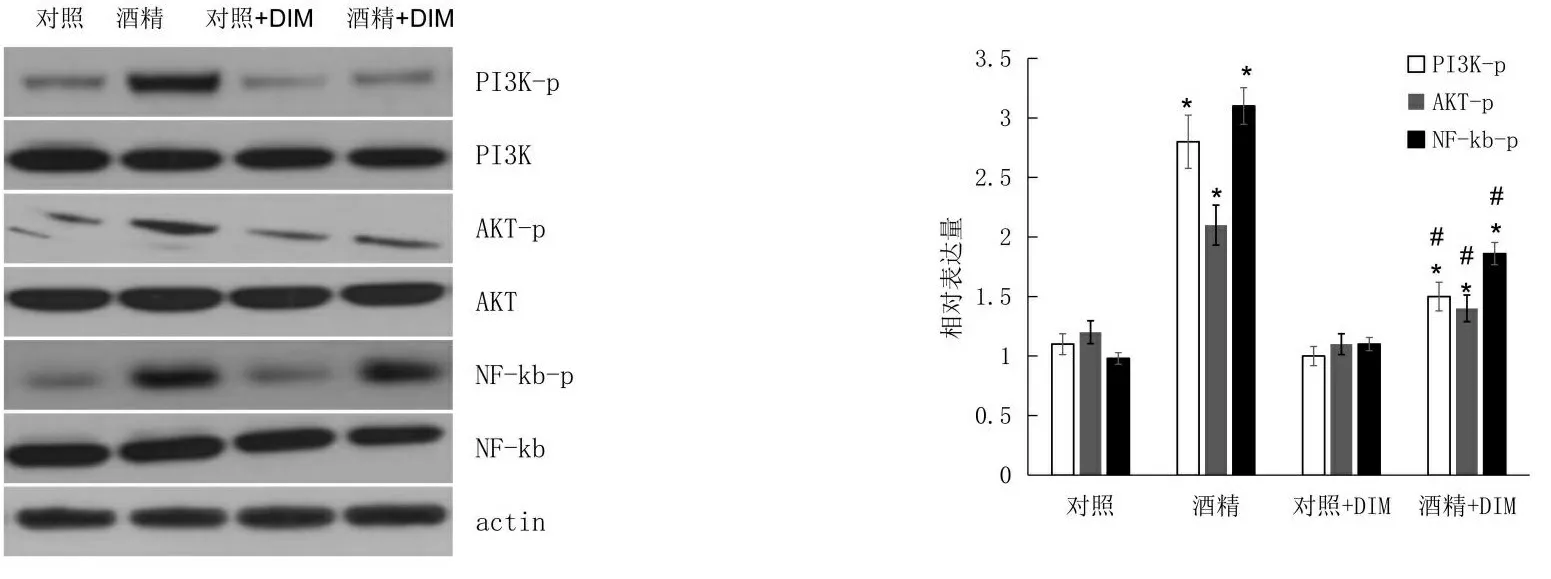
*表示乙醇组与对照组相比,n=3,P<0.05;#表示乙醇+DIM组与单纯乙醇组相比,n=3,P<0.05。
3 讨论
酒精性肝纤维化是ALD病程中重要的病理改变,肝星状细胞在其中起着重要作用,乙醇暴露能够引起肝细胞损伤之外,还能够激活星状细胞,成为分泌α-平滑肌肌动蛋白的收缩肌成纤维细胞,并在肝脏受损部位大量活化增殖,引起肝纤维化[5-7]。因此,通过抑制星状细胞的活化和增殖可逆转肝纤维化的发生发展。本实验结果也显示乙醇暴露后,引起星状细胞形态改变,a-SMA表达增加并向成纤维细胞分化。研究发现DIM作为一种具有生物功能的植物化学物能够抑制炎症,调节免疫,抑制肿瘤细胞增殖[8-10],本研究发现DIM还能够抑制乙醇诱导的星状细胞的激活,降低了a-SMA的表达水平。表明DIM能够作为一种改善酒精诱导肝纤维化的候选药物之一。
研究表明PI3K/AKT信号途径在肝星状细胞的生长、增殖和分化及激活过程中起重要的调控作用[11-13]。体外实验发现活化的星状细胞中PI3K/AKT信号通路被明显激活,给予PI3K/AKT通路抑制剂后,能显著抑制星状细胞增殖分化,降低a-SMA等活化星状细胞标志蛋白的表达[14]。此外,PI3K/AKT信号通路通过直接或间接调控细胞凋亡相关分子或蛋白的表达,参与细胞凋亡的调控[15]。本研究发现乙醇暴露后激活了PI3K/AKT信号通路,因此可以推断乙醇可能通过PI3K/AKT信号通路,促进了星状细胞增殖,诱导星状细胞激活,而DIM能够抑制乙醇诱导的PI3K/AKT的激活,因此可以推断DIM可能通过此通路来逆转肝纤维化。NF-κB是一种重要的核转录因子,参与多种生理和病理过程的调控。当细胞受到各种因素刺激后,引起NF-κB活化,并发生胞核胞浆的转移,进而激活NF-κB信号通路。NF-κB信号逋路激活后,可激活单核巨噬细胞,进一步增力炎症细胞因子的分泌,并同时激活星状细胞,诱发并加重肝纤维化[16-17]。在使用通路特异性抑制剂抑制NF-κB通路的激活后,能够显著抑制活化星状细胞增殖、诱导星状细胞凋亡。AKT通过 PI3K 的磷酸化调控后,进一步磷酸化下游信号的传导细胞因子IKKs。IKK属于丝/苏氨酸蛋白激酶复合体,非激活状态下,NF-κB 与IkB 结合存在于胞质中,当上游信号通路激活 IKK活化后,活化的 IKK 可通过泛素化或磷酸化激活 IkB,使之与 NF-κB 解离入核发挥生物效应[18]。本研究发现乙醇暴露后激活了NF-κB信号通路,因此可以推断乙醇可能通过PI3K/AKT/NF-κB信号通路,促进了星状细胞增殖,诱导星状细胞激活,而DIM能够抑制乙醇诱导的PI3K/AKT/NF-κB的激活,因此可以推断DIM可能通过此通路来逆转肝纤维化。
本研究发现,DIM对乙醇诱导的星状细胞激活的抑制作用可能与抑制PI3K/AKT/NF-κB通路的信号传导有关。初步阐明了在体外水平DIM的抗酒精诱导的肝纤维化作用,为其治疗肝纤维化提供实验依据和理论支持。

