颅内动脉钙化对急性脑梗死患者溶栓治疗的临床预后影响
刘 潇,余浩佳,辛世萌
大连医科大学附属第二医院神经医学重症科,辽宁 大连116023
脑卒中目前仍然是世界第二大死亡原因,也是导致患者长期残疾的主要原因[1-2]。急性脑梗死是主要的卒中类型。在亚洲人群中,大动脉粥样硬化型脑梗死占比最大[3]。血管钙化是动脉粥样硬化过程中不可或缺的一部分[4]。除了传统的危险因素外,颅内动脉钙化(IAC)也是急性脑梗死患者预后不良的独立危险因素[5-6]。2018年发布的《中国急性缺血性脑卒中诊治指南》指出:静脉溶栓是血管再通的首选方法(I级推荐A级证据)[7]。然而,能够从溶栓治疗中获益的患者不足3%[8]。现有研究建议联合应用核磁共振脑部灌注加权成像及脑部弥散加权成像诊断早期脑梗死缺血半暗带,从而判断预后情况,但溶栓治疗具有严格的时间窗限制,完善颅脑核磁耗时较长,易造成不必要的时间延误[9]。而颅脑CT具有无创性、简便、快捷等优点,同时也是接诊时疑似脑梗死患者首选的影像学检查方法[7]。颅脑CT对钙化灶的检测具有高敏感度和特异性[10]。
在心血管疾病研究中,研究者通过冠脉CT检测发现冠脉钙化是经皮冠状动脉介入治疗后冠心病患者预后不良的危险因素[11-12]。既往研究发现急性缺血性脑卒中患者机械取栓前的颈内动脉钙化体积越大,表明术后动脉血运重建较差,功能预后较差[13]。而在静脉溶栓方面,欧洲一项研究表明,对于接受静脉溶栓治疗的脑梗死患者来说,颅内段颈内动脉钙化是一个独立的死亡预测因子,不影响静脉溶栓治疗的有效性或安全性。但该研究主要依赖钙化的范围及厚度进行评分,相对主观,存在一定局限性[14]。为发展定量测定方法,有学者使用特殊的插件及免费的ImageJ软件测量钙化灶,将高于预设阈值的像素数和增量相乘来计算钙化容积,对钙化容积进行定量计算,大大提高了钙化量的精度及准确度[15]。本研究试图通过对IAC进行半自动测量,回顾性分析接受溶栓治疗的急性脑梗死患者颅内段颈内动脉钙化程度对临床预后的影响,以便积极预判预后情况。
1 资料与方法
1.1 一般资料
连续收集2020年8月~2021年9月入住大连医科大学附属第二医院神经内科并接受静脉溶栓治疗的急性前循环脑梗死患者124例。纳入标准:符合《中国急性缺血性脑卒中诊疗指南》中的诊断标准,并根据症状、体征及辅助检查,考虑定位为前循环脑梗死的患者[7];就诊时完善颅脑CT以排除颅内出血,并于发病时间窗(6 h)内接受静脉溶栓治疗;患者病前改良Rankin 量表(mRS)评分<3分,生活可基本自理,既往无脑梗死后遗症状,从本次发病起3个月内未患其他严重疾病。排除标准:颅脑CT存在血肿或肿瘤占位效应等影像学表现的患者;静脉溶栓治疗后桥接动脉取栓、动脉溶栓或血管成形术等治疗的患者;存在外伤或其他重大疾病病史,如恶性肿瘤、严重感染、肝肾功能衰竭、血液疾病等。
1.2 研究方法
1.2.1 研究指标 包括一般资料、既往病史及用药史、实验室指标及结局指标。(1)一般资料:年龄、性别、BMI、吸烟史、饮酒史、发病至溶栓时间、溶栓前美国国立卫生研究院卒中量表(NIHSS)评分。(2)既往病史及用药史:高血压病史、糖尿病史、脑卒中史、冠心病史、房颤史、既往口服抗凝药物及抗血小板聚集药物史。(3)实验室指标:白细胞计数(WBC)、中性粒细胞/淋巴细胞比值(NLR)、血红蛋白(Hb)、血小板计数(Plt)、国际标准化比值(INR)、谷丙转氨酶(ALT)、碱性磷酸酶(ALP)、同型半胱氨酸(Hcy)、空腹血糖、低密度脂蛋白(LDL)、肌酐/尿素氮比值、尿酸(UA)、血磷、血钙、钙磷乘积。(4)结局指标:住院时间、出院NIHSS评分。
1.2.2 颈内动脉钙化容积的评估 所有患者均于发病时完成颅脑CT,采用美国国立卫生院研究开发的图像处理软件ImageJ对DCM格式的影像学图像进行评估,选择垂体窝层面及床突层面的颅内段颈内动脉虹吸部,计算钙化容积。
1.2.3 分组 电话随访评估患者出院后3月时的临床预后情况,并根据改良Rankin量表(mRS)进行评分,mRS评分<3分的患者纳入预后良好组(n=87),mRS评分≥3分的患者纳入预后不良组(n=37)。
1.3 相关研究标准及颈内动脉钙化容积的计算方法
1.3.1 颅脑CT参数标准 采用我院Siemens 64层螺旋CT,扫描参数为120 kV,260 mAs,层厚为5 mm。所有神经影像学图像均采用轴位扫描,扫描范围从外耳孔下缘至颅顶部。
1.3.2 颈内动脉钙化容积的计算方法 调整图像的窗位为200 Hu,窗宽为800 Hu。钙化灶定义为CT值>130 Hu的病灶。标记钙化灶后,利用ImageJ中的插件测量每一层面目标部位的钙化面积,各层图像钙化面积之和与层厚的乘积即为钙化容积(图1)。由我院1名影像科医师和1名神经内科医师在仅了解患者的主要诊断的情况下,分别测量责任血管侧颈内动脉虹吸部的钙化容积,两次结果取平均值。若两人测量值相差10 mm3以上,则均需重新测量,取第2次测量的平均值为钙化容积。

图1 颈内动脉钙化容积的计算过程示例Fig.1 Example of the calculation process of the internal carotid artery calcification volume.
1.4 统计学分析
采用SPSS25.0对数据进行统计分析,符合正态分布的计量资料以均数±标准差表示,组间比较采用独立样本t检验;不符合正态分布的计量资料以中位数(四分位数)表示,组间比较采用Mann-WhitneyU检验;计数资料以n(%)表示,组间比较采用χ2检验。对预后可能产生影响的因素进行二元Logistic回归分析,得出独立危险因素。通过Logistic 回归计算钙化容积及溶栓前NIHSS评分的联合预测因子,采用Medcalc 18.2.1统计软件,纳入溶栓前NIHSS 评分及联合预测因子绘制ROC曲线,并用Delong法计算两者曲线下面积(AUC),采用Z检验比较两种指标间AUC的差异。以P<0.05为差异有统计学意义。
2 结果
2.1 两组患者的基本资料及钙化容积的比较
预后良好组患者相较于预后不良组年龄偏小,溶栓前NIHSS 评分偏低;BMI 较预后不良组偏高(P<0.05)。预后良好组的房颤患病率低于预后不良组(P<0.05)。预后良好组患者的WBC、NLR、INR、空腹血糖水平均低于预后不良组,Plt、血磷、钙磷乘积均高于预后不良组(P<0.05)。预后良好组的钙化容积明显低于预后不良组(P<0.05,表1)。
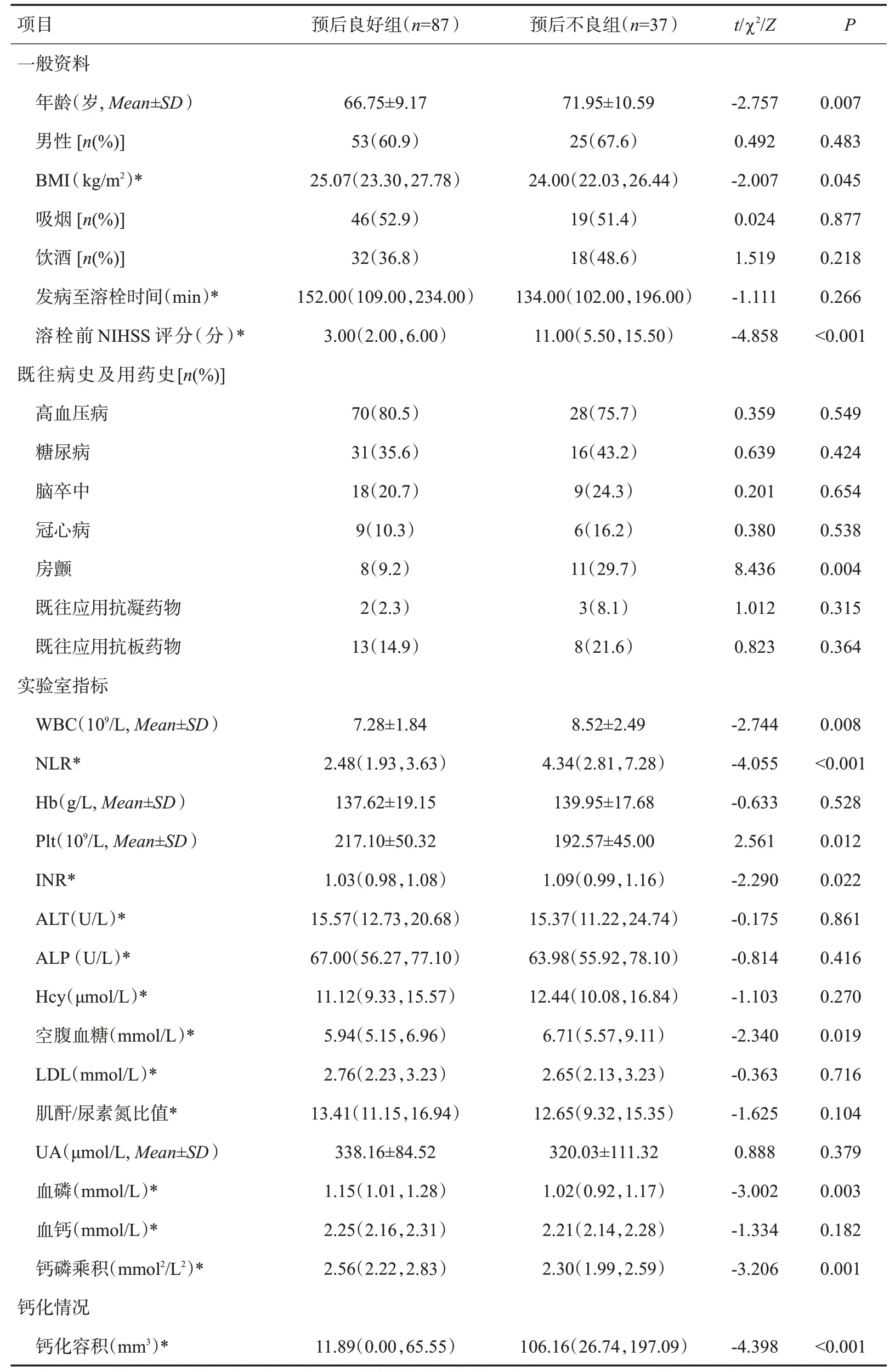
表1 预后良好组和预后不良组患者的基本资料及钙化容积的比较Tab.1 Comparison of basic data and calcification volume between patients with good prognosis and poor prognosis
在结局指标方面,相较于预后不良组,预后良好组的住院时间更短[7.00(6.00,7.00)vs8.00(7.00,11.00)],出院时NIHSS 评分更低[1.00(0.00,2.00)vs10.00(3.00,12.00)],差异均有统计学意义(P<0.05,表2)。

表2 预后良好组和预后不良组患者的结局指标的比较Tab.2 Comparison of outcome between patients with good prognosis and poor prognosis
2.2 患者预后不良影响因素的Logistic回归分析
将单因素分析中P<0.05 的影响因素纳入二元Logistic回归分析,结果显示:钙化容积的增大将增加患者预后不良的风险(OR=1.10,95%CI=1.05~1.21),钙化容积是接受静脉溶栓治疗的急性前循环脑梗死患者预后不良的独立危险因素(表3)。

表3 患者预后不良影响因素的Logistic回归分析Tab.3 Logistic regression analysis of factors influencing the poor prognosis of patients
2.3 溶栓前NIHSS评分联合钙化容积的ROC曲线分析
溶栓前NIHSS 评分的AUC=0.77(95%CI:0.69~0.85,P<0.05),截点值为5分,敏感度为75.7%,特异性为72.4%;溶栓前NIHSS评分联合钙化容积的AUC=0.83(95%CI:0.75~0.89,P<0.05),敏感度为75.7%,特异性为80.5%。相较于单独应用溶栓前NIHSS评分,联合预测因子对患者预后情况的预测价值更高,两者差异有统计学意义(Z=2.21,P=0.027,图2、表4)。

表4 溶栓前NIHSS评分及溶栓前NIHSS评分联合钙化容积的预测价值分析Tab.4 Predictive value of NIHSS score before thrombolysis and NIHSS score combined with calcification volume before thrombolysis
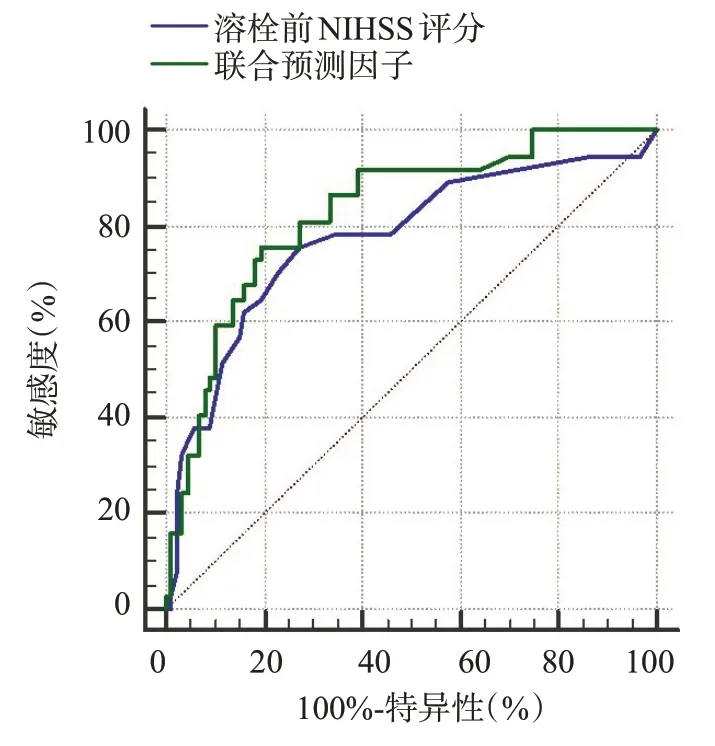
图2 溶栓前NIHSS评分及联合预测因子预测患者预后情况的ROC曲线Fig.2 ROC curve of NIHSS score and combined predictors before thrombolysis to predict the prognosis of patients.
3 讨论
有学者通过对患者颅脑CT所示钙化程度及血管造影术结果相比较,得出IAC与颅内动脉狭窄相关的结论;另有研究通过完善血管造影术发现,重度钙化与颈内动脉虹吸部狭窄>50%相关,这可能也对患者预后不良起到了促进作用[16-17]。虽然静脉溶栓治疗是血管再通的重要手段,但是如果责任动脉处存在狭窄,仍然会导致血液灌注不足,引起患者神经系统功能缺损,进而影响患者的预后情况。
既往组织学分析发现,血管内膜钙化常可见于未见狭窄的血管段,可引起血管末端出现低灌注,进而影响该血管所支配的脑区的功能[18]。有学者还在脑梗死患者的责任动脉下游发现微栓塞,推测可能与其颅内段颈内动脉钙化程度相关[19]。因此,可推测责任动脉管腔钙化越严重,其下游的微栓塞可能越多,出现大动脉栓塞的可能性越大,预后可能越差。
有研究发现,慢性炎症作用导致的巨噬细胞侵袭、血管平滑肌细胞增殖等细胞水平的变化也会导致血管钙化发生,同时还会发生脂质积累、细胞外基质蛋白功能障碍等分子水平的变化,这些不稳定的斑块在血管内壁上形成并发展成为阻塞性病灶[20]。同时,不稳定的点状钙化也可能会引发斑块破裂,造成远端血管栓塞,进而影响患者的预后情况[21]。也有研究发现IAC是颅脑微出血的独立危险因素,尤其是发生在脑深部的微出血,溶栓治疗也存在出血风险,IAC可能会使这一风险增加,进而对预后产生不利影响[22]。但欧洲一项研究发现,颅内段颈内动脉钙化并不会增加溶栓后脑出血的风险[14]。未来还需要进一步研究以阐明相关机制。
有学者对急性脑梗死患者出院后情况进行随访,发现患者颅内动脉钙化程度与其新发生的血管事件及死亡率显著相关,考虑IAC检测可以构成一个简单的指标,用于筛选高危缺血性卒中患者[6]。这与本研究的结论相似,但本研究着重关注接受静脉溶栓治疗的患者,揭示了血管钙化对静脉溶栓治疗的治疗后效果。不过,也有研究未发现IAC程度与溶栓治疗后功能结果的相关性,可能是大血管闭塞影响了溶栓治疗的效果及实验设计不同所致,但该研究也发现颈内动脉内膜钙化的患者更倾向于向预后不良的情势发展[23]。
本研究基于患者于门诊或急诊就诊时的颅脑CT图像,采用定量计算方法来量化颅内段颈内动脉的钙化程度,结果更加精确可靠;另外,本研究探讨分析了溶栓前NIHSS评分联合钙化容积对患者预后的预测价值,对就诊患者的预后和转归提供了新的预判指标,具有积极的意义。
此外,本研究也存在一定局限性:本研究为回顾性研究,且所收集的样本量较小,研究过程中存在失访现象,可能存在数据的偏倚。未来还需要加强宣教,让广大居民了解急性脑梗死这一疾病及规律随访的重要性,通过更大样本量的多中心前瞻性研究来校正。
综上所述,对于接受溶栓治疗的急性脑梗死患者来说,其临床预后与责任侧颅内段颈内动脉钙化相关,提示颅内动脉钙化容积可视为筛选预后良好者的指标,为急性脑梗死临床预后方面的研究提供参考。了解IAC及其影响急性脑梗死预后的机制也具有重要意义。

