建兰种子无菌萌发技术研究
赖金莉 郑 薇 罗素梅 郭崇炎 蔡继鸿 刘小平* 季春峰
(1赣州市蔬菜花卉研究所,江西赣州 341413;2江西农业大学,江西南昌 330045)
建兰(Cymbidium ensifolium)又称剑蕙、四季兰,是兰属地生兰的一种,其株型飘逸、易于管理、花香浓郁,常被用作园林造景植物。建兰作为兰科植物的一大类群,其繁殖方式主要有分株繁殖和外植体离体培养2种,后来科学家通过试验发现了一种可以获得大量植株的方法——种子的非共生萌发,即种子无菌萌发。兰科植物种子无菌萌发繁殖系数高、周期短,在短时间内可以获得大量同品种兰花的无菌芽,是兰科植物最优的繁育方法[1]。因此,在建兰大规模生产过程中,种子繁殖成为研究者研究的热点之一。
余迪求等[2]以建兰未成熟的种子为材料,以MS为基本培养基,对建兰原球茎的发生进行了研究,结果发现,培养体系为MS+0.5 mg/L 6-BA+2.0 mg/L NAA时,建兰种子的原球茎发生率可达85.71%。这是建兰最早的种子无菌萌发研究。近年来,随着建兰珍稀名品的不断出现,建兰在花卉市场上的热度暴涨,关于其种子繁育技术的研究也逐渐增多。叶秀仙等[3]研究了基本培养基和植物激素2个关键因子对素心建兰种子萌发、根状茎增殖、分化等各培养阶段的影响,提出了素心建兰在各生长发育阶段的最佳培养体系以及培养方法。陈春[4]以建兰岭南奇蝶自交成熟的果荚为研究对象,研究了外植体消毒时间、生长素浓度、分化培养基、有机添加物等4个因素对外植体污染率、根状茎增殖、分化和生根壮苗等的影响,克服了使用茎尖培养污染率高的问题,且培养基中添加0.5~3.0 mg/L NAA及0.5~1.5 mg/L IBA,可大大提高根状茎的增殖系数。此外,陈绪盛等[5]、唐凤鸾等[6]也对建兰的非共生萌发进行了研究,获得了较好的试验成果。目前,关于建兰种子无菌萌发的研究较多,但是都局限于市场前景较好的品种,鲜有对乡土品种的报道。本研究以赣南地区野生建兰的成熟蒴果为试验材料,采用组织培养的方法,对其种子无菌萌发技术进行了研究,以探索最适合建兰种子无菌萌发的培养体系,为本地建兰工厂化、规模化生产及新品种培育提供参考。
1 材料与方法
1.1 试验材料
供试材料为野生建兰成熟但未开裂的果荚,于2020年7月采自上犹五指峰和崇义齐云山。
1.2 试验方法
1.2.1 外植体消毒。①流水冲洗。取建兰尚未开裂的成熟蒴果,用剪刀剪去过长的果柄,用清水洗净果荚表面的灰尘,放于烧杯中,用流水冲洗1 h。②初步消毒。用70%乙醇浸泡5 min进行初步消毒后,转入超净工作台。然后用无菌水冲洗果荚表面的乙醇,冲洗2遍。③氯化汞消毒。用氯化汞消毒液浸泡5 min后,用无菌水冲洗3~5遍。
1.2.2 种子萌发培养基的配制。采用固体培养基,以1/2 MS为基本培养基,分别设置如下6个处理,即1/2 MS+8 g/L 琼脂粉+30 g/L 蔗糖(A)、1/2 MS+8 g/L琼脂粉+30 g/L蔗糖+2.0 mg/L NAA+0.4 mg/L 6-BA(B)、1/2 MS+8 g/L 琼脂粉+60 g/L 蔗糖(C)、1/2 MS+8 g/L琼脂粉+60 g/L蔗糖+2.0 mg/L NAA+0.4 mg/L 6-BA(D)、1/2 MS+8 g/L 琼脂粉+90 g/L 蔗糖(E)、1/2 MS+8 g/L琼脂粉+90 g/L蔗糖+2.0 mg/L NAA+0.4 mg/L 6-BA(F)。以上培养基均添加1g/L活性炭,pH值5.8。
1.2.3 无菌播种。外植体消毒结束后,在酒精灯旁,用酒精灯灼烧过的解剖刀把建兰蒴果从中间剖开,将种子均匀撒在培养基上。播种后在黑暗条件下培养至有种子开始萌发,再放入光照培养箱,培养温度为(25±2)℃,光照强度为2 000 lx,相对湿度为 75%。
1.2.4 生根壮苗培养。以1/2 MS为基本培养基,分别加 0、0.4、0.8、1.2、1.6 mg/L NAA。 以上培养基均添加0.4 mg/L 6-BA、30 g/L蔗糖、50 g/L琼脂、1.0 g/L活性炭,pH值5.4。以650 mL组培瓶为培养容器,每瓶培养基用量100 mL,每瓶接种20个幼芽,每个NAA浓度接种4瓶,培养温度(25±3)℃,光照强度 2 000~2 500 lx。
1.3 萌发指标计算与统计方法
播种后每隔30 d,用体视显微镜观察每个平板上种子的萌发状态,并统计种子发育的数量及阶段,计算各阶段发育所需时间。将建兰初期萌发过程分为 A、B、C、D、E等 5个阶段:A 阶段,种胚未萌动;B阶段,种胚膨大但未突破种皮;C阶段,原球茎突破种皮;D阶段,根状茎突破种皮且变成绿色;E阶段,根状茎出现分枝现象[7]。无菌播种培养300 d后统计萌发结果,生根壮苗试验接种90 d后统计生根率,计算公式如下:
式中,A、B、C、D、E 分别为不同阶段种子数量。
1.4 数据统计分析
采用Excel 2007进行数据整理,采用SPSS 20.0软件进行统计分析。
2 结果与分析
2.1 不同培养基对建兰种子萌发的影响
植物激素的有无以及蔗糖浓度的高低对建兰种子萌发均有显著影响。在不添加植物激素的条件下,建兰种子也可萌发,但萌发率较低,如表1所示,处理A、C、E未添加 6-BA、NAA,萌发率分别为 46.43%、65.43%、27.68%;添加 6-BA 与 NAA 后,处理 B、D、F萌发率分别为74.04%、86.27%、57.94%,分别较处理A、C、E增加了27.61个百分点、20.84个百分点和30.26个百分点。在蔗糖浓度为60 g/L时,种子萌发率最高达86.27%,显著高于蔗糖浓度为30 g/L和90 g/L的处理;种子的萌发指数最高可达23.76,显著高于其他处理。可见适宜的蔗糖浓度可以促进种子萌发,蔗糖浓度过高或者过低都会在一定程度上抑制建兰种子萌发。综上可知,添加外源植物生长调节剂6-BA、NAA以及适宜浓度的蔗糖能显著提高建兰种子的萌发率。本试验筛选出建兰种子无菌萌发最适培养基为1/2 MS+8 g/L琼脂粉+60 g/L蔗糖+2.0 mg/L NAA+0.4 mg/L 6-BA+1 g/L活性炭(处理D),为后期建兰种苗批量繁育奠定了基础。
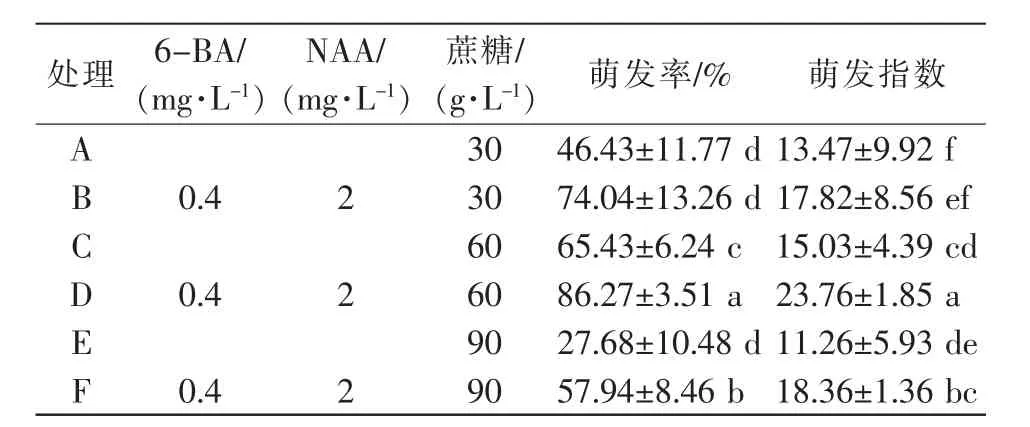
表1 不同培养基对建兰种子萌发的影响
2.2 建兰种子萌发过程观察
用高清体视显微镜观察种子在处理D培养基中的萌发过程,建兰种子呈纺锤状,外层由透明种皮包裹,见图1(a)。在萌发培养基上经过120 d的培养,观察到种子开始萌发。发育至图1(c)的种子,突破种皮,开始萌动,并出现绿色的原球茎。取出10个发育至图1(b)的种子进行重点观察,结果发现,由图 1(b)发育至图1(c)平均约需40 d,其中用时最长 68 d、最短15 d,此阶段原球茎体积快速增大,颜色呈深绿色。
由图 1(c)发育至图 1(d)平均约需 43 d,其中用时最长64 d、最短34 d,此发育阶段原球茎长度和体积快速增长,颜色加深。 图 1(d)发育至图 1(e)平均约需 47 d,其中用时最长86 d、最短32 d,继续培养形成绿色的原球茎,原球茎不断伸长继而形成根状茎,并出现分枝现象,此时根状茎完全脱离种皮。在萌发过程中,还有一些不能正常萌发的种子,受种胚发育不良、营养缺乏等影响,种子生长发育缓慢,最后完全褐化死亡,见图 1(f)。
2.3 NAA对建兰生根壮苗培养的影响
由表2可知,在生根培养基中添加生长素NAA后,可以明显提高建兰无菌芽的生根率。NAA浓度为 0.4、0.8、1.2、1.6 mg/L 时,接种 90 d 的平均生根率分别为53.39%、72.04%、60.60%、48.03%。由此可知,在NAA浓度为0.8 mg/L时,生根率最高,在90 d时最高可达80.50%。综上可知,在生根培养基中添加0.8 mg/L NAA时,建兰的生根效果最好。
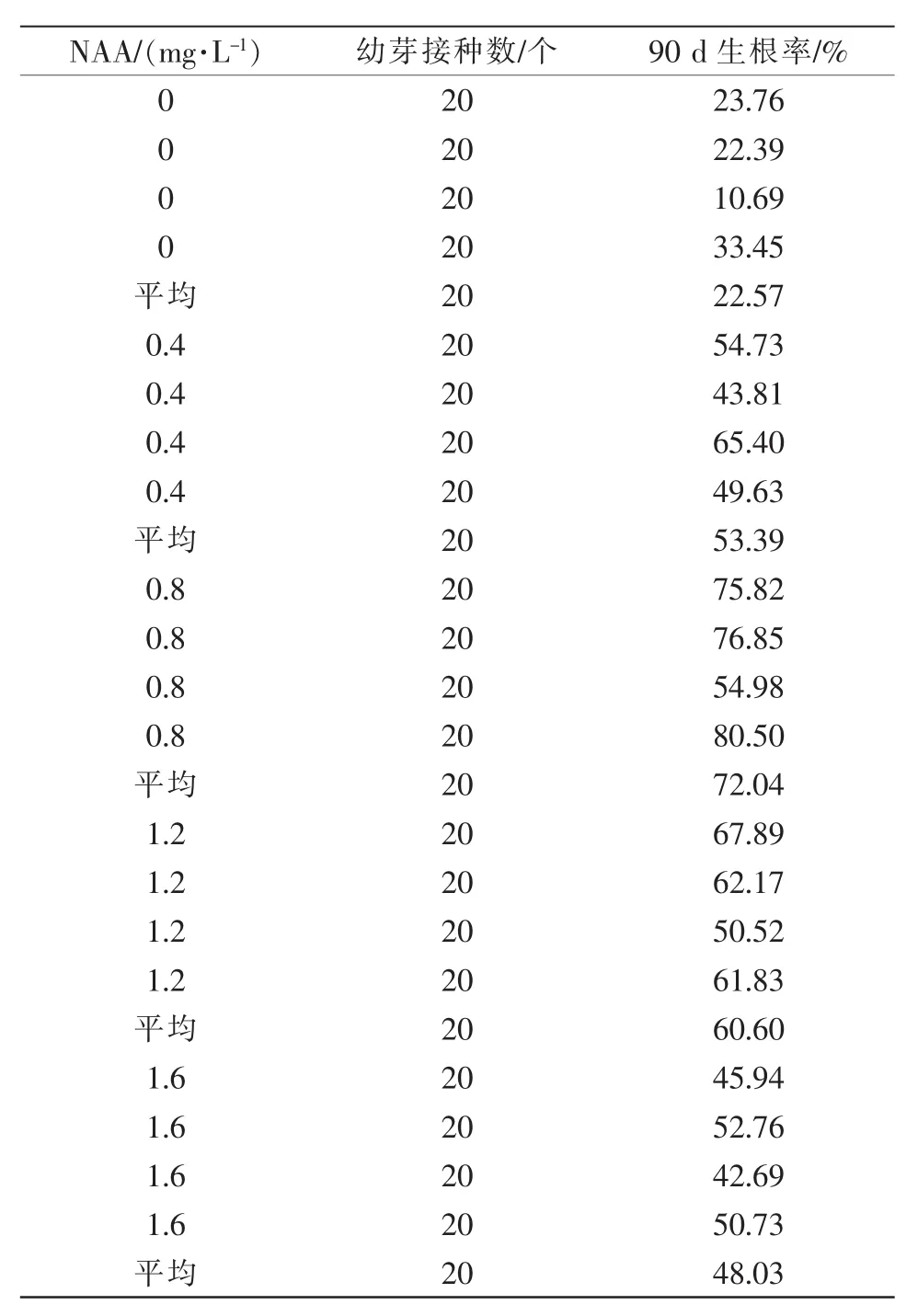
表2 NAA浓度对生根的影响
3 结论与讨论
兰科植物的一个蒴果内含有数万粒甚至百万粒种子[8],且种子非常细小,呈粉末状。受种胚发育不良、无子叶和胚乳、营养物质较少、种皮致密、透气性差等因素影响,兰科植物的种子在自然条件下很难萌发[9]。传统的分株繁殖由于繁殖周期长、繁殖率低,且存在种性退化和携带病毒的问题,不能满足市场对优良品系的需求[7]。兰科植物种子数量多、易获得,是进行组织培养的重要材料。因此,种子无菌萌发成为相关研究的热点之一,如陈丹丹[10]、席会鹏等[11]、郑洲翔等[12]在无菌播种的条件下,探索了兰科植物种子萌发的最适培养条件。
培养基是植物组织培养的关键,它为植物的离体培养提供了生长发育所需的各种营养元素。蔗糖作为能源物质在组织培养过程中起着至关重要的作用,相关研究表明,2%蔗糖最有利于兰花原球茎的生长,2%~3%蔗糖有利于芽的形成,5%蔗糖有利于根的生长和分化[13]。植物生长调节剂作为组织培养过程中另一个重要因素,常用的有生长素类和细胞分裂素类,包括NAA、6-BA和IBA等,一般组培苗在不同生长阶段对生长素和细胞分裂素的需求也不同。
本研究以建兰种子为试验材料,探索了蔗糖浓度及植物生长调节剂对建兰种子萌发及生根的影响。结果表明,60 g/L蔗糖与0.4 mg/L 6-BA、2 mg/L NAA组合,建兰种子萌发率最高;在生根壮苗试验中,当0.8 mg/L NAA与0.4 mg/L 6-BA组合时,生根率最高,在90 d时最高可达80.50%。此外,本研究还观察了建兰种子无菌萌发的过程,在播种后到根状茎分枝大约要经历250 d,后续生根壮苗还需要一段较长的时间。对建兰种子萌发过程的观测可加深对建兰种子萌发研究的理解。

