基于高通量测序技术的新疆哈密地区盐碱地土壤细菌群落结构分析
李卓然,张子怡,阮爱东,鲁 祥,武 帅
(水文水资源与水利工程科学国家重点实验室/河海大学水文水资源学院,南京 210098)
中国盐碱土总面积约为3.6×107hm2,占全国可利用土地面积的4.88%[1],主要分布在内陆干旱和半干旱地区,其中盐碱耕地主要分布在黄淮海、东北平原地区,盐碱荒地主要遍布在西北地区[2]。其中,内陆盐碱地面积占全国盐碱地总面积的95%[3]。
新疆地处干旱半干旱地区,具有气候干旱、降雨稀少、昼夜温差大等特点,一些地区耕地、草地盐碱化严重,且呈逐渐加重的趋势。新疆灌区耕地总面积达398.78×104hm2(不含旱地),其中盐渍化面积达127.90×104hm2,占灌区耕地总面积的32.07%[4]。由于盐碱地面积大,蒸降比失衡,地形封闭或低平,生长在其上的盐生植物种类较多,如碱蓬(Suaeda glauca)、滨藜(Atriplex patens)、柽柳(Tamarix chinensis)等,这类植物具有很强的耐盐性及耐旱性[5]。盐生植物不但能适应高盐和干旱的极端环境,还能改良盐碱地土壤。20世纪90年代以来,许多学者将其作为生物手段修复盐碱地的天然宝贵资源,进行了大量的研究[6]。地表植被类型的变化与土壤性质密切相关,尤其是土壤细菌的群落多样性[7]。土壤细菌多样性对环境的作用主要通过不同生物群落代谢功能与强度的差异性实现[8]。此外,土壤细菌群落结构及其代谢功能对于环境变化十分敏感,可及时反映土壤质量的变化趋势,是评价土壤变化的重要指标[9,10]。因此,对不同植被群落下土壤细菌群落结构的研究能加深对当地土壤环境状况的了解。随着人口增长和经济发展的压力以及改善生态环境的需要,盐碱地土壤资源和耐盐植物资源将会变得更加重要[11],然而新疆荒漠植物对土壤细菌多样性的影响研究仍未得到广泛重视。
本研究以新疆哈密地区盐碱地土壤为研究对象,采用Hiseq高通量测序方法,对裸地和灌丛下土壤细菌群落组成、结构与代谢功能进行研究,探究盐碱土壤中影响细菌群落的关键环境因子。研究成果初步揭示了新疆哈密地区荒漠化盐碱土壤细菌群落结构及其可能的影响机制,可为新疆荒漠化环境治理提供基础性数据,同时为荒漠化地区的植被恢复与生态稳定性提供理论依据。
1 材料与方法
1.1 研究区域与土壤样品采集
研究区位于新疆维吾尔自治区哈密市伊吾县幻 彩 湖 周 围(43°23′25.70″N、94°16′14.93″E,海 拔1 896 m)(图1)。哈密市地域辽阔,天山山脉横贯哈密中部,特殊的自然地理条件使哈密兼有南疆和北疆的气候特点,哈密属典型的温带大陆性干旱气候,干燥少雨,晴天多,年平均气温10.04℃(1953—2014年),年降水量38.2 mm(1953—2014年),年蒸发量3 300 mm[12]。该地区土壤为典型的盐碱土,区内植被以碱蓬、霸王(Zygophyllumxanthoxylon)等旱生灌木和芨芨草(Achnatherum splendens)、沿沟草(Catabrosa aquatica)等禾本科植物为主,并有少量骆驼蓬(Peganum harmalaL.)等半灌木或草本植物,多以斑块状分布。
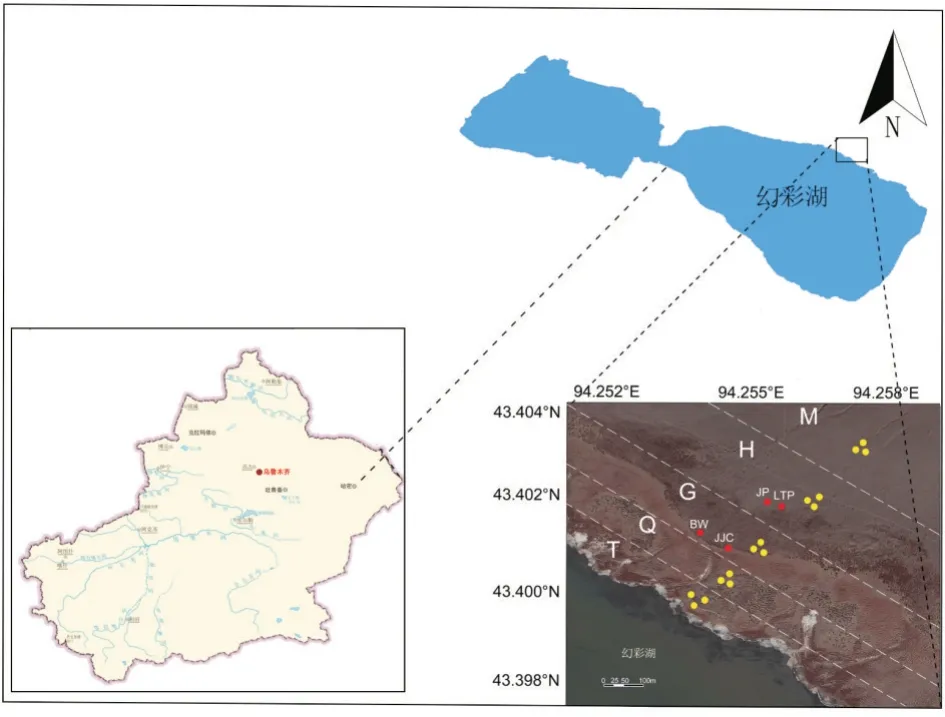
图1 新疆哈密市幻彩湖采样点
样品采集于2019年9月下旬,采样地点为天山北麓东段山脚到幻彩湖边的一片盐碱地。将采样区域以不同优势植物种类划分为5个区域,不同区域离湖由远到近分别命名为M、H、G、Q和T,其中山脚处至湖边的无植被区域命名为M区域;H区域优势植物是碱蓬,在区域内呈斑块状分布,另有少量骆驼蓬零散分布其中;G区域优势植物是芨芨草,同样在区域内呈斑块状分布,另有少量霸王零散分布其中;Q区域全部被优势植物沿沟草覆盖,未见其他植被物种;T区域是幻彩湖边无植被消落区。各采样点地势平坦、处于自然状态或少受人类活动干扰状态。在各区域分别设置3个平行采样点,去除表层1 cm土壤,采集表层(1~10 cm)非根际土壤,命名为样品M、H、G、Q和T。另外分别在H和G区选取生长良好的碱蓬、芨芨草、骆驼蓬、霸王各1丛,在每个灌丛下方接近根系处采集表层(0~10 cm)土壤,分别命名为样品JP组(碱蓬)、JJC组(芨芨草)、LTP组(骆驼蓬)和BW组(霸王),再将其等量混合样品命名为样品R组。将样品装入无菌自封袋后低温带回实验室。在实验室内将各样品分为2份,分别保存于-80℃冰箱和4℃冰箱,用于DNA提取、测序和土壤理化性状的测定。
1.2 土壤理化性质的测定
将采集到的所有土壤样品进行处理,经自然风干、研磨过筛(2 mm)后,测定其理化性质,包括土壤pH、电导率(Electrical conductivity,EC)、有机碳含量(Total organic carbon,TOC)、全碳含量(Total carbon,TC)、全氮含量(Total nitrogen,TN)。
将上述风干土壤样品与去离子水按1∶5混合后用pH计(Testo 206-pH2)和电导率仪(DDS-307A)测定土壤pH和电导率;土壤有机碳含量使用TOC仪(Multi N/C2100)测定;利用干式燃烧法并使用元素分析仪(EA4000,德国,JENA)测定土壤全碳和全氮含量。另取各原始样品,采用烘干法测定土壤含水量。
1.3 土壤细菌DNA提取和高通量测序
将上述等量土样冷冻干燥后,交由百迈克基因组测序公司(北京)采用MN NucleoSpin 96 Soi试剂盒进行DNA提取;用515F(5′-GTGYCAGCMGCCGCGGTAA-3′)和926R(5′-CCGYCAATTYMTTTRA GTTT-3′)引物对V4~V5可变区进行扩增。将合格的PCR产物在Hiseq nova平台上进行高通量测序。测序数据已上传至NCBI中的SRA数据库,编号为PRJNA784184。
1.4 数据处理与分析
对原始数据进行拼接(FLASH[13],version 1.2.11),将拼接得到的序列进行质量过滤(Trimmomatic[14],version 0.33),并去除嵌合体(UCHIME[15],version 8.1),得到高质量的Tags序列。在相似性97%的水平上对序列进行聚类(USEARCH[16],version 10.0),以0.005%的群落相对丰度作为阈值展开过滤,获得最终OTUs信息表[17]。利用RDPclassifier[18]对每条序列进行物种分类注释,比对Silva数据库[19],设置置信度阈值为0.8。
利用Mothur软件计算α多样性指数(Simpson、Shannon、Chao、Ace、Coverage),利用R语言ggplot2包绘制物种相对丰度图。利用GraphPad Prism 9绘制α多样性指数折线图。利用R语言中PCoA分析不同区域土壤间菌群结构差异;利用R语言工具制作相关性Heatmap图,分析环境因子与细菌门水平群落结构和α多样性指数的关系。为了更深入地探索细菌群落与土壤理化性质的关系,利用R语言vegan包,通过VIF(Variance inflation factor,方差膨胀因子)分析对环境因子进行筛选,并利用Mantel检验和典范对应分析(Canonical correspondence analysis,CCA)对细菌群落结构和土壤性质之间的关系进行研究。
2 结果与分析
2.1 土壤理化性质分析
各土样理化性质测定结果如表1所示。从表1可以看出,除区域M外,各区域土壤pH均偏碱性,且离湖越近pH越低,灌丛下混合土样pH略低于其他裸露土样。除临近幻彩湖的2个区域土壤含水量较高(29.515%和38.629%)之外,其余土样含水量均极低,值得关注的是灌丛混合土样含水量仅0.595%。土壤TOC、TN和TC含量均在植被全覆盖区域(Q组)中最高,而在区域H中最小,与含水量的变化呈相同趋势。4种植物中,JP(碱蓬)的TN和TC要明显高于其他灌丛下土样和其所在区域土壤(H组),其余3种灌丛下土样与其所在区域土壤TN、TC值相近。另外,JP的碳氮比在各灌丛下土壤中最低。JJC(芨芨草)的pH、含水量、TOC及EC值都低于其所采区域(G组),但TOC值和碳氮比要高于其余灌丛下土壤。土样LTP(骆驼蓬)的pH最高,达8.810,大于各区域土壤pH;EC值远小于其所采区域(样品H组)。土样BW(霸王)的含水量低于其余植被灌丛下土壤含水量,同时远低于其所采区域土壤(土样G组)的含水量;相比于G组EC值3.835 mS/cm,土样BW的EC值远小于该值,仅有0.659 mS/cm。在植物灌丛下土壤(R组)中的TN和TC要高于其在区域H和G的值。电导率EC在区域Q中最高,在区域M中最小,在区域H、区域G、区域Q、区域T仍与含水量变化相同。土壤碳氮比在区域H最高,在区域Q最低。
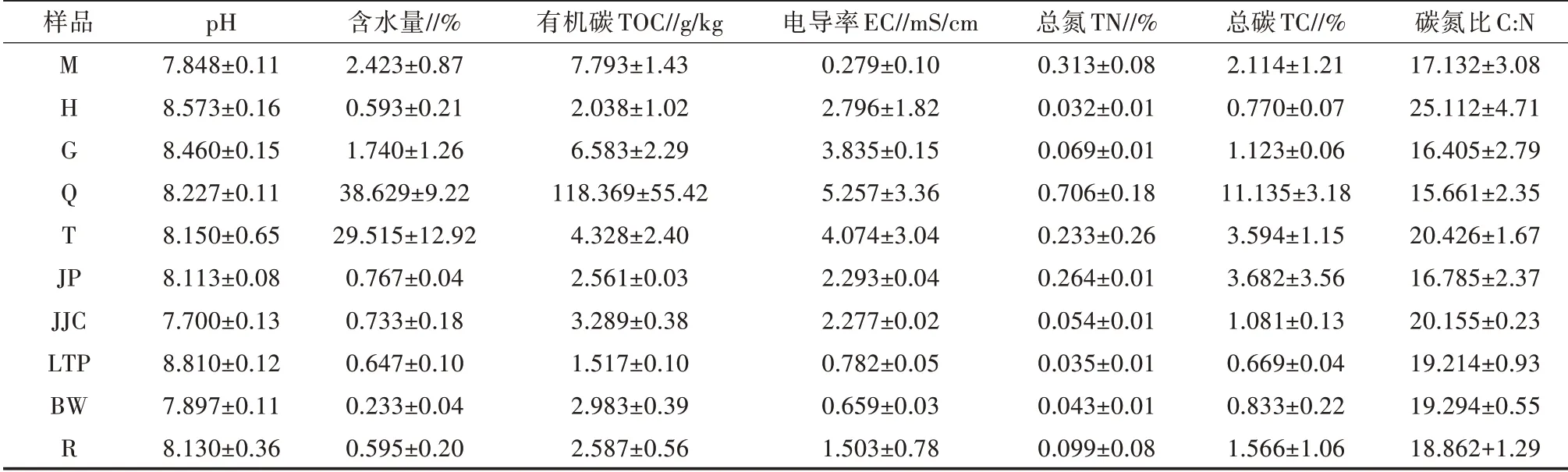
表1 不同区域的土壤理化性质
2.2 土壤物种注释及组间土壤细菌群落差异分析
采用高通量测序和分类学对土壤样品进行分析(图2),全部样本共获得1 322个OUT,得到细菌23个门类44个纲103个目178个科379个属以及489个种。基于物种注释结果,在门分类水平上选择最大丰度的前10种,对相对丰度柱状图进行分析。该细菌群落主要由拟杆菌门(Bacteroidetes)、变形菌门(Proteobacteria)、浮霉菌门(Planctomycetes)、放线菌门(Actinobacteria)、酸杆菌门(Acidobacteria)、广古菌门(Euryarchaeota)、疣微菌门(Verrucomicrobia)、异常球菌-栖热菌门(Deinococcus-Thermus)、奇古菌门(Thaumarchaeota)、绿弯菌门(Chloroflexi)等组成。结果表明,不同样本的优势菌门组成和比例存在显著差异,主要优势菌门为变形菌门、拟杆菌门和放线菌门,总和占36.54%~66.43%。随各区域离湖距离的减小,放线菌门的相对丰度呈下降趋势。样品JP和JJC作为区域H和区域G的优势植物灌丛下土样,其物种组成分别与土样H、土样G呈相似的特点,且其中拟杆菌门相对丰度显著高于其分别所在区域非根际土壤。对于4种植物灌丛土壤,广古菌门和异常球菌-栖热菌门在碱蓬、芨芨草灌丛土壤中的相对丰度远大于其在骆驼蓬和霸王土壤中的相对丰度,而奇古菌门则正相反,其在骆驼蓬土壤中的相对丰度远大于其在碱蓬与芨芨草土壤中的相对丰度。拟杆菌门在碱蓬、芨芨草和霸王中的相对丰度要大于其在骆驼蓬土壤中的相对丰度。
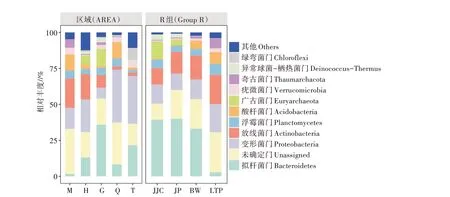
图2 细菌门水平上的相对丰度
2.3 α多样性分析
由表2可见,区域Q的土壤细菌多样性较高,在不同区域土壤间,ACE和Chao1指数反映出相似的规律,区域H最低,区域Q较高,区域M大于区域G。均匀度指数(Simpson和Shannon指数)趋势较为相似,即先下降后上升再下降,且区域M较高,区域T最低,区域T土壤细菌虽然多样性较高但均匀度很低,反之区域M均匀度相对较高。各区域细菌α多样性指数与其理化因子的变化趋势相近,而细菌群落均匀度指数并未出现相同的趋势。
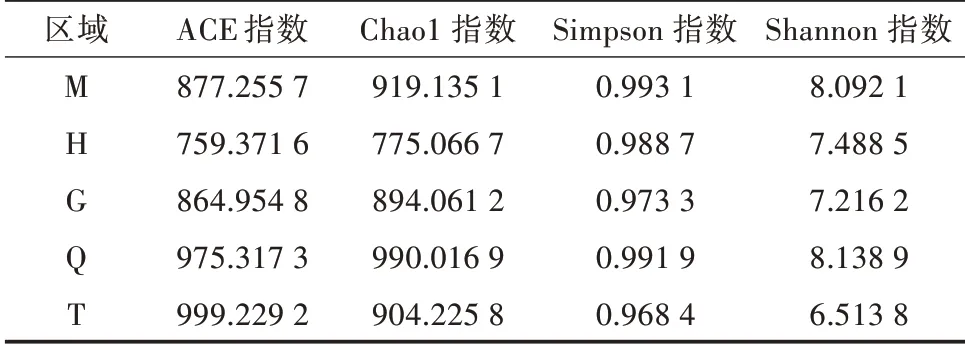
表2 不同区域的α多样性指数
2.4 β多样性分析
基于Bray-Curtis距离,在OTU水平上的PCoA分析揭示了不同采样点的土壤细菌群落之间的相似性(图3)。结果表明,在不同组分的采样点发生了显著分离,说明细菌群落结构受不同区域的影响差异较大。混合组R的4种灌丛下土壤较为分离,JP与JJC与区域G距离相近,LTP、BW分别与区域G、H距离相近。除JP外,其余灌丛土壤与其所在区域的相近关系与采样结果一致。
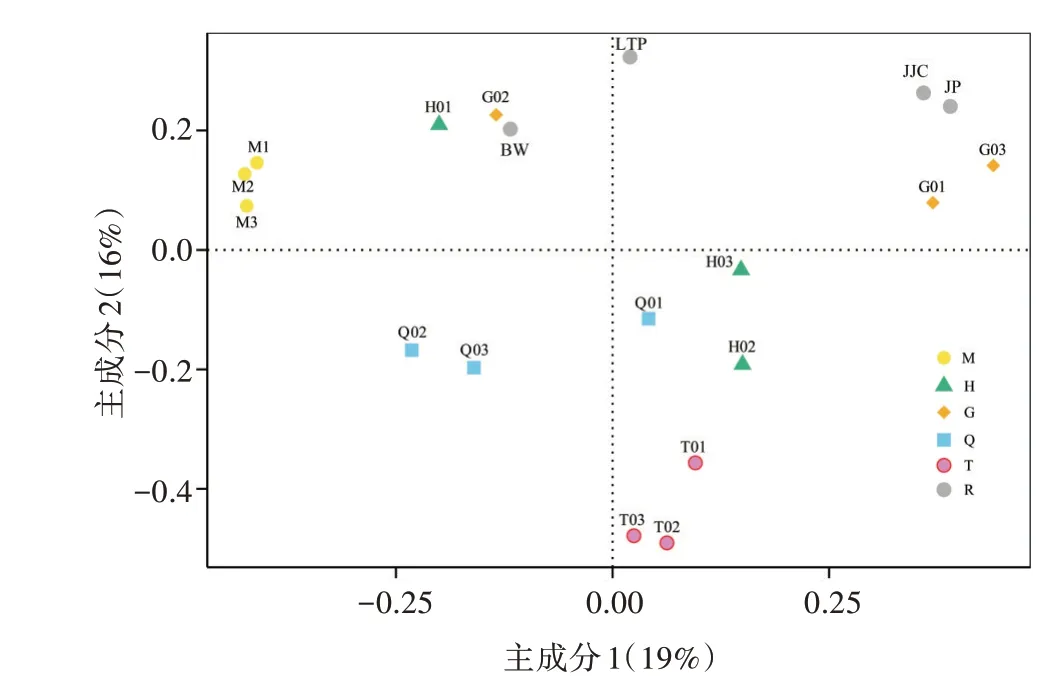
图3 新疆哈密地区盐碱土壤细菌β多样性的主坐标(PCoA)分析
基于Bray-Curtis距离,OTU水平的置换多元方差分析结果显示F=2.779 9,R2=0.516 72,P=0.001,组间差异极为显著。根据Anosim分析,结果显示R=0.61>0,P=0.001,表示组间差异显著大于组内差异。
2.5 土壤细菌群落与理化性质的关系
图4为不同区域土壤优势群落与土壤理化因子之间的Spearman相关性分析。结果表明,在不同区域,电导率(EC)是影响细菌群落最显著的环境因子,与电导率显著正相关的优势门有拟杆菌门(P<0.05)和异常球菌-栖热菌门(P<0.01),EC越高,拟杆菌门和异常球菌-栖热菌门占比越大。说明电导率对这2个优势菌门占比影响较大。而在所有区域中均占优势的变形菌门和放线菌门与这些环境因子均未显示出显著的相关性,说明理化因子对其他优势菌门的分布影响极小。

图4 门水平上Spearman相关性分析
对α多样性指数与土壤理化因子之间进行Pearson相关性分析(图5)。土壤pH与ACE指数均呈极显著正相关(P<0.01),说明pH对群落丰富度影响较大。而土壤含水量、有机碳、总碳、总氮等与细菌α多样性指数无明显相关性。
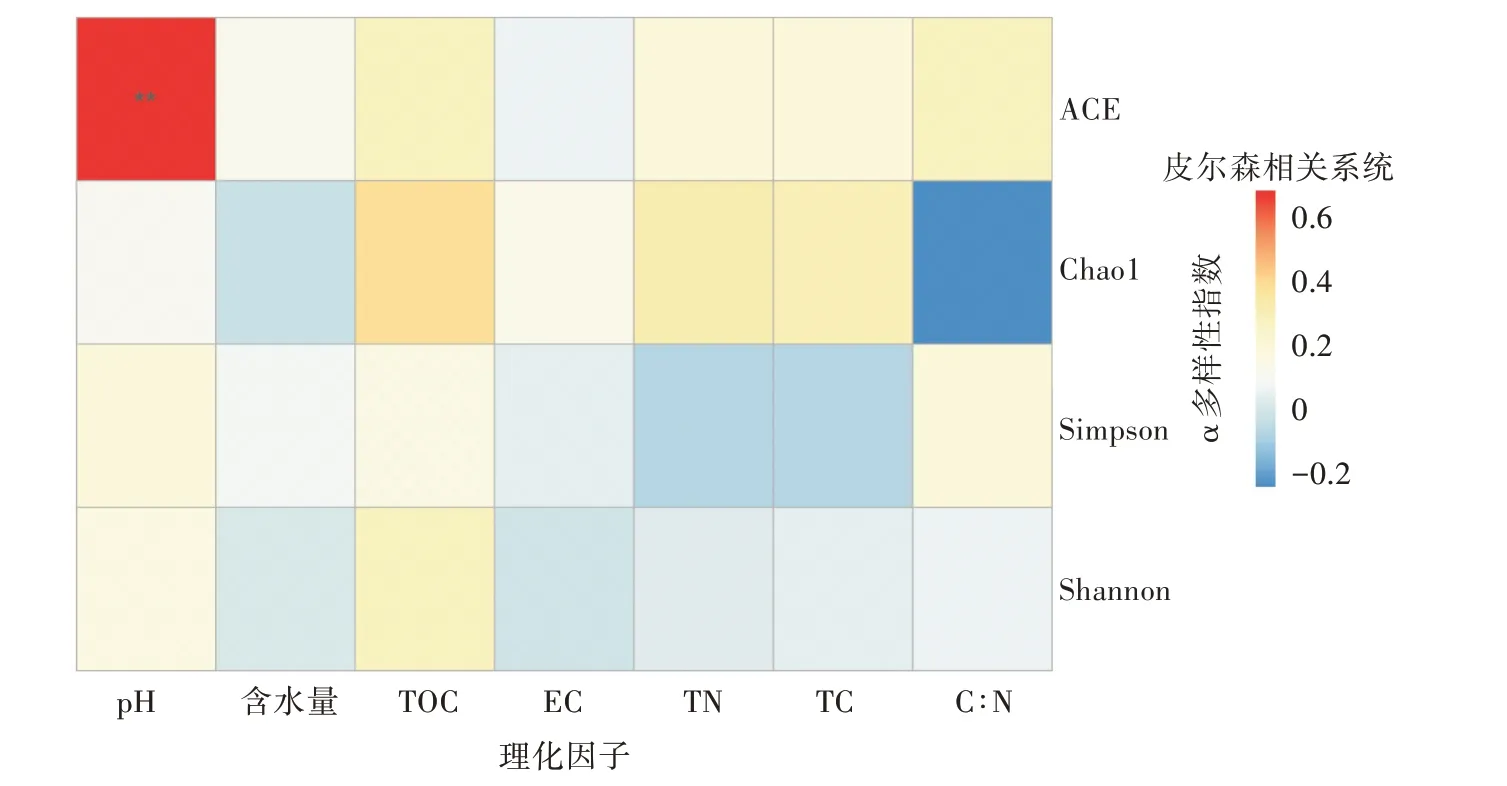
图5 土壤理化因子与α多样性指数的相关性分析
基于Bray-Curtis距离,在OTU水平上和理化因子进行Mantel检验(表3),Total为总群落,Sub1为细菌群落,Sub2为古菌群落。结果表明,总群落结构与pH呈显著相关关系(P=0.044),细菌群落结构和pH呈显著相关关系(P=0.038),而古菌群落结构与理化因子无显著性相关关系。
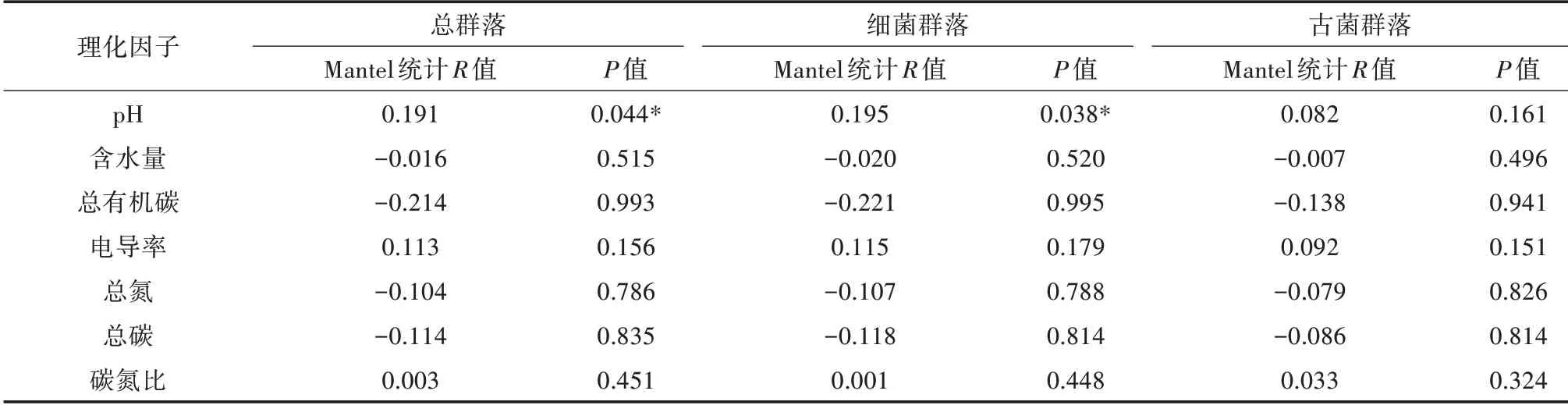
表3 基于Bray-Curtis距离通过Mantel检验分析细菌群落结构和土壤性质的关系
土壤细菌群落与环境因子的CCA分析(图6)的前2个轴分别解释了26.01%和22.82%的变异,这2轴共解释了48.83%的变异。可以看出,在各理化因子的关系上,TOC、TC和土壤含水量与pH、C∶N呈负相关关系,pH和C∶N呈正相关关系,TOC与土壤含水量呈正相关关系。
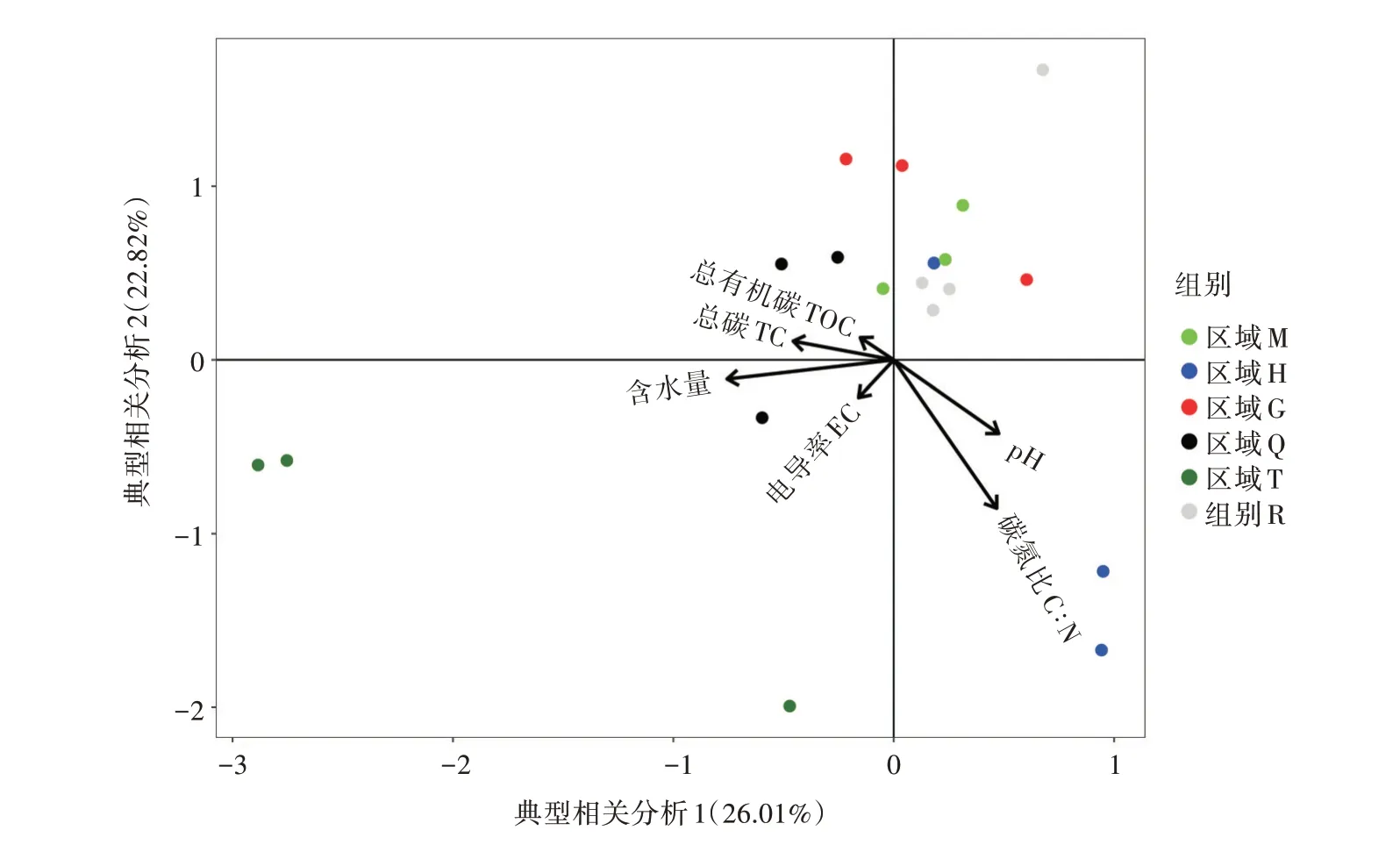
图6 优势菌群与土壤性质的CCA分析
2.6 土壤细菌群落功能预测
采用Tax4Fun2对细菌群落功能进行预测(图7),得到各组之间细菌群落功能注释存在显著性差异,有16类功能基因相对丰度与区域变化有显著响应关系。代谢方面,糖代谢和氨基酸代谢在细菌群落中高度富集。区域G的细菌群落功能注释预测除在糖类代谢和氨基酸代谢的相对丰度较高之外,整体细菌群落功能注释预测结果相对丰度比较低。随着各区域离湖距离的减小,其生物降解和代谢呈逐渐上升的趋势,说明距离幻彩湖边越近的区域,代谢能力越强。在环境信息处理方面,信号传导的相对丰度仅次于糖代谢和氨基酸代谢,且在区域Q丰度最高。在人类疾病和细胞过程这两类一级代谢通路功能基因下,二级代谢通路功能基因均以区域G丰度最低。
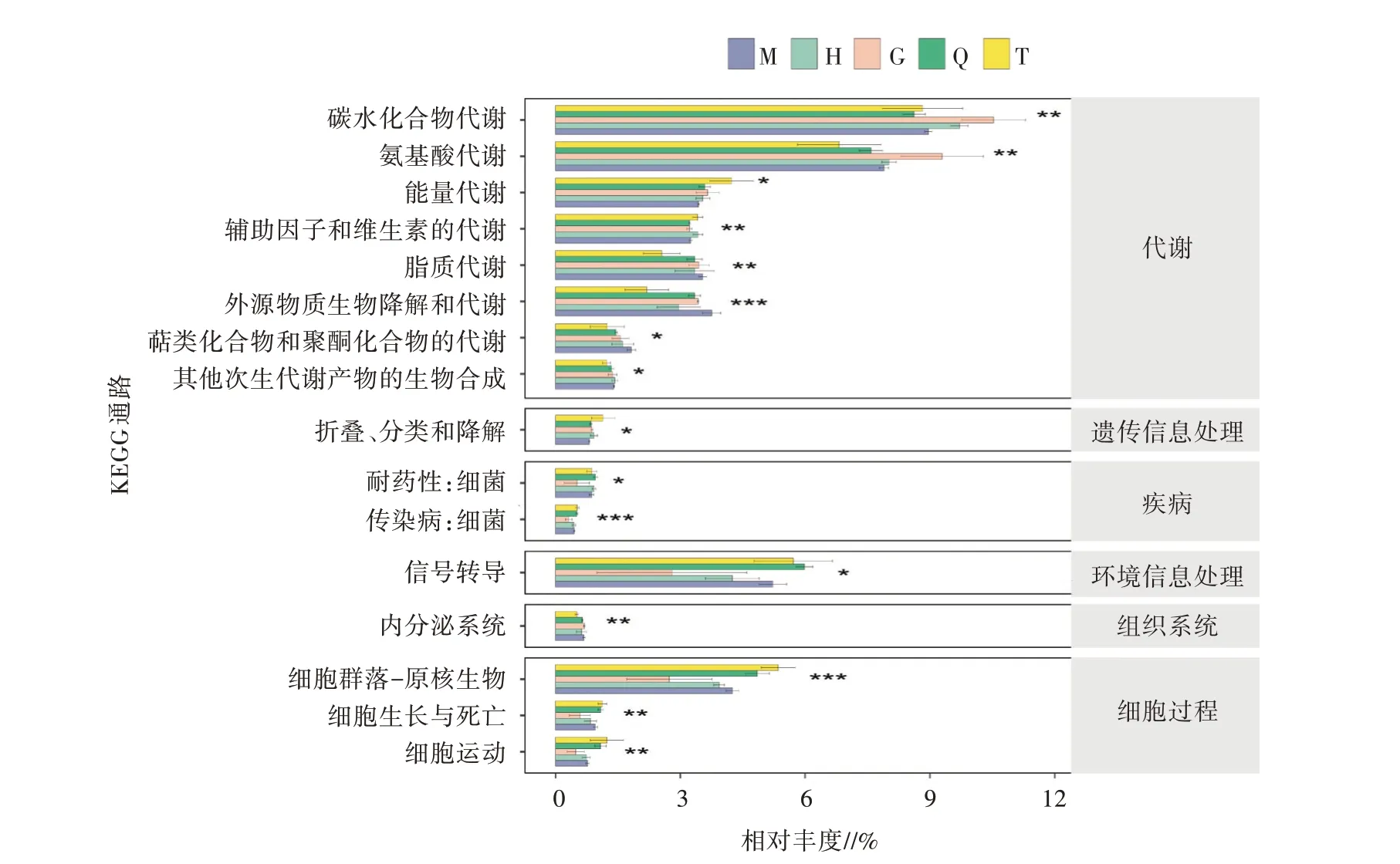
图7 不同区域KEGG二级通路注释功能相对丰度差异
3 讨论
3.1 植被条件对土壤性质的影响
除样品LTP外的3种植物JP、BW、JJC及R组的植物灌丛下土壤pH要普遍低于除区域M以外的土壤,这可能是植被凋落物产生的有机酸[20]导致土壤pH下降。从区域H到区域T离幻彩湖距离逐渐减小,土壤pH呈下降趋势,其原因可能与生长于不同区域的优势植物相关,因为盐生植物可以对盐碱土的理化性质进行改善,但不同种类的优势植物对pH下降的影响程度不同[21]。在土壤含水量影响下,土壤TOC、TC和TN从干旱区域H到较为湿润区域Q,呈上升趋势。据报道,植物根系在土壤中纵横交错,其分泌物、脱落的根毛和根表皮细胞可极大地增加根系周围土壤营养元素的含量[22],综上所述,认为在新疆哈密地区不同区域中改变土壤性质的首要因素可能是植物。
细菌群落的分类学组成、多样性和丰富度反映了土壤细菌对不同特征区域的响应。放线菌门在所有样品中均为优势菌门,在其他对相应植物土壤细菌[23,24]和其他干旱地区土壤细菌[25,26]的研究中放线菌门也占主要组成部分。这是因为放线菌门是一类能很好适应诸如干旱和高盐等环境胁迫的菌群,并且能在贫瘠土壤中生存[27,28]。
细菌多样性和丰富度最高的区域为区域Q,这可能是由于该区域土壤含水量高,土壤中有更多的营养物质,而细菌的数量与土壤有机质含量呈极显著相关[29]。M区域均匀度指数较高,这可能与该区域为无植被区域有关,M区域与其他区域相比并没有植被因素影响该区域的细菌群落组成,因为植物应对盐碱胁迫的过程中,会发生一系列反应,根部会产生各种分泌物,有研究[30]发现根系分泌物的组成和量的微小变化会导致根系区微生物种群的重大变化。不同区域的细菌群落结构表现出组间差异大于组内差异,其可能受到不同区域土壤含水量变化和不同优势植物的影响,因为干旱可能通过调节水分有效性直接影响根细菌群落,也可能通过改变土壤化学和植物表型间接影响根细菌群落[31]。
3.2 细菌群落与环境因子的关系
研究表明,电导率是影响土壤细菌群落结构的主要因素之一[32]。优势菌门中的拟杆菌门和异常球菌-栖热菌门与电导率呈显著正相关,土壤电导率对土壤细菌群落的影响主要是通过对拟杆菌门的影响来完成的。
α多样性指数中的ACE指数与pH呈显著正相关,说明该地区细菌群落多样性和丰富度在一定范围内与pH呈正相关。在Mantel检验中同样表现出群落结构与pH呈显著性关系,这与Fierer等[33]的结果一致。土壤pH作为影响细菌群落主要因素的原因可能为以下几点。首先,土壤pH可能不会直接影响细菌群落结构,而是作为一个综合变量,直接或间接影响土壤性质如土壤水分状况和盐度等[34]。其次,土壤pH的微小差异(仅0.10)可能导致多种细菌群落变化[35],说明pH可以在小范围内影响细菌群落结构的变化。
4 结论
基于Illumina Hiseq高通量测序技术,对新疆哈密地区盐碱地土壤与4种灌丛下土壤细菌群落进行研究。在理化因子方面,除天山山脚下区域M,植物灌丛下土壤pH要普遍低于各区域土壤pH,随各区域离湖距离逐渐减小,优势植物逐渐变化,同时土壤pH随着土壤含水量的升高呈下降的趋势;在细菌群落结构组成方面,拟杆菌门、变形菌门、放线菌门为优势菌门,各组间群落差异明显;土壤电导率对拟杆菌门和异常球菌-栖热菌门影响显著,土壤pH对细菌群落多样性与组成影响最为显著。植被条件可能是影响新疆哈密地区盐碱地土壤性质的首要因素,而土壤pH可能为各区域细菌群落变化的主要影响因素;由Tax4Fun2功能预测可得,该地区土壤细菌群落的代谢功能在代谢和环境信息处理方面较为丰富,可能是干旱和盐碱胁迫对相关基因有促进作用。本研究初步揭示了新疆哈密地区盐碱地土壤细菌群落结构及其可能影响机制,可为荒漠化地区的植被恢复与生态稳定性分析提供数据支持和理论依据。

