Clcn3 敲除对幼龄小鼠实质器官的影响
经争辉,李春英,刘蓉,任俞华,崔诗雨,赵文宝,张海峰*
(1. 西安交通大学转化医学研究院遗传与发育研究所,西安 710100; 2. 西安交通大学基础医学院病理学系,西安710061; 3. 浙江省丽水学院,浙江 丽水 323000; 4. 陕西省西安市高陵区医院检验科,西安 710299)
电压门控氯离子通道3(chloride voltage-gated channel 3,Clcn3)在哺乳动物组织中广泛表达,主要分布于细胞膜、胞浆,细胞核内少量分布;小鼠体内共有4 种不同的Clcn3 亚型,分别为Clcn3a,Clcn3b,Clcn3c,Clcn3e,其主要区别是不同亚型的Clcn3 蛋白N 端和C 端氨基酸序列不同[1]。 容积调控性阴离子通道(volume-regulated anion channel,VRAC)是一类具有种属、组织细胞差异性的功能蛋白复合体。Clcn3 被认为是一种潜在 VRAC 候选蛋白,其胞膜组份对保持特定组织细胞体积平衡至关重要[2-4];多数Clcn3 分布于胞浆内,位于溶酶体膜上的Clcn3 作为2Cl-/H+交换体,降低溶酶体内pH 值使其酸化,从而维持溶酶体系统的正常生物学功能[5];胞核内Clcn3 功能研究少见报道。 亚细胞分布的Clcn3 通过复杂的分子机制,参与细胞增殖、迁移、凋亡、分化、药物转运等生物学过程[6-13],在肿瘤[14]、免疫[15]、炎症[16]、神经[17]、生殖[18]、心血管[19]等相关疾病的发生发展中具有重要作用,其可作为相关疾病诊断和治疗的潜在靶点。
基因编辑动物是研究基因与人类疾病发生关系的有效动物模型,通过构建Clcn3 基因敲除动物,有助于揭示其参与相关疾病发生发展的分子机制。本研究旨在收集Clcn3+/+、Clcn3+/-及Clcn3-/-小鼠的心、肝、脾、肾、肺和脑等主要实质器官组织,观察Clcn3 缺失对主要实质器官大体和组织结构的影响,为以Clcn3 敲除小鼠为模型动物的科学实验提供一定的理论参考。
1 材料与方法
1.1 材料
1.1.1 实验动物
Clcn3 基因敲除FVB SPF 级小鼠由中国苏州赛业生物公司【SCXK(苏)2018-0003】通过CRISPR-cas9 技术生产。 简要步骤如下:靶向小鼠Clcn3 的sgRNA 和cas9 mRNA 共同注射到雌性小鼠的受精卵中,经胚胎移植生产Clcn3-/-小鼠(gRNA1:GATTTATTTAACCCTAATGAAGG和gRNA2:AATGGGCTGTATTGTCCTCCTGG); 将Clcn3-/-与Clcn3+/+小鼠交配,繁殖杂合子小鼠;后代Clcn3-/-小鼠由杂合子Clcn3+/-小鼠自交繁殖。Clcn3+/-小鼠饲养(深圳大学第一附属医院邓志钦馈赠)在西安交通大学动物实验中心的SPF 级动物房【SYXK(陕)2018-001】。 本实验使用 15 只 SPF 级 FVB 小鼠,3 周龄,体重约为6 ~12 g,其中野生型、杂合子和纯合子小鼠各5 只。 饲养环境:屏障环境、独立换气;昼夜光照各半,湿度恒定;自由采食和饮水。 所有动物实验操作符合西安交通大学伦理委员会要求(2021-1499)。
1.1.2 主要试剂与仪器
引物合成(擎科生物,中国),蛋白酶K(天根生物,RT403,中国),2X Taq Master Mix(苏州近岸蛋白质 科 技, E005-01B, 中 国), TritonX-100 (Thermo Fisher,85111,美国),100 bp DNA ladder(天根生物,MD109,中国),Tris(博奥拓达,T6061,中国),琼脂糖(天根生物,RT101,中国)。 干式恒温器(合众生物, GH-100, 中 国), 凝 胶 电 泳 仪 ( BIO-RAD,1704469,美国),凝胶成像系统(Bio-Rad,ChemiDoc MP,美国),轮转式石蜡切片机(瑞沃德,S700A,中国),全自动数字病理扫描分析系统(江丰生物,KFPRO-002,中国),PCR 仪(BIO-RAD,T100,美国)。
1.2 方法
1.2.1 小鼠基因型鉴定
(1)小鼠基因组DNA 提取:小鼠出生后2 ~3周,剪取鼠尾2 ~3 mm 放入1.5 mL 离心管中,加入100 μL 裂 解 液 (1.37 g KCl, 1.2 g Tris, 1 mL TritonX-100,溶于1 L 纯水中,加入浓盐酸调节pH= 9.0)和4 μL 的蛋白酶 K,56℃过夜裂解。 裂解完成后,98℃金属浴加热 15 min 终止裂解。 10 000 rpm 离心 15 min,取上清,即可得到小鼠基因组DNA。
(2)小鼠基因型鉴定:小鼠基因型均通过PCR进行鉴定。 PCR 反应体系为 25 μL,其中 2 × Taq Master Mix 12.5 μL,上下游引物各 1 μL(10 μmol/L),基因组 DNA 3 μL,纯水 7.5 μL。 PCR 鉴定小鼠基因型共需要3 条引物,引物的序列信息如表1 所示。 PCR 反应条件为:预变性94℃ 1 min 30 s;变性94℃ 20 s,退火 65℃ 30 s,延伸 72℃ 1 min,循环 30次;72℃ 5 min;4℃ 保存。 取 10 μL PCR 产物加入到2%琼脂糖凝胶中,100 V 电泳40 min 后在凝胶成像系统中拍照,分析小鼠的基因型。 F1、R1 用来扩增突变的Clcn3 基因,产物大小为 654 bp;F2、R1 用来扩增正常的Clcn3 基因,产物大小为769 bp。
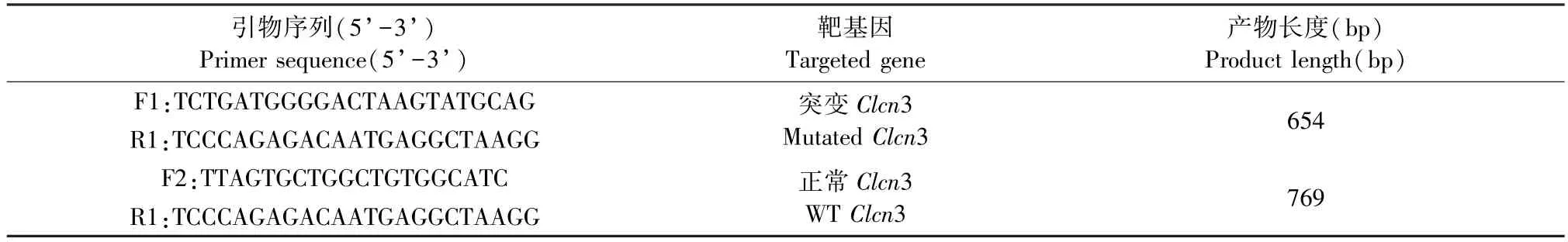
表1 小鼠基因型鉴定所使用的引物序列Table 1 Primers sequence for genotyping identification of mouse
1.2.2 小鼠样品采集
小鼠出生后,母鼠喂养至3 周龄,脱颈处死,剪开小鼠的胸腔和腹腔,采集小鼠的心、肝、脾、肾、肺和脑组织。 采集的小鼠组织器官用PBS 冲洗干净后,摆放在具有标尺的手术布上拍照,利用Image J软件测量小鼠各器官的面积。 拍照完毕后,将小鼠器官放入10%福尔马林溶液中常温保存,用于制作石蜡切片。
1.2.3 石蜡切片制作及HE 染色
小鼠组织器官浸入10%中性福尔马林溶液(10倍体积)固定24 h 后,利用不同浓度梯度的乙醇溶液进行脱水处理,步骤为:70%、80%和90%的乙醇溶液分别脱水2 h;95%和100%的乙醇溶液分别浸泡脱水1 h。 接着,将小鼠器官放入100%二甲苯溶液内透明30 min 后,浸蜡包埋:将透明好的小鼠器官放入石蜡二甲苯混合液中(1 ∶1)30 min,然后浸入石蜡Ⅰ和Ⅱ中各2 h。 包埋好的小鼠组织利用切片机切片,切片厚度为4 μm。 石蜡切片脱蜡后,利用苏木素伊红染液行HE 染色。 树胶封片后,利用病理数字切片系统扫描HE 切片,KIBIO.SlideViewer软件观察不同基因型小鼠主要实质器官细微结构。
1.3 统计学分析
2 结果
2.1 小鼠基因型鉴定
三引物PCR 法鉴定野生型(Clcn3+/+)、杂合子(Clcn3+/-)及纯合子(Clcn3-/-)FVB 小鼠;F1、R1 引物靶向扩增经CRISPR-CAS9 编辑过的Clcn3 基因,产物大小为 654 bp,F2、R1 引物靶向扩增正常的Clcn3 基因,产物大小为 769 bp(表 1)。 如图 1 所示,利用 F1、R1 和 F2 扩增鼠尾 DNA,1 和 3 号小鼠只出现654 bp 的条带,为纯合子小鼠;12 和13 号小鼠经3 条引物扩增后只出现了769 bp 的条带,为野生型小鼠;其他小鼠经3 条引物扩增后同时出现了654 bp 和769 bp 的条带,为杂合子小鼠。

图1 部分小鼠的基因型鉴定结果Note. A. The product size of amplification using primer F1 and R1(654 bp).B. The product size of amplification using primer F2 and R1(769 bp).Figure 1 Genotype results of mice identification
2.2 Clcn3 敲除对小鼠体重的影响
如图2A 所示,Clcn3-/-小鼠头、体、尾、毛发、四肢、耳、鼻、口、眼等器官未见明显畸形。Clcn3 敲除小鼠生长明显缓慢,3 周龄的Clcn3-/-小鼠体型明显小于Clcn3+/+和Clcn3+/-小鼠。Clcn3+/+与Clcn3+/-小鼠的体重差异不显著(P>0.05),但均显著高于Clcn3-/-小鼠的体重(P< 0.05),野生型、杂合子、纯合子小鼠3 周龄时的平均体重分别为10.4、10.2 和5.9 g(图2B)。
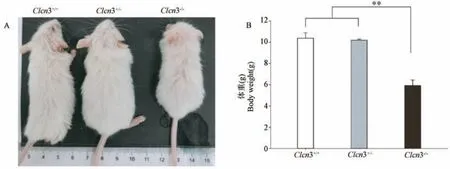
图2 不同基因型小鼠3 周龄时的外形体征及体重Note. A. Physical features of different genotypes mice at 3 weeks. B. Body weight of different genotypes mice at 3 weeks. Compared with Clcn3+/+or Clcn3+/- mice,**P < 0.05.(The same in the following figures)Figure 2 Physical features and body weight of different genotypes mice at 3 weeks
2.3 Clcn3 敲除对小鼠实质器官面积的影响
为进一步剖析Clcn3-/-小鼠生长缓慢和体型矮小之因,我们观察了小鼠主要实质器官的发育状况。 3 周龄小鼠处死后,采集心、肝、脾、肺、肾、脑等组织并拍照,利用Image J 软件测量其面积。 如图3所示,Clcn3+/+和Clcn3+/-小鼠的心脏、肝、脾、肺、肾等器官的投影面积差异不显著(P>0.05),但均显著大于Clcn3-/-小鼠(P<0.05);脾变化最为明显,野生型和杂合子小鼠的脾平均面积为53.6 mm2和50.1 mm2,而Clcn3 敲除的纯合子小鼠的脾面积只有25.5 mm2,减少了将近50%。 此外,不同基因型小鼠脑组织的面积没有显著差异(P>0.05)。 以上数据提示Clcn3 敲除会导致幼龄小鼠主要实质器官减小。
图3 不同基因型小鼠3 周龄时的实质器官面积Figure 3 Parenchymal organs area of different genotypes mice at 3 weeks
2.4 Clcn3 敲除对小鼠实质器官微观结构的影响
Clcn3-/-小鼠生长缓慢,体型矮小,主要实质器官体积明显减小。 HE 染色小鼠心、肝、脾、肺、肾、脑组织切片,观察Clcn3 敲除对小鼠主要实质器官组织结构的影响。 如图4 所示,不同基因型小鼠心脏的心肌纤维呈柱状,卵圆形细胞核位于心肌细胞中央,没有发生明显变化;与Clcn3+/+和Clcn3+/-小鼠相比,Clcn3-/-小鼠单位面积上的心肌细胞数量明显增多提示Clcn3-/-小鼠心肌细胞的体积变小。 小鼠肝的HE 染色切片显示:不同基因型小鼠的肝结构未发生明显改变,肝小叶结构正常,肝细胞核大而圆。 敲除Clcn3 导致小鼠脾红髓和白髓的面积相对变小,脾结构组成未见明显变化。 小鼠肺组织切片HE 染色显示:与Clcn3+/+、Clcn3+/-小鼠相比,Clcn3-/-小鼠的肺泡壁明显变薄,细胞数量减少。Clcn3-/-小鼠肾基本结构健全,肾小球血管球发育不全,即细胞聚集、毛细血管袢不明显。 不同基因型小鼠的脑组织结构未见明显改变。

图4 不同基因型小鼠实质器官的HE 染色Figure 4 Parenchymal organs HE staining of mice
3 讨论
Clcn3 广泛表达于哺乳动物的各种组织细胞中,在细胞增殖、迁移、凋亡、分化、生殖、脑发育以及心血管疾病中等方面具有重要的作用[11,18-22]。Clcn3 基因编辑动物是探讨其功能、参与相关疾病发生发展机制的理性动物模型。 黄雪莲等[23]利用Clcn3 敲除小鼠研究匹伐他汀药物降脂作用的机制。 Xiong 等[24]利用基因编辑技术生产的小鼠在心肌细胞中特异性高表达Clcn3,为研究Clcn3 在心脏中的作用提供了理想的动物模型。 利用基因编辑模式动物探讨Clcn3 基因的功能虽已被广泛报道,但Clcn3 基因敲除对小鼠实质器官的影响还未被系统阐述,尤其是幼龄小鼠。 本实验采集了野生型、杂合子以及Clcn3 敲除的纯合子小鼠的心脏、肝、脾、肺、肾和脑组织,系统分析Clcn3 基因敲除对幼龄小鼠实质器官大小和组织结构的影响。
本实验未使用成年小鼠,均使用3 周龄的幼龄小鼠,可排除因分笼、饮食等外界因素干扰,进而更准确反映Clcn3 敲除对小鼠实质器官发育的影响。本实验发现Clcn3 敲除的纯合子小鼠在3 周龄时的体重显著低于野生型和杂合子的体重,这与潘萌等[1]所描述的一致。 测量不同基因型小鼠实质器官的面积后发现,Clcn3-/-小鼠心、肝、脾、肺、肾的面积显著小于野生型和杂合子小鼠,提示Clcn3-/-小鼠主要实质器官发育迟缓、体积小是小鼠体重明显降低的主要原因之一。 不同基因型3 周龄小鼠脑面积无显著差异,推测:脑作为动物最重要的器官,在动物器官未发育完全之前,机体会优先供应脑发育之需。 总之,本研究发现Clcn3 基因敲除小鼠的实质器官显著减小。
利用器官组织切片HE 染色,我们进一步观察了Clcn3 敲除对小鼠主要实质器官组织结构的影响。 HE 染色结果提示Clcn3 基因敲除未影响小鼠心脏的结构,可导致心肌细胞变小;Clcn3 敲除未影响小鼠脾和肾的结构组成,但明显减小了小鼠脾红髓和白髓的体积以及肾毛细血管球的体积;Clcn3-/-小鼠肺泡壁明显变薄,细胞数量减少;Clcn3-/-小鼠肝和脑组织结构未见明显改变,而Stobrawa 等[22]发现干扰Clcn3 表达会导致小鼠的海马区在7 月龄时消失,而本实验的脑组织HE 切片显示3 周龄小鼠的脑组织结构并没有产生明显改变,这提示我们Clcn3 敲除导致小鼠海马区丢失可能是一个渐进的过程。 综上所述,敲除Clcn3 不会造成小鼠实质器官结构组成改变,但会导致小鼠实质器官的结构或细胞体积减小,这是导致Clcn3 敲除小鼠实质器官面积和体重显著降低的主要原因之一。Clcn3 通过何种机制影响细胞生长、延缓器官发育,有待运用高通量测序、翻译后修饰、基因组、蛋白组学等多种技术手段更加深入地探讨研究。
基因修饰动物在生物医学领域的应用十分广泛,例如发病机制探究,药物筛选等[25]。 本实验探究了Clcn3 敲除对小鼠实质器官的影响,发现敲除Clcn3 会导致幼龄小鼠的实质器官减小,但未对幼龄小鼠实质器官产生明显的病理损伤,可以为相关实验研究提供理论参考。
4 结论
Clcn3 基因敲除会降低幼龄小鼠体重和实质器官的大小,但未对幼龄小鼠实质器官产生明显的病理损伤。

