高脂高糖饮食诱导五指山小型猪动脉粥样硬化模型肠道菌群的变化
沈利叶,潘永明,徐雁云,郁晨,黄俊杰,马全鑫,陈民利
(浙江中医药大学动物实验研究中心/比较医学研究所,杭州 310053)
心血管疾病是全世界人口死亡的主要原因[1],据统计我国心血管疾病死亡率一直占据首位[2],并呈逐年上升趋势,给我国的医疗卫生行业带来了巨大的经济负担[3]。 动脉粥样硬化(atherosclerosis,AS)是心血管疾病的主要病理基础[4],也被认为是一种慢性代谢综合征,其特征是由血管内皮损伤引起的轻度血管炎造成的长期代谢紊乱。 大量的研究已证实,AS 的发生与饮食、血脂异常、糖尿病、高血压各种代谢紊乱性疾病等环境因素有关,而饮食是引起AS 的重要环境因素。 高脂高糖饮食是目前常见的一种生活方式,研究发现高脂饮食能够改变肠道中定植的微生物,从而导致肠道通透性的增加和菌群代谢产物水平的变化,激活体内多条通路[5],加重肥胖与AS 的发生发展[6]。
小型猪与人的各器官系统不仅在形态结构上相似,而且生理学功能也基本相同,特别是心血管系统与胃肠道系统,且AS 病变与人类AS 病变的分布特点相一致,并具有人类成熟斑块的特点[7]。 五指山小型猪是我国的特色小型猪品种。 前期研究发现五指山小型猪在饲喂高脂6 个月后,会发生明显的脂质代谢异常和炎症反应,主动脉病理可见明显的AS 斑块[8],但对肠道菌群的变化尚不清楚。为此,本研究采用高脂高糖饮食诱导五指山小型猪AS 模型,观察五指山小型猪AS 模型肠道菌群的变化,为五指山小型猪在AS 研究中的应用提供参考。
1 材料与方法
1.1 材料
1.1.1 实验动物
12 只3 ~4 月龄普通级雄性五指山小型猪,体重12 ~15 kg,购买于五指山小型猪购自海南省农业科学院畜牧兽医研究所【SCXK(琼)2014-0006】。所有小型猪饲养于浙江中医药大学动物实验研究中心普通环境设施中【SYXK(浙)2018-0012】,室温(22 ± 2)℃,相对湿度 40% ~ 70%,光照黑暗交替12 h/12 h。 所有饲养和操作均经过浙江中医药大学实验动物管理与伦理委员会审查并批准(批准号:ZSLL-2016-0031)。
1.1.2 主要试剂与仪器
苏丹IV 粉末(美国 Sigma 公司);曙红 Y(国药集团化学试剂有限公司);苏木精(上海伯奥生物科技有限公司);总胆固醇(total cholesterol,TC)、甘油三酯(triacylglycerol,TG)、高密度脂蛋白胆固醇(high-density lipoprotein cholesterol,HDL-C)、低密度脂蛋白胆固醇(low-density lipoprotein cholesterol,LDL-C)、葡萄糖(glucose,GLU,)、果糖胺(FMN,fructosamine)等生化试剂盒均购自宁波美康生物科技股份有限公司。 RM2245 半自动石蜡切片机(德国徕卡公司);Autostainer XL 自动染色机(德国徕卡公司);2.0 RS Nana Zoomer 数字切片扫描设备(日本滨松公司);日立3100 全自动生化分析仪(日本日立公司)。
1.2 方法
1.2.1 AS 模型的建立
五指山小型猪经适应性饲养8 周后,根据体重随机分成 2 组,即正常对照(normal control,NC)组和 AS 组,每组 6 只。 NC 组饲喂基础饲料,AS 组饲喂高脂高糖(high fat/sugar diet,HFS)饲料,连续饲喂24 周,HFS 饲料配方为1.5%胆固醇、15.0%起酥油、10.0%蛋黄粉、20.0%果糖、1.0%食盐和52.5%基础饲料,每组饲喂量为体重的2.5%,分成两等份,上下午各1 次,每2 周重新称重计算饲喂量。
1.2.2 生化检测
造模24 周后,禁食不禁水16 h,取前腔静脉血5 mL,3000 rpm,离心 10 min,分离血清,使用日立3100 全自动生化分析仪检测血清TC、TG、HDL-C、LDL-C、GLU、FMN 等生化指标。 同时进行糖耐量试验,耳缘静脉注射1.2 mL/kg 50%葡萄糖注射液,在1 ~ 2 min 内注射完毕,检测注射后 0、5、15、30、60、120 min 的血糖值,计算糖耐量曲线下面积(area under glucose tolerance curve,U-GLU)。
1.2.3 体重与体脂观察
造模24 周后,禁食不禁水16 h,称重,行安死术,取腹部脂肪、大网膜脂肪、肠系膜脂肪、睾丸周边脂肪进行称重。
1.2.4 组织病理观察
动物安乐死后取主动脉弓至腹主动脉髂部的主动脉血管,经4%中性甲醛固定24 h 后,用苏丹Ⅳ染液染色15 min 后,拍照后用Image-pro Plus 6.0 软件测定主动脉的脂质沉积率(脂质沉积率=红染面积/血管总面积×100%)。 另取部分腹主动脉血管组织经10%中性甲醛固定24 h 后,制备4 μm 石蜡切片,进行HE 染色后用NDP.view 2 软件观察腹主动脉血管组织的病变情况,并计算腹主动脉内中膜厚度(intima-media thickness,IMT)。
1.2.5 16S rDNA 测序及生物信息学分析
每组随机取3 只动物的盲肠内容物进行16S rDNA 测序,按照Stool DNA Kit(200)试剂盒说明从五指山小型猪盲肠内容物中提取微生物总DNA。琼脂糖凝胶电泳检测DNA 质量,紫外分光光度计进行DNA 定量。 随后使用引物扩增16S rDNA 基因的可变区(V3 和V4)该部分及16S rDNA 测序交由杭州联川生物科技有限公司完成。 对获得的原始数据进行预处理,质量优化,舍弃低质量序列,连接序列,过滤连接的序列,获得最终用于分析的序列。使用Verseach v2.3.4 软件进行过滤,将相似度大于97%的操作分类单元(operational taxonomic units,OTU)进行分类,进一步使用核糖体数据库项目分类器给每一个OTU 选择一条代表序列,最终得到各OTU 的代表序列和对应丰度。 在Microbiomeanalyst网站上分析菌群α-多样性和β-多样性,在门和属水平上对比两个组的差异,找出具有显著性差异的微生物类型,默认阈值为0.05。 在联川生物云平台上使用 LEfSe(linear discriminant analysis effect size,LEfSe)分析两个组之间差异丰富的微生物分类群,使用联川PICRUSt2 功能分析预测微生物基因功能,然后使用京都基因和基因组百科全书(Kyoto encyclopedia of genes and genomes,KEGG)数据库对预测的基因及其功能进行注释。
1.3 统计学分析
2 结果
2.1 血脂变化
与 NC 组相比,AS 组血清 TC、HDL-C 和 LDL-C均显著升高(P<0.01),但 TG 差异不显著(P>0.05)(见图1)。
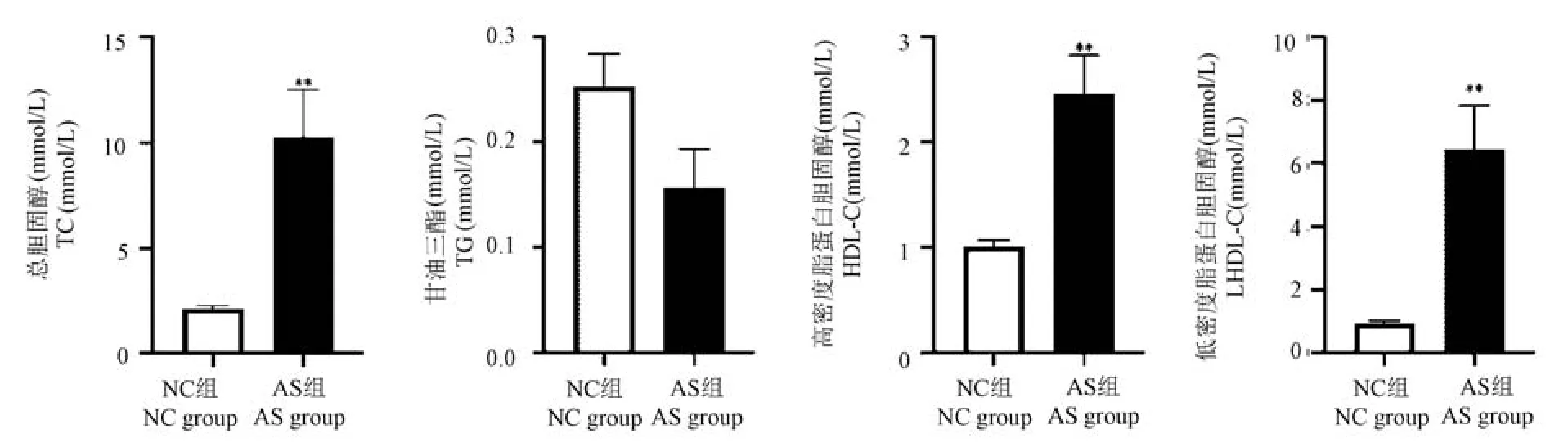
图1 各组血脂水平的变化Note. Compared with NC group,**P < 0.01.Figure 1 Changes of blood lipid levels in each group
2.2 血糖、果糖胺与糖耐量的变化
与 NC 组比,AS 组 GLU 和 FMN 均显著上升(P< 0.05,P< 0.01);糖耐量试验结果显示,AS 模型组给糖后的血糖曲线均高于 NC 组,在 15、60、90 min 时具有显著性差异,且AS 模型组 G-AUC 显著高于 NC 组,(P< 0.05)(见图 2)。
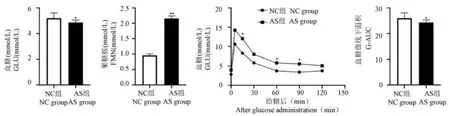
图2 各组血糖、果糖胺与糖耐量的变化Note. Compared with NC group,*P < 0.05,**P < 0.01. (The same in the following figures and tables)Figure 2 Changes of blood glucose, fructose amine and glucose tolerance in each group
2.3 体重和体脂分布的变化
与NC 组相比,AS 组小型猪体重、腹部脂肪、大网膜脂肪、肠系膜脂肪、睾丸周边脂肪和总脂肪重量均显著增加(P<0.01)(见表1)。

表1 各组体重和体脂分布的变化Table 1 Changes of body weight and body fat distribution in each group
2.4 主动脉血管脂质沉积的变化
主动脉血管苏丹Ⅳ染色显示,NC 组血管内皮无明显红染脂质沉积,无突起;而AS 组主动脉血管内皮上有明显红染脂质沉积与脂质条纹,且脂质沉积处呈斑块状突起。 定量分析结果显示,AS 组主动脉血管脂质沉积率显著增加(P<0.01)(见图3)。
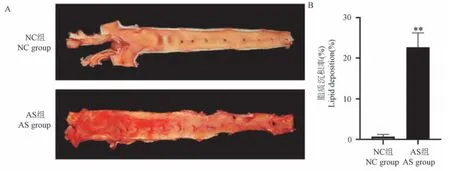
图3 各组主动脉血管脂质沉积的变化Note. A. The representative picture of Sudan IV staining of aortic vessels. B. Lipid deposition rate.Figure 3 Changes of lipid deposition in aortic vessels in each group
2.5 AS 模型腹主动脉血管组织病理学观察
HE 染色结果显示,NC 组腹主动脉血管结构完整清晰,内膜内皮细胞整齐排列,未见有突起斑块,中膜外膜平滑肌细胞排列紧密,弹力纤维层结构完整,未见明显异常。 AS 组腹主动脉血管结构破坏,内膜内皮细胞突起,含大量泡沫细胞及炎性细胞,增生明显,外膜平滑肌细胞与弹力纤维层排列松散。 定量分析结果显示,与 NC 组比,AS组腹主动脉血管IMT 显著增加(P<0. 01)(见图4)。

图4 各组腹主动脉血管组织病理学观察Note. A. The representative picture of HE staining of abdominal aortic vessels,and the right picture is an enlarged 40-fold of the black frame of the left picture. B. Intima-media thickness.Figure 4 Histopathological observation of abdominal aorta in each group
2.6 肠道菌群的分析结果
2.6.1 多样性分析
α-多样性是体现体内肠道微生物物种的个数(丰富度)以及每个物种的数量及分布(均匀度),常见指标为 Chao1、ACE、Observed、Shannon。 Chao1 是C 用Chao1 算法估计样本OTU 数量的指数,可以度量物种类别多样性。 ACE 也是用来估计群落种OTU 数目的指数,与Chao1 的算法不同,这两个指数可以显示肠道微生物群落的丰富度。 Observed 描述的是群落中实际的OTU 的个数。 Shannon 可以描述群落物种的丰富度和均匀度,相同物种丰富度的情况下,群落中的物种均匀度越高,则多样性越大。与 NC 组 相 比,AS 组 的 Chao1、 ACE、 Observed、Shannon 指数均显著降低(P< 0.05,P< 0.01)(图5A,5B,5C,5D)。 β-多样性分析是对不同样本之间的微生物群落构成进行比较分析。 将各样本在属水平下,基于 Bray-Curtis index 距离进行 PCoA 分析。 以第一主坐标(Axis1)为基准,NC 组与 AS 组相距较远,表明长期的高脂高糖饮食能够使五指山小型猪AS 模型的肠道菌群发生(图5E)。

图5 各组肠道菌群多样性分析Note. A. CHAO1. B. ACE. C. Observed. D. Shannon. E.β-diversity.Figure 5 Analysis of intestinal flora diversity in each group
2.6.2 从门水平上分析AS 模型小型猪肠道菌群组成变化
将样本进行OTU 聚类分析,在门的水平上对物种进行分类,五指山小型猪的盲肠内容物中的菌群主要包括厚壁菌门(Firmicutes)、拟杆菌门(Bacteroidetes)、螺旋体菌门(Spirochaetes)、变形杆 菌 门 ( Proteobacteria )、 放 线 菌 门(Actinobacteria)、广古菌门(Euryarchaeota)、疣微菌门(Verrucomicrobia)、软壁菌门(Tenericutes)、互养 菌 门 ( Synergistetes )、 纤 维 杆 菌 门(Fibrobacteres)、梭杆菌门(Fusobacteria)等 11 个门(图6A)。 NC 组的优势菌群为厚壁菌门与拟杆菌门,占所有菌群的90.4%,AS 组的优势菌群为厚壁菌门、变形杆菌门和拟杆菌门,占总菌群的97.2%。 与NC 组比,AS 组拟杆菌门和放线菌门丰度均明显降低(P<0.05,P<0.01),变形菌门丰度则明显升高(P<0.05)(图6C);同时厚壁菌门/拟杆菌门比值亦显著升高(P<0.05)(图6B)。
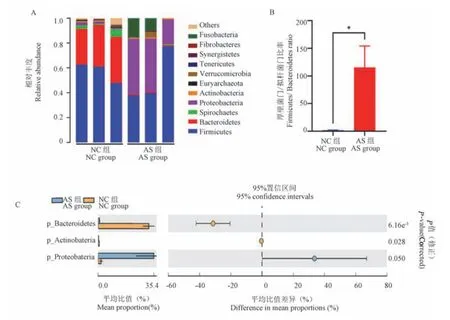
图6 各组肠道菌群在门水平上的变化Note. A. Histogram of relative abundance of intestinal flora at phylum level. B. Firmicutes/Bacteroidetes ratio. C. The differential phylum.Figure 6 Changes of intestinal flora at phylum level in each group
2.6.3 从属水平上分析AS 模型小型猪的肠道菌群组成变化
NC 组与AS 组肠道菌群种类在属水平上分别发现95 个和69 个属,其中普氏菌属(Prevotella)、瘤胃球菌属(Ruminococcus)、粪球菌属(Coprococcus)、考拉杆菌属(Phascolarctobacterium)、埃希氏菌属(Escherichia)为前15 个丰度较高的菌属。 与NC 组相比,AS 组黑斯伯利亚属(Hespellia)、瘤胃球菌属(Ruminococcus)、毛螺菌属(Lachnospiracea_incertae_sedis)、假丁酸弧菌属(Pseudobutyrivibrio)、颤杆菌属(Oscillibacter)、巴恩斯氏菌属(Barnesiella)等17 个菌属的相对丰度显著下降(P< 0.05,P<0.01),沙壤土杆菌属(Ramlibacter)、 鞘氨醇杆菌属(Sphingorhabdus)、污水管杆菌属(Cloacibacillus)、草酸 杆 菌 (Oxalobacter)、 鞘 脂 单 胞 菌 属(Sphingomonas)、新脂醇菌属(Novosphingobium)等11 个菌属的相对丰度显著上升(P<0.05)。 LEfSe分析发现普氏菌属(Prevotella)、 瘤胃球菌属(Ruminococcus)、 考 拉 杆 菌 属(Phascolarctobacterium)、梭杆菌属(Fusobacterium)和芽绿菌属(Gemmiger)等这些菌属在AS 发生过程中产生了影响(见图7)。

图7 各组肠道菌群在属水平的变化Note. A. Venn diagram of NC group and AS group. B. The relative abundance of the top 15 genera. C. Differential genera. D. The LDA bar chart. E. LEfSe diagram.Figure 7 Changes of intestinal flora at genus level in each group
2.6.4 肠道菌群功能预测及与AS 相关指标的关联分析
PICRUSt2 功能分析结果显示,与NC 组相比,AS 组肠道菌群的分泌系统、多糖的生物合成和代谢、脂多糖(LPS)的生物合成、脂多糖生物合成蛋白等15 条途径丰度显著增加(P<0.05),而谷胱甘肽代谢、甘油脂代谢、初级胆汁酸的生物合成、鞘糖脂生物合成-神经节苷脂系列、NOD-样受体信号通路、硫代谢、花生四烯酸代谢、亚油酸代谢、牛磺酸和次生牛磺酸代谢等37 条途径丰度显著降低(P<0.05)(见图8A)。 另外,相关分析显示,草酸杆菌属与IMT、TC 明显正相关,鞘氨醇单胞菌属于TC、IMT、脂质沉积率明显正相关,短波单胞菌属与脂质沉积率、果糖胺明显正相关,污水管杆菌属、未分类的梭菌属、瘤胃球菌属、锥杆菌属、盐生孢杆菌属、毛螺菌属与TC、IMT、脂质沉积、果糖胺明显相关,巴恩斯氏菌属与IMT、脂质沉积、果糖胺呈负相关;未分类的厚壁菌属与脂质沉积、果糖胺呈负相关,黑斯伯利亚属、梭菌属和未分类的毛螺菌属与果糖胺呈负相关(见图8B)。
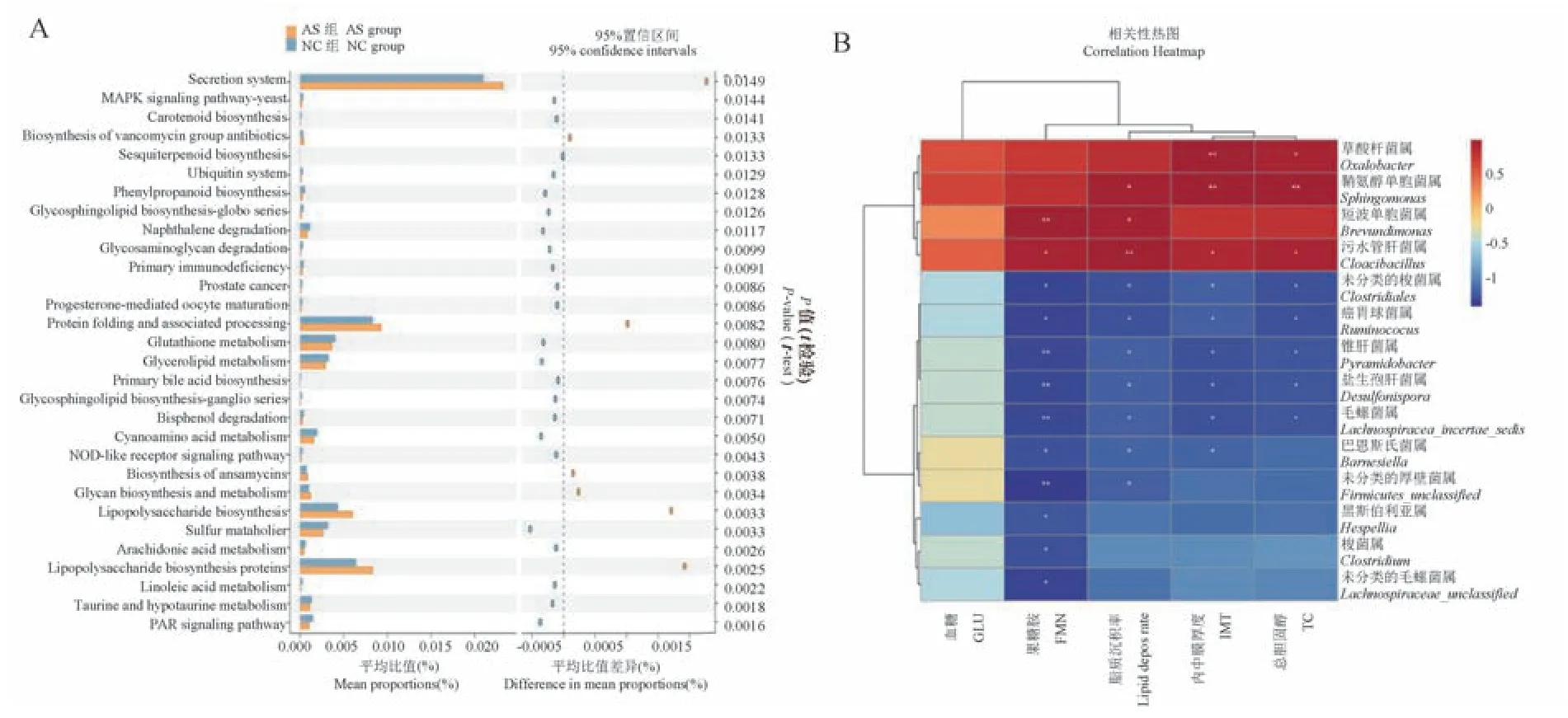
图8 肠道菌群功能预测及与AS 相关指标的关联分析Note. A. PICRUSt2 predicted and analyzed prediction of intestinal flora function by PICRUSt2. B. Correlation analysis between intestinal flora and AS related indicators.Figure 8 Functional prediction of intestinal flora and correlation analysis with AS related indicators
3 讨论
心血管疾病(cardiovascular disease,CVD)是严重危害人类健康的一类重大疾病。 AS 是CVD 的主要病理基础,过度食用富含高脂、高糖的食物和某些环境因素均会导致严重的代谢变化[9],但这种AS相关性进程的起始事件却不完全清楚。 最近研究证实肠道菌群与心脏代谢疾病密切相关[10],营养的摄入、肠道菌群及宿主之间的相互作用会改变CVD的发生率[11]。 五指山小型猪具有在高脂环境下易出现血脂紊乱、肥胖以及易形成AS 的特点[7-8]。 本研究采用模拟人类的高脂高糖饮食饲喂五指山小型猪24 周后,能呈现出肥胖和体内脂肪沉积、糖脂代谢紊乱、糖耐量异常等代谢综合征现象,主动脉血管有明显凸起的脂质条纹,中内膜厚度增加以及典型的AS 病变。 由此可见,五指山小型猪AS 模型的血管病变与人类临床AS 血管病变较为相似。16S rDNA 高通量测序结果显示,高脂高糖饮食后五指山小型猪的肠道菌群多样性明显降低,表明肠道菌群失衡。
正常人群的肠道优势菌门为厚壁菌门和拟杆菌门,其次是放线菌门与疣微菌门[12],这与五指山小型猪的肠道菌群总体特征十分相似。 拟杆菌门是人类及小型猪体内的优势菌种,拟杆菌能够降解食物中的大分子碳水化合物,降解成葡萄糖和其他易消化的小分子糖类,从而提高食物的利用率。 拟杆菌是体内维持体内肠道微生物稳态的重要菌群[10],当体内拟杆菌门特殊物种发生变化,它们在营养消化和能量吸收等代谢功能也会发生变化,可能会导致肥胖、糖尿病、动脉粥样硬化和神经退行性疾病等炎症性疾病[13]。 在肥胖人群中,厚壁菌门与拟杆菌门的比值上升,肥胖人群的心血管患病率也高于正常人群,冠心病患者的拟杆菌门也存在显著下降[14]。 同样,在高脂高糖饮食诱导的AS 模型猪肠道菌群的拟杆菌门显著降低,厚壁菌门与拟杆菌门的比值显著上升,提示高脂高糖饮食诱导五指山小型猪出现的肥胖、糖脂代谢紊乱和AS 的形成,可能与拟杆菌门丰度减少和肠道菌群失调有关。放线菌门虽在肠道微生物中所占比例较小,但放线菌门是维持肠道屏障稳态的主要菌门之一,它还能参与调节肠道通透性、免疫系统、新陈代谢和肠脑轴[15]。 在本研究也发现AS 模型猪的放线菌门显著下降,提示可能存在肠道通透性增加,肠道屏障稳态被破坏的现象。 另外,健康的哺乳动物肠道含有少量变形菌门的细菌,当这些细菌的数量较少时,这些细菌表现为良性,但是当数量增加并改变肠道微生物结构,会成为引发炎症的微生物[16]。 这与本研究中观察到五指山小型猪AS 模型中变形菌门丰度上升相一致,表明高脂高糖饮食会引起五指山小型猪肠道菌群结构改变,影响肠道通透性和肠屏障功能,促发脂质紊乱和炎症,加速AS 形成。
肠道菌群失衡可引起肠粘膜通透性的增加,特别是革兰氏阴性菌外膜上的脂多糖(LPS)可进入血液循环,引发慢性炎症与血栓形成,促进AS 的发生;另外,LPS 也可与 Toll 样受体4 结合,促进脂蛋白相关受体的表达,摄取脂质并影响胆固醇转运,加剧泡沫细胞生成和AS 的发生发展。 在本研究中,观察到五指山小型猪AS 模型中鞘氨醇杆菌属、梭状菌属、鞘氨醇单胞菌属、新鞘氨醇菌属等革兰阴性菌丰度的增加,能产生低毒的LPS,且与菌群功能预测到LPS 的生物合成和LPS 生物合成蛋白途径丰度增加相一致,推测五指山小型猪AS 的发生发展可能与肠道菌群失调引发的LPS 慢性低度炎症有关。
进一步关联分析显示,TC、内中膜厚度、脂质沉积、果糖胺与草酸杆菌属、鞘氨醇单胞菌、污水管杆菌属、梭菌属、瘤胃球菌属等14 个菌属存在关联。Briand 等[17]研究发现,在高胆固醇血症金黄地鼠中Oxalobacter 菌属与总胆固醇水平明显相关,这与本研究一致。 Sphingomonas 的DNA 被发现存在于AS斑块与血清中,该菌可产生脂化蛋白参与体内的免疫反应[18],本研究相关分析也显示该菌与TC、IMT和脂质沉积关联,推测该菌可能参与血管中斑块的生成与发展。 短波单胞菌属普遍存在于土壤和水中,被认为无处不在,有报告发现该菌在心内膜炎的患者血液中存在[19],推测该菌能够激发机体免疫反应,参与促炎反应,从而促进脂质沉积和斑块的发展。 瘤胃球菌属被认为与肥胖等代谢性疾病相关,在肥胖患者中与体重和血脂呈明显正相关[20],且该菌属与机体肥胖、胃肠道炎症、血脂异常、胆汁酸代谢以及AS 斑块发生均相关,同时瘤胃球菌属能够通过降解纤维素产生短链脂肪酸,调节机体免疫反应和血脂代谢[21-22],影响AS 斑块发生,同时该菌属能够产生炎性多糖,诱导Toll 样受体4 产生肿瘤坏死因子-α(TNF-α),而 TNF-α 在 AS 过程中发挥促炎作用[23]。 相关性分析结果发现,瘤胃球菌属与TC、IMT、脂质沉积和果糖胺明显相关,提示瘤胃球菌属在五指山小型猪AS 模型中可能通过产生短链脂肪酸和炎性多糖参与体内糖脂代谢和AS 斑块形成。 最近,毛螺菌属等菌群被发现在冠状动脉粥样硬化患者中丰度降低,且这些患者的脂多糖生物合成蛋白、脂多糖生物合成、蛋白质折叠等途径显著上升[24],同时该菌还被发现与血糖水平相关联,并能够通过产生短链脂肪酸进而调节机体的免疫炎症反应[25]。 同样,在五指山小型猪AS 模型中毛螺菌属丰度下降,提示该菌可能参与AS 进程中的炎症反应。 可见,通过这些菌属与AS 相关指标的关联分析,为进一步寻找AS 发生的关键靶向菌群提供了新的方向,同时也表明了五指山小型猪AS的发生与肠道菌群失调有关。
综上所述,高脂高糖饮食诱导的五指山小型猪AS 模型具有肥胖、糖脂代谢紊乱和明显的AS 病变的特点,其发生可能与肠道菌群失调有关。

