基于全基因组和转录组的绿豆谷胱甘肽转移酶基因及其对镉胁迫的响应
张创娟程 斌杨 乐冷 艳李师翁
(兰州交通大学 生物与制药工程学院,兰州 730070)
谷胱甘肽转移酶(GST,EC 2.5.1.1.8)广泛分布于真核生物与原核生物,该酶蛋白含有1个N 端结构域和一个C端结构域,N 端包括谷胱甘肽结合和催化残基,而相对保守的C 端主要由5~6个螺旋组成,结合疏水底物并决定GST 的特异性和活性[1]。基于免疫交叉反应性、蛋白质序列相似性、基因结构、底物特异性和特定残基的保守性,可将植物GST 分为14类:Phi(F)、Tau(U)、Theta(T)[2]、Zeta(Z)、Lambda(L)、谷胱甘肽依赖性脱氢抗坏血酸还原酶(DHAR)[3]、Metaxins、Hemerythrin(H)、Iota(I)[4]、四氯对苯二酚脱氢卤化酶(TCHQD)、真核翻译延伸因子1B的γ-亚基类(EF1Bγ)、谷胱甘肽氢醌还原酶(GHRs)、含两种硫氧还蛋白的 GSTs(GST2N)、微粒体前列腺素E合成酶2型(mPGES2)[5]。其中Tau、Phi、Zeta、Theta和TCHQD都含有1 个具有催化功能的丝氨酸,Iota、Hemerythrin、DHAR、Lambda、GHRs、m PGES2 和Metaxins类在活性位点的基序中有1 个非常保守的半胱氨酸。Tau、Phi、DHAR 和Lambda四类是植物所特有的,且Tau和Phi类在植物中含量最丰富。DHAR 和Lambda类是单体,对外源底物没有谷胱甘肽结合活性,在氧化还原稳态中发挥作用[6-7]。Iota类仅在非维管植物、藻类和蓝藻中被鉴定,似乎在大多数陆生植物的进化过程中丢失了[4,7]。GST 基因(GST)家族在多种植物中都有研究,例如,甘蓝型油菜基因组含有83个GSTs,44.2%在不同的染色体上,47.6%的重复GSTs具有不同的表达模式[8]。萝卜中鉴定出82个GSTs,分为Tau、Pfhi、Theta、Zeta、Lambda、TCHQD 和DHAR 7类[9]。研究表明,GST 通过催化谷胱甘肽(GSH)的硫醇基团和亲电基团在疏水和有毒底物中的S偶联,保护细胞免受化学诱导的毒性,并提高其耐受性[10]。盐、寒、旱和ABA(脱落酸)处理均导致烟草GST 表达上调[11]。过氧化氢、铜、砷、镉和锌胁迫下,甘薯地上组织中IbGSTU19表达下调,IbGSTU5、IbGSTU3和Ib GSTU12表达上调;而在地下组织中,Ib GSTU24、Ib GSTU27 和Ib GSTU16 表 达 上调[12]。近年来,GST 在植物响应重金属Cd胁迫中的作用受到广泛关注。例如,Cd和Ni显著提高小麦幼苗芽和根中GST 活性[13],200 mg/L Cd暴露72 h 和96 h 增加大豆GST 活性[14],白菜BcGSTUs的表达受到Cd的诱导[15]。绿豆[Vigna radiata(L.)R.Wilczek]是世界范围内广泛种植的豆科作物,主要分布在南亚和东南亚、非洲、南美和澳大利亚[16]。前期的研究发现,Cd胁迫强烈上调绿豆根中GSTs[17],但对于绿豆GSTs及其编码蛋白的特征和功能尚不清楚。为此,本研究运用基因组学方法分析绿豆GST 家族成员及其编码蛋白,并与拟南芥和大豆进行比较;运用转录组学方法分析绿豆GST 在根、茎、叶中的表达谱及其对Cd胁迫的响应;最后,分析Cd胁迫对根、茎、叶中GST 酶活性的影响。本研究结果为植物GST 及其功能研究和绿豆GST 的基因工程应用提供科学资料。
1 材料与方法
1.1 植物材料培养与处理
新鲜绿豆[Vigna radiata(L.)R.Wilczek]种子用蒸馏水冲洗后用75%乙醇浸泡15 min,无菌水冲洗,于(25±1)℃培养箱中暗培养24 h,播种于蛭石和珍珠岩基质(1∶1)的育苗盘中,每盘不少于20株。对照组以1/2 Hogland营养液浇灌,处理组以浓度100μmol/L Cd Cl2·6 H2O 的1/2 Hogland营养液浇灌,每组至少种植3 个生物学重复[17]。将育苗盘置于25 ℃、光强度为2 500 lx、光周期为14/10 h(光照/黑暗)的光照培养箱中培养。在无菌条件下,于培养的第1、5、9天分别取根、茎、叶于液氮迅速冷冻,置于-80 ℃冰箱储存用于RNA提取。于培养的第1、3、5、7、9天分别取根、茎、叶用于GST酶活测定。
1.2 转录组测序与基因表达分析
用RNA 提取试剂盒(SK8631,上海生工生物)按操作说明进行总RNA 提取,所得总RNA溶解于50μL无RNA 酶的水中,于-80 ℃冰箱储存。用安捷伦2100 生物分析仪和NanoDrop ND-1 000 分光光度计评估RNA 质量和浓度,RIN 值为8.1~9.9,OD260/280为1.8~2.2。用Truseq TM RNA(Illumina)试剂盒纯化m RNA,Truseq TM DNA(Illumina)试剂盒构建cDNA 文库,用安捷伦2100 生物分析仪检测cDNA 文库的质量。文库构建及转录组测序由上海美吉生物医药科技有限公司进行。
转录组测序得到的raw reads,用软件FastQC V0.10.1设置ASCII Q-score偏移量为33进行质量评估,使用软件HISAT2(http://ccb.jhu.edu/software/hisat2/index.shtml)将产生的clean reads 与绿豆基因组(https://www.ncbi.nlm.nih.gov/genome/? term =Vigna radiata)进行比对,使用软件String Tie(http://ccb.jhu.edu/software/stringtie/)将比对的reads组装为转录本,软件RSEM 对基因的表达水平进行定量分析,表达量的结果以TPM(transcripts per kilobase per million mapped reads)值表示,利用软件DESeq2进行样品间基因差异表达分析,设置参FDR<0.05,|log2FC|≥1,符合标准的基因为差异表达基因(DEGs)。
1.3 GST酶活分析
0.5 g 植物材料,液氮研磨,加3 m L 0.2 mol/L 的Tris-HCl缓冲液(含1 mmol/L Na2-EDTA,5 mmol/L DTT,p H 7.8)研磨成匀浆,倒入预冷离心管中,用1 m L 缓冲液冲洗研钵一并倒入离心管,于4 ℃12 500 r/min 离心15 min,上清液为粗酶液。酶反应体系为2.7 m L 0.1 mol/L磷酸盐缓冲液(含1 mmol/L Na2-EDTA,p H 6.5),0.1 m L 30 mmol/L 的GSH,50 μL 粗 酶 液,然 后 加 入0.1 m L 30 mmol/L 的1-氯-2,4-二硝基苯(CDNB)启动反应,以不加CDNB的空白管为对照,测定OD340,计算酶活(U/g),1 U=1μmol/min,每个样品重复3次。
1.4 绿豆GST基因鉴定及特征分析
分别从TAIR(https://www.arabidopsis.org/browse/genefamily/gst.jsp)数据库和Legume Information System (LIS,https://legumeinfo.org/)数据库中检索拟南芥和大豆GST 序列,通过NCBI的BLASTN 比对(E-value<10-10)和绿豆全基因组数据检索,获得候选的绿豆GSTs,NCBI的保守域数据库(https://www.ncbi.nlm.nih.gov/Structure/cdd/wrpsb.cgi)确定其蛋白质结构中含有典型的GST_N 和GST_C 结构域[18],确定绿豆GST 家族成员,采用绿豆拉丁名首字母缩写“Vr”为前缀,后接GST 和分类简写,最后接唯一编号进行命名,例如VrGSTF1。
用MEGA 7.0软件的Clustal W 邻接法构建绿豆GST 氨基酸序列系统树,获得Newick树文件,使用在线软件MEME(https://meme-suite.org/meme/)进行GST 蛋白序列的保守motif分析,motif的数量设置为10,分析结果以XML 文件输出,将获得的Newick 树文件、XML 文件和基因组注释文件通过Tbtools软件可视化。
1.5 绿豆GST蛋白特征分析
用ProtParam tool (http://web.expasy.org/protparam/)在线软件预测GSTs的理化性质,包括分子质量、理论等电点和氨基酸组成等[19]。在Wo LFPSORTⅡ(https://www.genscript.com/wolf-psort.html)预 测GST 亚 细 胞定位。Pfam Search(http://pfam.xfam.org/search#tabview=tab1)分析GST 结构域,分析结果用Tbtools软件可视化。
1.6 GSTs系统发育分析
使用ClustalW 进行拟南芥、大豆及绿豆GSTs比对[20],使用MEGA 7.0邻接法构建系统发育树,bootstrap设置为1 000[21],并使用iTOL在线软件(https://itol.embl.de/itol.cgi)可视化[22]。
2 结果与分析
2.1 Cd胁迫对绿豆幼苗生长的影响
形态学统计分析表明,100μmol/L CdCl2胁迫显著抑制绿豆幼苗的生长(表1),导致株高降低4.4%,根长降低10.4%,侧根数减少28.4%,茎叶鲜质量和干质量分别减少16.4%和16.3%,根鲜质量减少16.5%。表明Cd严重影响根伸长和侧根生长,而对根干质量无影响,这可能与根吸收和积累了过量Cd有关。
表1 Cd胁迫绿豆幼苗形态指标(±s)Table 1 Morphological parameters of mung bean seedlings under Cd stress

表1 Cd胁迫绿豆幼苗形态指标(±s)Table 1 Morphological parameters of mung bean seedlings under Cd stress
样本Samples株高/mm Plant height根长/mm Root length侧根数Lateral root No.茎叶鲜质量/g Shoot fresh mass茎叶干质量/g Shoot dry mass根鲜质量/g Root fresh mass根干质量/g Root dry mass CK 181.75±3.46 a 135.53±11.40 a 29.18±2.13 a 305.67±12.25 a 30.0±0.5 a 172.33±13.59 a 8.11±0.73 a 100μmol/L CdCl2 173.62±3.19 b 121.38±3.43 a 20.9±1.19 b 255.57±11.78 b 25.1±0.29 b 143.88±4.08 b 8.13±0.51 a
2.2 绿豆GST基因及其结构特征
从TAIR 和LIS数据库中检索到53个拟南芥和100 个大豆GST 蛋白序列,通过BLASTN比对和全基因组数据检索,获得候选基因,然后通过NCBI的保守域数据库(CDD)用来识别基因编码蛋白质中典型的GST_N 和GST_C结构域,最终鉴定出93个绿豆GST 家族成员,将其命名为Vr GSTs,包括Tau、Phi、Lambda、Theta、Zeta、DHAR、EF1Bg、GHRs、mPGES2 和TCHQD10类,其分类命名见表2。其中属于Tau 类和Phi类GSTs最多,分别为38和12个。
在系统进化树中(图1),Tau类为一大分支,各亚类在进化关系上最近,聚集在同一小的分支。保守基序分析结果表明,Vr GSTs在motif数目和种类上差异较大,Motif 2几乎是所有基因共有的,存在于91%的基因;同一分类motif分布具有相似性,如Tau类都含有motif(1-6),Phi类都含有motif 2、motif 4和motif 9,GHRs类具有完全相同的motif分布。基因结构分析结果表明,不同类Vr GSTs在结构上具有较大差异,同一分类Vr GSTs 结 构 高 度 相 似;除Vr GSTF7、Vr GSTF8、Vr GSTL1 没有内含子外,其余基因都有2~3个内含子,外显子数目在2~10个不等(图1-c),Tau 类 和TCHQD 类 都 含 有2 个 外 显 子,Phi类除VrGSTF1 和Vr GSTF7 外都含有3 个外显子,GHRs类有5 个,Lambda、Theta、Zeta、DHAR、EF1Bg 和mPGES2 有 较 多 的 外 显 子(6~10个)。
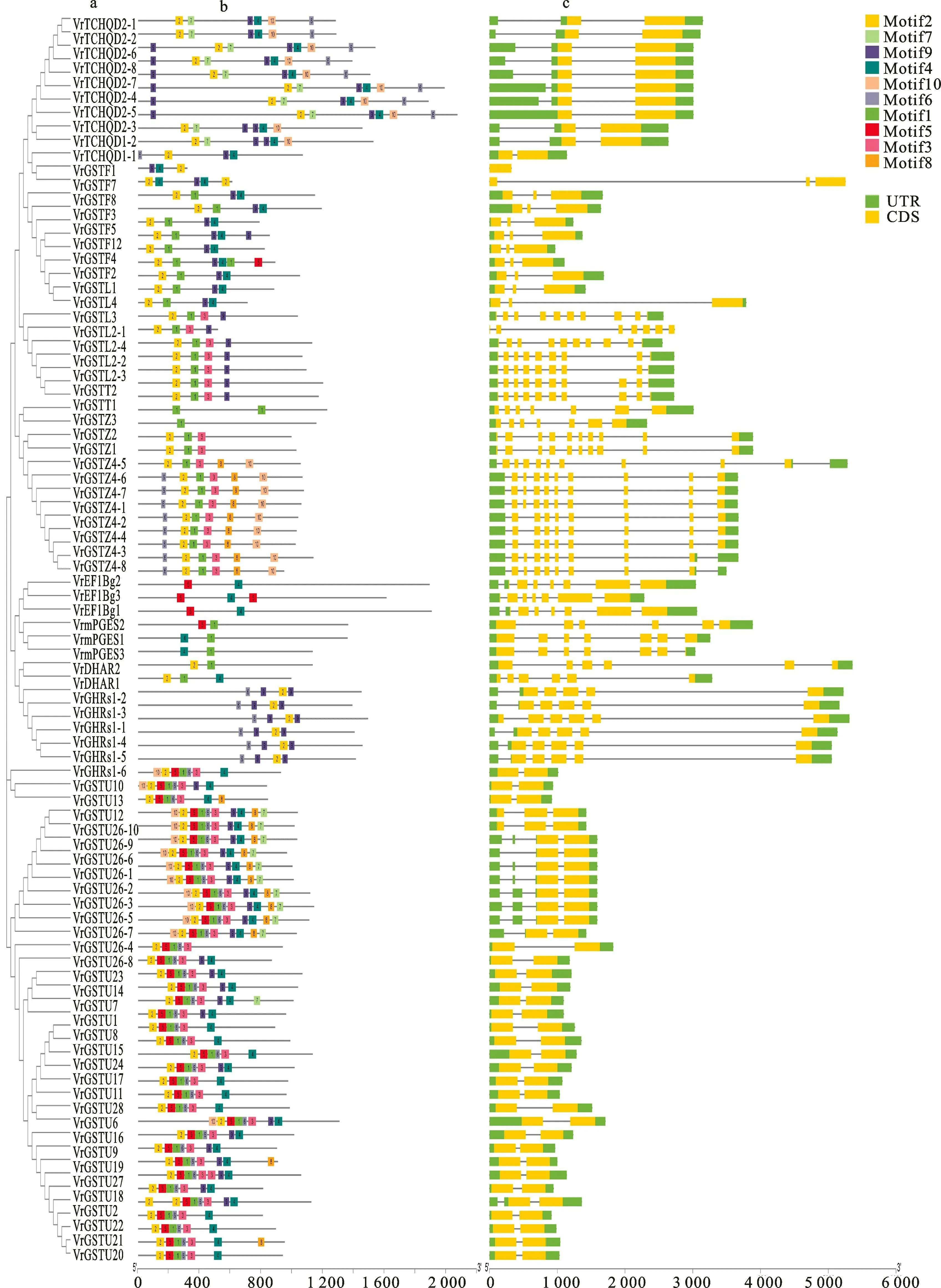
图1 绿豆GST亲缘关系(a)、保守motif(b)和基因结构(c)Fig.1 Phylogenetic relationship(a),conserved motif(b)and structure of mung bean GSTs(c)
2.3 绿豆GST蛋白结构及特征
ProtParam tool软件对绿豆GST 的理化性质的预测结果见表2。绿豆GSTs 的氨基酸数目为107(Vr GSTF7)~ 420(Vr EF1Bg1、Vr EF1Bg2),Vr GSTF7、VrGSTL4、Vr GSTZ4-3和Vr GSTZ4-8少于200,Vr EF1Bg1-3、m PGES1-2 和GHRs 类 多 于300 个 氨 基 酸 外,其 余(84.2%)氨基酸数目均在200~300。分子质量介于12.42~47.93 ku,分子质量最小的为氨基酸数目最少的Vr GSTF7,分子质量最大的为Vr EF1Bg3,GHRs和mPGES2类分子质量也比较高,最高分别为42.19 和40.19 ku,大多(70.5%)集中在20~30 ku。等电点的范围为4.52~9.67,其中Theta、m PGES2和TCHQD 类的等电点都大于8,Vr GSTU10、Vr GSTU14、Vr GSTF1、Vr GSTF 7、Vr GSTF 8和Vr DHAR 2的等电点大于7,分别为7.87、8.38、7.69、8.01、7.68和8.62,其余(77.89%)的蛋白的等电点都在4.52~6.82内,大多数都为酸性蛋白。蛋白质亚细胞定位预测结果表明Vr GSTs分布于细胞质、叶绿体、细胞核、线粒体及过氧化物酶体,但主要存在于细胞质中,其中Vr GSTT2、Vr GSTF10、VrGSTF11、VrmPGES2定位于线粒体中,Vr GSTU1、Vr GSTL1等19个定位于叶绿体。

表2 绿豆GST蛋白特性Table 2 Characteristics of the GST protein of mung bean
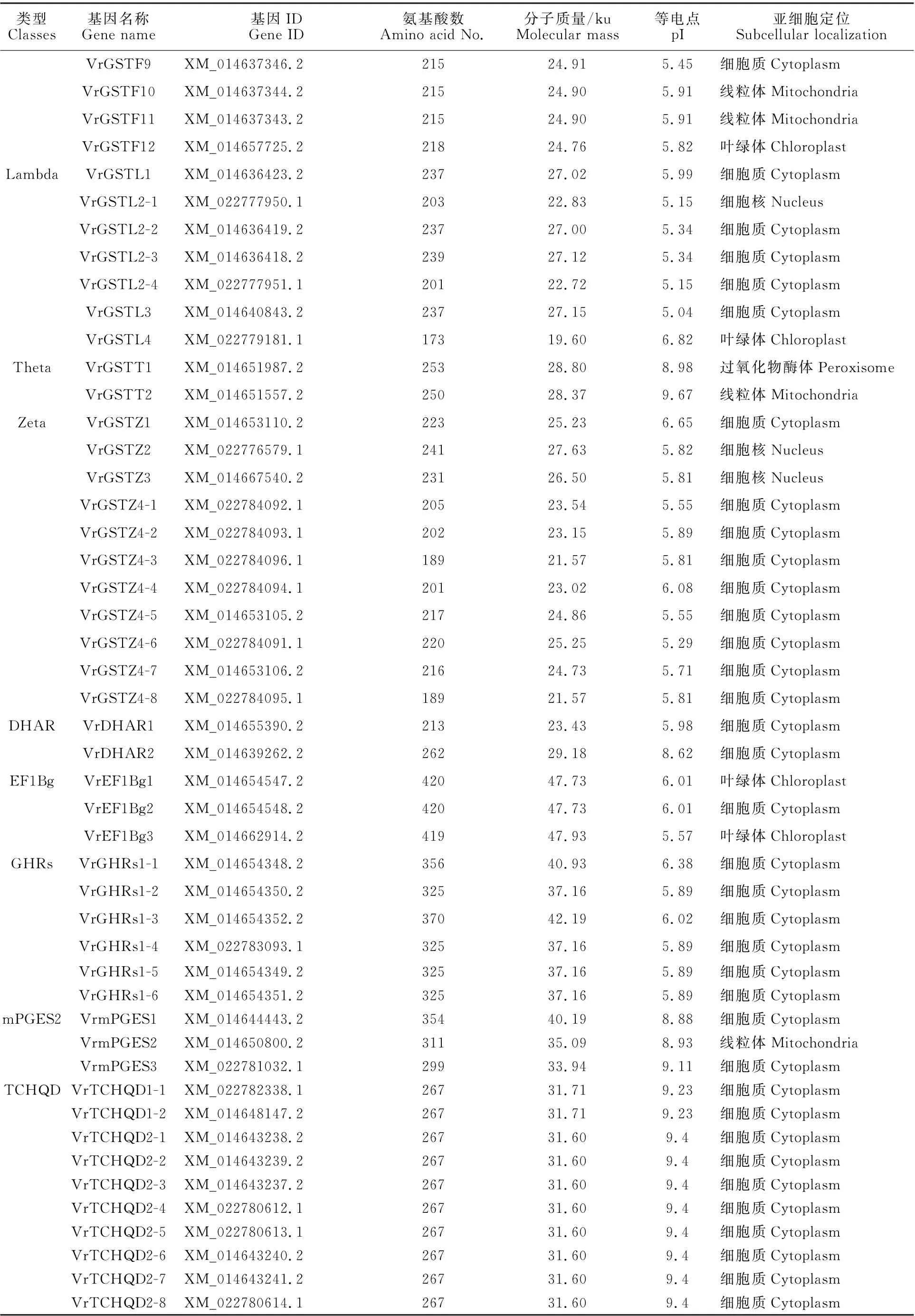
(续表2 Continued table 2)
对 Vr GST 结构域分析表明(图2),Vr DHAR2、Vr GSTL2-1、Vr GSTL2-4 和Vr GSTL4只含有GST_N 端结构域,Vr GSTF7 和Vr GSTF8只含有GST_C 端结构域,其余Vr GSTs都含有GST_N 和GST_C 结构域。Tau类都具有GST_N_Tau和GST_C_Tau结构域,Phi属于同一个超基因家族,此外EF1Bg(1-3)还具有其独特的EF1G 结构域。

图2 绿豆GST蛋白结构域Fig.2 Domains of mung bean GST proteins
2.4 Vr GST系统发育关系
将Vr GST 与拟南芥和大豆GST 氨基酸序列共构建进化树(图3),结果显示GST 家族可分为三大分支,Tau类和Lambda类各占一个分支,其余8类聚为一支,Vr GST 与大豆GST 亲缘关系较近,而与拟南芥GST 较远,且绿豆和大豆具有较多的直系同源蛋白对,分别为Lambda类的VrGSTL1/GmGSTL3,DHAR类的VrDHAR2/Gm-DHAR2, EF1Bg 类 的 VrEF1Bg3/GmEF1Bg和Tau 类 的VrGSTU23/GmGSTU23、VrGSTU14/GmGSTU17、 VrGSTU9/GmGSTU8、 VrGSTU2/GmGSTU24、VrGSTU11/GmGSTU1、VrGSTU10/GmGSTU27、VrGSTU12/GmGSTU26、VrGSTU17/GmGSTU25,Tau 类在植物中最为丰富,其直系同源蛋白对也最多。
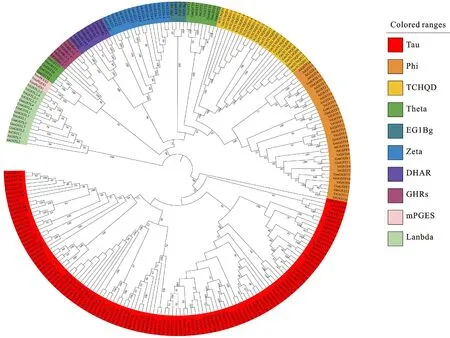
图3 绿豆GSTs与拟南芥和大豆的系统发育树Fig.3 Phylogenetic tress of GSTs from genomes of mung bean,A.thaliana and soybean
2.5 Vr GST在根、茎、叶中的表达模式
转录组测序结果表明,共有40个VrGSTs在绿豆根、茎或叶中表达,其中Vr GSTF7、Vr GSTF8和Vr GSTF12 的表达量TPM 值接近于零,37 个Vr GST 表达模式见图4,其中Vr GSTF2、Vr GSTF9 和Vr GSTU22 只 在 叶 中 表 达,Vr GSTU27只在茎中表达,Vr GSTL4 和Vr GSTU2只在根中表达,其余31个基因在根茎叶中都表达。Vr DHAR1、Vr GSTF11、Vr GSTU6 等14个基因的表达量基本呈现根>茎>叶的趋势,Vr GSTF1、Vr GSTF3、Vr GSTL3 等9 个 基 因 在茎中表达量最高,Vr DHAR2、Vr GSTU7、Vr GSTU8 等 7 个基因在叶中表达量最高。Vr DHAR1、VrGSTF1、Vr GSTU7、Vr GSTU8、VrGSTF11和Vr GSTF11 等基因在根、茎、叶中表达量都很高。其中Vr GSTU7和Vr GSTU8是叶中表达量最高的基因,在叶中最高分别达到817TPM 和266TPM ,同时,Vr GSTU7也是茎中表达量最高的基因,表达量TPM 为250,根中表达量最高的Vr GSTF11 TPM 为200。结果表明,VrGSTs的表达具根、茎和叶的组织特异性,且基因在根茎叶中的表达没有明显的时序性。
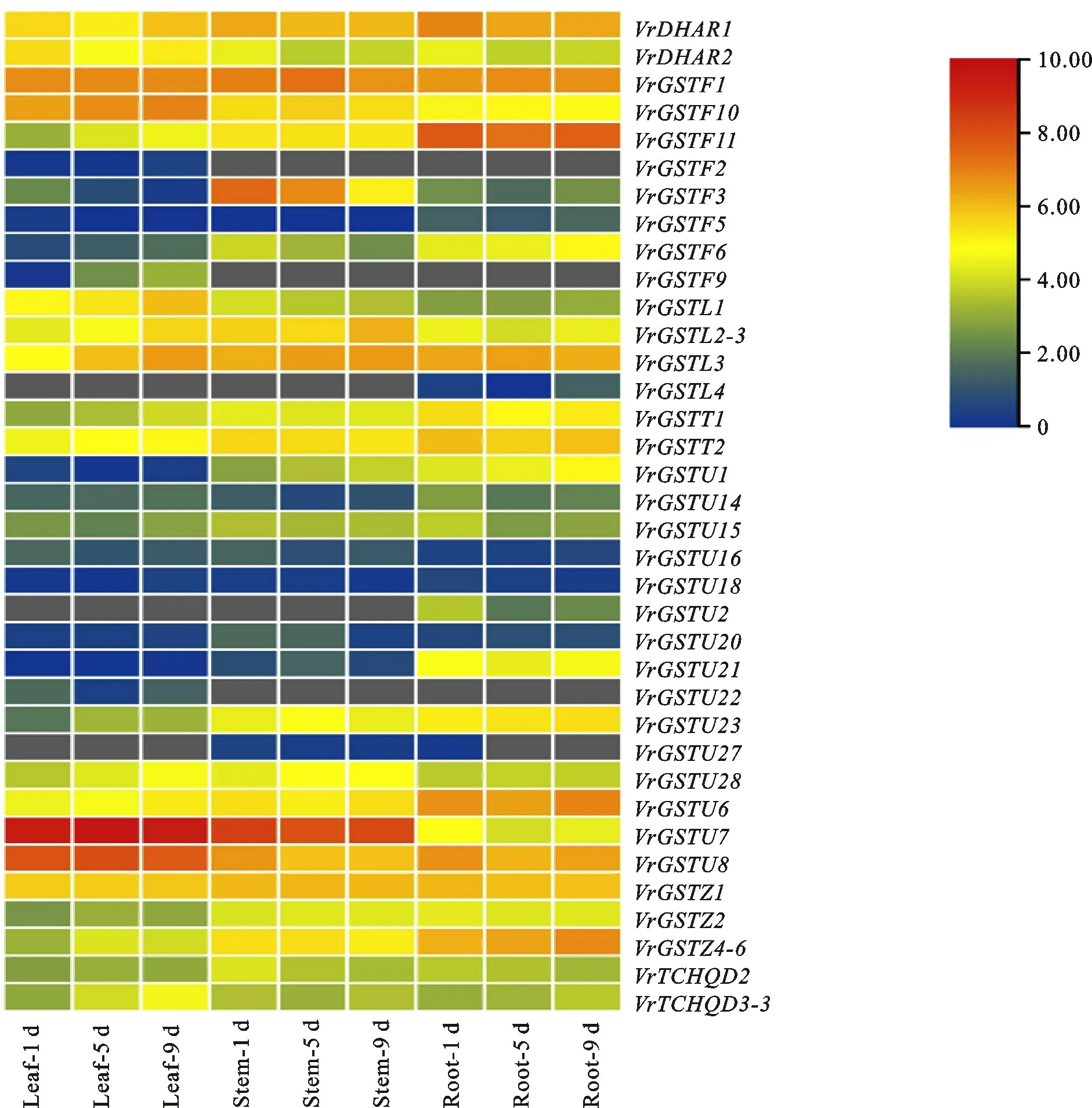
图4 绿豆VrGSTs在根、茎和叶中的表达谱(数据为log2 TPM 值)Fig.4 Expression pattern of VrGSTs in mung beanroot,stem,and leaf tissues(Data are shown as log2 TPM)
2.6 Cd胁迫对VrGST表达的影响
如图5所示,Cd胁迫第1天,根、茎、叶中分别有11、6、6个Vr GSTs显著上调,平均上调倍数分别为2.48、1.99和2;分别有8、1、2个Vr GSTs显著下调,平均下调倍数分别为1.44、2.05 和1.5。Cd胁迫第5天,根、茎、叶中分别有11、11、9个Vr GSTs 显著上调,平均上调倍数分别为2.15、2.24和3.69;分别有8、2、2个Vr GSTs显著下调,平均下调倍数分别为2.59、1.48 和2.06。Cd胁迫第9 天,根、茎、叶中分别有11、11、5个Vr GSTs显著上调,平均上调倍数分别为1.88、2.53和4.09;分别有11、2、8个VrGSTs显著性下调,平均下调倍数分别为2.44、1.55 和1.61。其中,根、茎、叶中随时间延长显著上调的基因分别为10、8和4个,平均上调倍数为2.17、2.25和3.26。表明差异表达Vr GSTs数量呈现根>茎>叶的明显趋势,说明Cd 胁迫对根中Vr GST 表达的影响最强。而且,茎中被Cd显著上调的Vr GST 数量明显多于显著下调的数量,表明茎中Vr GST 在Cd 响应中也起重要作用。有趣的是Vr GSTU2在对照组的茎中不表达,而在Cd处理的第9天被显著上调4.07倍。Cd胁迫下叶 中Vr GSTF3、VrGSTF6 和Vr GSTU1 分别被显著上调达3.72、6.81 和5.87 倍;茎中VrGSTF11、VrGSTF6、Vr GSTU1、Vr GSTU2、Vr GSTU23和Vr GSTU28 分别被显著上调达2.93、3.28、2.51、4.07、2.40 和2.03 倍;根 中Vr GSTF11、Vr GSTL3、Vr GSTL2-3、 Vr GSTU23、VrGSTU28 和Vr GSTU2 分 别 达 别 被 显著上调3.17、1.39、2.89、2.52、3.32和3.29倍。VrGSTF5和VrGSTU16在根中被显著下调,而在叶被上调;Vr GSTU23 在叶中被显著下调,但是在根和茎中都为上调。上述结果表明,Cd 对根、茎和叶中Vr GST 表达的影响不同,也说明根、茎、叶中响应Cd胁迫的Vr GST 不相同。
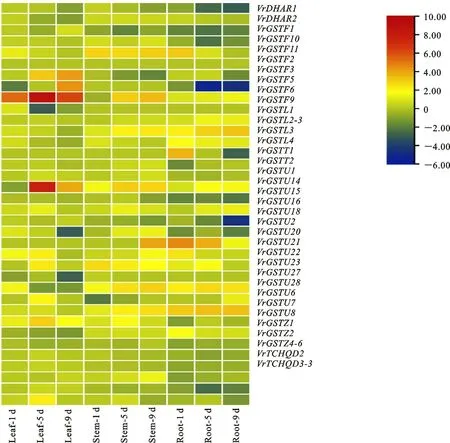
图5 Cd胁迫下绿豆GSTs表达谱(数据为log2 FC)Fig.5 Expression profile of mung bean GSTs in response to Cd stress(Data are shown as log2 FC)
2.7 谷胱甘肽(GSH)代谢途径对Cd 胁迫的响应
为进一步了解GSH 代谢途径对Cd胁迫的响应,对参与该途径的基因表达进行了转录组层面的分析,发现直接参与GSH 合成与分解的39个基因编码14酶(图6),包括4个γ-谷氨酰羟化酶/γ-谷氨酰肽酶(EC:2.3.2.2,3.4.19.13)、2个GSH 羟化酶(EC:2.3.2.2,3.4.19.13)、2 个γ-谷氨酰环转移酶(EC:4.3.2.9)、1个谷氨酸-半胱氨酸连接酶(EC:6.3.2.2)、6个葡萄糖-6-磷酸脱氢酶(EC:1.1.1.49)、3个GSH 还原酶(EC:1.8.1.)、1个GSH 合酶(EC:6.3.2.3)、8个异柠檬酸脱氢酶(EC:1.1.1.42)、4个peroxiredoxin(EC:1.11.1.27)、1个GSH 过氧化物酶(EC:1.11.1.12)、1 个thiol-disulfide oxidoreductase(1.8.4.7)、2个thiosulfate sulfurtransferase(2.8.1.3),以及40个编码GSTs(2.5.1.18)基因。这些基因的共同调控维持细胞内GSH 动态平衡。基因表达分析表明,根中大多数基因被Cd下调,而叶和茎中大多数基因被Cd上调,这一方面说明,由于根、茎和叶中Cd浓度不同,对基因表达的影响不同;另一方面说明根、茎和叶中参与GSH 代谢基因对Cd的响应不同。在茎和叶中,上述基因表达水平上调,促进了GSH 合成和GSH 与GSSG 之间的转化,而在根中这些基因表达的下调和GSTs的上调,会影响细胞内GSH 的水平。然而,由于GSTs催化一个R 基团(主要是烷基和芳香基)转移到GSH 上,而无外源供给时,细胞内并不会积累烷基和芳香基。因此,Cd胁迫导致GSTs基因表达上调和酶活性升高,可能不直接造成GSH 减少,影响细胞内GSH 平衡。
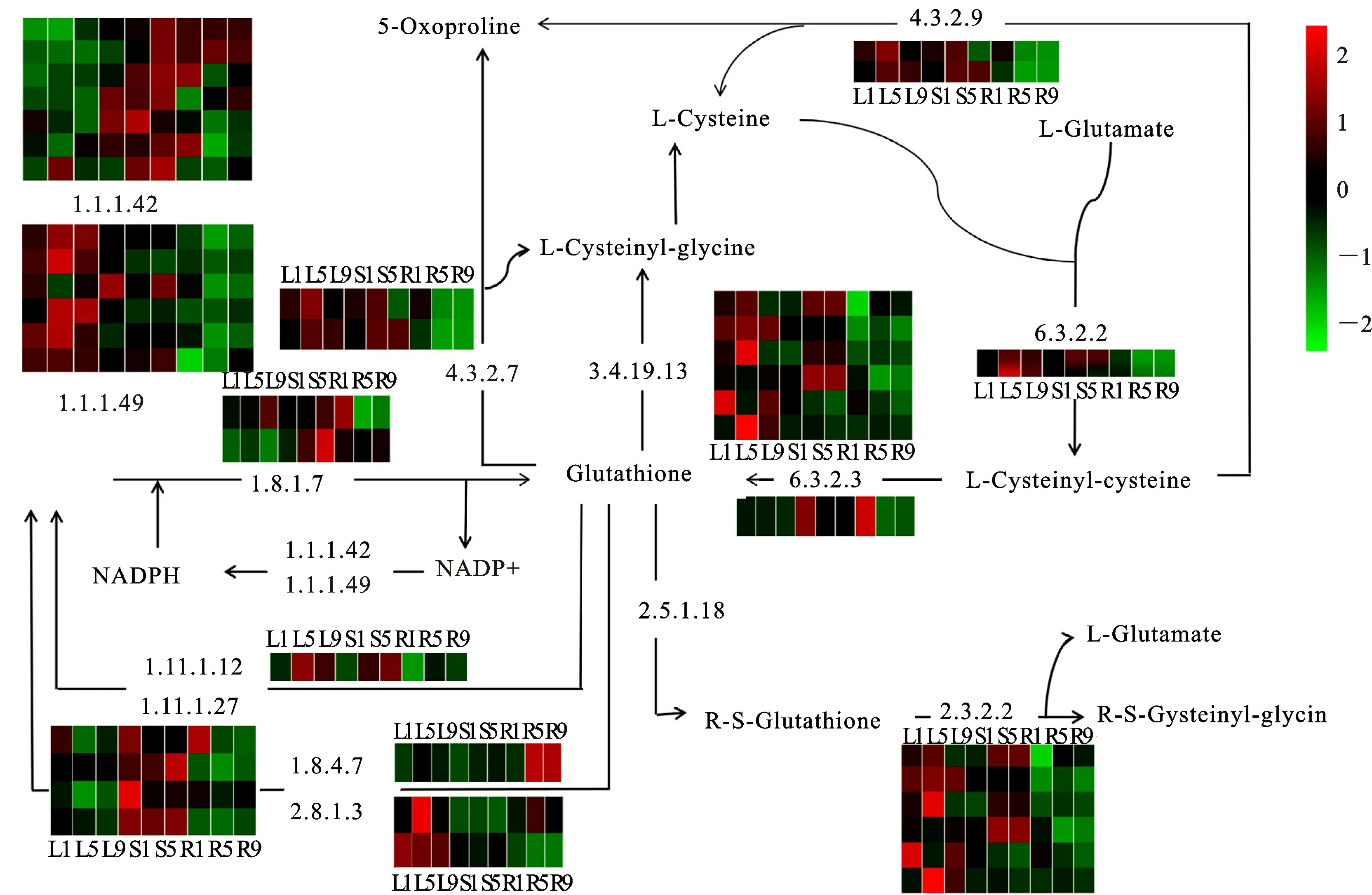
图6 谷胱甘肽代谢途径对Cd胁迫的响应(图中热图表示该基因在叶、茎和根中3个时间点的表达)Fig.6 Response of glutathione metabolism to Cd stress(Heat maps show expression of corresponding genes in leaves(L),stems(S),and roots(R)at threepoint-in-time)
2.8 Cd胁迫对GST酶活性的影响
GST 酶活性分析表明(图7),对照组根、茎和叶中平均GST 酶活性分别为163.85 U/g、173.79 U/g和276.59 U/g,表明叶中的酶活高于茎和根。Cd处理组根、茎和叶中平均GST 酶活性分别为350.85 U/g、216.09 U/g和265.78 U/g,根和茎中GST 酶活分别上升2.14和1.27倍,根中的酶活变化显著高于茎和叶,这与Vr GST 表达谱(图4)和Cd处理对其表达的影响结果一致(图5)。Cd处理对叶中GST 活性影响较小(图7-a),只在第1天显著降低叶中GST 活性下。然而,Cd显著升高茎中第5、7、9 天GST活性,分别比对照组提高29%、27%和27%;显著升高根中1、3、5、7、9 d GST 活性,分别比对照组提高了48%、53%、50%、59%和51%。显然,Cd对根中GST 活性的影响最大,茎中GST 活性对Cd的响应具有滞后性。也说明根中GSTs在响应Cd胁迫中起最主要作用。
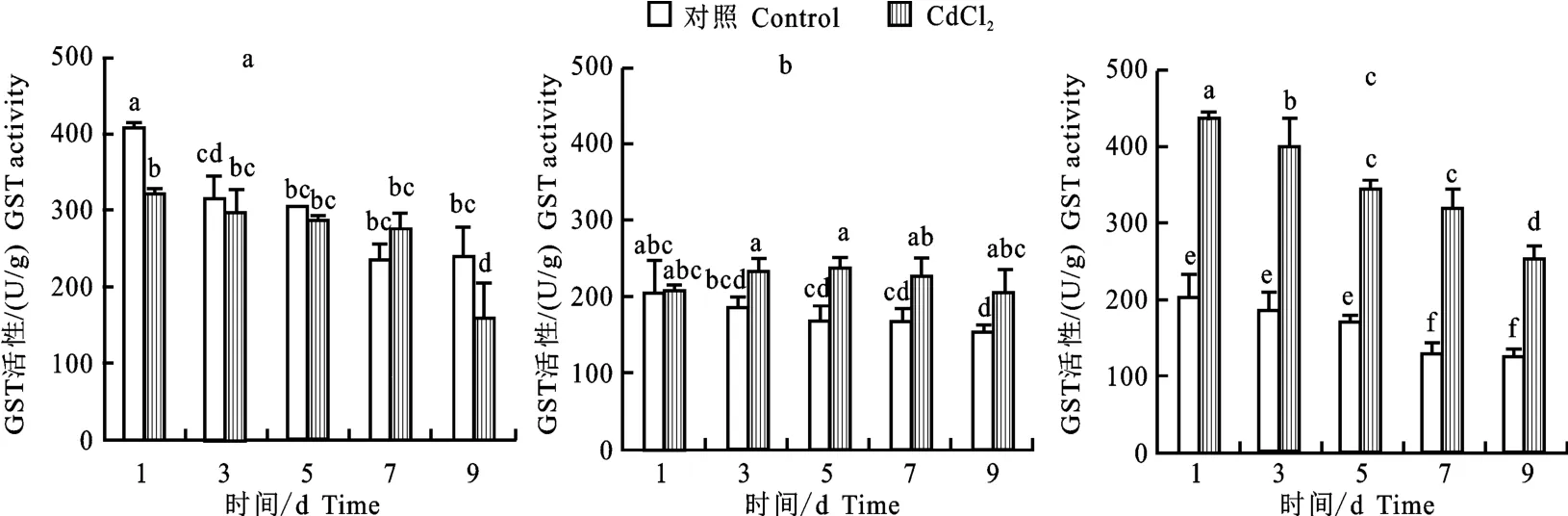
图7 Cd胁迫绿豆叶(a)、茎(b)和根(c)中GST酶活性Fig.7 Activity of GST enzyme in leaf(a),stem(b),and root(c)tissuesunder Cd stress
3 讨论
GST 因其在植物响应非生物胁迫中起重要作用而被广泛关注,研究者通过全基因鉴定了101个大豆[23]、62个柑橘[24]、81个毛果杨[3]、54个拟南芥[25]、59 个水稻[26]GST 家族成员,本研究鉴定了93个绿豆GST 家族成员,表明不同植物中GST 基因家族成员的数量差异较大,就目前结果而言,豆科植物具有更多GST 家族成员。绿豆93个Vr GSTs中Phi和Tau数量最多,这与Phi和Tau类在植物中含量最丰富一致[27]。基因结构分析结果显示,不同类型的Vr GST 内含子与外显子的数目和分布存在较大差异,同一类Vr GSTs具有相似的结构,与甘蓝型油菜GST 结构分析结果相一致[27]。Tau类含有2个外显子,Phi类含有3 个外显子,与大豆GST 结构相类似[23],也符合高等植物Tau 类和Phi类的GST特 征[28]。Vr GST 的 Zeta、Lambda、Theta、DHAR、EF1Bg 和mPGES2 类 有6 个 以 上 外 显子,与文献报道一致[29-30]。所有确定的Vr GSTmotif中,motif 2 存在于91%的基因中,Tau 含有所有的motif,类似于已经报道[31]。
系统发育分析表明,绿豆、大豆和拟南芥属于同一亚类的GSTs聚集在一起,且绿豆和大豆的亲缘关系最近,具有多个直系同源蛋白对。GST有两个结构域:N 端和C 端结构域。N 端结构域包含α-螺旋和β-链,C端结构域均为α-螺旋结构。除Vr DHAR2、VrGSTL2-1、VrGSTL2-4和Vr GSTL4只含有GST_N 端结构域,Vr GSTF7 和Vr GSTF8只含有GST_C 端结构域,其余Vr GSTs都含有为GST_N 和GST_C结构域,N 端结构域类型和位置更为稳定,这意味着N 端结构域更保守,这与在其他植物中研究的结果类似[3,23,32]。所有植物的GSTs分子质量约为50 ku,由两个大小相似(约25 ku)的亚基组成,等电点在4~5[33]。绿豆Tau类和Phi类的分子质量在以前研究的数据范围内,但是EF1Bg、GHRs和mPGES2类最高分别为47.73、42.19和40.19 ku,此结果与Swati对绿豆GST 蛋白分析的结果相同[31],说明不同植物间GST 的理化性质也存在很大的差异。亚细胞定位分析表明,Vr GSTs主要分布于细胞质中,其中VrGSTT2、Vr GSTF10、Vr GSTF11、VrmPGES2 定 位 于 线 粒 体中,参与维持线粒体中的GSH:GSSG 比率,这符合线粒体中有高浓度GSH[34];Vr GSTU1、Vr GSTL1等19个定位于叶绿体,叶绿体的GSTs在其他植物中也有鉴定[35]。
GST 的表达存在组织差异性和特异性[36],绿豆Vr GSTF2、Vr GSTF9和Vr GSTU22只在叶中表达,Vr GSTU27 只在茎中表达,VrGSTL4 和Vr GSTU2只在根中表达,Vr GSTU7在叶和茎中表达量最高,VrGSTF11在根中表达量最高。He等[36]对荠菜的研究表明,25个Tau类GSTs中,13个在所有检测的组织中表达,12 个选择性表达。其中Cr GSTU23仅在根组织中表达,Cr GSTU5和CrGSTU19 仅在种子组织中表达,而Cr GTU10 仅 在 下 胚 轴 区 表 达,12 个Phi 类GSTs,5个在所有组织中表达,5个选择性表达,还有两个在所有组织中都不表达。酶活分析表明,对照组中酶活呈现叶>茎>根的趋势,这可能与Vr GSTU7在茎叶中的高表达有关,Vr GSTU7在茎和叶中的表达量分别达到TPM 680 和TPM250,而根中表达量最高的Vr GSTF11只达到TPM 200,可能与GSTs参与茎和叶中色素的转运有关[37]。形态学指标显示,Cd胁迫严重影响绿豆幼苗的生长。转录组分析发现,Cd 胁迫下,根和茎中上调基因的数量明显高于叶中,相应的根和茎中的GSH 酶活明显增高,这与根直接接触Cd有关。且Vr GSTF6在叶和茎中上调最明显,其差异表达倍数在1 d、5 d、9 d都在5倍和3倍以上,Vr GSTU28在根中的差异表达倍数在1 d、5 d、9 d也都在3倍以上。他们可能是根和茎中酶活的主要贡献者。有研究将刚毛怪柳ThGSTZ1在拟南芥中过表达,转基因植株GST酶活在Cd胁迫下高于野生株[38]。为验证GSTU在白菜抗Cd 中的作用,将BcGSTU4、BcGSTU11、BcGSTU12和BcGSTU22在酵母中表达,发现BcGSTU11提高了酵母对Cd的耐受性[15]。这些研究都表明,GST 在植物响应Cd胁迫中起作用。
重金属胁迫导致植物ROS 爆发,过量的ROS抑制酶活性,引发脂质过氧化和蛋白质氧化等。因此,Cd 胁迫下,具有过氧化物酶活性的GSTs,与超氧化物歧化酶(SOD)、过氧化物酶(POD)过氧化氢酶(CAT)等抗氧化酶共同参与ROS清除,调节细胞内的氧化还原稳态[39]。而且,GST 发挥Ⅱ期解毒作用,GST 催化GSH 结合过氧化产物和游离的Cd,降低Cd对绿豆的毒害。此外,GST 在响应盐[40]和干旱[11]等非生物胁迫以及病原菌[41]等生物胁迫中也起重要作用。Wang等[42]研究表明,干旱条件下,转基因香蕉MaGSTU2和MaGSTU3表达量显著升高,表明这两个基因响应干旱胁迫。盐、干旱、低温及重金属等非生物胁迫都能引起细胞膜结构的破坏,脂质过氧化和活性氧的产生,植物GST 通过抗氧化酶活性修复自由基引起的膜磷脂损伤、抑制微粒体过氧化反应等途径发挥抗氧化作用[43]。本研究获得的Vr GSTs有望为运用基因工程手段提高或改善植物重金属抗性的研究,提供有价值的科学资料和依据。

