玉米BBX基因家族鉴定及表达分析
赵长江徐尚缘都梦翔宋巨奇徐晶宇杨克军李佐同
(黑龙江八一农垦大学 农学院/农业农村部东北平原农业绿色低碳重点实验室/黑龙江省现代农业栽培技术与作物种质改良重点实验室/黑龙江省秸秆资源化利用工程技术研究中心/黑龙江省普通高校寒地作物种质改良与栽培重点实验室,黑龙江大庆 163319)
锌指(结构)蛋白作为一类重要的转录因子,能够与核酸及蛋白质互作,参与多种生物学过程调控[1]。其中一个亚家族B-box(BBX)蛋白N 端至少含有一个B-box结构域,有的成员会多一个B-box或CCT(CONSTANS,CO-like and TOC1)结构域,在植物生长发育过程中发挥重要作用[2-3]。值得一提的是,CCT 结构域也是具有转录因子活性的基因家族[4-5]。拟南芥(Arabidopsis thaliana)CONSTANS(CO)/At BBX1 作为该家族的典型代表,已成为光周期途径调控开花的主导者[6-8],同时还有At BBX4[9]、AtBBX6[10]、At-BBX7[11]和At BBX28[12]等成员参与开花调控。其中AtBBX28通过与AtBBX1互作,调控开花Flowering Locus T(FT)基因表达[12];当然BBX家族对开花的调控也存在不依赖AtBBX1的通路[13]。众所周知,光周期对开花的调控归根结底是对光信号的响应,包括避荫反应[13]。在光敏色素和隐花色素依赖途径中,依据与通路中两标志因子 CONSTITUTIVE PHOTOMORPHOGENIC1(COP1)和ELONGATED HYPOCOTYL 5(HY5)的关系,将BBX 参与光形态建成信号通路大致分为4 种类型,即双因子依赖、依赖COP1不依赖HY5、不依赖COP1 依赖HY5 和双不依赖[2]。当然COP1 可以激活也可以抑制BBX,BBX 亦可激活也可抑制HY5,形成复杂的信号通路实现植物对光的形态建成调控。其中,At BBX24不仅参与可见光的形态建成,也参与UV-B光介导的形态建成[14-15]。近来发现,苹果(Malus domestica)MdBBX37直接与光信号正向调节因子Md HY5的启动子结合并抑制其表达,从而解除Md HY5介导的下胚轴抑制[16]。
植物BBX 除参与光生长发育调控,还参与对多种逆境和激素的应答[2,17]。例如,AtBBX18和AtBBX24分别参与对热和盐等非生物逆境响应[18-19]。Md BBX37调控茉莉酸介导的耐冷性,通过 JAZ (JAZ MONATE ZIM-DOMAIN)-BBX37-ICE1(inducer of CBF expression 1)-CBF(C-repeat binding factor)级联通路提高耐冷性[20]。 菊 花 (Chrysanthemum morifolium)CmBBX19通过与ABF3 模块通过ABA(脱落酸)依赖的途径在菊花的耐旱性调控中发挥作用[21]。甜薯(Ipomoea batatas)IbBBX24可以通过调控茉莉酸合成和信号途径增强植物对纹枯病的抗性并提高产量[22]。目前,已有研究对拟南芥[23]、水稻[24](Oryza sativa)、番茄[25](Solanum lycopersicum)、苹果[26-27]、葡萄[28](Vitis vinifera)和矮牵牛[29](Petunia hybrida)等多个物种中BBX基因家族进行鉴定。然而关于高光效C4作物玉米(Zea mays)BBX 基因家族系统研究鲜有报道。本研究通过生物信息学方法鉴定出玉米BBX 所有成员,对家族基因特征、全生育期和非生物逆境下表达情况,并对生育期组织基因的共表达进行分析,为揭示玉米BBX 基因家族成员的生物学功能提供依据。
1 材料与方法
1.1 蛋白鉴定及系统进化分析
通过Phytozome(https://phytozome.jgi.doe.gov/pz/portal.html)下载玉米、拟南芥、水稻、二穗短柄草(Brachypodium distachyon)和番茄基因组数据,以拟南芥和水稻BBX 家族成员蛋白序列为模板,利用TBtools软件获取候选ZmBBX 蛋 白 序 列,并 上 传 到 NCBI CD-Search、PFAM、SMART 进一步验证。利用Expasy(https://web.expasy.org/protparam/)预测等电点、相对分子质量、氨基酸数量,利用PSORT 网站(http://psort1.hgc.jp/form.html)预测亚细胞定位。
利用MegaX(https://www.megasoftware.net/)进行ClustalW 多重对比,构建系统进化树,生成算法为ML(Maximum Likelihood),校验参数Bootsrtrap重复1 000次。
1.2 基因结构及其启动子顺式作用元件分析
利用TBtools绘制基因在染色体上的分布图及外显子-内含子结构图;取翻译起始点ATG 上游2 000 bp和1 000 bp启动子序列提交Plant-CARE (http://bioinformatics.psb.ugent.be/webtools/)进行顺式作用元件分析。利用MCScan X 进行物种间共线性分析。
1.3 蛋白结构及互作蛋白预测分析
利用 MEME (https://meme-suite.org/meme/tools/meme)分析蛋白保守基序,并利用TBtools绘制保守基序图。使用STRING (https://string-db.org/)数据库对蛋白互作关系进行预测。
1.4 逆境和全生育期组织表达谱
逆境(低温、高温、盐、紫外)的表达数据来源于SRA 数据库,登录号为低温(SRR1238717,SRR1819204,SRR1819205)、高温(SRR1238715,SRR1819196,SRR1819198)、盐(SRR1238719)和紫外(SRR1238720)。玉米全生育期的表达数据来源于Maize eFP Browser(http://bar.utoronto.ca/efp_maize/)数据库。从NCBI-GEO 下载GSE50191转录组表达谱数据,提取其中的FPKM 值转化为TPM 值作为基因表达谱数据。
1.5 组织表达数据的共表达分析
使用TBtools进行加权共表达网络构建,以至少6成样本中该基因的TPM 值>1为标准对基因表达矩阵进行筛选,构建无尺度网络与划分相关模块,阈值为0.8软阈值为β=22,并绘制模块-性状热图。利用TBtools 软件进行GO 和KEGG 富集分析,以玉米基因组为参考数据库,利用TBtools进行可视化,设置数量参数为30。
1.6 盐胁迫表达分析
以玉米自交系合344为供试材料,1/2 Hoagland营养液培养至两叶一心期进行处理。在营养液中添加150 mmol/L NaCl,分别于处理0 d、1 d、3 d和7 d取样,将地上和地下部分离,用液氮冷冻存放于-80 ℃冰箱中保存。每组样品3个生物学重复。采用TRIZOL 试剂提取玉米叶片和根组织总RNA,纯化后构建c DNA 文库,通过聚合酶链反应(PCR)富集cDNA 文库,然后使用Illumina HiSeq 2000平台对构建的文库进行RNA-seq测序(SRP176441 和SRP307694)。抽取BBX基因构建盐处理下根和叶表达谱,相对表达量计算方法为:首先将3次生物学重复处理的FPKM 平均值与对照(0 d)平均值相比,然后对二者比值进行log2FC转换,转换值即为相对表达量。
2 结果与分析
2.1 ZmBBX基因家族成员的鉴定与命名
获得34个ZmBBX 基因家族成员,按照基因在染色体的位置依次命名为ZmBBX1-ZmBBX34(表1)。家族成员中蛋白氨基酸序列长度为142~498 aa,分子质量为15.38~53.77 ku;等电点为4.55~10.52。预测亚细胞定位发现,除ZmBBX5、ZmBBX19、ZmBBX26定 位 于 细 胞质,Zm BBX9、Zm BBX24、ZmBBX25、Zm BBX30和ZmBBX32定位于线粒体,ZmBBX33定位于内质网外,其余成员均定位于细胞核内。
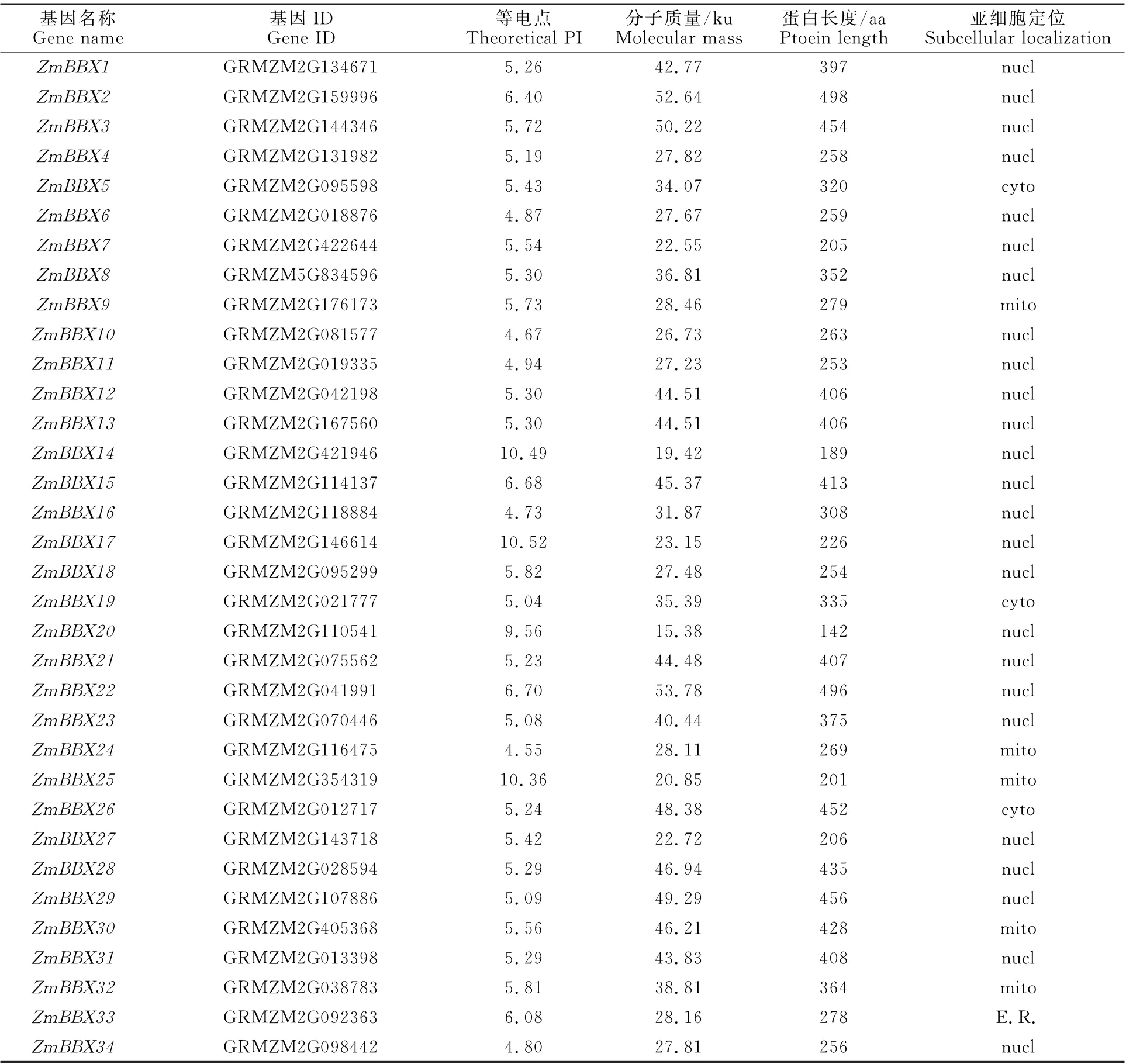
表1 ZmBBX 基因编码蛋白序列理化性质Table 1 Physicochemical properties of protein sequence encoded by ZmBBX gene
2.2 ZmBBX家族成员蛋白进化分析
选取鉴定的34个玉米、32个拟南芥、30个水稻、22个二穗短柄草和29个番茄BBX 家族成员进行系统聚类分析,根据含有B-box 和CCT结构域的情况,ZmBBX家族可分为5个亚家族(Ⅰ~Ⅴ)(图1),第Ⅰ亚族只含有2个B-box结构域,包括ZmBBX4、ZmBBX6、ZmBBX7、ZmBBX8、ZmBBX11、Zm BBX16、Zm BBX18、Zm BBX20、ZmBBX23、ZmBBX24、ZmBBX27、ZmBBX28和Zm BBX34等13个家族成员;第Ⅱ和Ⅴ亚族含有2个B-box结构域和1个CCT 结构域,但其B-box 在氨基酸序列上有差异,分别包括ZmBBX1、ZmBBX2、ZmBBX5、ZmBBX9、ZmBBX19、ZmBBX30、Zm BBX32和ZmBBX33等8个成员和Zm BBX12、ZmBBX13、Zm BBX21 和ZmBBX31等4个成员;第Ⅲ亚族含有1个B-box结构域和1个CCT 结构域,包括ZmBBX3、Zm BBX15、ZmBBX22、ZmBBX26 和ZmBBX29 等5个成员;第Ⅳ亚族只含有1个B-box结构域,包括ZmBBX10、ZmBBX14、ZmBBX17 和ZmBBX25等4个成员。各个亚家族中玉米与水稻、二穗短柄草聚成一支,表明双子叶与单子叶植物的进化存在差异。

图1 ZmBBX家族成员蛋白系统进化树Fig.1 Protein phylogenetic tree of ZmBBX family member
2.3 ZmBBX家族成员基因进化分析
对玉米、水稻、二穗短柄草的BBX 家族基因进行共线性分析(图2),34个Zm BBX基因不均匀地分布在10条染色体上,其中5号染色体上分布的成员最多,涉及Zm BBX15~Zm BBX21共8个,8号染色体上不存在BBX 家族成员。另外,18个ZmBBX同源基因出现在二穗短柄草和水稻染色体中,供试禾本科作物基因组BBX 具有较好的共线性,这与进化树的结果一致。同时,对Zm BBX 家族基因进行串联重复事件分析,共有11对重复基因,分别是ZmBBX3~Zm BBX15、ZmBBX4~Zm BBX20、Zm BBX7~Zm BBX27、ZmBBX11~ZmBBX18、ZmBBX12~Zm BBX21、ZmBBX14~Zm BBX17、ZmBBX16~ZmBBX24、Zm BBX17-Zm BBX25、Zm BBX23~ZmBBX28、ZmBBX34~Zm BBX4、Zm BBX34~ZmBBX20,其Ka/Ks 值 介 于0.187 856~0.570 824之间,二者比值小于1说明其受到纯化选择。
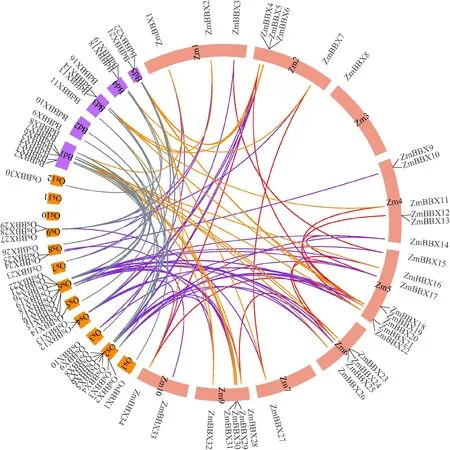
图2 ZmBBX家族染色体定位(A)及二穗短柄草、玉米、水稻间共线性(B)Fig.2 Chromosome location of ZmBBX family(A)and collinearity analysis among Brachypodium distachyon,Zea mays and Oryza sativa(B)
2.4 ZmBBX家族基因结构及编码蛋白保守结构分析
保守结构域分析发现成员含有2~8个保守基序(图3-A、3-C),所有成员均含有B-box结构域核心序列(Motif 1)。其中ZmBBX4、Zm BBX5、ZmBBX6、Zm BBX7、Zm BBX8、Zm BBX11、ZmBBX12、ZmBBX13、ZmBBX16、ZmBBX18、Zm BBX19、Zm BBX20、Zm BBX21、Zm BBX23、Zm BBX24、ZmBBX27、ZmBBX28、ZmBBX31和Zm BBX3419 个 成 员 含 有 另 一 个B-box 保 守 域(Motif 3);ZmBBX1、ZmBBX2、ZmBBX3、ZmBBX5、ZmBBX9、ZmBBX12、ZmBBX13、ZmBBX15、ZmBBX19、ZmBBX21、ZmBBX22、ZmBBX26、ZmBBX29、ZmBBX30、Zm BBX31、ZmBBX32和ZmBBX3317 个 成 员 除 了 具有典型的B-box 结构域外,还含有CCT 结构域(Motif 3)。
对Zm BBX 家族成员的基因内含子和外显子分析(图3-B),第Ⅰ组成员内含子数量为1~5个,第Ⅱ组为0~3个,第Ⅲ组和Ⅳ均为3~4个,第Ⅴ组为0~2个。其中,Zm BBX9、ZmBBX14、ZmBBX17、ZmBBX25和ZmBBX33没有内含子,ZmBBX28内含子数目最多为5个。

图3 ZmBBX家族保守结构域(A和C)及基因结构(B)Fig.3 ZmBBX family conserved domain(A and C)and gene structure(B)
2.5 ZmBBX家族基因启动子区顺式作用元件分析
通过基因上游2 000 bp启动子区元件分析发现,除启动子核心元件TATA-box、CAAT-box以外,Zm BBX 家族基因启动子还存在四大类作用元件(图4-A),如光响应相关元件G-box、Sp1、GT1-motif等20 种,环境胁迫相关元件ARE、MBS等7种,以及ABRE、P-box等5种激素应答相关元件,同时还有生长发育相关元件CATbox、O2-site等5种。光响应、激素应答、环境胁迫相关元件均分布在所有Zm BBX 成员中,除ZmBBX1、ZmBBX23和ZmBBX27外其余家族成员均含有生长发育相关元件。ZmBBX家族基因上游1 000 bp启动子区域部分元件的数量及位置统计如下(图4-B),其中光响应元件(G-box)以及脱落酸应答元件(ABRE)数目较多分布广泛,且在5′-3′链上数目较多;参与低温响应的元件(LTR)在ZmBBX11上数目最多;其余元件(GT1-motif、TGA-element、CAT-box、O2-site、ARE)在部分成员中也有分布但数目较少。

图4 ZmBBX家族基因启动子区顺式作用元件分布(A)及数目(B)Fig.4 Distribution(A)and number(B)of cis-acting elements in promoter of ZmBBX gene family
2.6 ZmBBX家族基因全生育期组织表达谱分析
ZmBBX 家族(除ZmBBX24)在玉米全生育期的基因表达模式分为3 大类,进一步细分为5小 类(图5)。其 中,ZmBBX 7、ZmBBX 2 7和ZmBBX28等3个基因在玉米全生育期的表达量都很高并在表达模式中聚为第一大类;第二大类包括在全生育期具有表达但表达量较低的Zm BBX2、Zm BBX4、ZmBBX8、Zm BBX9、ZmBBX10、ZmBBX16、ZmBBX17、ZmBBX25、ZmBBX26、ZmBBX29、Zm BBX31、ZmBBX33和ZmBBX3413个基因在内的第一类和表现出较为明显的组织特异性,在玉米叶片中表达量较高的ZmBBX3、ZmBBX5、Zm BBX14、ZmBBX15、Zm BBX19、ZmBBX20和ZmBBX227 个基因的第二类。第三大类包括3 个亚类,第一亚类涉及ZmBBX6、ZmBBX11、Zm BBX18和Zm BBX324 个 成 员,在玉米叶片、种子形成前期和第一茎节间等组织部位特异表达;第二亚类涉及ZmBBX1、Zm BBX12、ZmBBX13和ZmBBX234个成员,在叶片、苞叶、胚胎、种子、胚乳中表达量较高,且Zm BBX12和Zm BBX13在各组织中表达量完全一致;第三亚类涉及Zm BBX21和Zm BBX302 个成员,在全生育期均有表达但整体表达量较低。

图5 ZmBBX家族基因全生育期表达分析Fig.5 Expression of ZmBBX family gene during whole growth period
2.7 生育期共表达的GO 和KEGG 富集分析
以GEO 数据库的GSE50191转录组数据为基础构建全生育期基因共表达网络,通过对筛选的18 000个基因进行分析获得8个共表达模块(图6-A、6-B)。在所有模块中有19 个Zm BBX基因在列,其中MEbrown 和MEblue模块中的数目最多,分别包括ZmBBX1、ZmBBX4、Zm BBX10、ZmBBX16、ZmBBX32和Zm BBX7、Zm BBX19、ZmBBX27、Zm BBX28、Zm BBX34,MEturquoise 中 包 括ZmBBX11、ZmBBX18、Zm BBX30和Zm BBX31,MEblack 中 包 括ZmBBX17和ZmBBX33,MEpink、MEred、MEmagenta中分别包括ZmBBX2、ZmBBX5和Zm BBX24。依据模块与表型性状的相关性,选择有Zm BBX基因参与的且与GK 2相关性最高的MEbrown模块进行GO 和KEGG 富集分析(图6-C、6-D),其模块与性状的相关系数为0.9和P值为0.002。GO 富集分析发现,基因分子功能主要富集于蛋白质异二聚活性(GO:0046982)和磷酸甘油酸变位酶活性(GO:0004619),细胞组分富集于细胞质(GO:0005737)和微体(GO:0042579),生物过程富集于有机酸代谢过程(GO:0006082)、羧酸代谢过程(GO:0019752)和含氧酸代谢过程(GO:0043436)等。KEGG 分析发现,该模块主要涉及代谢和碳水化合物代谢等代谢过程,内质网蛋白质加工的遗传信息过程,过氧化物酶体等细胞过程,外泌体和脂质合成蛋白等蛋白功能。
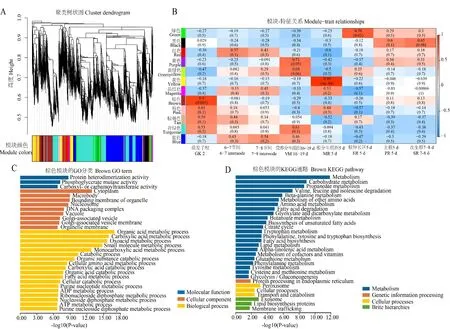
图6 共表达网络构建(A和B),关键模块GO 功能富集分析(C)和KEGG 富集分析(D)Fig.6 Co-expression network construction(A and B),GO enrichment analysis of key modules(C)and KEGG enrichment analysis(D)
2.8 盐处理下ZmBBX家族基因表达谱
Zm BBX 家族成员在NaCl处理玉米幼苗根和叶中表达不尽相同(图7)。玉米幼苗叶片中差异表达(log2FC≥1)的ZmBBX基因共有17个,上调的有13个和下调的4个;其中log2FC≥2的有10个,上调的8个和下调的2个。同时,玉米幼苗根中差异表达(log2FC≥1)的Zm BBX基因共有19个,上调的有13 个和下调的6 个;其中log2FC≥2的有2个,均上调表达。
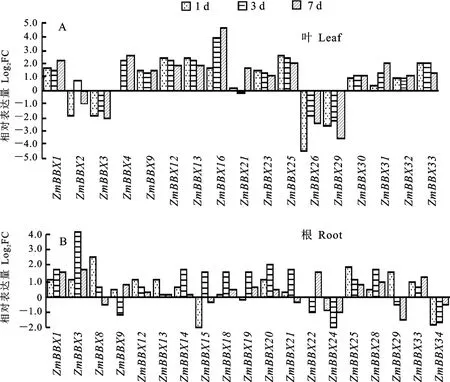
图7 ZmBBX家族基因叶(A)和根(B)响应盐胁迫的表达分析Fig.7 Expression analysis of ZmBBX family in leaves(A)and roots(B)under salt stress
地上和地下都差异表达(log2FC≥1)的ZmBBX基因有9个,包括ZmBBX1、ZmBBX3、ZmBBX9、Zm BBX12、ZmBBX13、Zm BBX21、ZmBBX25、ZmBBX29和Zm BBX33,其 中 除ZmBBX3在叶片中下调和根中上调,其余ZmBBX 在叶片和根中基本都上调表达。值得一提的是,差异表达倍数较大(log2FC≥4)的基因有3个,其中叶片中Zm BBX16上调表达和Zm BBX26下调表达,根中ZmBBX3明显上调表达。
2.9 ZmBBX蛋白互作及逆境表达谱分析
利用STRING 数据库预测BBX 的蛋白互作特性(图8-A)。整个蛋白互作网络有23个节点,节点之间共存在45 组蛋白互作关系。其中Zm BBX14、Zm BBX17 和ZmBBX25 位 于 整 个BBX 基因家族蛋白互作网络的中心,分别与Zm BBX2、Zm BBX4、ZmBBX7、ZmBBX16、Zm BBX20、ZmBBX24、ZmBBX27 和ZmBBX34 这8个家族成员互作,还发现其他家族蛋白MYBR20、glk45、GRMZM2G181030 都 与 Zm BBX12、ZmBBX13、ZmBBX21 和ZmBBX31 有 互作关系,且glk45还与ZmBBX19和Zm BBX30存在互作关系。结合逆境基因共表达分析(图8-B)ZmBBX21与GRMZM2G181030、MYBR20表 达模式相似,都在低温胁迫下高表达,其中MYBR20在低温下表达量大幅上调,在转录水平上支持蛋白互作。
3 讨论
植物转录因子通过其特有结构域与DNA 及其他蛋白相互作用,激活或抑制基因的表达[30],其中植物BBX 转录因子在调节多种生命活动中发挥着重要的作用[2]。本研究利用生物信息学方法鉴定出玉米34个Zm BBX,依据蛋白进化该家族可以划分为5个亚族。其中,划归第Ⅰ亚族的8个(AtBBX18~At BBX25)拟南芥家族成员均已报道参与光(暗)的形态建成,且AtBBX22、At-BBX24和At BBX25均可以与COP1和HY5 互作[2],推测同组Zm BBX4、ZmBBX6、ZmBBX7、ZmBBX8、ZmBBX11、ZmBBX16、ZmBBX18、ZmBBX20、ZmBBX23、ZmBBX24、ZmBBX27、ZmBBX28和ZmBBX34这13 基 因 可 能 也 参 与玉米对光形态建成的调控。第Ⅱ亚族中包括6个(AtBBX1~AtBBX6)拟南芥家族成员,该亚族基因涉及开花调控、气孔开放、逆境响应等生理作用[2],推测同组玉米ZmBBX1、Zm BBX2、Zm BBX5、ZmBBX9、ZmBBX19、ZmBBX30、ZmBBX32和Zm BBX33这8个基因也具有类似功能,其中ZmBBX30与OsBBX18/Hd1[31]直系同源,参与花期调控,值得一提的是,本组Zm BBX19/Zm-COL3已被鉴定在玉米花期调控中发挥重要作用[32]。第Ⅴ亚族中包括9 个拟南芥AtBBX 成员,其中AtBBX7、AtBBX9、AtBBX11和AtBBX13主要参与对生物逆境和非生物逆境的响应[2],推 测 同 组Zm BBX12、Zm BBX13、Zm BBX21和ZmBBX31这4 个 基 因 参 与 玉 米 对 逆 境的应答,而且本研究也发现上述4个基因均可以被盐处理诱导表达,其中Zm BBX12、ZmBBX13和ZmBBX21具有相同组织表达模式。此外,与ZmBBX31聚于一个分支的OsBBX7/DTH2为水稻抽穗调控基因[33],推测该基因还参与植物生长发育调控。
本研究中对盐胁迫下玉米幼苗ZmBBX 家族基因的表达进行分析,发现有24 个Zm BBX基因参与玉米幼苗对盐胁迫的应答,包括地上和地下都差异表达的9 个Zm BBX基因,分别为ZmBBX1、ZmBBX3、ZmBBX9、ZmBBX12、ZmBBX13、Zm BBX21、ZmBBX25、ZmBBX29和Zm BBX33,其中根部ZmBBX3明显上调表达。此外叶片ZmBBX16上调和Zm BBX26下调亦十分明显。另一方面,从全生育期组织表达结果来看ZmBBX7、Zm BBX27和Zm BBX28在玉米全生育期的表达量都很高,ZmBBX21和ZmBBX30在全生育期均有表达但整体表达量较低,且部分基因具有较明显的组织表达特异性。上述基因的表达支持了本研究Zm BBX基因启动子存在大量光、生长发育、环境胁迫以及激素应答等相关顺式作用元件的结果。进一步通过全生育期共表达分析 发 现,ZmBBX1、ZmBBX4、ZmBBX10、ZmBBX16和ZmBBX32等基因可能参与光响应的萌发籽粒的代谢和生长发育[34],而且可能通过蛋白二聚化分子功能,调控细胞质和过氧化物酶体中糖和酸代谢等生物学功能来实现。
通过互作蛋白预测分析发现,同属第Ⅴ类的ZmBBX12、ZmBBX13、ZmBBX21 和ZmBBX31等BBX 蛋白与已知的生长发育调控转录因子家族成员MYBR20[35]和glk45[36]构成一个互作组;同时,多种逆境表达谱分析也发现ZmBBX21和MYBR20共聚一类,该共表达模式也支持了蛋白互作的预测结果。此外,Zm BBX14、ZmBBX17和ZmBBX25居于BBX 家族同源互作的核心,多种逆境表达模式下Zm BBX14和ZmBBX17相近,ZmBBX17和ZmBBX25全生育期组织表达模式相近,不仅支持蛋白互作预测,而且表明ZmBBX 同源互作可能具有分工,用于协调逆境与生长发育。
4 结论
本研究在玉米基因组水平共鉴定出BBX 基因家族成员34个,Zm BBX 家族基因生育期组织表达和逆境表达分化明显,在盐等非生物逆境和光相关的生长发育调控中发挥重要作用。

