环状RNA⁃PCAC1在肝癌细胞增殖、侵袭和转移中作用机制研究
何文广 郭海坤 朱晟 刘小梨
肝细胞癌是我国常见的一类恶性肿瘤,具有发病隐匿、治疗手段少及预后差等特点[1]。目前,手术是治疗HCC 最常见的治疗手段,但术后生存形势依然较为严重[2]。因此,进一步探索阐明HC发生及进展的分子机制显得极为迫切。近年来,circRNA 参与参与多种肿瘤发生、侵袭和迁移等恶性生物学行为[3-4]。本课题组前期通过高通量测序检测HCC 患者病理组织异常表达的circRNA,发现其中一种circ_RNA_PCAC1 在HCC 患者表达升高,查阅文献未见其在HCC 中的报道。基于此,因此,本研究检测circ_RNA_PCAC1在肝癌细胞系中的表达,并进一步探讨其对肝癌细胞生物学行为的影响,为阐明其在肝癌中的作用机制提供依据。
1 材料与方法
1.1 实验材料人肝癌细胞系Li⁃7、HepG2、Hep3B 及人正常肝细胞系HL⁃7702 购自美国ATCC 细胞库,胎牛血清,DMEM 培养基(Gibco,USA),Trizol 试剂(美国Invitrogen 公司);逆转录试剂盒和SYBR Premix Ex Taq Ⅱ试剂盒购自(日本Takara 公司),引物(生工生物工程科技(上海)有限公司);CCK⁃8 试剂(碧云天公司),Transwell小室及基质胶(Corning 公司)。circ_RNA_PCAC1沉默慢病毒(siRNA)及相应的阴性对照组慢病毒(NC)(上海吉凯基因科技有限公司)。
1.2 细胞培养肝癌细胞系及正常肝细胞系用含10%胎牛血清的DMEM 高糖培养基培养。在37℃、5%CO2培养箱中培养。待细胞融合达到80%以上时,用0.25%胰蛋白酶消化,并进行传代。
1.3 实时荧光定量PCR 检测circ_RNA_PCAC1 mRNA 的表达水平应用Trizol 法提取细胞总RNA,分光光度计测量总RNA 浓度及纯度,根据逆转录试剂盒说明书将1 μg RNA 按逆转录为合成cDNA,随后进行qRT⁃PCR。内参GAPDH 的引物序列为:F:5′⁃ACA GTC AGC CGC ATC TTC TT⁃3′;R:5′⁃GACAAGCTTCCCGTTCTCAG⁃3′。circ_RNA_PCAC1 引 物 序 列 为:F:5′⁃GAGGGTTCTGCT⁃GTCCTGT;R:5′⁃GATAGACGCGTGCACCAC⁃3′,PCR 反应程序:95 ℃,5 min 预变性;95 ℃30 s 变性,60℃,30 s 退火;72 ℃,30 s 延伸。PCR 反应体系为10 μL :2×SYBR Green Master(ROX),上下游引物各0.3 μL,cDNA 模板1 μL,RNase Free dH2O补至10 μL,以GAPDH 为内参,使用2-△△Ct法分析目的基因的相对表达量。
1.4 circ_RNA_PCAC1 敲低的肝癌细胞模型胰酶消化细胞接种至6孔板,感染前6 h 更换培养基,慢病毒稀释后与增强感染液混合。参照感染说明书分别将circ_RNA_PCAC1沉默慢病毒及相应阴性对照组慢病毒感染HepG2细胞,分别设为siRNA 组和NC 组,6 h 后替换常规培养基继续培养。感染72 h后,更换含2 μg/mL嘌呤霉素的培养基,继续培养14 d,然后用qRT⁃PCR实验检测感染效率。
1.5 CCK⁃8 检测肝癌细胞增殖能力用胰酶消化处于对数生长期的感染细胞,按5×103个/孔接种于96 孔板中,每组重复5 次。分别于培养0 h、24 h、48 h、72 h 时加入CCK⁃8 试剂10 μL,继续孵育2 h,用酶标仪检测,以450 nm 波长处的光密度(OD)值代表增殖活力。
1.6 平板克隆实验检测增殖能力用胰酶消化处于对数生长期的感染细胞,加入完全培养液5 ml终止消化,1 000 rpm,4℃离心5 min,弃上清;加入3 mL 完全培养液,以200 细胞/孔的密度接种至6孔板,培养至细胞集落形成。4% 多聚甲醛固定20 min,PBS 清洗3 次,1% 结晶紫染色20 min,拍照记录细胞集落形成情况,计算细胞克隆形成数。
1.7 划痕实验检测迁移能力用胰酶消化处于对数生长期的感染细胞,然后将细胞按5×103个/孔接种于接种于6 孔板,将细胞置于培养箱中常规培养,待细胞的融合达到90%,用10 μL 的无菌枪头划板,弃去原培养基,用PBS 轻轻清洗3 次。分别于划痕后0 h、48 h 时取样,同时利用Image J软件测量迁移距离。
1.8 Transwell 实验检测细胞侵袭能力用胰酶消化处于对数生长期的感染细胞,200 μL 肝癌细胞(含1×105 个细胞)接种至Transwell 小室的上室,用500 μL 含10%胎牛血清置于下室,于37℃、5% CO2培养箱内孵育48 h,4%多聚甲醛固定20 min,苏木素染色30 min,随机选取不同的5 个视野在光学显微镜下拍照并计数,最后取均值作为细胞侵袭数。
1.9 统计分析采用SPSS 19.0 统计软件包进行统计学分析。计量资料以(±s)表示,多组间比较单因素方差分析(One⁃Way ANOVA),以P<0.05表示差异有统计学意义。
2 结 果
2.1 circ_RNA_PCAC1在肝癌细胞和正常肝细胞 中 的 表 达qRT ⁃ PCR 检 测 结 果 显 示:circ_RNA_PCAC1 在人肝癌细胞系Li⁃7、HepG2、Hep3B 中的表达量明显高于HL⁃7702 细胞系(P<0.05),详见图1。
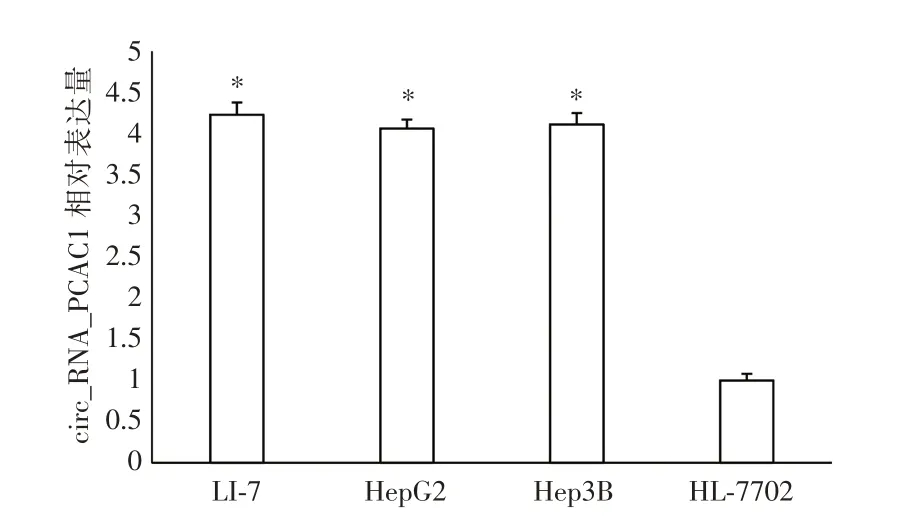
图1 circ_RNA_PCAC1 在肝癌细胞和正常肝细胞中的表达
2.2 circ_RNA_PCAC1 在肝癌细胞系中的沉默效 果 用qRT ⁃ PCR 法 检 测 siRNA 组 的circ_RNA_PCAC1 表达水平明显低于NC 组(P<0.05),表明成功建立沉默circ_RNA_PCAC1 的HepG2 细胞株。详见图2。

图2 circ_RNA_PCAC1 在肝癌细胞系中的沉默效果
2.3 干扰circ_RNA_PCAC1 表达抑制肝癌细胞HepG2 的增殖通过CCK⁃8 细胞增殖实验检测干扰circ_RNA_PCAC1 后HepG2 细胞的生长变化,结果显示,与NC 组细胞相比,siRNA 组HepG2 细胞明显抑制生长,平板克隆形成实验结果显示siR⁃NA 后细胞形成的克隆数目明显减少(P<0.05)。详见图3。

图3 干扰circ_RNA_PCAC1 表达对肝癌细胞HepG2 增殖的影响
2.4 干扰circ_RNA_PCAC1 表达抑制肝癌细胞HepG2 的迁移细胞划痕实验结果显示:48 h 时,siRNA 组细胞迁移数目均较NC 组少(均P<0.05),见图4。

图4 干扰circ_RNA_PCAC1 表达抑制肝癌细胞HepG2的迁移
2.5 干扰circ_RNA_PCAC1表达抑制肝癌细胞HepG2 的侵袭Transwell 实验结果显示,siRNA组细胞侵袭和迁移数目均较NC 组少(均P<0.05)。详见图5。
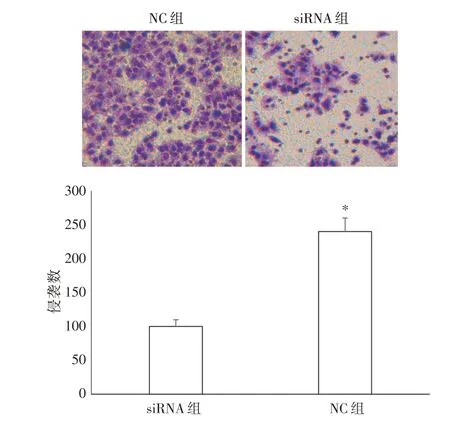
图5 干扰circ_RNA_PCAC1 表达抑制肝癌细胞HepG2的侵袭
3 讨 论
高转移和高侵袭性是造成肝癌患者死亡的重要因素[5]。因此,阐明肝癌进展机制,仍是肝癌研究的重要内容。目前多项研究证明环状RNA 异常表达可以促进或抑制肝癌的发生与进展。可望成为潜在的肿瘤诊疗标志物,具有巨大的应用前景。
circ_RNA_PCAC1 是一个新近发现的cir⁃cRNA,国内李玉婷等[6]受研究首次发现circRNA⁃PCAC1 在胰腺导管腺癌中高表达并促进胰腺导管腺癌侵袭转移,然而到目前为止,circ_RNA_PCAC1在肝癌中的表达方式和生物学功能尚不清楚。基于本课题组前期对HCC 组织的测序的结果,本研究进一步发现circ_RNA_PCAC1 在肝癌中表达明显高于旁癌组织。但其是否对肝癌细胞的生物学行为并未研究。本研究首先检测了肝癌细胞和正常肝细胞中 circ_RNA_PCAC1 的表达,发现circ_RNA_PCAC1 在肝癌细胞中的表达均高于正常肝细胞。因此,推测circ_RNA_PCAC1 在肝癌细胞的发生发展中发挥着重要的调控作用。为了进一步明确circ_RNA_PCAC1 在肝癌细胞的增殖、侵袭和迁移中的作用,本研究建立沉默circ_RNA_PCAC1的HepG2细胞模型,通过细胞体外CCK⁃8细胞增殖实验、平板克隆形成实验、划痕愈合实验以及Tran⁃swell 小室实验全面验证其对肝癌细胞增殖和侵袭等行为的影响,各项结果显示,结果发现沉默circ_RNA_PCAC1 可以显著抑制肝癌细胞在体外的增殖、迁移及侵袭能力,因此,本研究利用体外实验首次证明了circ_RNA_PCAC1在肝细胞癌中的促癌作用。今后将通过生物信息学手段和双荧光素酶等技术手段探索circ_RNA_PCAC1的下游调控网络。
综上所述,circ_RNA_PCAC1 在肝癌细胞中表达上调,沉默circ_RNA_PCAC1 可以明显制肝癌细胞增殖,迁移和侵袭,今后还需深入研究circ_RNA_PCAC 在肝癌发生发展中的确切分子机制。

