miR-181a调控PINK1/Parkin通路对骨质疏松大鼠破骨细胞线粒体自噬的影响
祝震亚,童蕾,陆燕群
嘉兴市中医医院骨科,浙江嘉兴 314001
骨质疏松症(osteoporosis,OP)是一种骨代谢异常性疾病[1]。目前研究发现,破骨细胞吸收亢进是引起OP骨量减少及骨结构破坏的重要原因[2]。破骨细胞在骨吸收过程中发挥着重要作用[3]。线粒体自噬有助于及时清除细胞内堆积的受损线粒体,从而维持细胞的存活[4-5],但有关线粒体自噬对OP骨代谢影响的研究较少。PTEN诱导激酶1(PTENinduced kinase 1,PINK1)可聚集于线粒体外膜,促进帕金森病相关基因(Parkinson-related genes,Parkin)蛋白转位到线粒体表面,引起线粒体蛋白泛素化修饰,从而诱导线粒体自噬[6]。但PINK1/Parkin通路介导的线粒体自噬在破骨细胞存活及骨吸收过程中的调节作用鲜见报道。
短链非编码微小RNA分子(microRNA,miRNA)参与了OP等骨代谢疾病的骨骼重塑[7-8]。近年来有研究发现,miR-181a在OP模型小鼠中呈高表达[9],可靶向调控骨保护素(osteoprotegerin,OPG)的水平,影响破骨细胞活性[10];miRNA基因靶点预测结果显示,miR-181a与Parkin之间存在靶向负调控作用,提示miR-181a可能靶向调控PINK1/Parkin自噬通路,影响破骨细胞活性,从而参与OP的发生发展。本研究探讨了miR-181a调控PINK1/Parkin通路对OP大鼠破骨细胞线粒体自噬的影响,以期阐明OP破骨细胞骨吸收靶向调控的机制,为OP的基因治疗提供新的思路。
1 材料与方法
1.1 主要试剂及仪器 MTT试剂盒(EY-19238)购自上海一研生物科技有限公司;RNA提取试剂盒(TR205-50)购自北京天漠科技开发公司;RNA反转录试剂盒(CD-G102537m)购自武汉纯度生物科技有限公司;兔抗PINK1(abs137219)购自上海爱必信生物科技有限公司;兔抗Parkin(ab15494)、小鼠抗线粒体外膜标记蛋白(TOMM20;ab56783)、兔抗线粒体自噬受体蛋白(NIX;ab109414)、兔抗溶酶体相关膜蛋白2(lysosome-associated membrane protein 2,LAMP2;ab120568)、兔抗泛素蛋白(ubiquitin,Ub;ab140601)、兔抗自噬选择性底物(p62;ab109012)购自美国Abcam公司;兔抗凋亡剪切蛋白-半胱天冬酶-3(cleaved caspase-3;AF7022)、兔抗微管轻链蛋白3-Ⅱ/Ⅰ(LC3-Ⅱ/Ⅰ;AF5402)购自常州Affinity公司。JCM-6000电子显微镜购自日本尼康公司;Talos F200S G2S/TEM透射电镜购自美国赛默飞公司;ImageXpress激光共聚焦显微镜购自上海美谷分子仪器有限公司;CytoFLEX SRT流式细胞仪购自中国贝克曼库尔特商贸公司。
1.2 实验动物及分组 健康雌性SD大鼠20只,6~8周龄,体重200~220 g,购自广州赛业百沐生物科技有限公司[实验动物生产许可证号:SCXK(粤)2020-0055],于嘉兴市中医医院动物房中常规饲养。随机分为OP模型组(n=10)与对照组(n=10),OP模型组参照文献[11]的方法摘除双侧卵巢,对照组大鼠只暴露卵巢不行摘除术。2个月后,采用micro-CT扫描大鼠右后肢股骨,若骨结构参数如骨密度、骨体积分数降低,则表示造模成功(10只全部造模成功)。本研究符合3R原则,实验过程符合国家和单位有关实验动物的管理和使用规定。
1.3 大鼠破骨细胞提取 处死大鼠,参照文献[12]的方法在无菌条件下分离提取大鼠四肢长骨中的破骨细胞,经形态学及噬骨实验鉴定后,按照1×108个/L、100 μl/孔的密度接种于6孔板中。
1.4 破骨细胞转染si-miR-181a实验分组 OP大鼠破骨细胞分为OP组(未转染,正常培养)、si-miR-181a组(转染si-miR-181a)、si-NC组(转染si-NC阴性对照质粒)、ad-miR-181a组(转染ad-miR-181a)与ad-NC组(转染ad-NC阴性对照质粒);对照组大鼠破骨细胞正常培养,设为正常对照组。各组分别设置6个复孔,实验重复6次。构建miR-181a低表达(si-miR-181a)、高表达(ad-miR-181a)载体及阴性对照(si-NC、ad-NC)质粒,用Lipofectamine 2000转染试剂分别用各载体质粒转染各组破骨细胞,继续在M199培养液中培养48 h,进行后续试验。
1.4.1 RT-PCR检测破骨细胞中miR-181a的表达收集各组细胞,粉碎裂解、研磨后,用Trizol法提取总RNA,反转录成cDNA,采用PCR仪进行扩增。反应条件:95 ℃预变性110 s;95 ℃ 55 s,50~60 ℃ 60 s,72 ℃ 50 s,共45个循环;75 ℃延伸60 s。以U6为内参,采用2-ΔΔCt法计算miR-181a表达水平。引物由上海生工生物工程公司设计合成,miR-181a引物序列:正义链5'-CTTTGGTTAT AATTCCTAAGTGGCACC-3',反义链5'-ATTGGC AACCCTCGTTCCCTTTACCA-3';U6引物序列:正义链5'-TCCTCCGATCGTGTCACG-3',反义链5'-ACGTGACAAGTTCGGAGA-3'。
1.4.2 MTT法及流式细胞术检测破骨细胞存活及凋亡情况 取各组细胞,加入20 μl MTT溶液继续培养4 h,于490 nm波长处检测吸光度(OD)值,计算细胞存活率。细胞存活率(%)=(OD实验组-OD空白)/(OD对照组-OD空白)×100%。取各组细胞,调整浓度重悬后,加入Annexin V-FTTC及PI孵育30 min,采用流式细胞仪检测破骨细胞凋亡情况。
1.4.3 透射电镜观察破骨细胞中线粒体结构及自噬情况 收集各组细胞,用胰酶消化后,加入2.5%戊二醛、1%锇酸固定,脱水、浸透处理后,用醋酸双氧铀和柠檬酸铅双染并于透射电镜下观察。
1.4.4 免疫荧光共定位检测破骨细胞线粒体中Parkin的表达情况 收集各组细胞,用4%多聚甲醛溶液固定及0.5%曲拉透明化处理,加入兔抗Parkin(1∶500)及小鼠抗TOMM20(1∶500)抗体4 ℃孵育24 h;洗涤后,加入TRITC标记的山羊抗兔IgG(1∶200)及FITC标记的山羊抗小鼠IgG(1∶200)二抗37 ℃孵育40 min,于荧光共聚焦显微镜下观察、拍照,用Image Pro Plus 5.0图像分析系统分析单位面积内Parkin与TOMM20阳性共表达区域的平均光密度值(MD)。
1.4.5 Western blotting检测目的蛋白表达 收集各组细胞,裂解、匀浆,提取细胞总蛋白,BCA法测定总蛋白浓度。取50 μg蛋白进行电泳、转膜,加入PINK1、Parkin、NIX、LC3、LAMP2、Ub、p62、cleaved caspase-3一抗(1∶1000)及β-actin内参抗体(1∶1500),4 ℃孵育过夜;加入辣根过氧化物酶标记的羊抗兔二抗(1∶2000),室温孵育1.5 h。采用增强化学发光法显色,ImageJ软件分析上述目的蛋白条带的灰度值。
1.5 破骨细胞共转染si-miR-181a和si-Parkin取OP大鼠破骨细胞,按照1×108个/L、100 μl/孔的密度接种于6孔板中,设置空白对照组(正常培养)、simiR-181a+si-Parkin组(转染si-miR-181a和si-Parkin)、si-miR-181a组(转染si-miR-181a和si-NC-2阴性对照质粒)、si-Parkin组(转染si-Parkin和si-NC阴性对照质粒)与空载质粒对照组(转染si-NC、si-NC-2阴性对照质粒)。构建Parkin低表达(si-Parkin)载体质粒及阴性对照(si-NC-2)质粒,用Lipofectamine 2000转染试剂分别将载体质粒转染至各组破骨细胞。转染及培养48 h后,采用RT-qPCR检测miR-181a的表达(详细步骤见1.4.1),MTT法测定细胞存活率(详细步骤见1.4.2),Western blotting检测PINK1蛋白的表达(详细步骤见1.4.5)。
1.6 线粒体/溶酶体共定位检测 细胞分组及处理方法同1.5,继续培养36 h,加入终浓度为10 μmol/L的氧化磷酸化解耦联剂(FCCP)处理6 h,PBS洗涤后,加入线粒体膜绿色荧光标记染料(Mito Tracker Green,MTR green,200 nmol/L),37 ℃下染色30 min;加入溶酶体红色荧光标记染料(Lyso Tracker Red,LTR red,25 nmol/L)染色10 min,于激光共聚焦显微镜下观察。
1.7miR-181a与Parkin的靶向关系预测 采用miRtarbase软件预测miR-181a与ParkinmRNA的结合位点。
1.8 双荧光素酶报告实验验证miR-181a与Parkin的靶向关系 构建有miR-181a结合序列的Parkin-3'UTR野生型(WT)和Parkin-3'UTR突变型(MUT)片段,克隆至萤火虫荧光素酶载体质粒(pmiR-Report)载体中,分别与miR-181a模拟物(miR-181a-mimics)及其阴性对照(miR-181a-NC)共转染至破骨细胞中,设置miR-181a-mimics+WT组(转染miR-181amimics及Parkin-3'UTR-WT)、WT组(转染miR-181a-NC及Parkin-3'UTR-WT)、miR-181a-mimics+MUT组(转染miR-181a-mimics及Parkin-3'UTR-MUT)与MUT组(转染miR-181a-NC及Parkin-3'UTR-MUT),继续培养48 h,检测萤火虫荧光活性/海肾荧光活性。
1.9 统计学处理 采用GraphPad Prism 8及SPSS 22.0软件进行统计分析。实验数据以±s表示,两组间比较采用t检验,多组间比较采用单因素方差分析,进一步两两比较采用SNK-q检验。P<0.05为差异有统计学意义。
2 结 果
2.1 OP大鼠骨密度及骨体积分数检测结果 与对照组比较,OP模型组大鼠骨密度[(273.59±12.16) mg/cm3vs. (420.01±20.10) mg/cm3,P<0.05]及骨体积分数(5.59%±0.56%vs. 22.32%±2.12%,P<0.05)均明显降低,表明OP模型造模成功。
2.2 上调或下调miR-181a的表达对大鼠破骨细胞存活及凋亡的影响 与正常对照组比较,OP组破骨细胞中miR-181a表达水平升高(1.59±0.15vs.1.02±0.11,P<0.05)。与OP组比较,ad-miR-181a组破骨细胞中miR-181a表达水平升高(2.02±0.20,P<0.05),si-miR-181a组破骨细胞中miR-181a表达水平降低(0.93±0.09,P<0.05)。ad-NC组、si-NC组与OP组破骨细胞中miR-181a表达水平差异无统计学意义(1.52±0.12vs. 1.56±0.15vs. 1.59±0.15,P>0.05)。
与正常对照组比较,O P 组破骨细胞存活率、凋亡率升高(P<0.05)。与OP组比较,ad-miR-181a组破骨细胞存活率升高(P<0.05),凋亡率降低(P<0.05),si-miR-181a组破骨细胞存活率降低(P<0.05),凋亡率升高(P<0.05)。ad-NC组、si-NC组破骨细胞存活率、凋亡率与OP组比较差异均无统计学意义(P>0.05) (图1,表1)。
表1 各组大鼠破骨细胞存活率、凋亡率比较(±s, n=6)Tab.1 Comparison of osteoclast's survival rate and apoptosis rate in each group of rats (±s, n=6)
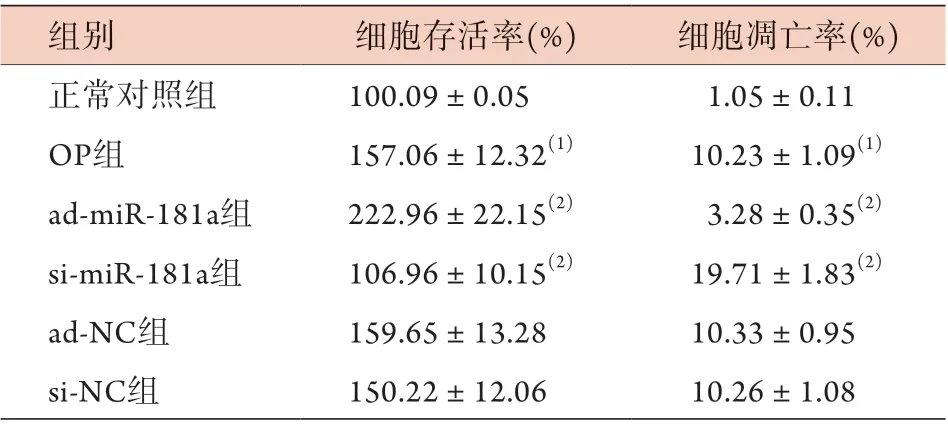
表1 各组大鼠破骨细胞存活率、凋亡率比较(±s, n=6)Tab.1 Comparison of osteoclast's survival rate and apoptosis rate in each group of rats (±s, n=6)
与正常对照组比较,(1)P<0.05;与OP组比较,(2)P<0.05
组别 细胞存活率(%) 细胞凋亡率(%)正常对照组 100.09±0.05 1.05±0.11 OP组 157.06±12.32(1) 10.23±1.09(1)ad-miR-181a组 222.96±22.15(2) 3.28±0.35(2)si-miR-181a组 106.96±10.15(2) 19.71±1.83(2)ad-NC组 159.65±13.28 10.33±0.95 si-NC组 150.22±12.06 10.26±1.08
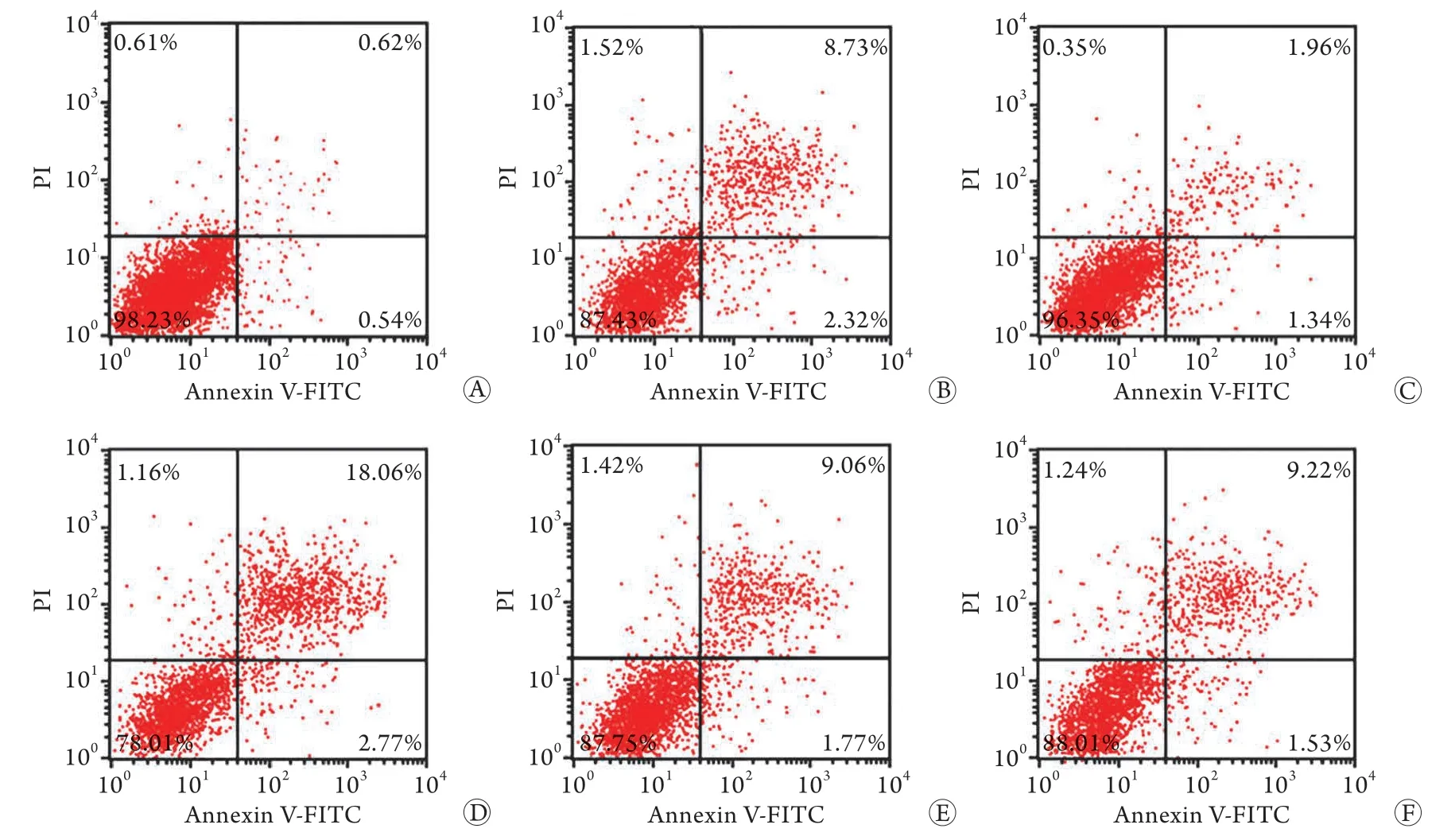
图1 各组大鼠破骨细胞凋亡情况Fig.1 Osteoclast apoptosis in each group of rats A. 正常对照组;B. OP组;C. ad-miR-181a组;D. si-miR-181a组;E. ad-NC组;F. si-NC组
2.3 上调或下调miR-181a的表达对大鼠破骨细胞自噬的影响 透射电镜观察显示,正常对照组破骨细胞线粒体轮廓清晰,崤完整,仅有少量自噬体形成。OP组破骨细胞可见线粒体嵴断裂、空泡样变化、自噬体形成增多。与OP组比较,ad-miR-181a组破骨细胞中线粒体肿胀、嵴断裂及空泡样变化缓解,自噬体形成减少;si-miR-181a组线粒体肿胀、嵴断裂及空泡样变化加重,自噬体形成增多。ad-NC组、si-NC组破骨细胞自噬形态与OP组相近(图2)。免疫荧光共定位检测结果显示,正常对照组破骨细胞中仅少量Parkin表达于线粒体外膜(TOMM20阳性标记部位)上,OP组破骨细胞中大量Parkin表达于线粒体外膜上。与正常对照组比较,OP组破骨细胞中Parkin+TOMM20+、PINK1、Parkin蛋白表达水平升高(P<0.05)。与OP组比较,admiR-181a组破骨细胞Parkin+TOMM20+、PINK1、Parkin蛋白表达水平降低,si-miR-181a组破骨细胞Parkin+TOMM20+、PINK1、Parkin蛋白表达水平升高(P<0.05)。ad-NC组、si-NC组Parkin+TOMM20+、PINK1、Parkin蛋白表达水平与OP组比较差异无统计学意义(P>0.05)(图3-4,表2)。
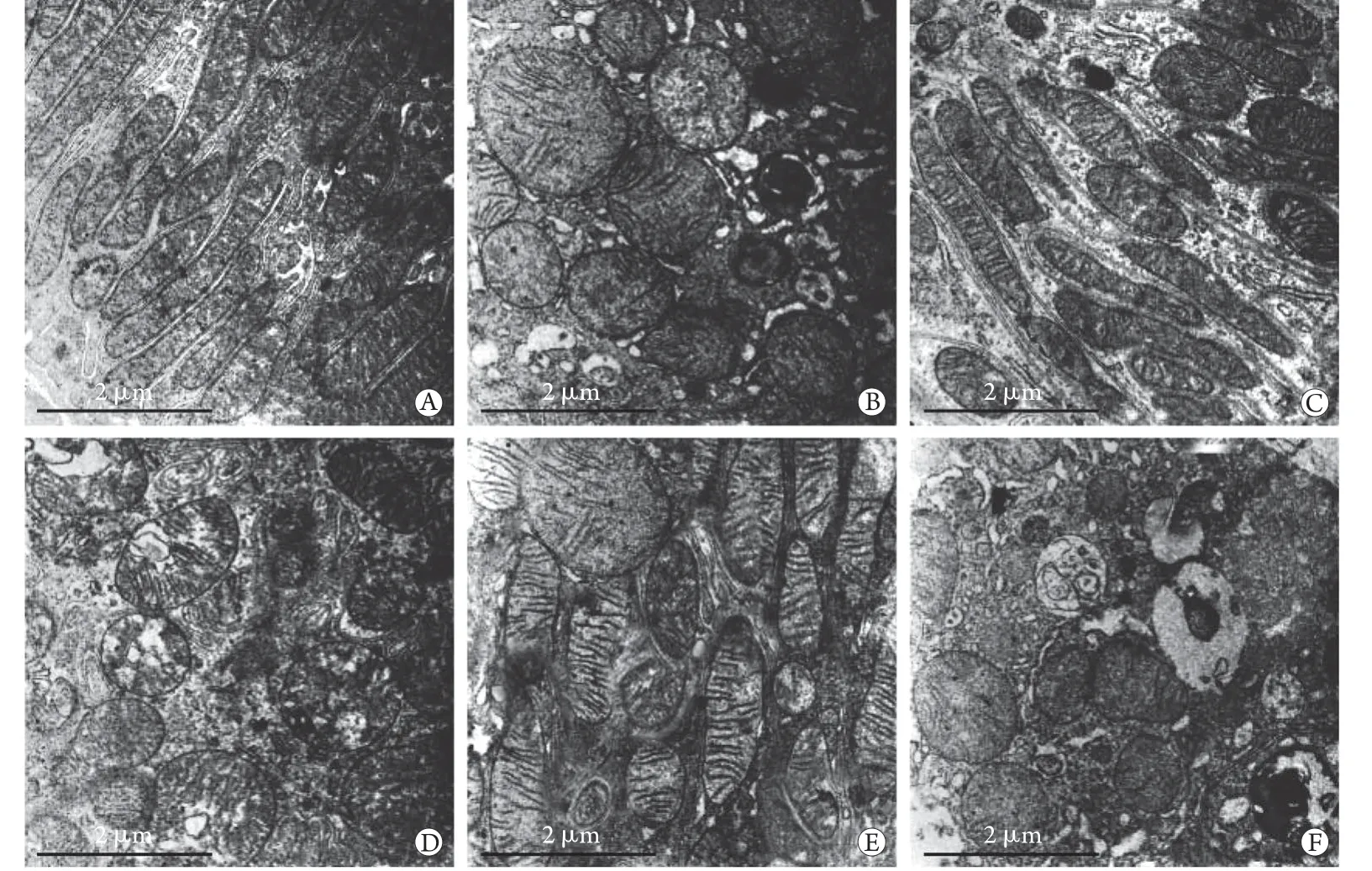
图2 各组破骨细胞电镜观察图Fig.2 Electron microscope observation of osteoclasts in each groupA. 正常对照组;B. OP组;C. ad-miR-181a组;D. si-miR-181a组;E. ad-NC组;F. si-NC组
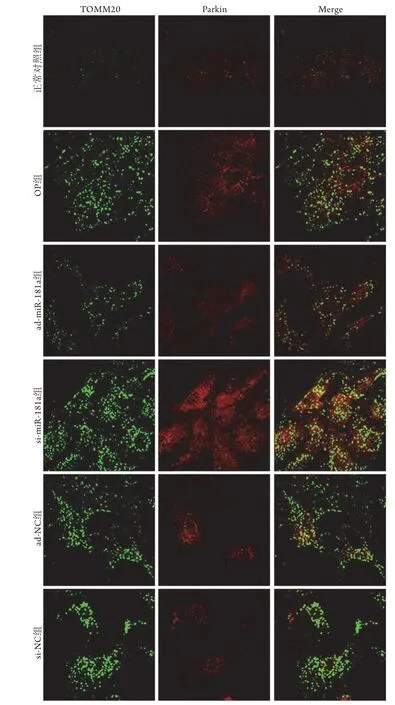
图3 各组Parkin与TOMM20免疫荧光染色共定位图(×400)Fig.3 Co-localization map of Parkin and TOMM20 in each group (Immunofluorescence staining, ×400)
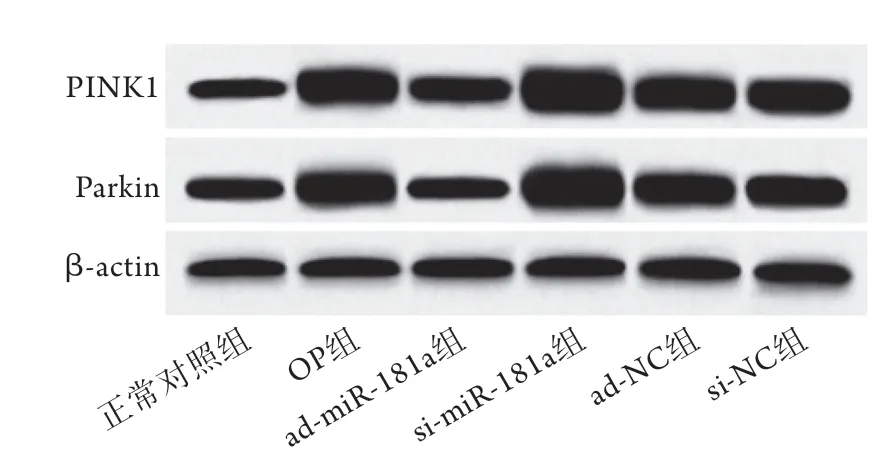
图4 各组破骨细胞中PINK1/Parkin通路蛋白表达情况(Western blotting)Fig.4 Expression of PINK1/Parkin pathway protein in osteoclasts of each group (Western blotting)
表2 各组破骨细胞中PINK1/Parkin通路蛋白表达水平比较(±s, n=6)Tab.2 Comparison of the expression levels of PINK1/Parkin pathway proteins in osteoclasts of each group (±s, n=6)
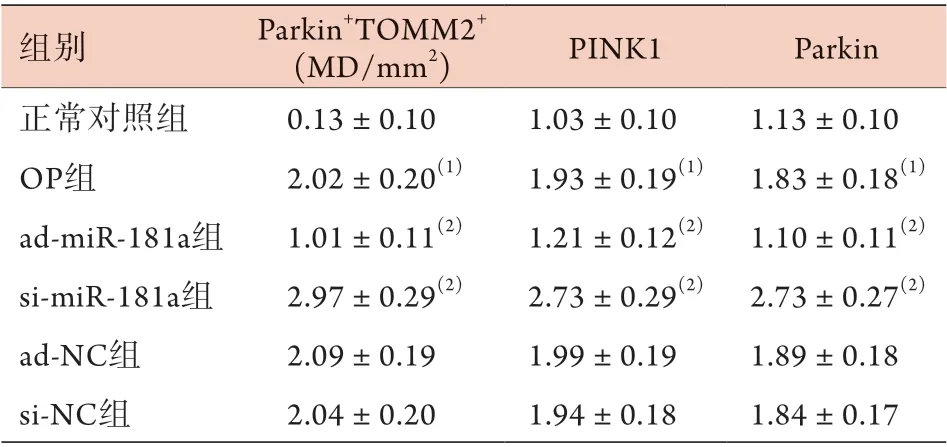
表2 各组破骨细胞中PINK1/Parkin通路蛋白表达水平比较(±s, n=6)Tab.2 Comparison of the expression levels of PINK1/Parkin pathway proteins in osteoclasts of each group (±s, n=6)
Parkin. 帕金森病相关基因;TOMM20. 小线粒体外膜标记蛋白;与正常对照组比较,(1)P<0.05;与OP组比较,(2)P<0.05
组别 Parkin+TOMM2+(MD/mm2) PINK1 Parkin正常对照组 0.13±0.10 1.03±0.10 1.13±0.10 OP组 2.02±0.20(1) 1.93±0.19(1) 1.83±0.18(1)ad-miR-181a组 1.01±0.11(2) 1.21±0.12(2) 1.10±0.11(2)si-miR-181a组 2.97±0.29(2) 2.73±0.29(2) 2.73±0.27(2)ad-NC组 2.09±0.19 1.99±0.19 1.89±0.18 si-NC组 2.04±0.20 1.94±0.18 1.84±0.17
2.4 上调或下调miR-181a表达对大鼠破骨细胞中PINK1/Parkin通路下游蛋白表达的影响 与正常对照组比较,OP组破骨细胞中NIX、LAMP2、Ub、p62蛋白表达水平及LC3-Ⅱ/Ⅰ比值升高(P<0.05),cleaved caspase-3蛋白表达水平降低(P<0.05)。与OP组比较,ad-miR-181a组破骨细胞中NIX、LAMP2、Ub、p62、cleaved caspase-3蛋白表达水平及LC3-Ⅱ/Ⅰ比值降低(P<0.05),si-miR-181a组破骨细胞中NIX、LAMP2、Ub、p62及cleaved caspase-3蛋白表达水平及LC3-Ⅱ/Ⅰ比值升高(P<0.05) (图5)。
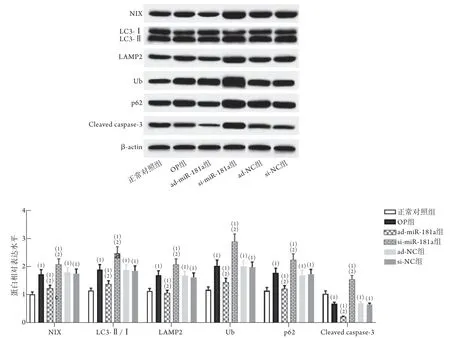
图5 各组破骨细胞中NIX、LAMP2、Ub、p62、cleaved caspase-3蛋白表达水平及LC3-Ⅱ/Ⅰ比值比较(±s, n=6)Fig.5 Comparison of the expression levels of NIX, LAMP2, Ub, p62, cleaved caspase-3 protein and ratio of LC3-Ⅱ/Ⅰ in each group of osteoclasts (±s, n=6)
2.5 共转染si-miR-181a和si-Parkin对破骨细胞存活率、miR-181a及Parkin蛋白表达的影响 与空白对照组比较,si-miR-181a组细胞存活率、miR-181a表达水平降低(P<0.05),Parkin蛋白表达水平升高(P<0.05),si-Parkin组细胞存活率升高(P<0.05),Parkin蛋白表达水平降低(P<0.05),miR-181a表达水平无明显变化(P>0.05)。与si-miR-181a组比较,si-miR-181a+si-Parkin组Parkin蛋白表达水平降低(P<0.05),细胞存活率升高(P<0.05),miR-181a表达水平无明显变化(P>0.05)。空载质粒对照组上述指标与空白对照组比较差异无统计学意义(P>0.05)(图6、表3)。
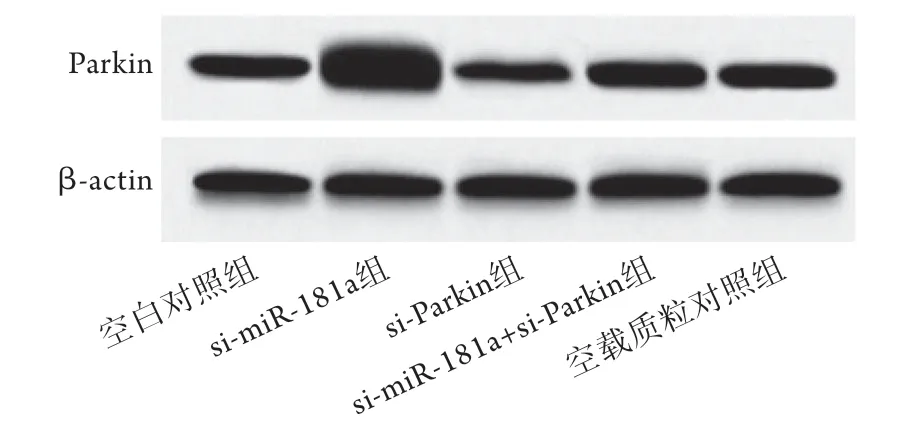
图6 各组破骨细胞中Parkin蛋白表达情况(Western bloはing)Fig.6 Expression of Parkin protein in each group of osteoclasts(Western blotting)
表3 各组破骨细胞存活率及miR-181a、Parkin蛋白表达水平比较(±s, n=6)Tab.3 Comparison of osteoclast survival rate and the expression levels of miR-181a and Parkin protein in each group (±s, n=6)
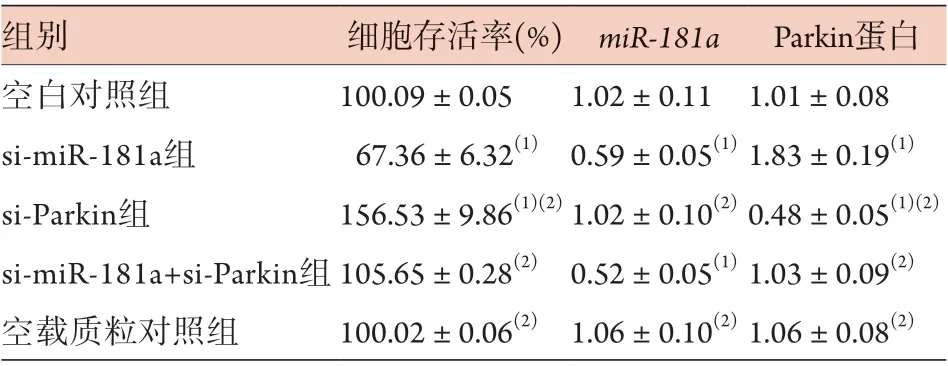
表3 各组破骨细胞存活率及miR-181a、Parkin蛋白表达水平比较(±s, n=6)Tab.3 Comparison of osteoclast survival rate and the expression levels of miR-181a and Parkin protein in each group (±s, n=6)
与空白对照组比较,(1)P<0.05;与si-miR-181a组比较,(2)P<0.05
组别 细胞存活率(%) miR-181a Parkin蛋白空白对照组 100.09±0.05 1.02±0.11 1.01±0.08 si-miR-181a组 67.36±6.32(1) 0.59±0.05(1) 1.83±0.19(1)si-Parkin组 156.53±9.86(1)(2)1.02±0.10(2) 0.48±0.05(1)(2)si-miR-181a+si-Parkin组105.65±0.28(2) 0.52±0.05(1) 1.03±0.09(2)空载质粒对照组 100.02±0.06(2) 1.06±0.10(2) 1.06±0.08(2)
2.6 共转染si-miR-181a和si-Parkin对破骨细胞线粒体自噬的影响 线粒体/溶酶体共定位检测结果显示,空白对照组线粒体与溶酶体存在共定位(显黄色结构)。与空白对照组比较,si-miR-181a组线粒体与溶酶体共定位(黄色区域)荧光强度升高[(3.83±0.19) MD/mm2vs. (1.68±0.18) MD/mm2,P<0.05],线粒体自噬增强,si-Parkin组线粒体与溶酶体共定位减少,黄色区域荧光强度降低[(0.88±0.08) MD/mm2,P<0.05],线粒体自噬减弱。与si-miR-181a组比较,si-miR-181a+si-Parkin组线粒体与自噬溶酶体共定位减少,黄色区域荧光强度降低[(1.63±0.16) MD/mm2,P<0.05],线粒体自噬减弱。空载质粒对照组黄色区域荧光强度[(1.60±0.16) MD/mm2,P>0.05]与空白对照组比较差异无统计学意义(图7)。

图7 各组线粒体/溶酶体共定位染色图(×1000)Fig.7 Mitochondrial/lysosomal colocalization staining map of each group (×1000)
2.7miR-181a与Parkin靶向关系验证 miRtarbase预测结果显示,miR-181a与ParkinmRNA的3'UTR存在结合位点(图8)。
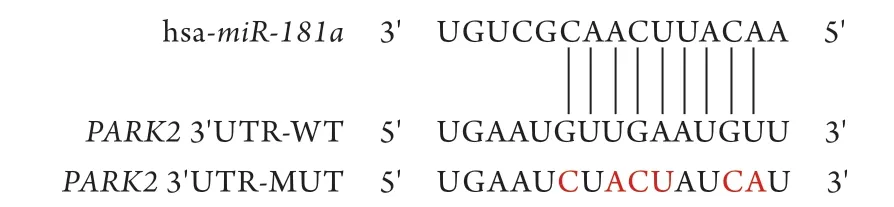
图8 miRtarbase软件预测miR-181a与Parkin mRNA的结合位点Fig.8 Binding site of miR-181a and Parkin mRNA predicted with miRtarbase software PARK2即为Parkin
双荧光素酶报告实验验证结果显示,与WT组比较,miR-181a-mimics+WT组荧光素酶活性降低(0.40±0.04vs. 1.02±0.10,P<0.05);MUT组与miR-181a-mimics+MUT组荧光素酶活性差异无统计学意义(1.03±0.12vs. 1.01±0.10,P>0.05) (图9)。
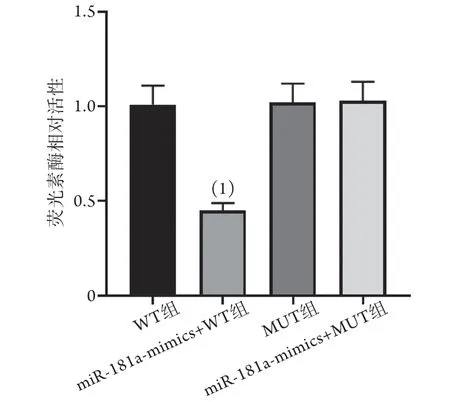
图9 各组破骨细胞荧光素酶相对活性比较(±s, n=6)Fig.9 Comparison of the relative activity of luciferase in osteoclasts of each group (±s, n=6)与WT组比较,(1)P<0.05
3 讨 论
绝经后OP是最常见的骨代谢异常疾病之一。大量研究发现,破骨细胞数量及骨吸收活性增加是引起OP骨量丢失的重要原因之一[13]。线粒体自噬在破骨细胞骨吸收及存活过程中发挥着重要作用,已有研究证实,破骨细胞骨吸收及降解过程中会释放溶酶体,激活骨吸收蛋白的表达而降解骨质,并诱导自噬标志蛋白LC3定位于破骨细胞褶皱边缘,促进破骨细胞发生自噬性死亡[14];该研究认为,线粒体自噬激活一方面反映了破骨细胞骨吸收活性增强,另一方面可影响破骨细胞的存活,提示干预破骨细胞线粒体自噬可能是抑制破骨细胞骨吸收活性及存活的潜在机制。目前线粒体自噬对破骨细胞存活的影响尚未明确。PINK1/Parkin通路是调控线粒体自噬的关键通路。在一定应激及病理条件下,PINK1可感知线粒体损伤并聚集于线粒体外膜上,促进Parkin转位到线粒体外膜并泛素化线粒体蛋白,诱导p62聚集并与LC3特异性结合,从而介导线粒体自噬[15]。本研究发现,OP大鼠骨量丢失(骨体积分数、骨密度降低)增加,破骨细胞凋亡率、存活率升高,而破骨细胞中线粒体自噬形成的溶酶体及自噬体增多,PINK1/Parkin自噬通路激活,证实OP大鼠破骨细胞存活数量增加,可能与线粒体自噬激活有关。
近年来研究发现,miRNA与OP破骨细胞活性增强关系密切[16],其中miR-181a可靶向上调死亡受体相关蛋白(FasL)的表达,促进破骨细胞的增殖及分化[17],从而影响OP进程。miR-181a是一种线粒体自噬抑制因子,Goljanek-Whysall等[18]研究发现,骨骼功能异常及肌肉萎缩与miR-181a水平降低以及线粒体自噬相关蛋白Parkin、p62、自噬溶酶体底物蛋白-泛素结合蛋白核自噬受体(sequestosome 1,SQSTM1)积聚有关,上调miR-181a可抑制Parkin、p62积聚,改善线粒体质量和骨骼肌功能,提示miR-181a可能与线粒体自噬有关。本研究发现,miR-181a与Parkin之间存在靶向负调控关系,OP大鼠破骨细胞中miR-181a、Parkin蛋白表达水平明显高于正常大鼠,推测Parkin介导的自噬激活可能代偿性地促进miR-181a上调,从而对机体发挥应激保护作用。进一步上调OP大鼠破骨细胞中miR-181a的表达后,Parkin介导的自噬活性降低,细胞存活率升高、凋亡率降低,推测抑制OP大鼠破骨细胞自噬可促进破骨细胞存活,这与Sharma等[19]的抑制线粒体自噬可减轻细胞过度活化产生的应激性损伤从而减缓细胞自噬性死亡的观点相一致。反之下调miR-181a的表达后,Parkin介导的自噬进一步被激活(Parkin在线粒体外膜上表达,PINK1、Ub、LAMP2、NIX表达水平及LC3-Ⅱ/Ⅰ比值均明显升高),破骨细胞存活率降低,提示OP过程中下调miR-181a的表达可能会促进破骨细胞发生自噬性死亡,这与既往研究中下调miR-181a表达可抑制破骨细胞活性[10]以及自噬过度激活导致细胞能量崩溃死亡[19]等结论一致。另外,外源性敲除破骨细胞中的Parkin基因,可逆转miR-181a下调发挥的促进自噬及促凋亡作用。
综上所述,上调OP大鼠破骨细胞中miR-181a的表达可靶向下调Parkin的表达,抑制线粒体自噬激活,促进破骨细胞存活。这可能为阐明OP破骨细胞骨增殖及存活机制提供了一定的依据。但本研究尚存在不足之处,如未对线粒体自噬与破骨细胞骨吸收之间的关系进行研究,而破骨细胞存活及骨吸收的靶向miRNA较多,且影响miR-181a表达改变的上游靶向调控机制尚不明确,仍需进一步研究。

