功能代谢组学在生物医药领域中的应用
刘璟贤,张建永,李晓飞,3*
1遵义医科大学基础医学院,贵州遵义 563000;2遵义医科大学药学院,贵州遵义 563000;3遵义医科大学贵州省普通高等学校特色药物肿瘤防治重点实验室,贵州遵义 563000
代谢组学作为系统生物学的重要组成之一,是继蛋白质组学、转录组学后发展起来的围绕机体代谢的新兴组学,通过分析机体在不同干预条件下的差异代谢物,继而发现背后的生物代谢机制。既往代谢组学与其他组学的整合多是通过独立分析,再通过数理统计分析及生物信息学分析等方法寻求代谢组学发现的差异代谢物与其他组学发现的差异蛋白、基因之间的联系,然而这种方法是建立在查阅文献及推测的基础上的,代谢物-蛋白-基因之间的上下游联通关系尚未经生物学研究印证,同时代谢物与蛋白之间存在代谢酶的桥接,目前的多组学联合分析也难以实现。功能代谢组学是继代谢组学之后发展起来的研究策略和方法,其在代谢组学发现差异代谢物、预测差异代谢通路的基础上,通过实验对差异代谢物关联的上游代谢酶、蛋白及基因进行验证,是自下而上系统分析生物学病理生理现象的全新途径,是对代谢组学的有力补充,也是加强代谢组学与其他组学沟通的有力手段。本文系统地介绍功能代谢组学的原理及采用的研究策略,并对其在生物医药研究中取得的系列成果和最新进展进行综述,以为其发展和应用提供更多科学依据及参考。
1 概 况
1.1 代谢及代谢组学 代谢是一系列生物化学反应的集合,通过一系列代谢产物维持机体的正常生命活动,在生物体内发挥着重要作用。在该过程中,代谢产物可促进不同生理过程的物质交换并在生物体内合成能量,是机体代谢反应的关键前体及分解代谢反应的关键底物[1]。当机体受到内源性和外源性刺激时,一些内源性小分子代谢物可被扰动而发生改变。
代谢组学是继蛋白质组学、转录组学后发展起来的围绕机体代谢的新兴组学,其研究对象是机体内分子量较小的内源性代谢物,如糖类、氨基酸、脂质和有机酸等。代谢组学通过检测机体受到干扰后内源性代谢物的变化,从中找出与干扰相关的差异代谢物,同时结合生物信息学分析阐明代谢通路,继而解析生物代谢机制[2]。目前,根据研究目的不同,代谢组学可划分为非靶向代谢组学和靶向代谢组学两种类型。其中,非靶向代谢组学侧重于发现,对分析的代谢物没有偏向性,是对整个机体代谢组的比较;靶向代谢组学是非靶向代谢组学的深入,侧重于精准,是一种预先建立假设的分析方法,用于分析已知的小分子代谢物,可达到精准定量,能更准确地挖掘出差异代谢物的精准变化。非靶向代谢组学是进行代谢组学研究的首选,在高通量分析生物体内代谢物方面具有明显优势[3],靶向代谢组学是在非靶向代谢组学基础上的进一步深入研究。
1.2 代谢组学研究技术及应用 目前,核磁共振技术(nuclear magnetic resonance,NMR)、气相色谱-质谱(gas chromatography-mass spectrometry,GCMS)和液相色谱-质谱(liquid chromatography-mass spectrometry,LC-MS)是代谢组学研究的主要技术。其中NMR样品需求量小、前处理简单,是一种无损的多参数和动态监测技术,多用于广谱代谢组学分析,但其灵敏度低、检测通量小[4]。GC-MS重现性较好,分辨率及灵敏度较高,且具有系统自带数据库,可用于差异代谢物的鉴别,是目前检测代谢物的一种重要方法并被广泛使用,但对于挥发性较低的代谢产物需要繁琐的衍生化处理且检测通量不高[5]。LC-MS具有样品前处理简单、分析范围广、分离能力强、代谢物组覆盖率广等特点,可很好地弥补GC-MS的物质检测偏向性和NMR的低灵敏度,是目前代谢组学研究主要使用的分析技术,但存在代谢物鉴定没有数据库等问题[6]。
近年来,代谢组学已被广泛应用于生物医药研究中,对于发现机体病理生理过程及药物干预过程中的关键代谢途径和生物标志物具有独特优势,可用于辅助疾病的早期诊断以及疾病机制、药物作用机制、靶点发现、毒效和毒理机制等方面的研究。目前大多数代谢组学研究仍聚焦于发现标志代谢物,通过生物信息学分析揭示其生化功能和相关机制,缺少对差异代谢物相关的酶、蛋白以及反应途径功能的实验验证,缺少上下游的有机整合[1]。因此,在通过代谢组学获取准确结果后,有必要对代谢物的上下游进行整合分析。
1.3 功能代谢组学 通过代谢组学对不同病理生理状态下内源性代谢物进行精准表征,发现差异代谢物后,进一步通过实验对代谢物及其变化前后的关联酶、通路进行功能验证,便形成了功能代谢组学。功能代谢组学由于整合了代谢物及其上下游的酶、基因和蛋白,可更好地阐释代谢组学发现的生物学分子本质[1],更全面地反映机体的状态,从而为疾病的诊断、治疗、药效、毒效以及机制研究提供新的思路。
2 功能代谢组学的研究策略
2.1 基于代谢物功能的研究 基于代谢物功能的研究策略如图1所示:首先通过代谢组学获得差异代谢物,进一步筛选差异较大的关键代谢物,接下来围绕关键代谢物的功能进行深入研究。通常在获得关键代谢物后,可通过查阅文献,获取关键代谢物的功能。此时可采取两种策略,一种是采用数理统计方法将关键代谢物含量与同时观测到的疾病生理、生化指标进行关联分析,通过相关分析获取关键代谢物可能参与的主要功能;另一种是通过实验验证关键代谢物的功能在所研究的病理生理条件下的具体作用。这属于功能代谢组学的初级研究,如Sun等[7]发现,茵陈蒿汤(YCHT)干预阳黄综合征(Yang Huang syndrome,YHS)模型小鼠后,D-葡萄糖醛酸是关键的差异代谢物,进一步分析发现戊糖和葡萄糖醛酸酯的相互转化途径是关键的代谢途径,且该途径的上游调节蛋白尿苷二磷酸葡萄糖醛酸基转移酶(UDP-ducuronosyltranskrase,UGT)与YHS的代谢标志物相关。有研究发现,UGT参与了内源性化合物如胆红素的生物代谢,通过检测小鼠血清生化指标胆红素的变化,发现UGT可导致血清胆红素含量增加,证实了YCHT通过戊糖和葡萄糖醛酸酯相互转化途径影响胆红素的含量,从而治疗YHS。
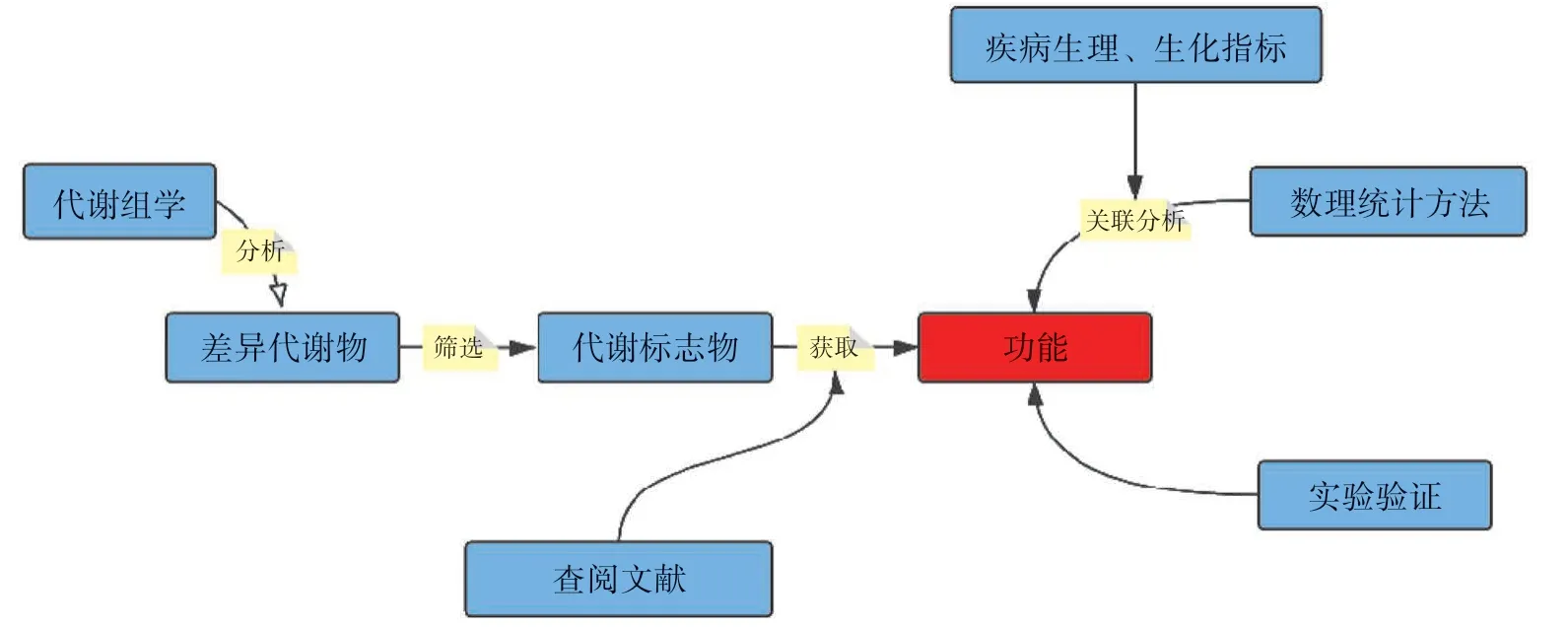
图1 基于代谢物功能的研究策略Fig.1 Research strategies based on metabolite function
进一步深入地开展功能代谢组学研究,采用的策略一般是通过体内外实验,使用关键代谢物干预动物、离体器官、细胞等,结合分子生物学技术(如流式细胞术、Western blotting、RT-PCR等)验证关键代谢物的生物学功能,从而揭示代谢物在病理生理状态下的作用,从而为探讨疾病发病机制及药/毒理作用机制等提供科学依据。例如,有研究通过代谢组学分析发现,贝壳杉烷型二萜类化合物(parvifoline AA,PAA)可增加不同人肝癌细胞系(SMMC-7721、Huh7和HepG2细胞)中活性氧(reactive oxygen species,ROS)的含量,进一步研究发现参与ROS生成的过氧化物酶Ⅰ和Ⅱ(Prxs-Ⅰ/Ⅱ)的表达升高,流式细胞术检测发现ROS清除剂N-乙酰半胱氨酸(N-acetylcysteine,NAC)可有效抑制PAA在人肝癌细胞中诱导的ROS累积[8]。有研究通过代谢组学分析发现,2型糖尿病患者血清中代谢物4-甲酚的浓度与疾病严重程度呈负相关;采用4-甲酚干预高脂喂养的小鼠发现,小鼠胰岛β细胞阳性面积和密度增加,表明4-甲酚可促进胰岛素的分泌;进一步采用RT-PCR检测发现,4-甲酚可促进小鼠脂肪组织中激素敏感性脂肪酶(hormone sensitive lipase,HSL)和patatin样磷脂酶结构域2(patatin-like phospholipase,PNPLA2)的表达,增加胰腺相关基因编码淀粉酶、血管内皮生长因子、脑源性神经营养因子、白细胞介素-10(interleukin-10,IL-10)和去沉默调控蛋白1(sirtuin 1,SIRT1)基因的转录表达[9]。有研究通过代谢组学分析发现,黄芪多糖(APS)可改善高脂饮食(HFD)小鼠的代谢紊乱,其关键代谢物为2-羟基丁酸(2-hydroxybutyric acid,2-HB);采用2-HB干预人HepG2细胞和小鼠胚胎成纤维3T3-L1细胞,Western blotting检测发现2-HB能促进肝细胞HSL、三酰甘油脂肪酶(adipose triglyceride lipase,ATGL)和羧酸酯酶1(carboxylesterase 1,CE1)的表达,并促进3T3-L1细胞中三酰甘油的释放,提示2-HB可促进脂质降解[10]。
2.2 基于代谢物所在代谢途径的研究 如图2所示,通过代谢组学发现的差异代谢物可以表征生物体的病理生理状态,同时差异代谢物所在的代谢通路也与病理生理状态密切相关。除代谢物外,代谢通路中代谢物关联的上下游的酶、基因等至关重要,因此通过探索代谢物所在代谢通路中的酶及基因变化可更全面地阐述代谢物的功能,这也是功能代谢组学的主要研究策略。目前采用的方法是通过体内外实验使用酶的激活剂和抑制剂进行干预,或是敲除/过表达相关酶及基因的表达后,观察体内外模型的代谢表型变化,同时采用分子生物学技术检测代谢物关联的酶和基因的功能进一步佐证。Zhao等[11]发现,雷公藤红素降低了胆汁淤积患者血清胆汁酸的浓度,而SIRT1蛋白表达水平与胆汁酸浓度呈反比[12],通过功能代谢组学方法,采用小鼠干预实验及细胞实验,发现雷公藤红素可抑制胆汁酸浓度的增加,逆转肝脏SIRT1蛋白表达的下降,进一步通过敲除法尼醇X受体(farsenoid-X receptor,FXR)和SIRT1抑制剂实验证实了雷公藤的这种保护作用与激活SIRT1-FXR信号通路有关。Wang等[13]建立了长春新碱(vincristine,VCR)诱导的大鼠肠梗阻模型和伊立替康(irinotecan hydrochloride infusion,CPT-11)诱导的大鼠腹泻模型,通过代谢组学分析发现,模型大鼠结肠中犬尿氨酸(kynurenine,KYN)和喹啉酸(kynurenic acid,KA)水平急剧升高,进一步使用VCR、CPT-11干预人结肠上皮细胞(NCM460),发现KYN和KA可明显促进IL-6和芳烃受体基因(aryl hydrocarbon receptor,AHR)的表达;结合研究报道IL-6和AHR均对修复受损肠道具有积极作用[14-16],当加入特异性抑制剂(CH223191)阻断或者敲除AHR基因时,AHR的作用被显著抑制。此外Western blotting和RT-PCR检测发现,IL-6能显著促进吲哚胺2,3-双加氧酶1(indoleamine 2,3-dioxygenase 1,IDO1)蛋白和mRNA的表达,IDO1可促进犬尿氨酸(kynurenine,KYH)的生成,进一步验证了KYN和KA通过IL-6/IDO1/AHR正反馈通路发挥作用。
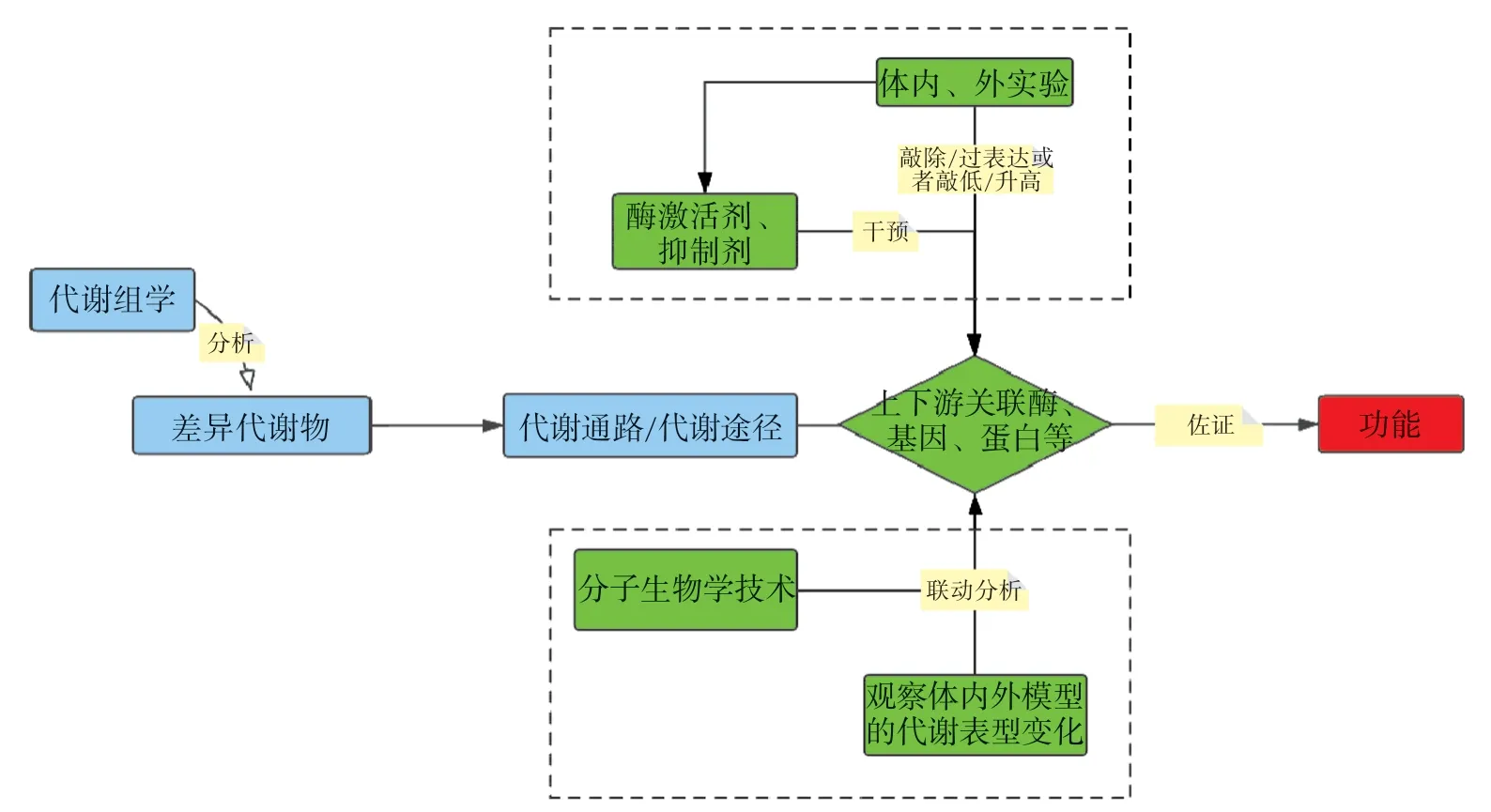
图2 基于代谢物所在代谢途径的研究策略Fig.2 Research strategies based on the metabolic pathways of metabolites
3 功能代谢组学在生物医药领域的应用
3.1 用于疾病发病机制与致病靶点的研究 机体发生病理改变是由于体内发生了相应功能变化,进而其对应代谢物的含量水平发生改变,通过代谢组学发现差异代谢物后,对这些差异代谢物进行功能分析,即通过功能代谢组学可发现新的有利于疾病诊断的生物标志物,进一步深入揭示发病机制及潜在靶标。目前已有多位学者开展了功能代谢组学研究,并取得了一些积极的结果。
3.1.1 生物表型研究 生物表型研究常被用于揭示疾病特别是遗传性疾病的生物标志物,如基因表型研究主要是利用影响染色质结构的小分子进行生化修饰,从而导致基因表达消失(如甲基化)或激活(如乙酰化),从而揭示人类疾病的异质性和治疗反应差异。而功能代谢组学可利用代谢组学手段有效读取基因组和环境的影响,即提取疾病变化中具有相同生物表型的代谢产物,在此基础上验证影响同表型代谢物的相同基因、蛋白或酶,以此揭示疾病表型下的深刻内在变化[17]。Müllede等[18]通过代谢组学分析发现,敲除雷帕霉素靶蛋白复合体1(target of rapamycin complex 1,TORC1)的上游激活因子与雷帕霉素处理后的酿酒酵母菌的氨基酸代谢特征相似,主要表现为丙氨酸、天冬氨酸、天冬酰胺、谷氨酸、谷氨酰胺、支链氨基酸和芳香族化合物的含量增加,以及甘氨酸、丝氨酸和赖氨酸的含量减少,通过捕获染色质转录调控区寻找与上述氨基酸变化表征相同的基因(如Dmch5、Dopt2和Dtef4等),进一步采用雷帕霉素处理酿酒酵母菌,敲除这些基因后发现雷帕霉素的敏感性增加,再与文献[19、20]证实的TORC1在氨基酸代谢中通过维持膜的转运来调节膜泡介导的运输功能进行关联分析,得到雷帕霉素具有抑制TORC1表达作用的结论。
3.1.2 代谢途径作为潜在的疾病治疗靶标 代谢组学发现差异代谢物后,可通过生物信息学分析获得差异代谢通路和途径,但这些途径是否在疾病中发挥作用尚不可知,功能代谢组学可进一步对差异代谢物所在代谢途径关联的关键酶或通路进行深入分析,主要通过开展实验对代谢物所在的代谢途径进行干预,也可与选择性抑制剂结合使用加以佐证。例如,Yan等[21]发现,糖酵解是川楝素(toosendanin,TSN)致肝毒性的关键代谢途径,而磷酸丙糖异构酶(triose-phosphate isomerase,TPIS)是该代谢途径的主要酶,进一步采用TSN建立大鼠及原代肝细胞毒性模型,体内外研究均发现TSN抑制了糖酵解过程,且TPIS的活性被显著抑制,表明TPIS及其所在的糖酵解途径可能是TSN致肝毒性的关键靶标。
能量代谢改变是肿瘤的重要特征之一[22],而癌基因和抑癌因子均可通过调节能量代谢发挥作用,因此,能量代谢途径可能是肿瘤发病的重要机制。通过功能代谢组学可深入研究能量代谢途径,揭示其在不同肿瘤中发挥的作用。例如,三阴性乳腺癌(triple negative breast cancer,TNBC)是浸润性乳腺肿瘤的主要类型之一,但目前预后工具和靶向治疗方法的价值有限。Apaya等[23]发现,TNBC肿瘤组织中花生四烯酸细胞色素P450(cytochrome P450,CYP)环氧酶和环氧花生四烯酸(epoxyeicosatrienoic acids,EET)含量较正常乳腺组织明显升高;qPCR检测发现,CYP环氧酶过表达时TNBC肿瘤分子转移能力减弱;进一步相关分析发现,TNBC肿瘤EET含量与CYP环氧酶基因的表达呈正相关,表明CYP环氧酶代谢途径可作为TNBC肿瘤治疗及预后的代谢靶标。
3.1.3 疾病靶点研究 功能代谢组学通过对代谢物关联的酶、基因等的系统研究[24],将生物体内的代谢通路上下游阐述清楚,而通路中的酶和基因可能是疾病的致病靶点,从而可多层次揭示疾病的发病机制,为疾病的早期诊断、预后评估和个性化治疗提供科学依据。例如,Zhang等[25]发现冠状动脉疾病(coronary artery disease,CAD)患者血浆中有36种差异代谢产物,其中一种差异显著的代谢物N-乙酰神经氨酸(Neu5Ac)在CAD患者血浆中表达上调;体外研究发现,Neu5Ac可诱导心肌细胞活性降低,促使心肌细胞凋亡;进一步采用Western blotting检测发现,Neu5Ac可诱导RhoA和Cdc42蛋白表达增加,激活ROCK1和ROCK2蛋白,促进c-Jun氨基末端激酶(c-Jun NH2-terminal kinase,JNK)和细胞外信号调节激酶(extracellular-signal regulated kinase,ERK)的磷酸化。此外,有研究发现,CAD患者和大鼠心肌缺血模型心脏中调节Neu5Ac生成的神经氨酸酶1的表达急剧增加,进一步印证了Neu5Ac及其关联酶神经氨酸酶1可能是CAD发病的重要靶点。Nemet等[26]发现,脑血管疾病(cerebral vascular diseases,CVD)组(162例受试者)中一种肠道微生物代谢物——苯乙酰谷氨酰胺(PAGln)显著表达,进一步采用体外细胞实验验证PAGln的功能,发现其可诱导血小板聚集,诱导人骨髓来源的巨核母细胞以及人骨髓来源的红细胞发生特定的凝血酶-凝血酶受体结合反应,加入G蛋白偶联受体(G-proteincoupled receptor,GPCR)抑制剂后这种诱导作用减弱,继续采用RNA敲除技术敲除血小板受体(A2A等)或加入受体抑制剂后可显著阻断PAGln诱导的血小板聚集反应,进一步证实了PAGln可通过GPCR介导血小板功能反应,具有引起血栓的风险,表明其可能是治疗CVD的重要靶点。Peng等[27]采用基于毛细血管电泳质谱的代谢组学分析发现,人胶质瘤组织中亚牛磺酸水平明显升高;进一步研究表明,亚牛磺酸可刺激人神经胶质细胞瘤细胞(U251)增殖,并证实其是通过竞争性抑制脯氨酸羟化酶结构域-2(PHD2)来激活缺氧信号通路,从而增强胶质瘤细胞的增殖和侵袭。此外,胱氨酸/牛磺酸代谢途径被证实是细胞亚牛磺酸的主要来源途径之一[28-29]。将胶质母细胞瘤异种移植到小鼠建立模型,给予亚牛磺酸的氧化代谢物牛磺酸喂养,结果显示,牛磺酸可降低胶质瘤细胞中亚牛磺酸的含量,导致细胞生长阻滞[27]。综上,亚牛磺酸水平升高可促进胶质瘤的生长,因此亚牛磺酸代谢途径可能作为胶质母细胞瘤诊断和治疗的全新途径。
3.2 用于药物作用机制的研究 通过监测药物对机体内源性环境的扰动作用,找到药物靶点及其代谢途径和相应功能变化的信号通路,有助于用药效果的最大化和用药不良反应的最小化。功能代谢组学可从代谢组学对药物作用后内源性小分子的监测拓展到对生物大分子的研究,从而为阐明药物在机体内的作用机制提供新的途径。目前水产养殖业中滥用抗生素常引起细菌耐药,导致抗生素功效降低[30],但其机制并不清楚。Zhao等[31]比较了硫酸新霉素敏感株与耐药株之间的代谢差异,发现L-天冬氨酸在敏感株中的含量较高;进一步研究发现L-天冬氨酸可提高硫酸新霉素在金鱼中的杀菌效果。此外,L-天冬氨酸与硫酸新霉素联合使用可提高嗜水链球菌感染后金鱼的成活率,表明L-天冬氨酸作为硫酸新霉素的增效剂,不仅可改善杀菌作用和抗菌药物的功效,还可减少药物的使用量及其残留物的不良影响。Ma等[32]发现,已感染链球菌但未死亡的罗非鱼中L-亮氨酸的含量较高,推测L-亮氨酸可提高罗非鱼的生存能力,进一步采用口服和注射的方式给予被海豚链球菌感染的罗非鱼外源性L-亮氨酸并检测其抗菌能力,发现L-亮氨酸提高了罗非鱼的生存率,且罗非鱼以剂量依赖性的方式逃逸细菌感染。
此外,功能代谢组学也可用于探讨药物毒性的机制,这为药物毒性研究提供了新的思路。Chan等[33]发现,对乙酰氨基酚(paracetamol,APAP)可提高动物或人体血清和尿液中脂肪酸及酰基肉碱的含量,并可通过抑制肉碱棕榈酰转移酶1(carnitine palmitoyltransferase 1,CPT1)的活性而导致肝毒性的发生;进一步通过HepG2肝细胞和小鼠动物实验,加入CPT1抑制剂[N-乙酸-对苯醌亚胺(NAPQI)和依托莫司],同时用过氧化物酶体增殖物激活受体α(peroxisome proliferator activated receptors α,PPARα)诱导剂非诺贝特预处理,发现非诺贝特可通过上调脂肪酸β-氧化基因的表达而减弱APAP对CPT1的抑制作用,这与PPARα可保护小鼠免于APAP毒性的报道相符[34-35]。
4 功能代谢组学的其他研究
4.1 网络药理学与功能代谢组学的结合 网络药理学主要利用人体代谢酶及蛋白质的相互作用网络,分析药物对疾病作用的特定节点,从基因、蛋白等分子水平分析药物对疾病的干预作用及机制。功能代谢组学是从药物作用后的代谢物自下入手,从而发现代谢物关联的酶、基因和蛋白,也是从分子水平分析药物对疾病的干预作用及机制。二者研究策略不同,结果必然存在差异,因此网络药理学和功能代谢组学结合可互为补充,更全面地揭示药物作用的生物学意义及机制(图3)。Sun等[36]发现,芒硝可通过上调鹅去氧胆酸含量来调节胆汁酸分泌,从而治疗结直肠癌;同时采用网络药理学分析发现,鹅去氧胆酸可间接抑制与胆汁酸代谢相关且参与炎症反应的相关蛋白激酶(如ERK1/2,NF-κB,Mapk和Akt)的活性,这几种酶为FXR/RXR途径的上游酶;进一步分析发现,芒硝可上调FXR受体的表达且通过激活FXR受体来调节炎症通路,这与代谢组学和独创性通路分析软件(ingenuity pathway analysis,IPA)分析结果一致,对于更好地发现背后的生物学现象具有重要作用。

图3 网络药理学与功能代谢组学联用Fig.3 Combination of network pharmacology and functional metabolomics
4.2 功能代谢组学的延伸——重编程代谢组学代谢组学逐步发展至今天,一方面可分析代谢物的丰度,以及各种病理生理条件下的代谢途径及代谢网络,逐步实现基因-表型、基因-环境的联系;另一方面,市售代谢物标准品干预研究对象后的效应与不同物种之间的基础代谢物或相关蛋白、酶产生的效应相似,使得通过外源性代谢物重新编程代谢成为可能。在功能代谢组学阐明细胞应答机制的基础上,对有功能的代谢途径或者通路通过代谢调节剂(如干扰素IFN-α2b)进行重编程,可使关键标志物及相关代谢途径对逆转疾病发展、减缓药物毒性或降低药物耐药性等产生积极影响,目前已应用于控制和预防病原体感染以及增强宿主抵抗病原体等方面[37],进一步形成了通过功能代谢组学分析和重编程实验来进行新陈代谢重建的全新策略[38]。但重编程代谢组学在生物医药研究中的应用尚处于起步阶段。
5 总结与展望
综上所述,功能代谢组学弥补了代谢组学单纯研究病理生理变化与代谢物及代谢通路关系的不足,通过结合分子生物学技术实现了代谢-生化机制、代谢物-关联基因、代谢物-关联的蛋白/酶的整合分析[25],实现了对生物系统中复杂相互作用的探索,并将细胞、生物体和种群进行多角度、深入的机制还原,系统研究特定生物学环境中代谢改变的功能,阐明导致代谢失调的主要生物学机制,在生物医药领域具有广阔的应用前景。
但功能代谢组学尚存在以下问题:首先,功能代谢组学研究高度依赖代谢组学数据,因此继续开发精准的代谢组学分析方法仍面临挑战[39]。其次,在功能验证时,如何在大量的差异代谢物中筛选出具有较大意义的代谢物,目前的手段还是通过含量的差异倍数(fold-change)来判断,但代谢物含量变化不一定与病理生理状态紧密关联。因此,迫切需要建立功能代谢物选择原则,减少假阳性。最后,差异代谢物的功能验证后如何转化为靶点仍需更多的分子生物学技术来补充。

