短链脂肪酸对脂多糖诱导的大鼠急性呼吸窘迫综合征的影响及其作用机制
向小琴,张婷婷,钟江姗,尹国芳,范贤明*
1西南医科大学附属医院呼吸与危重症医学科,四川泸州 646000;2西南医科大学附属医院炎症与变态反应实验室,四川泸州 646000
根据柏林定义,急性呼吸窘迫综合征(acute respiratory distress syndrome,ARDS)是一种急性弥漫性肺部炎症,可导致肺血管通透性及肺重量增加,参与通气的肺组织减少,其主要临床特征为急性进行性及顽固性低氧血症[1]。多种情况可诱发ARDS,如重症胰腺炎、外伤、大量输血、严重脓毒症、肺炎等[2]。ARDS发病机制复杂,目前主流的观点认为ARDS的本质是炎症,肺内炎性细胞过度活化,释放过多炎性介质,大量炎性因子与炎性细胞相互作用、相互激活,引发失控的炎症级联反应。另有研究发现,导致ARDS的原因是机体产生过度的免疫反应,肺上皮细胞和血管内皮细胞出现广泛而严重的损伤,最终引起ARDS的病理改变[3]。本课题组前期研究使用粪便菌群移植(fecal microbiota transplantation,FMT)干预脂多糖(lipopolysaccharide,LPS)诱导的急性肺损伤(acute lung injury,ALI)大鼠模型发现,与对照组比较,模型组大鼠肠道微生物群发生明显紊乱,采用FMT干预后肠道菌群紊乱得到纠正,肺损伤得到明显改善[4-5],但肠道菌群改善ALI/ARDS的具体介质和机制尚不明确。短链脂肪酸(short chain fatty acids,SCFAs)是肠道微生物群产生的最丰富和最重要的代谢产物之一,被认为是影响炎症和免疫调节的代谢物[6],其中乙酸、丙酸、丁酸占比最高,达90%~95%,三者比例约为3∶1∶1[7]。已有少量国内外研究探讨了乙酸、丙酸、丁酸对ALI/ARDS模型的影响及其机制,但三种主要SCFAs合用对ARDS模型影响的相关研究少见。本研究通过肠道内补充三种SCFAs(乙酸∶丙酸∶丁酸=3∶1∶1)对LPS诱导的ARDS大鼠模型进行干预,探讨SCFAs对ARDS的影响及其可能的作用机制。
1 材料与方法
1.1 主要试剂及仪器 脂多糖、乙酸钠、丙酸钠、丁酸钠(美国S i g m a 公司);肿瘤坏死因子(tumour necrosis factor,TNF)-α、白细胞介素(interleukin,IL)-6、IL-10酶联免疫吸附实验(ELISA)检测试剂盒(武汉科鹿生物科技有限责任公司);c-Jun氨基末端激酶(c-Jun N-terminal kinase,JNK)、细胞外调节蛋白激酶(extracellular regulated protein kinases,ERK)、p38丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)、核因子κB(nuclear factor kappa-B,NF-κB) p65、磷酸化JNK(p-JNK)、磷酸化ERK(p-ERK)、磷酸化p38 MAPK(p-p38 MAPK)、磷酸化NF-κB p65(p-NF-κB p65)抗体(美国CST公司);甘油醛-3-磷酸脱氢酶(GAPDH)(英国Abcam公司);闭锁小带蛋白1(zonula occludens 1,ZO-1)、闭锁蛋白(Occludin)抗体(英国Abcam公司)。手持血气分析仪(美国雅培公司);正置荧光显微镜(日本Olympus公司);酶标仪(美国赛默飞世尔科技有限公司);电泳仪和转膜仪(美国Bio-Rad公司)。
1.2 实验动物 SPF级成年雄性SD大鼠20只,6~8周龄,体重(200±20) g,购自西南医科大学实验动物中心[动物许可证号:SYXK(川)2018-065],适应性喂养1周。本研究经西南医科大学实验动物伦理委员会批准(201903-85),实验过程符合国家和单位有关实验动物管理和使用的规定。
1.3 实验分组及ARDS大鼠模型构建 将20只大鼠按照随机数字表法分为对照组、模型组、低剂量SCFAs组与高剂量SCFAs组,每组5只。低剂量SCFAs组给予乙酸钠300 mg/kg、丙酸钠100 mg/kg、丁酸钠100 mg/kg进行灌胃,高剂量SCFAs组给予乙酸钠600 mg/kg、丙酸钠200 mg/kg、丁酸钠200 mg/kg进行灌胃,对照组、模型组分别给予等量生理盐水灌胃,1次/d,连续7 d。干预完成后开始造模,模型组、低剂量SCFAs组、高剂量SCFAs组大鼠通过气管内灌注LPS(5 mg/kg)建立ARDS模型,对照组大鼠气管内灌注等量生理盐水,造模后12 h麻醉大鼠并进行取材。
1.3.1 大鼠动脉血氧分压(PaO2)检测 采用动脉采血针采集大鼠腹主动脉血1 ml,于手持血气分析仪上检测PaO2。
1.3.2 ELISA法检测血清及支气管肺泡灌洗液(BALF)中TNF-α、IL-6、IL-10的浓度 抽取大鼠腹主动脉血5 ml,3000 r/min离心15 min,取上清,于-70 ℃冰箱冻存待测。解剖大鼠胸部和颈部,结扎气管和右侧肺叶,用18G气管插管插入气管上端灌洗左肺,以生理盐水5 ml反复灌洗3遍,按上述方法离心后取上清于-70 ℃冰箱冻存待测。按照ELISA检测试剂盒说明书步骤检测血清及BALF中TNF-α、IL-6、IL-10的浓度。
1.3.3 肺湿/干重比(W/D)测定 取出完整右肺,无菌滤纸吸干表面水分和血渍,用精密电子秤称量湿重(W),然后将肺组织置于烘箱内烘烤72 h左右至完全脱水,取出称量干重(D),计算W/D,评价肺水肿程度。
1.3.4 HE染色观察肺组织病理变化并进行肺损伤病理评分 取左上肺组织,于4%多聚甲醛溶液中固定24 h,常规脱水、石蜡包埋,制作5 μm切片,行HE染色观察肺组织病理变化并进行肺损伤病理评分。依照Murao等[8]的方法进行评分,标准如下:(1)局灶性肺泡膜增厚;(2)毛细血管充血;(3)肺泡内出血;(4)间质中性粒细胞浸润;(5)肺泡内中性粒细胞浸润。根据无损伤(0分)、轻度(1分)、中度(2分)或重度(3分)进行评分。每只大鼠随机选取5个高倍视野,以各项评分总和的平均值作为每例样本的肺损伤病理评分。
1.3.5 Western blotting检测肺组织中JNK、p-JNK、ERK、p-ERK、p38 MAPK、p-p38 MAPK、NF-κB p65、p-NF-κB p65蛋白的表达 取左下肺组织,用预冷的PBS漂洗2~3次,加入组织蛋白提取试剂彻底匀浆,冰上裂解,4 ℃下12 000 r/min离心15 min,收集上清液,用BCA法测定蛋白浓度。上样行SDSPAGE电泳,转膜、封闭,分别加入JNK(1∶3000)、p-JNK(1∶500),ERK(1∶3000)、p-ERK(1∶1000)、p38 M APK(1∶3000)、p-p38 M APK(1∶500)、NF-κB p65(1∶3000)、p-NF-κB p65(1∶500)、GAPDH(1∶10 000)一抗4 ℃孵育过夜,次日加入二抗(1∶10 000)室温孵育1 h,经曝光、显影、定影,将胶片进行扫描存档,采用AlphaEaseFC软件处理系统分析目的条带的灰度值。
1.3.6 免疫组化检测结肠组织中紧密连接蛋白ZO-1、Occludin的表达 取大鼠回肠末端至盲肠上方5 cm处的结肠组织,于4%中性甲醛溶液中固定24 h,制作石蜡切片,然后脱蜡至水、抗原修复、PBS洗涤,3% H2O2室温孵育,加入ZO-1(1∶150)、Occludin(1∶100)一抗4 ℃孵育过夜,次日加入二抗工作液(1∶200)37 ℃水浴锅孵育30 min,DAB显色,苏木精染核,脱水、封片,于正置荧光显微镜下观察并拍照。使用Image-Pro Plus 6.0软件系统进行半定量分析,每张切片随机选取3个视野,测量并记录每个视野阳性染色的积分光密度值(IOD),取平均值作为每个样本ZO-1、Occludin的相对表达量。
1.4 统计学处理 采用SPSS 17.0软件进行统计分析。正态分布的计量资料以±s表示,多组间比较采用单因素方差分析,方差齐时进一步两两比较采用LSD法,方差不齐时采用Dunnett's T3法。P<0.05为差异有统计学意义。
2 结 果
2.1 各组大鼠PaO2和肺W/D比较 与对照组比较,模型组大鼠PaO2明显降低[(56.40±2.61) mmHgvs. (81.80±2.77) mmHg,P<0.05],肺W/D升高(5.20±0.11vs. 4.23±0.05,P<0.05);与模型组比较,低、高剂量SCFA s组大鼠PaO2升高[(64.80±2.39) mmHg、(72.80±2.59) mmHg],肺W/D降低(4.79±0.04、4.60±0.03),且高剂量SCFAs组PaO2高于低剂量SCFAs组,肺W/D低于低剂量SCFAs组,差异均有统计学意义(P<0.05)。
2.2 各组大鼠肺组织病理学变化及肺损伤病理评分比较 HE染色结果显示,对照组肺泡结构完整,无明显肺泡间隔增厚、充血、水肿、中性粒细胞浸润;模型组肺泡结构破坏严重,肺泡间隔明显增厚、断裂,可见出血、水肿,间质及肺泡内大量中性粒细胞浸润。与模型组比较,低、高剂量SCFAs干预后肺泡结构破坏减轻,肺泡间隔增厚、出血、水肿减轻,中性粒细胞浸润明显减少,且高剂量SCFAs组较低剂量SCFAs组肺组织病理改善更明显(图1)。
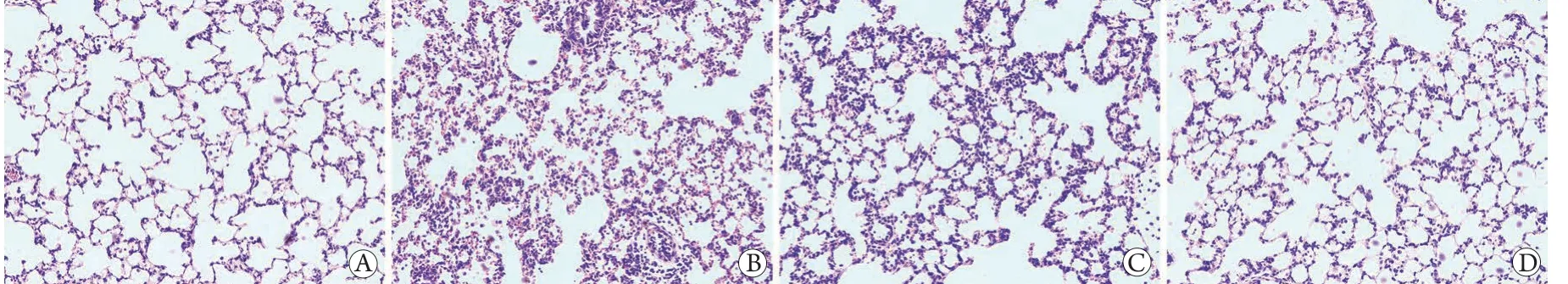
图1 各组大鼠肺组织病理变化(HE ×200)Flg.1 Pathological changes of lung tissue in each group of rats A. 对照组;B. 模型组;C. 低剂量SCFAs组;D. 高剂量SCFAs组
与对照组比较,模型组肺损伤病理评分升高[(10.09±0.54)分vs. (2.33±0.42)分,P<0.05];与模型组比较,低、高剂量SCFAs组肺损伤病理评分降低[(7.40±0.92)分、(4.47±0.31)分],且高剂量SCFAs组肺损伤病理评分低于低剂量SCFAs组,差异均有统计学意义(P<0.05)。
2.3 各组大鼠肺组织中JNK、p-JNK、ERK、p-ERK、p38 MAPK、p-p38 MAPK、NF-κB p65和p-NF-κB p65蛋白相对表达量比较 Western blotting检测结果显示,与对照组比较,模型组大鼠肺组织中p-JNK/JNK、p-ERK/ERK、p-p38 MAPK/p38 MAPK和p-NF-κB p65/NF-κB p65比值均明显增高(P<0.05);与模型组比较,低、高剂量SCFAs组大鼠肺组织中p-JNK/JNK、p-ERK/ERK、p-p38 MAPK/p38 MAPK和p-NF-κB p65/NF-κB p65比值降低,且高剂量SCFAs组上述各指标均低于低剂量SCFAs组,差异有统计学意义(P<0.05,图2)。
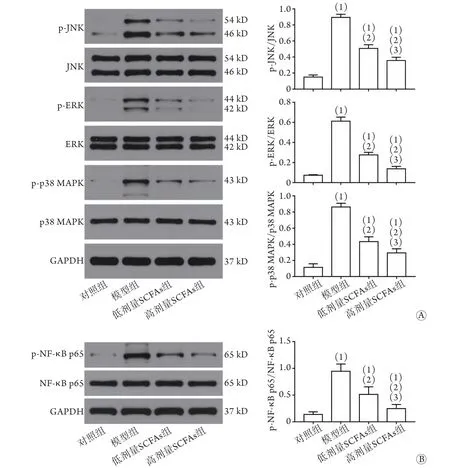
图2 各组大鼠肺组织中JNK、p-JNK、ERK、p-ERK、p38 MAPK、p-p38 MAPK、NF-κB p65和p-NF-κB p65蛋白相对表达量比较(n=3)Flg.2 Comparison of the relative expression levels of JNK, p-JNK, ERK, p-ERK, p38 MAPK, p-p38 MAPK, NF-κB p65 and p-NF-κB p65 protein in lung tissues of rats in each group (n=3)
2.4 各组大鼠血清及BALF中TNF-α、IL-6、IL-10浓度比较 ELISA法检测结果显示,与对照组比较,模型组大鼠血清及BALF中TNF-α、IL-6、IL-10浓度明显升高(P<0.05);与模型组比较,低、高剂量SCFAs组大鼠血清及BALF中TNF-α、IL-6浓度明显下降,IL-10浓度进一步升高,且高剂量SCFAs组大鼠血清及BALF中TNF-α、IL-6浓度低于低剂量SCFAs组,IL-10浓度高于低剂量SCFAs组,差异均有统计学意义(P<0.05,表1)。
表1 各组大鼠血清及BALF中TNF-α、IL-6、IL-10浓度比较(pg/ml, ±s, n=3)Tab.1 Comparison of the concentrations of TNF-α, IL-6 and IL-10 in serum and BALF of rats in each group (pg/ml, ±s, n=3)
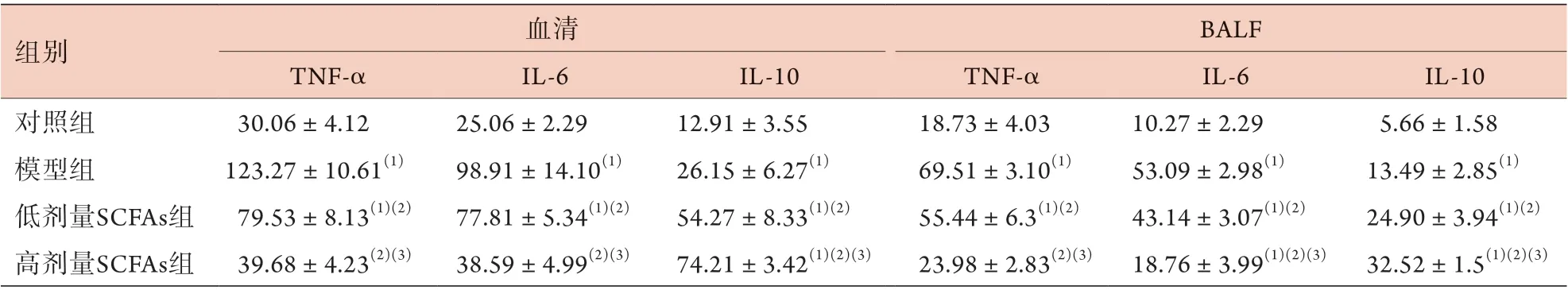
表1 各组大鼠血清及BALF中TNF-α、IL-6、IL-10浓度比较(pg/ml, ±s, n=3)Tab.1 Comparison of the concentrations of TNF-α, IL-6 and IL-10 in serum and BALF of rats in each group (pg/ml, ±s, n=3)
BALF. 支气管肺泡灌洗液;TNF-α. 肿瘤坏死因子-α;IL-6. 白细胞介素-6;IL-10. 白细胞介素-10;SCFAs. 短链脂肪酸;与对照组比较,(1)P<0.05;与模型组比较,(2)P<0.05;与低剂量SCFAs组比较,(3)P<0.05
组别 血清 BALF TNF-α IL-6 IL-10 TNF-α IL-6 IL-10对照组 30.06±4.12 25.06±2.29 12.91±3.55 18.73±4.03 10.27±2.29 5.66±1.58模型组 123.27±10.61(1) 98.91±14.10(1) 26.15±6.27(1) 69.51±3.10(1) 53.09±2.98(1) 13.49±2.85(1)低剂量SCFAs组 79.53±8.13(1)(2) 77.81±5.34(1)(2) 54.27±8.33(1)(2) 55.44±6.3(1)(2) 43.14±3.07(1)(2) 24.90±3.94(1)(2)高剂量SCFAs组 39.68±4.23(2)(3) 38.59±4.99(2)(3) 74.21±3.42(1)(2)(3) 23.98±2.83(2)(3) 18.76±3.99(1)(2)(3) 32.52±1.5(1)(2)(3)
2.5 各组大鼠结肠组织中紧密连接蛋白ZO-1、Occludin相对表达量比较 免疫组化半定量分析结果显示,与对照组比较,模型组大鼠结肠组织中ZO-1、Occludin蛋白相对表达量明显降低(P<0.05);与模型组比较,低、高剂量SCFAs组大鼠结肠组织中ZO-1、Occludin蛋白相对表达量增高,且高剂量SCFAs组上述各指标均高于低剂量SCFAs组,差异有统计学意义(P<0.05,图3)。
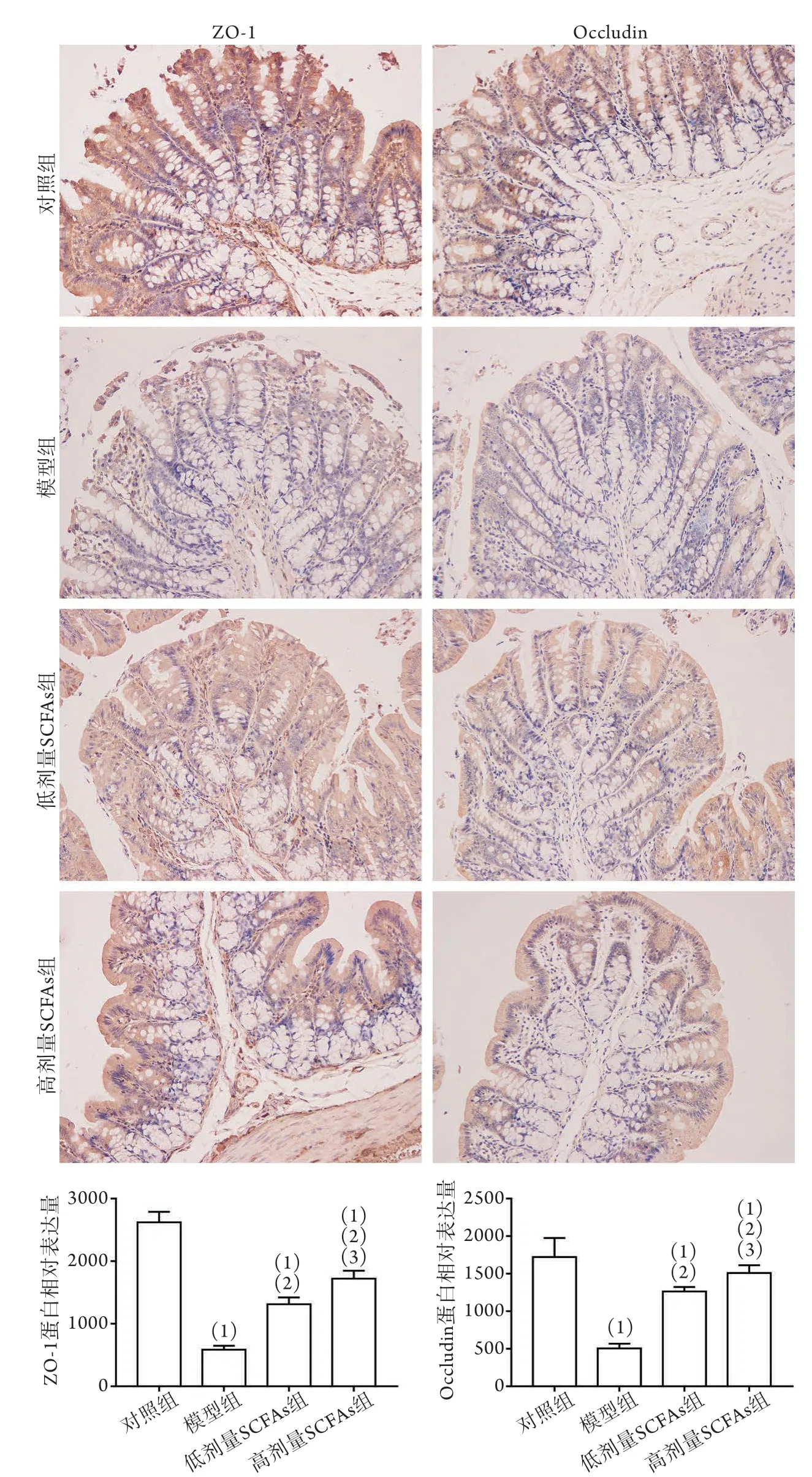
图3 各组大鼠结肠组织中紧密连接蛋白ZO-1、Occludin相对表达量比较(IHC ×200,n=3)Flg.3 Comparison of the relative expression levels of tight junction protein ZO-1 and Occludin in colon tissue of rats in each group(IHC ×200, n=3)
3 讨 论
SCFAs是肠道微生物群的重要代谢产物和信息分子[9],主要由肠道菌群发酵不被消化吸收的膳食纤维产生,为链长1~6个碳原子的饱和脂肪酸。SCFAs可刺激共生细菌的生长和活性,调节肠道屏障功能,促进免疫并抑制肠道和其他器官的炎症反应,这些功能由多种机制介导,包括组蛋白去乙酰化酶(histone deacetylase,HDAC)抑制、G蛋白偶联受体(G protein-coupled receptor,GPCR)信号传导等[10]。ARDS的主要发病机制是细胞因子风暴引起的全身性炎症反应,其发病率和病死率均较高,而新型冠状病毒肺炎(coronavirus disease 2019,COVID-19)大流行导致ARDS患者增多,但目前仍缺乏有效的药物治疗手段。最新研究发现,COVID-19患者粪便中SCFAs含量明显降低,且其含量与疾病严重程度和机体炎性因子水平呈负相关[11],进一步表明了SCFAs与疾病和炎症相关。
MAPK信号通路可被LPS、前炎性因子等激活,在炎症反应调节过程中起重要作用,该通路由JNK、p38 MAPK、ERK和ERK5等途径组成,其中前三条途径与炎症密切相关,磷酸化后可调节下游产物的活性,影响炎性细胞的激活和炎性因子(如TNF-α、IL-1、IL-6、IL-8等)的释放,在调控ARDS炎性因子生成中起重要作用[12]。NF-κB信号通路的激活与炎症反应的强度密切相关,是炎症的中心介质,在细菌LPS、电离辐射、活性氧(ROS)、细胞因子,以及病毒DNA、RNA[13]等的刺激诱导下,NF-κB磷酸化并发生核易位,与其同源DNA结合,激活参与宿主免疫、炎症、细胞增殖和凋亡的各种基因的转录[14],包括多种细胞因子(如IL-1、IL-6、TNF-α等)、趋化因子和黏附分子等[15],而这些下游介质又可进一步激活NF-κB信号通路,因此NF-κB信号通路在细胞因子风暴发生中起关键作用,而细胞因子风暴被认为是引起ARDS的重要原因。因此,抑制上述信号通路可能是ARDS的有效治疗靶点。有研究发现,SCFAs对免疫细胞和内皮细胞的NF-κB活化和MAPK信号通路具有调节作用[16],并通过IL-10等促进局部和全身的抗炎反应[17]。SCFAs发挥抗炎作用部分是通过调节紧密连接蛋白的表达而增强肠上皮屏障功能,进而阻止肠腔内有害物质进入血液循环实现的;而肠屏障受损可能导致肠道细菌及毒素移位,使促炎因子大量释放,加重ARDS及全身炎症反应等。
本研究发现,模型组大鼠肺组织中p-JNK/JNK、p-ERK/ERK、p-p38 MAPK/p38 MAPK和p-NF-κB p65/NF-κB p65比值明显升高,MAPK和NF-κB信号通路被激活,下游促炎因子TNF-α、IL-6浓度升高,导致大鼠肺组织损伤病理评分明显增高,PaO2降低,肺W/D升高,同步检测结肠组织中紧密连接蛋白ZO-1、Occludin表达减少,提示ARDS大鼠存在肠屏障功能受损;而补充低、高剂量SCFAs后,MAPK和NF-κB信号通路相关蛋白磷酸化水平降低,下游炎性因子TNF-α、IL-6浓度降低,抗炎因子IL-10浓度升高,PaO2上升,肺W/D、肺组织损伤病理评分降低,同时结肠组织中ZO-1、Occludin蛋白表达增加,肠黏膜屏障得以修复,且SCFAs高剂量组较低剂量组各项指标改善更明显,提示SCFAs的抗炎作用可能在一定范围内呈剂量依赖性。
近年来,随着对肠道微生物及其代谢产物的深入研究,越来越多的证据表明,SCFAs可影响机体的免疫、炎症与代谢过程,被认为是肠道微生物与免疫系统之间交流的介质。SCFAs的主要产生部位在结肠,是结肠细胞的主要能量来源,也有部分SCFAs从肠道转移到肝脏的门静脉循环,仅小部分的SCFAs通过血液循环到达全身,但这些血液中的SCFAs被认为足以影响全身的宿主细胞[18]。SCFAs无明显毒副作用,通过补充SCFAs调节机体免疫系统与炎症反应,改善ARDS甚至更多疾病是一种发展前景极佳的治疗手段。本研究结果显示,SCFAs可改善LPS诱导的大鼠ARDS,且SCFAs高剂量组较低剂量组改善更明显,然而具体的剂量-效应关系仍需进一步探索,以明确最大效能时的药物剂量,有条件时可同步检测肠道或血液中主要SCFAs的含量。SCFAs的作用机制复杂多样,尚不完全明确,可能涉及多种信号通路的调控,本研究仅对MAPK、NF-κB信号通路进行探讨,且通过三种混合SCFAs对ARDS大鼠进行干预,其中的机制错综复杂,乙酸、丙酸、丁酸各自的作用通路可能有所区别或存在交叉协同。此外,SCFAs主要通过肠道间接激活全身免疫系统还是通过吸收入血到达外周器官发挥抗炎作用尚不明确。以上问题均有待进一步深入研究。
综上所述,本研究结果显示SCFAs可改善LPS所致大鼠ARDS,其机制可能与通过维持肠道屏障功能、抑制MAPK和NF-κB信号通路蛋白的磷酸化,从而减少下游致炎因子的释放、增加抗炎因子的生成有关。

